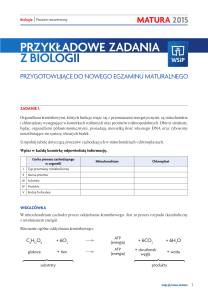
Metody bioinformatyki
Ekspresja genów
prof. dr hab. Jan Mulawka
Genetyczny skład prawie wszystkich komórek
somatycznych organizmów wielokomórkowych jest
identyczny.
Fenotyp (swoistość tkankowa lub komórkowa)
podyktowana jest różnicami ekspresji genów w
posiadanym zestawie genów.
Zmiany w ekstrakcji genów pozwalają komórce
adoptować się do zmian środowiskowych.
Ekspresja genów może być kontrolowana na
różnych poziomach poprzez zmiany w transkrypcji,
przekształcaniu, lokalizacji, trwałości lub sposobie
użytkowania RNA przez komórkę.
Działanie genów
eukariotycznych
Promotory dla polimerazy II składają się z
wielu sekwencji, z którymi wiążą się czynniki
transkrypcyjne
Obejmują one od kilkudziesięciu do ok. 200
nukleotydów
Z sekwencją TATA (-30) wiąże się czynnik
TFIID (a dokładniej jego składnik TBP – TATA
binding protein)
Często występuje sekwencja CAAT (-80)
Czynniki transkrypcyjne
Czynniki transkrypcyjne
biorące udział w wiązaniu
polimerazy II
A
D
B pol II
E F -
TFIIA
TFIID
TFIIB
- polimeraza RNA
TFIIE
TFIIF
w komórkach organizmów eukariotycznych mała
część całkowitego DNA występuje pod postacią genów
i regionów regulatorowych – inaczej niż u prokariotów
DNA w komórkach eukariotycznych jest mocno
upakowany i tworzy z białkami kompleks zwany
chromatyną
chromatyna zawiera histony
jednostką strukturalną chromatyny są nukleosomy
chromatyna i histony odgrywają znaczącą rolę w
mechanizmach regulacji ekspresji genów
włóknista substancja w jądrze komórkowym,
stanowiąca główny składnik chromosomów
może kurczyć się i rozkurczać, powodując
zmianę upakowania struktury chromosomów
stopień upakowania chromatyny odgrywa
rolę w kontroli ekspresji genów
taka zróżnicowana ekspresja jest możliwa
dzięki dostępności dla transkrypcji
odmiennych regionów chromatyny w
komórkach pochodzących z różnych tkanek
ważnym czynnikiem określającym
aktywność genów jest acetylacja i
acetylacja zachodzi w resztach lizynowych
końców aminokwasowych cząsteczek histonu
modyfikacja ta zmniejsza ładunek dodatni
tych końców, zmniejszając w ten sposób
powinowactwo histonu do obdarzonego
ujemnym
DNA
acetylacjaładunkiem
histonu może
prowadzić do rozpadu
struktury nukleosomów i ułatwiać dostęp czynników
transkrypcyjnych do pokrewnych im elementów
regulatorowych w DNA
skutkowałoby to wzmocnieniem wiązania elementu
podstawowego mechanizmu transkrypcyjnego z
promotorem
deacetylacja histonów jak można się spodziewać
dawałaby efekt odwrotny
u eukariotów w obrębie DNA znajdują się
elementy, które ułatwiają lub wzmacniają
inicjację transkrypcji w obszarze promotora
elementami wzmacniającymi transkrypcję są
enhancery
działają wówczas, gdy znajdują się w dużej
odległości od promotora
działają wówczas, gdy znajdują się przed
lub za promotorem
działają w obu orientacjach
działają na promotory homologiczne lub
heterologiczne
działają przez związanie jednego lub kilku
białek
ułatwiają wiązanie się podstawowego
kompleksu transkrypcyjnego z promotorem
Stwierdzono także obecność elementów
działających w układzie cis, które zmniejszają lub
wyciszają ekspresję swoistych genów. Zostały
zbadane
tylko
nieliczne
takie
elementy.
Uogólnienia co do mechanizmu ich działania nie
są możliwe, jakkolwiek uważa się, że do aktywacji
genu na poziomie chromatyny są potrzebne
kowalencyjne modyfikacje histonów i innych
białek przez (redukowane represorami) złożone z
wielu podjednostek korepresory.
Enhanceosom tworzony na enhancerze genu
ludzkiego β-interferonu:
u góry schemat rozkładu elementów typu cis
tworzących wzmacniacz genu β-interferonu
elementy cis tego wzmacniacza są miejscami
wiążącymi czynniki trans : HMGI(Y), cJun - ATF-2, IRF7
i NK-κB
czynniki oddziałują z tymi elementami w
uporządkowany sposób (zgodny z kolejnością
zaznaczoną przez strzałkę)
do odpowiedniej stymulacji transkrypcji w reakcji
na zakażenie wirusowe ludzkiej komórki
wymaganych jest wszystkich pięć elementów cis i to
w odpowiednim ułożeniu
Dobrze dobrany gen reporterowy wykazuje cechy:
nie występuje naturalnie u organizmu-biorcy, pojawia
się u niego dopiero w następstwie udanej transformacji
dostarcza produktu dającego łatwo dostrzegalną
fenotypową zmianę, np. powoduje syntezę jakiegoś
barwnika albo świecenie
nie powoduje żadnych zakłóceń fizjologicznych w
organizmie-biorcy
jego produkt jest stosunkowo nietrwały
kodowane przez ten gen białko zachowuje swoją
aktywność po przyłączeniu do jego końca (N lub C)
innego peptydu
wyróżniamy geny fuzyjne i chimeryczne
wykorzystując ligację regionów DNA z różnymi genami
reporterowymi można określić te regiony w sąsiedztwie genów
strukturalnych, które mają wpływ na ich ekspresję
fragmenty DNA, które są podejrzane o funkcje elementów
regulatorowych są przyłączane do odpowiedniego genu
reporterowego i wprowadzane do komórki gospodarza
podstawowa ekspresja genu reporterowego będzie się
zwiększała, jeśli fragment DNA zawiera sekwencję wzmacniającą
przykładowo: dodanie do pożywki hodowlanej hormonu lub
metalu ciężkiego będzie powodowało zwiększenie ekspresji genu
reporterowego, jeśli DNA zawiera element reagujący na hormon
lub jony metalu
Geny eukariotyczne bardzo rzadko są regulowane metodą
włączania-wyłączania (zwłaszcza w przypadku ssaków)
W przypadku eukariotów wymagane są procesy zapewniające
duży stopień elastyczności
Odpowiedź genu na złożone bodźce środowiskowe może mieć
różne cechy natury fizjologicznej
Odpowiedź genu ma szeroki zakres gdy sumującym się lub
synergistycznym odpowiedziom dodatnim są przeciwstawione
efekty negatywne lub represyjne
Koniecznym jest mechanizm za pomocą którego efektor (np.
hormon) aktywuje pewne geny w komórkach, jednocześnie
hamuje inne, a na niektóre nie wpływa w ogóle.
Grubość strzałek na rysunku wskazuje na wielkość aktywacji
Gen A
- jest aktywowany kombinacją aktywatorów 1, 2 i 3
Gen B
- zostaje aktywowany kombinacją aktywatorów 1, 3 i 4
- czynnik 4 nie wchodzi w kontakt z DNA bezpośrednio
- aktywatory bądź tworzą mostek łączący „maszynerię” z
promotorem, bądź DNA może się wypętlać
Gen C
- jest inaktywowany czynnikami 1,5 i 3.
- czynnik 5 uniemożliwia czynnikowi 2 związanie się z
DNA
Jeśli aktywator 1 pomaga w przyłączaniu się
represora 5 i jeśli przyłączanie się
aktywatora 1 wymaga obecności liganda
(zaczernione kółko na rysunku), to ligand
może aktywować w komórce jeden gen (gen
A) i hamować drugi (gen C).
Chromatyny tworzą specjalną strukturę z macierzą jądrową,
innymi elementami fizycznymi lub podprzedziałami jądrowymi,
które ograniczają wrzozec ekspresji genu
Niektóre regiony są kontrolowane przez złożone elementy DNA,
zwane Regionami Kontrolnymi Locus (LCR, ang. Locus control
regions)
Obecność regionów izolacyjnych czyli elementów DNA
związanych z białkami, zapobiegających działaniu sekwencji
wzmacniających na promotor po drugiej stronie sekwencji
izolujących i w innej domenie transkrypcyjnej
Helisa-skręt-helisa
Palec cynkowy
Suwak leucynowy
Na podstawie analizy trójwymiarowej struktury
regulatora transkrypcji λ, białka Cro, stwierdzono że
każdy z monomerów składa się z trzech
antyrównoległych struktur (harmonijek) β i trzech helis α.
Dimer powstaje przez połączenie się
przeciwrównoległych struktur β3. Helisy α3 tworzą
powierzchnię rozpoznającą DNA, a reszta cząsteczek
najprawdopodobniej stabilizuje te struktury. Przeciętna
średnica helisy α wynosi 1,2 nm, co odpowiada w
przybliżeniu szerokości większego rowka DNA w formie
B. Domena każdego monomeru Cro, rozpoznająca DNA,
oddziałuje z pięcioma parami zasad, a miejsca wiążące
dimer mają długość 3,4 nm.
Białko TFIIIA, które jest regulatorem pozytywnym
transkrypcji genu 5S RNA, wymaga do swej aktywności
jonów cynku. Każda cząsteczka TFIIIA ma dziewięć jonów
cynku w powtarzającym się kompleksie koordynacyjnym,
utworzonym przez ściśle ułożone reszty cysteina-cysteina,
po których następuje sekwencja 12-13 reszt
aminokwasowych, a następnie para histydyna-histydyna. W
niektórych przypadkach, zwłaszcza rodziny steroidowych
tarczycowych receptorów jądrowych, dublet His-His jest
zastąpiony przez drugą parę Cys-Cys. Białko zawierające
palec cynkowy przypuszczalnie leży na jednej płaszczyźnie
helisy DNA, a kolejne palce są ułożone naprzemiennie w
obrębie jednego skrętu w dużym rowku. Każdy palec
cynkowy białka TFIIIA łączy około pięć par zasad DNA.
Region białka tworzy helisę α, w której reszty leucynowe
zajmują cyklicznie powtarzające się miejsca, co siedem
reszt aminokwasowych. Takie ułożenie obejmuje osiem
helikalnych skrętów i cztery powtarzające się leucyny.
Sądzi się że suwak leucynowy umożliwia połączenie
dwóch identycznych monomerów lub heterodimerów na
wzór zamka błyskawicznego i powstanie mocnego
dimerycznego kompleksu o strukturze oplatających się
helis. Tego typu oddziaływanie białko-białko może
wzmacniać wiązanie oddzielnych domen wiążących
DNA z ich sekwencjami docelowymi.
Wiązanie musi cechować silne powinowactwo do swoistego miejsca w DNA, oraz słabe
powinowactwo do innych regionów DNA
Bezpośrednio z DNA łączą się niewielkie regiony białka. Pozostała część białka tworzy domeny
transaktywujące, może uczestniczyć w dimeryzacji monomerów białka wiążącego, może zapewniać
powierzchnię kontaktu do tworzenia heterodimerów, może zapewniać miejsca wiążące ligand lub
może zapewnić powierzchnię do oddziaływań z koaktywatorami lub korepresorami.
Oddziaływania białko-DNA są utrzymywane dzięki wiązaniom wodorowym i siłom van der Waalsa
Hierarchia składania kompleksów aktywujących
transkrypcję genów obejmuje białka wiążące DNA
i transaktywujące; białka, które tworzą kompleksy
białko-białko mostkujące białka wiążące DNA z
białkami transaktywującymi oraz białka tworzące
kompleksy
białko-białko
ze
składnikami
podstawowego aparatu transkrypcyjnego. W
danym białku może zatem występować wiele
powierzchni lub domen spełniających oddzielne
funkcje.
Mechanizmy kontroli transkrypcji
działają na poziomie oddziaływań białkoDNA oraz białko-białko. Oddziaływania te
pokazują modularność domen białkowych
oraz wysoki stopień swoistości
W czynnikach transkrypcyjnych
rozpoznano wiele różniących się klas
domen wiążących DNA
Modyfikacje chromatyny są ważnym
czynnikiem kontroli transkrypcji u
eukariotów
transkrypcja
amplifikacja genów
rearanżacja genów
edytowanie (redagowanie) RNA
alternatywny splicing mRNA
transport mRNA z jądra do cytoplazmy
regulacja trwałości mRNA
Zwiększanie liczby genów dostępnych do
transkrypcji cząsteczek, niezbędnych do
wczesnego rozwoju organizmów
wielokomórkowych. Geny te istnieją w
postaci wielu kopii w materiale
genetycznym gamet, przez co są
przenoszone z pokolenia na pokolenie w
ogromnej liczbie kopii.
Sekwencje kodujące, odpowiedzialne za powstawanie
swoistych cząsteczek białkowych (np. przeciwciał), nie
występują u ssaków w jednym bloku
Sekwencje kodujące DNA cechują się dużą
zmiennością. Zmiany takie są integralną częścią systemu
generowania wymaganej różnorodności rozpoznawania
antygenów, będącej istotą należytego działania układu
odpornościowego
W reakcji na niektóre leki możliwe jest zwiększenie o
kilka tysięcy liczby kopii określonych genów.
Komórki eukariotyczne , oprócz tego że
wpływają na wydajność użytkowania
promotora, wykorzystują do kontroli
ekspresji genów alternatywne
przekształcenia RNA, wynikające z:
użycia alternatywnych promotorów
użycia miejsc splicingu intron-ekson
użycia miejsc poliadenylacji
Struktura typowego eukariotycznego mRNA pokazująca
elementy biorące udział w regulacji stabilności mRNA.
Końce cząsteczek mRNA mają swój udział w zjawisku
stabilizacji mRNA. Czapeczka na końcu 5’ mRNA
zapobiega atakowi 5’-egzonukleoz, ogon poli(A) zaś
uniemożliwia działanie 3’-egzonukleoz. Zakłada się że w
cząsteczkach mRNA zawierających tego typu struktury
atak egzonukleoz i strawienie całej cząsteczki umożliwia
pojedyncze cięcie endonukleoityczne.
Mechanizmów regulacji stabilności mRNA jest wiele, tak
jak wiele jest mechanizmów regulacji syntezy mRNA.
Skoordynowana regulacja tych dwóch procesów daje
komórce niezwykłe zdolności adaptacyjne.