Uniwersytet Gdański, Wydział Biologii
Biologia i Biologia medyczna, II rok
Katedra Biologii Molekularnej
Przedmiot: Biologia Molekularna z Biotechnologią
=================================================================
Ćwiczenie 4
Klonowanie DNA
Prowadzący: mgr Katarzyna Kozłowska, mgr Aleksandra Urban,
mgr Gracja Topka, mgr Michał Sobala
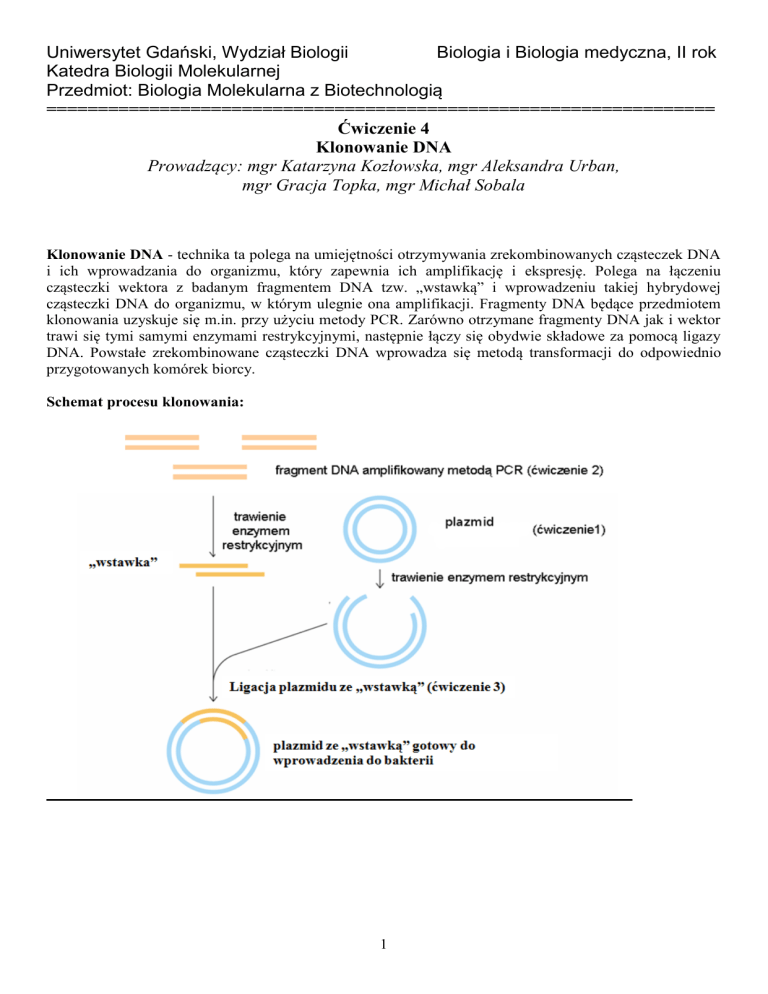
Klonowanie DNA - technika ta polega na umiejętności otrzymywania zrekombinowanych cząsteczek DNA
i ich wprowadzania do organizmu, który zapewnia ich amplifikację i ekspresję. Polega na łączeniu
cząsteczki wektora z badanym fragmentem DNA tzw. „wstawką” i wprowadzeniu takiej hybrydowej
cząsteczki DNA do organizmu, w którym ulegnie ona amplifikacji. Fragmenty DNA będące przedmiotem
klonowania uzyskuje się m.in. przy użyciu metody PCR. Zarówno otrzymane fragmenty DNA jak i wektor
trawi się tymi samymi enzymami restrykcyjnymi, następnie łączy się obydwie składowe za pomocą ligazy
DNA. Powstałe zrekombinowane cząsteczki DNA wprowadza się metodą transformacji do odpowiednio
przygotowanych komórek biorcy.
Schemat procesu klonowania:
1
Schemat klonowania wykonywanego na ćwiczeniach:
Plazmid pUC19 niosący gen
oporności na Ampicylinę (ampR)
oraz gen kodujący N-terminalną
domenę β-galaktozydazy (lacZ)
obejmujący miejsce MCS
Plazmid pCB104 niosący gen
klonowany fragment
Plazmid pUC19 niosący geny
oporności na Ampicylinę oraz
klonowany fragment w miejscu
MCS – udane klonowanie
unieaktywnia gen lacZ, a z tym βgalaktozydazę
2
Izolacja – ćw. 2
Trawienie enzymami
restrykcyjnymi BamHI
oraz PstI – ćw. 3
Reakcja PCR – ćw. 3
Trawienie enzymami
restrykcyjnymi BamHI
oraz PstI – ćw. 3
1. Ligacja
Ligacja oraz
transformacja szczepu
DH5α posiadającego
gen kodujący Cterminalną
podjednostkę βgalaktozydazy (lacZ)
Ligaza DNA - enzym łączący wolne końce cząsteczek DNA. Łączenie DNA następuje poprzez
wytworzenie wiązania fosfodiestrowego pomiędzy końcem hydroksylowym 3` a końcem fosforowym 5` w
reakcji zależnej od adenozynotrójfosforanu (ATP). Reakcja katalizowana przez ligazę to ligacja.
Przykład działania ligazy (łączenie fragmentów DNA z lepkimi końcami):
5'-AGTCTGATCTGACT-3'
3'-TCAGACTAGACTGACTACG-5'
5'-GATGCGTATGCTAGTGCT-3'
3'-CATACGATCACGA-5'
Powstaje:
5'-AGTCTGATCTGACTGATGCGTATGCTAGTGCT-3'
3'-TCAGACTAGACTGACTACGCATACGATCACGA-5'
W tej reakcji tworzą się dwa rodzaje wiązań - wodorowe pomiędzy nukleotydami komplementarnymi w
obrębie lepkich końców (a właściwie ich zasadami azotowymi) i fosfodiestrowe pomiędzy pierwszym i
ostatnim nukleotydem łączących się łańcuchów (a właściwie ich cząsteczkami deoksyrybozy). Wiązania
wodorowe tworzą się spontanicznie, natomiast tworzenie wiązań fosfodiestrowych katalizuje właśnie ligaza
DNA. Możliwa (choć mniej wydajna) jest też ligacja fragmentów zakończonych tępymi końcami. W tej
reakcji powstają tylko nowe wiązania fosfodiestrowe. Ligacja lepkich końców DNA jest znacznie
wydajniejsza ponieważ tworzące się wiązania wodorowe przytrzymują razem oba końce, co ułatwia reakcję.
Wszystkie bakterie posiadają ligazy zależne od NAD, z czego niektóre bakterie (np Haemophilus
influenzae) posiadają również ligazy ATP-zależne. Ostatnie wykazują pewne podobieństwo do ligaz
bakteriofagów. Bakteriofagi oraz organizmy z taksonu Archaea zawierają ligazy zależne od ATP.
2. Transformacja
Transformacja komórek bakteryjnych to proces aktywnego pobierania wolnego DNA ze środowiska.
Transformacja komórek bakteryjnych, obok koniugacji i transdukcji, jest jednym z mechanizmów
horyzontalnego transferu genów. Opisał go Griffith w 1928 roku u Streptococcus pneumoniae. W
eksperymencie tym dowiedziono, że żywe, niezjadliwe, bezotoczkowe szczepy nabyły właściwości
patogenne od chorobotwórczego, martwego szczepu z otoczką polisacharydową. Transformacja jest
procesem raczej korzystnym dla biorców, ponieważ pobrany DNA może być składnikiem pokarmowym,
brać udział w naprawie uszkodzeń DNA biorcy i prowadzić do nabycia nowych cech dających przewagę
transformantowi w środowisku.
Stan kompetencji to zdolność komórek bakteryjnych do pobierania DNA w procesie transformacji.
Niektóre
bakterie
posiadają
naturalny
stan
kompetencji,
są
nimi
na przykład organizmy z rodzaju Bacillus, Haemophilus, Staphylococcus, czy też Streptococcus. W
3
przypadku komórek Escherichia coli niezbędne jest wprowadzenie stanu kompetencji poprzez działanie
czynnikami chemicznymi bądź fizycznymi. Czynnikami takimi mogą być bufory zawierające
dwuwartościowe kationy (np. Ca2+, Mn2+, Rb2+), które destabilizują błonę komórkową (mechanizm nie jest
dobrze poznany). Wejście DNA do komórek, bezpośrednio z otaczającego je roztworu, ma miejsce dzięki
szokowi termicznemu. Wprowadzany DNA jest w formie dwuniciowego i koliście zamkniętego plazmidu.
Liniowy DNA nie utrzymuje się w komórce i jest szybko degradowany. DNA może także zostać
wprowadzony do elektrokompetentnych komórek poprzez elektroporację. Proces ten także polega na
destabilizacji błony komórkowej: silne pole elektryczne (krótki impuls prądu elektrycznego o napięciu ok.
1,6-2,5
kV)
powoduje
powstanie
przejściowych
porów
w błonie, przez które mogą przenikać cząsteczki DNA.
Wydajnością procesu transformacji nazywamy ilość transformantów (kolonii powstałych na podłożu
selekcyjnym) na mikrogram DNA użytego do transformacji (jednostka: cfu/μg DNA).
Schemat procesu transformacji komórek bakteryjnych DNA plazmidowym:
3. Zagadnienia
Ligacja (warunki reakcji; ligazy – mechanizm działania, fosfataza alkaliczna)
Komórki kompetentne (stan kompetencji)
Transformacja (warunki i mechanizm procesu; selekcja klonów; wydajność procesu; przeszukiwanie
transformantów)
Antybiotyki (mechanizm działania; mechanizm antybiotykooporności)
4. Literatura
„Krótkie wykłady – biologia molekularna” P.C. Turner, A.G. McLennan, A.D. Bates, M.R.H. White
„Genetyka molekularna” Piotr Węgleński
„Biochemia” Stryer Lubert
„Podstawowe techniki inżynierii genetycznej” T. Kaczorowski
4
5. Protokół do ćwiczeń
Przygotowanie mieszaniny ligacyjnej
1. Do jałowej probówki Eppendorfa dodać kolejno:
5 μl DNA plazmidu przeciętego enzymem restrykcyjnym
12 μl tzw. „wstawki” czyli fragmentu DNA amplifikowanego na poprzednich zajęciach
2 μl buforu ligacyjnego stężonego 10x (bufor zawiera już 5mM ATP)
1 μl ligazy DNA faga T4 (1 jednostka)
2. Zawartość probówki dokładnie wymieszać
3. Probówkę inkubować w temperaturze 22°C przez godzinę
4. Inaktywacja 10 min. w 65˚C - opcjonalnie
Transformacja bakterii zrekombinowanym DNA
1. Na lodzie przygotować 3 probówki Eppenorfa zawierające po 50 μl komórek kompetentnych. Dodać do
nich kolejno:
- 4 μl mieszaniny ligacyjnej
- 4 μl niepotrawionego plazmidu będącego próbą dodatnią eksperymentu
- w trzeciej probówce pozostawić tylko komórki kompetentne będące próbą negatywną eksperymentu
Delikatnie przepipetować.
2. Inkubować próbki w lodzie przez minimum 30 minut
3. Przenieść próbki na 60-90 sekund do 43°C – szok temperaturowy
4. Przenieść próbki na 2 minuty do lodu – cold shock
5. Dodać
500
μl
pożywki
LB
(bez
antybiotyku)
i
hodować
z
wytrząsaniem
w temperaturze 37°C przez minimum 40 minut (max. 60 minut)
6. Zwirować próbki - 2 min. przy 2-3 tyś. obr./min.
7. Na wysuszone płytki LA z odpowiednimi antybiotykami przenieść ok. 100μl hodowli
8. Zawiesinę rozetrzeć jałową głaszczką po całej powierzchni podłoża
9. Płytki inkubować przez noc w temperaturze 37°C
10. Policzyć wydajność transformacji.
5