POLITECHNIKA ŁÓDZKA
INSTRUKCJA Z LABORATORIUM W
ZAKŁADZIE BIOFIZYKI
Ćwiczenie 3
ANALIZA TRANSPORTU SUBSTANCJI
NISKOCZĄSTECZKOWYCH PRZEZ
BŁONĘ KOMÓRKOWĄ
Analiza transportu substancji niskocząsteczkowych przez błonę komórkową
I. WSTĘP TEORETYCZNY
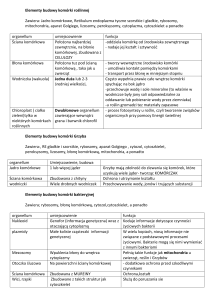
Każda komórka, zarówno roślinna, jak i zwierzęca jest otoczona błoną
komórkową, która stanowi selektywną, półprzepuszczalną barierę dla substancji
znajdujących się we wnętrzu komórki i w jej otoczeniu. Wszystkie błony biologiczne
zbudowane są przede wszystkim z lipidów oraz białek. Cząsteczki białek zanurzone
są w dwuwarstwowej błonie fosfolipidowej, której strukturę określa się mianem
płynnej mozaiki błony.
Cząsteczki fosfolipidów błonowych składają się z hydrofilowych główek i
hydrofobowych ogonków. W wodzie ogonki dążą do siebie, a główki na zewnątrz – w
ten sposób powstaje błona komórkowa (rys.1.).
Rys.1. Model struktury błony cytoplazmatycznej
B1 – białko integralne (wewnętrzne), B2–B5 - białka powierzchniowe (peryferyjne)
Błony biologiczne są strukturami dynamicznymi, zmieniającymi się w czasie.
Przez płynność błony należy rozumieć możliwość przemieszczania się elementów
tworzących błonę, szczególnie białek. Stopień płynności danego obszaru błony zależy
od czynników środowiskowych (temperatura, charakter chemiczny roztworów
stykających się z błoną) oraz strukturalnych: większą sztywność wykazują błony o
dużej zawartości płaskich cząsteczek cholesterolu i nienasyconych kwasów
tłuszczowych w fosfolipidach.
1
Analiza transportu substancji niskocząsteczkowych przez błonę komórkową
Cząsteczki białek błonowych mogą przenikać w poprzek całą błonę (białka
integralne lub transmembranowe) bądź tylko przyczepione do niej po obu jej
stronach.
Funkcje błon biologicznych są różnorodne. Lipidy błonowe nie przepuszczają
substancji rozpuszczonych w wodzie, powodując oddzielnie roztworów znajdujących
się po obu stronach błony. Transport substancji chemicznych przez błony odbywa się
głównie za pośrednictwem białek. Są wśród nich cząsteczki tworzące kanały, które w
miarę potrzeb mogą być otwierane i zamykane. Są białka, które po pobraniu
cząsteczek czy jonów po jednej stronie błony wędrują na drugą stronę, by tam je
uwolnić. Istnieją białka, które obracają się w błonie o 180 o, przenosząc tym samym
cząsteczki z jednej strony błony na drugą, niekiedy jednocześnie dwa rodzaje
cząsteczek w przeciwnych kierunkach.
Jeśli transport odbywa się zgodnie z gradientem stężeń danej substancji, tj. z
obszaru o większym stężeniu do obszaru o mniejszym stężeniu, nie sprawia to
problemów. Transport wbrew gradientowi stężeń wymaga natomiast nakładu energii
– jest to transport aktywny.
Pobieranie substancji chemicznych przez komórkę może odbywać się także
poprzez wpuklanie fragmentów błony i tworzenie pęcherzyków zawierających obiekt,
który przylegał do błony po stronie zewnętrznej.
Odpowiednio – wydzielanie substancji poza komórkę może polegać na
łączeniu się błony otaczającej pęcherzyk zawierający tę substancję z błoną
komórkową.
Oprócz pełnienia licznych funkcji ochronnych i transportowych błony
biologiczne, biorą udział w odbieraniu i przewodzeniu sygnałów. Sygnały docierają
do komórek najczęściej w postaci pewnych cząsteczek, np. hormonów. Aby komórka
mogła odebrać dany sygnał, musi mieć na powierzchni błony swoisty receptor –
białko, glikoproteinę, wiążące się z cząsteczką sygnałową. Związanie tej cząsteczki
powoduje zmiany w strukturze białka receptora, wpływające na białka enzymatyczne
we wnętrzu komórki.
2
Analiza transportu substancji niskocząsteczkowych przez błonę komórkową
III. PRZEBIEG ĆWICZENIA
Niezbędne materiały do przeprowadzenia ćwiczenia
zawiesina komórek drożdży Saccharomyces cerevisiae,
pipety,
wirówka,
kapilary szklane
Odczynniki wykorzystywane podczas analizy transportu:
FURA - 2 AM - indykator do oznaczania wolnych jonów wapnia
EDTA – (wersenian dwusodowy) substancja wiążąca jony dwuwartościowe
bufor fosforanowy pH 7,6
III. PRZEBIEG ĆWICZENIA
A) Przygotowanie materiału do badań - określenie cytokrytu hodowli
1. Przygotować 4 próbówki jednorazowe typu Eppendorf.
2. Dokładnie wymieszać hodowlę drożdży i pobrać po 1000μl zawiesiny komórek do
każdej z probówek. Następnie odwirować przez 1 min (wirówka Micro–
centrifuge type 320) w temperaturze pokojowej.
3. Supernatant dokładnie wylać, dodać 1000μl buforu fosforanowego, wymieszać.
Następnie odwirować.
4. Czynność z punktu 3 powtórzyć jeszcze dwukrotnie.
5. Bardzo dokładnie usunąć supernatant i zawiesić osad drożdży w 100 μl buforu.
6. W obecności prowadzącego ćwiczenia napełnić kapilary zawiesiną do ¾ objętości
(jedna kapilara z probówki).
7. Kapilary zamknąć przez opalenie końca nad palnikiem i umieścić w wirówce.
Odwirować.
8. Dla każdej kapilary wyliczyć cytokryt - zmierzyć długość obszaru zajmowanego
przez całą zawiesinę i przyjąć za 100%. Następnie zmierzyć długość obszaru
zajmowanego przez osad drożdży i obliczyć jaki jest to % długości. Policzyć
średnią dla wszystkich czterech kapilar.
3
Analiza transportu substancji niskocząsteczkowych przez błonę komórkową
B) Przygotowanie materiału
Badania należy przeprowadzić przy cytokrycie 5%.
1. 1000μl hodowli daje cytokryt obliczony w poprzedniej części. Używając proporcji
obliczyć ile należy wziąć μl hodowli, aby po uzupełnieniu do 1000μl otrzymać
cytokryt 5%.
2. Przygotować 10 probówek typu eppendorf (po dwie próby dla punktów czasowych
czasów 0min, 5min, 10 min, 20 min, 30 min).
3. Dodać obliczoną ilość dokładnie wymieszanej hodowli.
4. Odwirować przez 1 min (wirówka typu 320) w temperaturze pokojowej.
5. Supernatant dokładnie wylać, dodać 1000ml buforu fosforanowego, wymieszać,
a następnie odwirować.
6. Czynność z punktu 5 powtórzyć jeszcze dwukrotnie w celu dokładnego odmycia
resztek pożywki
7. Bardzo dokładnie usunąć supernatant i zawiesić osad drożdży w 1000 μl buforu.
C) Badanie transportu
1.Włączyć fluorymetr.
2. Do przygotowanych probówek w części B dodać 10µl odczynnika
fluorescencyjnego FURA2-AM ( wyłączając czas 0 min). Podczas drugiej część
ćwiczenia (badanie inhibicji transportu) dodać dodatkowo inhibitor.
3. Natychmiast dokładnie wymieszać i włączyć stoper.
4. Po upływie odpowiedniego czasu od rozpoczęcia reakcji (czyli po 5min, 10 min,
20min, 30min) należy odwirować probówki, wylać supernatant i dodać 1000 μl
buforu i dokładnie wymieszać.
5. Fluorymetr TKO 100 wyzerować „na powietrze”, wlać zawartość probówki
i uzupełnić dodatkowymi 1000 μl buforu. Wymieszać
6. Odczytać wynik pomiaru fluorescencji i zapisać w odpowiedniej tabeli.
4
Analiza transportu substancji niskocząsteczkowych przez błonę komórkową
Tab.1. Badanie transportu FURA - 2 AM
CZAS (min)
Średnia
0
5
10
20
30
Tab.2. Badanie transportu FURA-2AM w obecności EDTA
CZAS (min)
Średnia
0
5
10
20
30
IV. SPRAWOZDANIE POWINNO ZAWIERAĆ
1. Krótki wstęp teoretyczny.
2. Cel przeprowadzonego ćwiczenia.
3. Objaśnienie symboli stosowanych w sprawozdaniu.
4. Tabele z wartościami wielkości mierzonych.
5. Wykres szybkości transportu FURA – 2 AM i wykres szybkości transportu
FURA–2AM + EDTA
6. Dyskusję i wnioski.
5
Analiza transportu substancji niskocząsteczkowych przez błonę komórkową
V. PYTANIA KONTROLNE
1.
Budowa błony komórkowej.
2.
Rodzaje transportu przez błonę – omówić transport aktywny
3.
Zjawisko fluorescencji.
LITERATURA
1. J. St. Szopa: Biologia i inżynieria komórki - laboratorium; PŁ, Łódź 1994r.
2. F. Jaroszka: Biofizyka; Wydawnictwo Lekarskie PZWL; Warszawa 2001r.
3. K. Ostrowski: J.Kawiaka: Cytofizjologia; Państwowy Zakład Wydawnictw
Lekarskich; Warszawa 1990r.
4. A. Pilawski: Podstawy biofizyki; Państwowy Zakład Wydawnictw Lekarskich;
Warszawa 1985r.
6