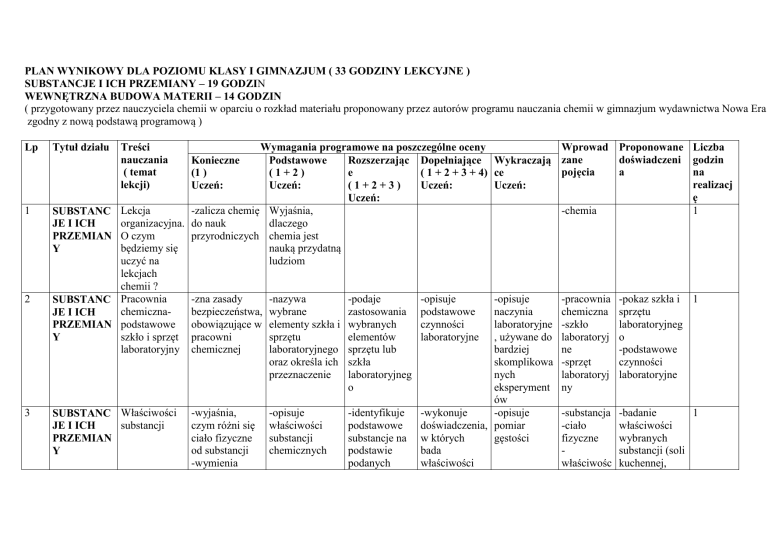
PLAN WYNIKOWY DLA POZIOMU KLASY I GIMNAZJUM ( 33 GODZINY LEKCYJNE )
SUBSTANCJE I ICH PRZEMIANY – 19 GODZIN
WEWNĘTRZNA BUDOWA MATERII – 14 GODZIN
( przygotowany przez nauczyciela chemii w oparciu o rozkład materiału proponowany przez autorów programu nauczania chemii w gimnazjum wydawnictwa Nowa Era
zgodny z nową podstawą programową )
Lp
1
2
3
Tytuł działu
Treści
nauczania
( temat
lekcji)
Wymagania programowe na poszczególne oceny
Wprowad
Podstawowe
Rozszerzając Dopełniające Wykraczają zane
pojęcia
(1+2)
e
( 1 + 2 + 3 + 4) ce
Uczeń:
(1+2+3)
Uczeń:
Uczeń:
Uczeń:
-zalicza chemię Wyjaśnia,
-chemia
SUBSTANC Lekcja
organizacyjna. do nauk
dlaczego
JE I ICH
przyrodniczych chemia jest
PRZEMIAN O czym
będziemy się
nauką przydatną
Y
uczyć na
ludziom
lekcjach
chemii ?
-zna zasady
-nazywa
-podaje
-opisuje
-opisuje
-pracownia
SUBSTANC Pracownia
chemicznabezpieczeństwa, wybrane
zastosowania podstawowe
naczynia
chemiczna
JE I ICH
czynności
laboratoryjne -szkło
PRZEMIAN podstawowe obowiązujące w elementy szkła i wybranych
szkło i sprzęt pracowni
sprzętu
elementów
laboratoryjne , używane do laboratoryj
Y
laboratoryjny chemicznej
laboratoryjnego sprzętu lub
bardziej
ne
oraz określa ich szkła
skomplikowa -sprzęt
przeznaczenie
laboratoryjneg
nych
laboratoryj
o
eksperyment ny
ów
-opisuje
-identyfikuje -wykonuje
-opisuje
-substancja
SUBSTANC Właściwości -wyjaśnia,
substancji
czym różni się właściwości
podstawowe
doświadczenia, pomiar
-ciało
JE I ICH
ciało fizyczne
substancji
substancje na w których
gęstości
fizyczne
PRZEMIAN
od substancji
chemicznych
podstawie
bada
Y
-wymienia
podanych
właściwości
właściwośc
Konieczne
(1 )
Uczeń:
Proponowane Liczba
doświadczeni godzin
a
na
realizacj
ę
1
-pokaz szkła i 1
sprzętu
laboratoryjneg
o
-podstawowe
czynności
laboratoryjne
-badanie
1
właściwości
wybranych
substancji (soli
kuchennej,
właściwości
substancji,
będących
głównymi
składnikami
produktów
stosowanych na
co dzień
4
SUBSTANC
JE I ICH
PRZEMIAN
Y
Zjawiska
fizyczne, a
reakcja
chemiczna
5
SUBSTANC Mieszaniny
substancji
JE I ICH
PRZEMIAN
Y
właściwości
podanych
substancji
i fizyczne i
chemiczne
substancji
-gęstość
-odróżnia
właściwości
fizyczne od
chemicznych
-opisuje różnice
w przebiegu
zjawiska
fizycznego, a
reakcji
chemicznej
-podaje
przykłady
zjawisk
fizycznych i
reakcji
chemicznych,
zachodzących w
najbliższym
otoczeniu
-wskazuje w
podanych
przykładach
zjawisko
fizyczne i
reakcję
chemiczną
-planuje i
wykonuje
proste
doświadczenie
obrazujące
reakcję
chemiczną
( np.
ogrzewanie
mieszaniny
siarki i żelaza
– tworzenie
siarczku
żelaza)
-przewiduje
wyniki
niektórych
doświadczeń
na podstawie
posiadanej
wiedzy
-zjawisko
fizyczne
-reakcja
chemiczna
-wyjaśnia
pojęcie
mieszaniny
-podaje
przykłady
mieszanin
-podaje cechy
mieszanin
jednorodnych i
niejednorodnyc
h
-wymienia
-wskazuje
wśród różnych
substancji
mieszaninę i
związek
chemiczny
-wyjaśnia
podstawowe
sposoby
rozdzielania
mieszanin
-sporządza
-wyjaśnia
rozdział
chromatograf
iczny
substancji,
metodę
-substancja
prosta
-substancja
złożona
mieszanina
mąki, wody,
cukru )
-porównanie
gęstości wody
i oleju
-obliczenia z
wykorzystanie
m masy,
gęstości i
objętości
1
doświadczenia,
przedstawiając
e zjawiska
fizyczne i
reakcje
chemiczne
( topienie
parafiny,
spalanie
świecy,
ogrzewanie
mieszaniny sisiarki i żelaza )
-reakcja
syntezy
-sporządzanie 1
mieszanin i
rozdzielanie
ich na
składniki (
piasek z wodą,
6
SUBSTANC
JE I ICH
PRZEMIAN
Y
Pierwiastek
chemiczny, a
związek
chemiczny
-dokonuje
podziału
substancji na
proste i złożone
-dzieli
mieszaniny na
jedno i
niejednorodne
podstawowe
sposoby
rozdzielania
mieszanin
-wyjaśnia
różnicę
pomiędzy
mieszaniną, a
związkiem
chemicznym
-definiuje
pojęcia
pierwiastek
chemiczny i
związek
chemiczny,
-rozpoznaje
pierwiastki i
związki
chemiczne
-wyjaśnia
różnice
-odszukuje
podane
pierwiastki w
układzie
okresowym
mieszaniny
destylacji
( pisaku z
wodą, cukru z
wodą, siarki z
żelazem )
-rozdziela
mieszaniny na
składniki
siarka z
mieszanina żelazem)
jednorodna
mieszanina
niejednoro
dna
-sączenie
sedymenta
cja
-dekantacja
krystalizacj
a
-destylacja
mechanicz
ne sposoby
rozdzielani
a
mieszanin
-destylacja
chromatogr
afia
-wyjaśnia
-opisuje
potrzebę i
historię
pierwiastek
genezę
odkrycia i
chemiczny
wprowadzenia symboli
-symbol
symboliki
chemicznych chemiczny
chemicznej
-związek
1
-podaje
przykłady
pierwiastków i
związków
chemicznych
-zna symbole
( O, N, H, S, C,
Mg, Ca )
7
SUBSTANC Metale i
niemetale
JE I ICH
PRZEMIAN
Y
-klasyfikuje
pierwiastki
chemiczne na
metale i
niemetale
-podaje
przykłady
metali i
niemetali
pomiędzy
pierwiastkiem i
związkiem
chemicznym
-zna symbole
pierwiastków i
posługuje się
nimi ( O,S, Mg,
Fe, Ca, Na, H,
N, Si, Ag, Au,
C, Cu, Zn, Sn,
Hg, Pb, Al., K,
Cl oraz P )
-definiuje
pojęcie stop
-klasyfikuje
stopy metali do
mieszanin
jednorodnych
-wyjaśnia, na
czym polega
korozja
chemiczny
-wzór
związku
chemiczne
go
-proponuje
sposoby
zabezpieczeni
a produktów,
zawierających
żelazo przed
rdzewieniem
-podaje
różnice we
właściwościac
h stopów i
metali, z
których te
stopy powstały
-potrafi zbadać
wpływ
różnych
czynników na
metale
-odróżnia
metale od
niemetali na
podstawie ich
właściwości
-opisuje
zastosowania
wielu
różnorodnych
stopów
-metal
-niemetal
-stopy
metali:
mosiądz,
brąz,
duralumini
um, stal
-badanie
1
właściwości
pierwiastków
(cynk, sód,
magnez,
siarka)
-porównanie
aktywności
chemicznej
metali
-porównanie
twardości
cynku, miedzi
oraz mosiądzu
-badanie
wpływu
różnych
czynników na
metale
8
SUBSTANC Powietrze
JE I ICH
PRZEMIAN
Y
9
SUBSTANC Tlen i jego
właściwości
JE I ICH
PRZEMIAN
Y
-określa, co to
są stałe i
zmienne
składniki
powietrza
-wyjaśnia rolę
powietrza w
życiu
organizmów
-wymienia stałe
i zmienne
składniki
powietrza
-określa, które -opisuje skład i
składniki
właściwości
powietrza są
powietrza
stał, a które
zmienne
-bada skład
powietrza
-opisuje
historię
odkrycia
składu
powietrza
-omawia
metodę
skraplania
powietrza i
rozdzielania
go na
składniki
-wymienia tlen -rozumie, co to -opisuje, na
-obserwuje
-wymienia
jako jeden z
znaczy, że tlen czym polegają doświadczenia, właściwości i
dwóch
podtrzymuje
reakcje
ilustrujące
zastosowania
podstawowych spalanie
syntezy i
typy reakcji i tlenku
składników
-wyjaśnia obieg analizy
formułuje
krzemu ( IV),
powietrza
tlenu w
-wskazuje
wnioski
-definiuje
-wie, że tlen
przyrodzie
substraty i
-wykonuje
pojęcie ciało
jest niezbędny -zapisuje
produkty,
doświadczenia, bezpostaciow
do oddychania i słownie
reagenty
mające na celu e
życia
przebieg reakcji reakcjach
zbadanie
-wymienia
otrzymywania
syntezy i
właściwości
podstawowe
tlenu z tlenku
analizy
tlenu
właściwości
rtęci ( II )
-zapisuje
-wymienia
fizyczne tlenu -opisuje
słownie
zastosowania
właściwości
równania
tlenków
fizyczne i
reakcji
wapnia, żelaza
chemiczne tlenu otrzymywania oraz glinu
przykładowyc -opisuje
h tlenków
znaczenie i
-otrzymuje
zastosowania
-powietrze -badanie
jako
składu
mieszanina powietrza
jednorodna
gazów
-reakcja
analizy
-zapis
słowny
przebiegu
reakcji
chemicznej
-substraty
reakcji
-produkty
reakcji
-reagenty
reakcji
-reakcja
syntezy
-utlenianie
-spalanie
-tlenek
-tlenki
metali
1
-otrzymywanie 1
tlenu z
manganianu
( VII ) potasu
-spalanie
pierwiastków
w tlenie
-termiczny
rozkład
węglanu
wapnia –
reakcja analizy
tlen w reakcji tlenu
rozkładu
manganianu
( VII ) potasu
10
SUBSTANC
JE I ICH
PRZEMIAN
Y
Azot –
główny
składnik
powietrza
11
SUBSTANC Gazy
szlachetne
JE I ICH
PRZEMIAN
Y
12
SUBSTANC
JE I ICH
PRZEMIAN
Y
Tlenek węgla
( IV ) –
właściwości i
rola w
przyrodzie
-wymienia azot
jako główny
składnik
powietrza
-wymienia
podstawowe
właściwości
fizyczne azotu
-wymienia
pierwiastki
chemiczne,
należące do
gazów
szlachetnych
-wymienia
produkty i
substraty
reakcji
fotosyntezy
-wymienia
podstawowe
właściwości
-wyjaśnia, jaki
jest obieg azotu
w przyrodzie
-wyjaśnia, gdzie
występuje azot
rozumie, że azot
jest gazem, nie
podtrzymujący
m spalania
-wyjaśnia,
dlaczego gazy
szlachetne są
mało aktywne
chemicznie
-określa ogólne
właściwości
gazów
szlachetnych
-wyjaśnia, na
czym polega
proces
fotosyntezy
-opisuje
właściwości
fizyczne oraz
chemiczne
-opisuje obieg
azotu w
przyrodzie
-opisuje
właściwości
fizyczne i
chemiczne
azotu
-opisuje
znaczenie i
zastosowanie
gazów
szlachetnych
-opisuje, na
czy polega
reakcja
wymiany
-opisuje obieg
tlenu i tlenku
węgla ( IV ) w
przyrodzie
tlenki
niemetali
-ciało
bezpostaci
owe
-szkło
-opisuje
znaczenie i
zastosowanie
azotu
-opisuje
odkrycie
azotu
1
-ocenia
zastosowanie
gazów
szlachetnych
oraz ich
przydatność do
różnych celów
-opisuje
-gazy
techniki
szlachetne
oświetleniow
e przy
zastosowaniu
gazów
szlachetnych
1
-obserwuje
doświadczenia
i formułuje
wnioski
-planuje i
wykonuje
doświadczenie,
pozwalające
-opisuje
właściwości
tlenku węgla
( II )
-tlenek
węgla (IV )
-reakcja
charakterys
tyczna
-woda
wapienna
-reakcja
-wykrywanie 1
obecności
tlenku węgla (
IV )
-otrzymywanie
tlenku węgla
(IV )
-badanie
fizyczne tlenku tlenku węgla
węgla ( IV )
(IV)
13
14
-wymienia parę
wodną jako
zmienny
składnik
powietrza
-wyjaśnia rolę
pary wodnej w
powietrzu
SUBSTANC Zanieczyszcze -wymienia
nia powietrza podstawowe
JE I ICH
źródła
PRZEMIAN
zanieczyszczeń
Y
powietrza
-wymienia
główne rodzaje
zanieczyszczeń
-wymienia
ogólne skutki
zanieczyszczeń
SUBSTANC Rola pary
wodnej w
JE I ICH
PRZEMIAN powietrzu
Y
-wymienia
dowody na
obecność pary
wodnej w
powietrzu
-wyjaśnia, na
czym polega
efekt
cieplarniany,
zjawisko
kwaśnych
deszczy
-wskazuje
substraty i
produkty w
reakcji
wymiany
wykryć tlenek
węgla ( IV ) w
powietrzu
wydychanym z
płuc
-wymienia
zastosowania
tlenku węgla
( IV )
-opisuje
-tłumaczy, na
zjawisko
czym polegają
higroskopijnoś zmiany stanów
ci
skupienia
-opisuje obieg
wody w
przyrodzie
wymiany
-suchy lód
-tlenek
węgla ( II )
właściwości
tlenku węgla (
IV )
-reakcja Mg z
tlenkiem węgla
(IV )
-ocenia
znaczenie
wody i pary
wodnej jako
naturalnego
regulatora
klimatu w
przyrodzie
-opisuje
-proponuje
-definiuje
powstawanie sposoby
pojęcia ppm,
dziury
zapobiegania jednostka
ozonowej
nadmiernemu Dobsona,
-opisuje skutki zwiększaniu
ozon
zanieczyszcze się efektu
-opisuje
nia powietrza cieplarnianego źródła,
-planuje
właściwości
sposoby
związków
postępowania, chemicznych
umożliwiające i wpływ na
ochronę
środowisko
powietrza
tlenku węgla
przed
(II ), tlenku
zanieczyszcze azotu ( II ),
-para
wodna
kondensacj
a
higroskopij
ność
zanieczysz
czenia
powietrza
– źródła
naturalne i
antropogen
iczne
-pyły
-dymy
-areozole
-freony
-ozon
-dziura
ozonowa
-pochłanianie
pary wodnej z
powietrza
przez stały
wodorotlenek
sodu
1
1
niami
15
SUBSTANC Wodór i jego
właściwości
JE I ICH
PRZEMIAN
Y
16
SUBSTANC Energia w
reakcjach
JE I ICH
PRZEMIAN chemicznych
Y
-wymienia
wodór jako
jeden ze
składników
powietrza
-wymienia
właściwości
fizyczne
wodoru
-opisuje
właściwości
fizyczne i
chemiczne
wodoru
-zapisuje
słownie
równanie
reakcji
otrzymywania
wodoru w
reakcji magnezu
z parą wodną
-dzieli reakcje -wyjaśnia, co to
na endo i
są reakcje endo
egzoenergetycz i
ne
egzoenergetycz
ne
-podaje
przykłady
takich reakcji
-określa typ
reakcji
magnezu z
parą wodną
-wskazuje
substraty i
produkty
reakcji
wymiany
-wyjaśnia, na
czy polega
reakcja
wymiany
-wyjaśnia
sposoby
wydzielania
energii i
towarzyszące
im efekty
-opisuje
reakcje
-uzasadnia, że
woda jest
tlenkiem
wodoru na
podstawie
reakcji
magnezu z
parą wodną
-wymienia
zastosowania
wodoru
-opisuje
przykłady
takich reakcji
w świecie
organizmów
żywych
tlenku azotu
(IV ) oraz
freonów
-smog
-kwaśne
opady
-efekt
cieplarnian
y
-ppm
-tlenek
azotu (II )
-jednostka
Dobsona
-planuje i
-wodór
wykonuje
doświadczeni mieszanina
e, mające na piorunując
celu zbadanie a
właściwości
wodoru
-reakcja
endoenerge
tyczna
-reakcja
egzoenerge
tyczna
-otrzymywanie 1
wodoru w
reakcji cynku z
kwasem
chlorowodoro
wym oraz w
reakcji
magnezu z
parą wodną
1
17
SUBSTANC
JE I ICH
PRZEMIAN
Y
18
SUBSTANC
JE I ICH
PRZEMIAN
Y
19
20
Reakcje
utleniania i
redukcji jako
szczególny
rodzaj reakcji
wymiany
Powtórzenie
wiadomości o
substancjach i
ich
przemianach
SUBSTANC Sprawdzian
wiadomości z
JE I ICH
PRZEMIAN działu
Substancje i
Y
ich przemiany
WEWNĘTR Ziarnista
budowa
ZNA
materii i
BUDOWA
historyczny
MATERII
rozwój
pojęcia atomu
-wymienia
reakcje
utleniania i
redukcji jako
szczególny
rodzaj reakcji
wymiany
endoenergetyc
zne w kuchni
-potrafi podać 2 --zapisuje
przykłady
słownie
takich reakcji
równania
reakcji
utleniania i
redukcji
-wskazuje w
zapisanym
przebiegu
reakcji proces
utleniania i
redukcji oraz
utleniacz i
reduktor
-opisuje, na
czym polega
reakcja
utleniania i
redukcji
-definiuje
utleniacz i
reduktor
-reakcja
utleniania
-reakcja
redukcji
-utleniacz
-reduktor
-utlenianie
-redukcja
1
1
1
-wyjaśnia
pojęcie dyfuzji
-wymienia
założenia teorii
atomistycznocząsteczkowej
budowy materii
-wyjaśnia
różnice
pomiędzy
pierwiastkiem, a
związkiem
chemicznym na
podstawie
założeń teorii
atomistycznocząsteczkowej
budowy materii
-wyjaśni, czym
-opisuje
ziarnistą
budowę
materii
-planuje
doświadczenia
, obrazujące
zjawisko
dyfuzji
-planuje i
wykonuje
doświadczenia,
przedstawiając
e zjawisko
dyfuzji
-obserwuje i
wyciąga
wnioski z
przeprowadzo
nych
doświadczeń
-opisuje
kształtowanie
się poglądów
na temat
budowy
atomu
-rysuje model
atomu
Thomsona
-opisuje
rodzaje
promieni
-dyfuzja
-atom
-cząsteczka
-teoria
atomistycz
nocząsteczko
wej
budowy
materii
pierwiastek
1.Obserwowan 1
ie zjawiska
dyfuzji na
przykładzie
różnych
substancji
różni się atom
od cząsteczki
21
WEWNĘTR Masa i
rozmiary
ZNA
atomów
BUDOWA
-definiuje
-wyjaśnia,
pojęcie
dlaczego masy
jednostka masy atomów i
-odczytuje
-oblicza masy
masy atomowe cząsteczkowe
dla różnych
prostych
-prowadzi
trudniejsze
obliczenia
chemiczny
(definicja
uwzględnia
jąca teorię
atomistycz
nocząsteczko
wej
budowy
materii )
-związek
chemiczny
na bazie
teorii
atmistyczn
ocząsteczko
wej
budowy
materii
-model
atomu
Thomsona
-zjawisko
promieniot
wórczości
-promienie
alfa, beta i
gamma
-masa
-obliczanie
1
atomowa
masy
-masa
cząsteczkowej
22
MATERII
atomowej
cząsteczek
pierwiastków
podaje się w
z układu
jednostkach
okresowego
masy atomowej
WEWNĘTR Budowa
atomów
ZNA
BUDOWA
MATERII
-wymienia
podstawowe
elementy
składowe
atomu
-definiuje
pojęcie: atom,
liczba
atomowa,
liczba masowa,
-rysuje
uproszczony
model atomu
pierwiastka
chemicznego
-opisuje i
charakteryzuje
skład atomu
pierwiastka
-wyjaśnia, czym
są i wymienia
cząstki
elementarne i
ich ładunki
-wyjaśnia, co
to są elektrony
walencyjne
-ustala liczbę
protonów,
neutronów i
elektronów na
podstawie
znanej liczby
atomowej i
masowej
-podaje dla
danego
pierwiastka
liczbę
atomową,
masową oraz
liczbę
elektronów
walencyjnych
związków
chemicznych
-wykonuje
różne
ćwiczenia
mające na celu
ustalenie
wszystkich
podanych
wielkości dla
atomu danego
pierwiastka
-zapisuje
konfigurację
elektronową
atomu danego
pierwiastka
cząsteczko
wa
-jednostka
masy
atomowej
-oblicza
maksymalną
liczbę
elektronów
na powłoce
wody
-obliczanie
masy
cząsteczkowej
tlenku węgla
(IV)
-atom –na -ćwiczenia w 1
podstawie podawaniu i
znajomości obliczaniu
budowy
wymienionych
-elektrony wielkości
-powłoki
elektronow
e
-protony
-neutrony
rdzeń
atomowy
-elektrony
walencyjne
-jądro
atomowe
-liczba
atomowa
-liczba
masowa
-nukleony
konfiguracj
a
elektronow
a
23
WEWNĘTR Izotopy
ZNA
BUDOWA
MATERII
-definiuje
pojęcie izotop
-wymienia 3
znane izotopy
wodoru
-wyjaśnia
różnice w
budowie
izotopów atomu
wodoru
-charakteryzuje
zjawisko
promieniotwórc
zości
-definiuje
pojęcie masa
atomowa jako
średnia masa
atomów danego
pierwiastka
chemicznego z
uwzględnieniem
jego składu
izotopowego
-wymienia
dziedziny
życia, w
których
stosowane są
izotopy
-ocenia
przydatność
izotopów w
różnych
dziedzinach
życia
-cząstki
materii
-oblicza
-izotopy
zawartość
-prot
procentową -deuter
izotopu w
-tryt
pierwiastku -izotopy
chemicznym promieniot
-wyjaśnia,
wórcze
czym się
-izotopy
różni
trwałe
promieniotw -izotopy
órczość
naturalne
naturalna od -izotopy
sztucznej
sztuczne
-definiuje
-średnia
pojęcie okres masa
półtrwania
atomowa
-opisuje
historię
promieniot
odkrycia
wórczość
promieniotw naturalna
órczości
promieniot
charakteryzuj wórczość
e rodzaje
sztuczna
promieni
-opisuje
pierwiastki
właściwości promieniot
ciężkiej
wórcze
wody
-reakcja
-oblicza
łańcuchow
-obliczenia
1
związane z
izotopami wg
wymienionych
średnią masę
atomową
pierwiastka
chemicznego
24
25
a
promienio
wanie
rentgenows
kie
-okres
półtrwania
-wymienia
-podaje treść
-odczytuje z
-wykonuje
-opisuje
-prawo
Ćwiczenia z
WEWNĘTR Układ
okresowy
podstawowe
prawa
układu
wszelkie
historię
okresowoś podanych
ZNA
pierwiastków części układu
okresowości
okresowego
ćwiczenia,
porządkowan ci
treści
BUDOWA
chemicznych okresowego
-odszukuje w
podstawowe
związane z
ia
-grupy
MATERII
-wymienia
układzie
informacje o
charakterystyk pierwiastków -okresy
podstawowe
okresowym
pierwiastkach: ą danego
chemicznych
wielkości,
metale,
nazwa,
pierwiastka w
charakteryzując niemetale,
symbol, liczba układzie
e położenie
półmetale oraz atomowa,
okresowym
pierwiastka w
gazy szlachetne masa
układzie
atomowa, nr
okresowym
grupy, nr
okresu, liczba
powłok
elektronowych
,
l.e.walencyjny
ch, rodzaj
pierwiastka
Zależność
-wie,
że
istnieje
-podaje
-tłumaczy, jak -wyjaśnia
-pracuje
-opisywanie
WEWNĘTR
między
związek
informacje na
się zmienia
związek
biegle z
różnych
ZNA
budową
pomiędzy
temat budowy
charakter
pomiędzy
układem
pierwiastków
BUDOWA
pierwiastka, a budową
atomu
chemiczny
podobieństwe okresowym
chemicznych
MATERII
jego
pierwiastka, a
pierwiastka
pierwiastków m właściwości
na podstawie
1
1
położeniem w
układzie
okresowym,
charakter
chemiczny
pierwiastków
grup
głównych
26
WEWNĘTR Rodzaje
wiązań
ZNA
chemicznych
BUDOWA
MATERII
jego
położeniem w
układzie
okresowym
-definiuje
pojęcie jony
-wie, że gazy
szlachetne są
bardzo mało
aktywne
chemicznie
chemicznego na
podstawie
znajomości
numeru grupy i
okresu w
układzie
okresowym
pierwiastków
chemicznych
grup głównych
w miarę
zwiększania
się numeru
grupy i
numeru okresu
pierwiastków
chemicznych
zapisanych w
tej samej
grupie układu
okresowego, a
budową ich
atomów i
liczbą
elektronów
walencyjnych
-opisuje sposób -opisuje
-zapisuje
powstawania
powstawanie elektronowo
jonów
wiązań
mechanizm
-wyjaśnia,
atomowych na powstawania
dlaczego gazy
przykładzie
jonów np. Na,
szlachetne są
m.innymi
Mg, Cl, Al., S
bardzo mało
wodoru,
-porównuje
aktywne
chloru, tlenku właściwości
chemicznie
węgla (IV ),
związków
wody,
kowalencyjnyc
chlorowodoru h i jonowych
-zapisuje
w zakresie
wzory
stanu
sumaryczne i skupienia,
strukturalne
temperatury
tych
topnienia i
cząsteczek
wrzenia
-opisuje rolę
elektronów
walencyjnych
w łączeniu się
ich położenia
w układzie
okresowym
-opisuje
wiązanie
koordynacyjn
e i wiązanie
metaliczne
-wyjaśnia
wpływ
odległości
powłoki
walencyjnej
od jądra
atomowego
na aktywność
chemiczną
pierwiastków
-wiązania
chemiczne
-oktet i
dublet
elektronow
y
-wiązanie
kowalencyj
ne
-wiązanie
kowalencyj
ne
spolaryzow
ane
-para
elektronow
a
wartościow
ość
pierwiastka
-sposoby
1
łącznie się
atomów np.
woda, chlor,
azot,
chlorowodór,
tlenek węgla
(IV ), chlorek
glinu, siarczek
magnezu
atomów
27
WEWNĘTR
ZNA
BUDOWA
MATERII
Znaczenie
wartościowoś
ci przy
ustalaniu
wzorów
związków
chemicznych
-definiuje
pojęcie
wartościowości
-pamięta, ile
wynosi
wartościowość
dla wodoru i
tlenu
-zna
podstawowe
symbole
pierwiastków
-interpretuje
zapisy, 2H,
4Mg, H2 itp.
-posługuje się
poznanymi
symbolami
pierwiastków
chemicznych
-ustala dla
podanych
tlenków nazwę
na podstawie
wzoru
sumarycznego
oraz wzór
sumaryczny na
podstawie
wartościowośc
i pierwiastków
chemicznych
-jony
-kationy
-aniony
-wiązanie
jonowe
-wzór
sumaryczn
y
-wzór
strukturaln
y
-wzór
elektronow
y
wiązanie
koordynac
yjne
-wiązanie
metaliczne
-zapisuje
wzory
strukturalne na
podstawie
wzorów
sumarycznych
podanych
tlenków
-odczytuje z
układu
okresowego
maksymalną
-ustalanie
1
wzorów
sumarycznych
i
strukturalnych
różnych
tlenków
wartościowość
względem
tlenu i wodoru
pierwiastków
grup1,2, 13,
14, 15, 16 i 17
-wykonuje
-wykonuje
-wykonuje
WEWNĘTR Prawo stałości -podaje treść
związku
prawa stałości proste
standardowe
różne
ZNA
chemicznego składu związku przykłady
obliczenia
obliczenia,
BUDOWA
chemicznego
związane w
związane z
MATERII
wykorzystanie tym tematem
m prawa
stałości składu
-definiuje
-wyjaśnia, co to -zapisuje
-zapisuje i
WEWNĘTR Równania
reakcji
równanie
są indeksy
równania
dobiera
ZNA
chemicznych reakcji
stechiometryczn reakcji
współczynniki
BUDOWA
chemicznej
e oraz
chemicznych stechiometrycz
MATERII
-wskazuje w
współczynniki syntezy,
ne w różnych
reakcji
stechiometryczn analizy oraz
równaniach
chemicznej
e
wymiany,
reakcji
substraty,
-odczytuje
podaje
chemicznych
produkty oraz
równania
przykłady
-przedstawia
reagenty reakcji reakcji
takich reakcji modelowy
chemicznych
schemat
równań reakcji
chemicznych
-podaje treść
-potrafi
-wykonuje
-wykonuje
WEWNĘTR Prawo
zachowania
prawa
zastosować
standardowe
różne
ZNA
masy
zachowania
prawo
obliczenia,
obliczenia
BUDOWA
masy
zachowania
związane
z
związane z
MATERII
masy do
wykorzystanie tym tematem
wykonania
m prawa
chemicznych
28
29
30
Prawo
stałości
składu
-stosunek
masowy
-obliczanie
1
stosunku
masowego
-obliczanie
składu
procentowego
-zapisywanie -równanie -zapisywanie 1
i uzgadnianie reakcji
różnych
trudnych
chemicznej równań reakcji
równań
chemicznych
reakcji
współczyn
chemicznych niki
stechiometr
yczne
-indeksy
stechiometr
yczne
-prawo
-obliczanie
zachowani masy
a masy
substratów,
produktów
1
31
-proste
WEWNĘTR Obliczenia
stechiometryc obliczenia
ZNA
zne
BUDOWA
MATERII
32
WEWNĘTR
ZNA
BUDOWA
MATERII
33
Powtórzenie
wiadomości z
działu ATOM
I
CZASTECZK
A
WEWNĘTR Sprawdzian
wiadomości
ZNA
BUDOWA
MATERII
prostych
zachowania
obliczeń
masy
-wykonuje
--------------proste
obliczenia
stechiometryczn
e
---------------
---------------- -zadania
stechimetri
a
-obliczenia
stechiometr
yczne
1
1
1