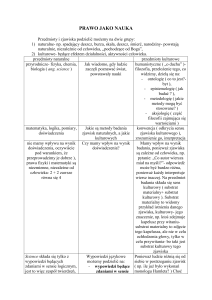
Ck08
Modelowanie molekularne
metodami chemii kwantowej
Dr hab. Artur Michalak
Zakład Chemii Teoretycznej
Wydział Chemii UJ
Wykład 11
http://www.chemia.uj.edu.pl/~michalak/mmod2007/
• Podstawowe idee i metody chemii kwantowej:
Funkcja falowa, gęstość elektronowa; równanie Schrodingera; Teoria Funkcjonałów Gęstości (DFT);
przyblienie Borna-Oppenheimera, zasada wariacyjna w mechanice kwantowej i w DFT, przyblienie
jednoelektronowe; metoda HF; korelacja elektronowa; metody korelacyjne oparte na funkcji falowej; metoda
Kohna-Shama
• Dane do obliczeń kwantowo-chemicznych; GAMESS:
Geometria czasteczki; macierz Z; bazy funkcyjne
w obliczeniach ab initio ; input/output programu GAMESS
• Struktura geometryczna układów molekularnych:
Optymalizacja geometrii; optymalizacja z wiazami; analiza konformacyjna; problem minimum
globalnego
• Struktura elektronowa układów molekularnych:
Orbitale molekularne, orbitale KS; wiazanie chemiczne; gęstość rónicowa; orbitale
zlokalizowane; analiza populacyjna; analiza rzędów wiązań
• Analiza
wibracyjna; Wielkości termodynamiczne;
Reaktywność chemiczna:
Analiza wibracyjna; wielkosci termodynamiczne;
modelowanie reakcji chemicznych; optymalizacja geometrii stanu
przejściowego, IRC; indeksy reaktywności chemicznej, molekularny
potencjał elektrostatyczny, funkcja Fukui’ego i teoria orbitali
granicznych; jedno- i dwu-reagentowe indeksy reaktywności
• Inne zagadnienia:
Metody hybrydowe QM/MM; modelowanie wielkich układów; efety rozpuszczalnika; modelowanie w katalizie
homo- i heterogenicznej; oddziaływania międzycząsteczkowe, i. in.
Reaktywność; reakcje chemiczne
Reaktywność; reakcje chemiczne
C
A+B
+E
F
D
Reaktywność; reakcje chemiczne
CH3
NO2
CH3
CH3
HNO3 / H2SO4
NO2
CH3
NO2
Przybliżenie adiabatyczne i Borna-Oppenheimera
TS
TS
Punkty charakterystyczne na PES:
-minima odpowiadają geometriom
równowagowym (substraty, produkty
reakcji chemicznych);
- punkty siodłowe – stany przejściowe
(TS) reakcji chemicznych
Ścieżki reakcji chemicznej – krzywe
na PES łączące substraty i produkty
reakcji poprzez odpowiedni TS
Energetyka reakcji chemicznych
Energia
Stan przejściowy (TS)
substrat(y)
produkt(y)
Współrzędna
reakcji
Energetyka reakcji chemicznych
Energia
Stan przejściowy (TS)
A+B
C
substrat(y)
produkt(y)
∆E = EC – (EA + EB)
Współrzędna
reakcji
Energetyka reakcji chemicznych
Energia
Stan przejściowy (TS)
A+B
C
substrat(y)
produkt(y)
∆E = EC – (EA + EB)
Produkt D preferowany termodynamicznie
D
Współrzędna
reakcji
Termodynamika reakcji chemicznych
Energia
Stan przejściowy (TS)
A+B
C
substrat(y)
produkt(y)
∆G = GC – (GA + GB) D
G = H - TS
Produkt D preferowany termodynamicznie
Współrzędna
reakcji
Termodynamika reakcji chemicznych
Energia
A⇔B
Stan przejściowy (TS)
Keq = exp(-∆Go / RT)
A
G = H - TS
B
substrat
produkt
∆E = EB –EA
Współrzędna
reakcji
Termodynamika reakcji chemicznych
Energia
A⇔B
Stan przejściowy (TS)
Keq = exp(-∆Go / RT)
A
G = H - TS
B
substrat
produkt
∆E = EB –EA
Uwaga!
typowe obliczenia
- dla izolowanego układu w fazie gazowej
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆E#
Energia aktywacji
C
A+B
substrat(y)
produkt(y)
∆E# = ETS – (EA + EB)
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
stała szybkości reakcji
k = A exp(-∆E# / RT)
∆E#
Energia aktywacji
C
A+B
substrat(y)
produkt(y)
∆E# = ETS – (EA + EB)
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Energia
Stan przejściowy
(TS)
∆G#
A+B
stała szybkości reakcji
k = (kBT/h) exp(-∆G# / RT)
Energia aktywacji
C
substrat(y)
produkt(y)
∆G# = GTS – (GA + GB)
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Energia
Stan przejściowy
(TS)
∆G#
A+B
stała szybkości reakcji
k = (kBT/h) exp(-∆G# / RT)
Energia aktywacji
C
substrat(y)
produkt(y)
∆G# = GTS – (GA + GB)
Zależność eksponencjalna –
- dokładność obliczeń niewystarczająca
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
∆G#D
C
substrat(y)
produkt(y)
D
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
∆G#D
C
substrat(y)
produkt(y)
D
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
∆G#D
C
substrat(y)
produkt(y)
D
Często rozsądne jakościowo wyniki
- ilościowo: należy zachować ostrożność
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
2.6 kcal/mol
Przykład
∆G#D
C
substrat(y)
produkt(y)
D
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
2.6 kcal/mol
∆G#D
C
substrat(y)
względne stałe szybkości T = 298 K
kC / kD ≈ 80.5
produkt(y)
D
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
2.6 kcal/mol
∆G#D
C
substrat(y)
względne stałe szybkości T = 298 K
kC / kD ≈ 80.5
produkt(y)
D
80.5 razy wiecej
produktu D
czyli 98.8 %
produktu D
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
1 kcal/mol
∆G#D
C
substrat(y)
produkt(y)
D
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
1 kcal/mol
∆G#D
C
substrat(y)
względne stałe szybkości T = 298 K
kC / kD ≈ 5.4
produkt(y)
D
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
1 kcal/mol
∆G#D
C
substrat(y)
względne stałe szybkości T = 298 K
kC / kD ≈ 5.4
produkt(y)
D
5,4 razy wiecej
produktu D
czyli 84,3 %
produktu D
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
0.5 kcal/mol
∆G#D
C
substrat(y)
produkt(y)
D
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
0.5 kcal/mol
∆G#D
C
substrat(y)
względne stałe szybkości T = 298 K
kC / kD ≈ 2,3
produkt(y)
D
Współrzędna
reakcji
Kinetyka reakcji chemicznych
Stan przejściowy (TS)
Energia
∆G#C
A+B
względne stałe szybkości
kC / kD = exp [ (∆G#D-∆G#C) / RT ]
0.5 kcal/mol
∆G#D
C
substrat(y)
względne stałe szybkości T = 298 K
kC / kD ≈ 2.3
produkt(y)
D
2.3 razy wiecej
produktu D
czyli 70 %
produktu D
Współrzędna
reakcji
Modelowanie reakcji chemicznych
Stan przejściowy (TS)
Energia
A+B
C
substrat(y)
D
produkt(y)
∆E# = ETS – (EA + EB)
Współrzędna
reakcji
Modelowanie reakcji chemicznych
Stan przejściowy (TS)
Energia
A+B
C
substrat(y)
D
produkt(y)
Produkt D preferowany kinetycznie
Współrzędna
reakcji
Modelowanie reakcji chemicznych
Stan przejściowy (TS)
Energia
A+B
C
substrat(y)
produkt(y)
D
Produkt D preferowany
i termodynamicznie, i kinetycznie
Współrzędna
reakcji
Modelowanie reakcji chemicznych
Stan przejściowy (TS)
Energia
A+B
C
substrat(y)
produkt(y)
D
Produkt D preferowany termodynamicznie Współrzędna
reakcji
Produkt C preferowany kinetycznie
Modelowanie reakcji chemicznych
Stan przejściowy (TS)
Energia
A+B
C
substrat(y)
produkt(y)
D
Produkt D preferowany termodynamicznie Współrzędna
reakcji
Produkt C preferowany kinetycznie
Modelowanie reakcji chemicznych
Energia
TS1
TS2
A+B
substrat(y)
C
Produkt
pośredni
D
produkt(y)
Współrzędna
reakcji
Modelowanie reakcji chemicznych
Energia
TS1
TS2
A+B
substrat(y)
C
Produkt
pośredni
D
produkt(y)
E(TS1) > E(TS2)
Współrzędna
reakcji
Modelowanie reakcji chemicznych
TS2
Energia
TS1
A+B
substrat(y)
C
Produkt
pośredni
D
produkt(y)
E(TS1) < E(TS2)
Współrzędna
reakcji
Modelowanie reakcji chemicznych
Energia
Alternatywne ścieżki reakcji;
wiele produktów
pośrednich
Współrzędna
reakcji
Modelowanie reakcji chemicznych
Energia
Alternatywne ścieżki reakcji;
wiele produktów
pośrednich
Współrzędna
reakcji
Wyznaczanie stanów przejsciowych
TS
TS
Wyznaczanie stanów przejsciowych
TS
TS
Optymalizacja stanu przejściowego
wymaga dobrego przybliżenia
jako punktu startowego
Poszukiwanie
minimum
na PES
Poszukiwanie
minimum
na PES
Poszukiwanie minimum na PES
Metoda najszybszego spadku (steepest descent)
Poszukiwanie TS na PES
Szukamy punktu siodłowego, a nie minimum
-łatwo „spaść” do minimum,
jeśli nie startujemy z punktu leżącego blisko TS
Poszukiwanie TS na PES
1.
TS
1. Wyznaczenie przyblizenia TS
w oparciu o obliczenia dla
tzw. „ścieżek reakcji”;
2. Optymalizacja TS;
3. Weryfikacja TS;
Poszukiwanie TS na PES
Poszukiwanie TS na PES
Poszukiwanie TS na PES
E
„współrzędna reakcji”
Poszukiwanie TS na PES
E
„współrzędna reakcji”
Poszukiwanie TS na PES
Przykład: izomeryzacja HCN ↔ CNH
Poszukiwanie TS na PES
Przykład: izomeryzacja HCN ↔ CNH
↔
Poszukiwanie TS na PES
Przykład: izomeryzacja HCN ↔ CNH
↔
Liniowa zmiana geometrii pomiedy produktem a substratem
doprowadzi do sytuacji typu:
Poszukiwanie TS na PES
Przykład: izomeryzacja HCN ↔ CNH
Rozsądną „współrzędną reakcji” wydaje się kąt H-C-N
zmieniajacy się od 180o do 0o
Poszukiwanie TS na PES
Przykład: izomeryzacja HCN ↔ CNH
1. Wyznaczenie przybliżenia TS: obliczenia dla szeregu wartości kąta
Poszukiwanie TS na PES
Przykład: izomeryzacja HCN ↔ CNH
E [kcal/mol]
1. Wyznaczenie przybliżenia TS: obliczenia dla szeregu wartości kąta
50
45
40
35
30
25
20
15
10
5
0
0
30
60
90
kat
120
150
180
Poszukiwanie TS na PES
Przykład: izomeryzacja HCN ↔ CNH
E [kcal/mol]
1. Wyznaczenie przybliżenia TS: obliczenia dla szeregu wartości kąta
50
45
40
35
30
25
20
15
10
5
0
0
30
60
90
120
150
180
150
180
kat
0.03
0.02
dE/ds [a.u.]
0.01
0
-0.01
-0.02
-0.03
-0.04
-0.05
-0.06
0
30
60
90
kat
120
Optymalizacja
geometrii
z więzem
Poszukiwanie TS na PES
Przykład: izomeryzacja HCN ↔ CNH
E [kcal/mol]
2. Optymalizacja TS, startując ze znalezionego punktu
50
45
40
35
30
25
20
15
10
5
0
Optymalizacja
TS
bez więzów
0
30
60
90
120
150
180
kat
0.03
0.02
dE/ds [a.u.]
0.01
70o 70.1o
0
-0.01
-0.02
-0.03
-0.04
-0.05
-0.06
0
30
60
90
kat
120
150
180
Poszukiwanie TS na PES
Przykład: izomeryzacja HCN ↔ CNH
3. Weryfikacja TS – obliczenia częstości, jedna urojona częstość
-1203 cm-1
Poszukiwanie TS na PES
Przykład: izomeryzacja HCN ↔ CNH
3. Weryfikacja TS – obliczenia częstości, jedna urojona częstość
-1203 cm-1
Weryfikacja poprzez częstości potwierdza TS, ale nie ma pewności
czy jest to właściwy TS, tj. prowadzący od substratów do produktów,
czy jest to najniżej energetyczny TS
Ścieżki reakcji - IRC
IRC – Intrinsic reaction coordinate
TS
Ścieżka najszybszego spadku
we współrzędnych kartezjańskich
ważonych przez masy
∂E
dxi = dt ;
∂xi
xi = mi X i
Fukui, K. Acc. Chem. Res. 1981, 14, 363.
Ścieżki reakcji - IRC
IRC – Intrinsic reaction coordinate
TS
Ścieżka najszybszego spadku
we współrzędnych kartezjańskich
ważonych przez masy
Dodatkowa weryfikacja TS
- prowadzi z TS do substratu i produktu
Fukui, K. Acc. Chem. Res. 1981, 14, 363.
Ścieżki reakcji - IRC
Przykład: izomeryzacja HCN ↔ CNH
Ścieżki reakcji - IRC
Przykład: otwarcie pierścienia cyklobutenu
cyklobuten
TS
IRC:
gauche-butadien
Ścieżki reakcji - IRC
Przykład: otwarcie pierścienia cyklobutenu
Ścieżki reakcji - IRC
Przykład: izomeryzacja chloropropenu
Cl -CH2-CH=CH2
TS
IRP (TS → R):
CH2=CH-CH2-Cl
Etylen
Etylen ++ butadien
butadien
TS
zbliżone reagenty
izolowane
reagenty
Ostateczny
produkt
produkt pośr.
k. torsyjny
Indeksy reaktywności chemicznej
Wielkości pozwalające przewidywać możliwy przebieg reakcji
na podstawie jedynie własności reagentów
Indeksy reaktywności chemicznej
Wielkości pozwalające przewidywać możliwy przebieg reakcji
na podstawie jedynie własności reagentów
CH3
NO2
CH3
CH3
HNO3 / H2SO4
NO2
CH3
NO2
Indeksy reaktywności chemicznej
Wielkości pozwalające przewidywać możliwy przebieg reakcji
na podstawie jedynie własności reagentów
CH3
NO2
CH3
- indeksy jednoreagentowe;
- indeksy dwureagentowe
CH3
HNO3 / H2SO4
NO2
CH3
NO2
Indeksy reaktywności chemicznej
Ładunki na atomach ?
CH3
+0.015
-0.069
-0.062
-0.067
Indeksy reaktywności chemicznej
Ładunki na atomach
CH3
+0.015
-0.069
-0.062
-0.067
Indeksy reaktywności chemicznej
Molekularny potencjał elektrostatyczny
V (r ) = ∑
α
Zα
ρ (r ' )
−∫
dr '
r − Rα
(r − r ' )
Jednoreagentowe indeksy reaktywności
Molekularny potencjał elektrostatyczny
V (r ) = ∑
α
Zα
ρ (r ' )
−∫
dr '
r − Rα
(r − r ' )
akrylonitryl
Jednoreagentowe indeksy reaktywności
Molekularny potencjał elektrostatyczny
V (r ) = ∑
α
Zα
ρ (r ' )
−∫
dr '
r − Rα
(r − r ' )
energia oddziaływania
jednostkowego ładunku
z molekułą
V < 0 stabilizacja
V > 0 destabilizacja
Jednoreagentowe indeksy reaktywności
Molekularny potencjał elektrostatyczny
|V| = 0.03
Jednoreagentowe indeksy reaktywności
Molekularny potencjał elektrostatyczny
ρ = 0.003
Jednoreagentowe indeksy reaktywności
Molekularny potencjał elektrostatyczny
ρ = 0.003
ρ = 0.009
ρ = 0.015
ρ = 0.05
ρ = 0.1
Molekularny potencjał elektrostatyczny
Model V2O5
V1278O6390
Adsorpcja
cząsteczki NO
atomem
azotu prostopadle do
Molekularny
potencjał
elektrostatyczny
powierzchni zredukowanego roztworu stałego MoO3 V2O5 modelowanego przez klaster V11MoO29
O
N
V
M
o
P. Kornelak, A. Michalak, M. Najbar, Catalysis Today, 2005, 101, 175-183
Molekularny potencjał elektrostatyczny
Rozkład potencjału
elektrostatycznego
w cząsteczce NO
Wartości dodatnie – linia ciągła;
Wartości ujemne – linia przerywana;
Zakres poziomic: od -0.011 do 0.02 z krokiem
0.001;
P. Kornelak, A. Michalak, M. Najbar, Catalysis Today, 2005, 101, 175-183
Molekularny potencjał elektrostatyczny
P. Kornelak, A. Michalak, M. Najbar, Catalysis Today, 2005, 101, 175-183
Jednoreagentowe indeksy reaktywności
Ładunki na atomach
Wynikają z podziału
gęstości elektronowej
molekuły
na poszczególne
atomy
CH3
+0.015
-0.069
-0.062
-0.067
często nie działają
Jednoreagentowe indeksy reaktywności
Funkcja Fukui’ego
Jednoreagentowe indeksy reaktywności
Funkcja Fukui’ego
„Elektrofilowa”, „nukleofilowa”, oraz„rodnikowa” FF:
−
∂ρ (r )
N
N −1
HOMO
f (r ) =
≈
ρ
(
r
)
−
ρ
(
r
)
≈
ρ
(r )
∂N v
−
+
∂ρ (r )
+
N +1
N
LUMO
f (r ) =
≈
ρ
(
r
)
−
ρ
(
r
)
≈
ρ
(r )
∂N v
1 −
f (r ) = f (r ) + f + (r )
2
0
[
]
Jednoreagentowe indeksy reaktywności
Atomowe indeksy FF
„Elektrofilowa”, „nukleofilowa”, oraz„rodnikowa” FF:
−
N
+
N +1
f i = Ni − Ni
f i = Ni
N −1
− Ni
N
1 −
+
fi = fi + fi
2
0
[
]
CO
nukleofilowa” FF
CO –– „„nukleofilowa”
FF
0.76
0.54
0.24
0.46
0.79
0.74
0.21
0.26
CO
elektrofilowa” FF
CO –– „„elektrofilowa”
FF
0.91
0.81
0.09
0.19
0.71
0.74
0.29
0.26
HCN
nukleofilowa” FF
HCN –– „„nukleofilowa”
FF
0.00
0.20
0.58
0.45
0.42
0.35
0.11 0.66
0.12
0.60
0.23
0.28
HCN
elektrofilowa” FF
HCN –– „„elektrofilowa”
FF
0.02
0.17
0.14
0.57
0.84
0.26
0.16
0.18
0.47
0.42
0.36
0.40
H
nukleofilowa” FF
H22CO
CO –– „„nukleofilowa”
FF
H
nukleofilowa” FF
H22CO
CO –– „„nukleofilowa”
FF
0.00
0.67
0.16
0.17
0.33
0.51
0.14 0.48
0.14
0.45
0.23
0.26
Pirol
elektrofilowa” FF
Pirol –– „„elektrofilowa”
FF
0.01
0.37
0.12
0.01
0.19
0.09
0.15
0.20
0.15
0.00
0.18
0.10
Podstawienie
Podstawienieelektrofilowe
elektrofilowewwpirolu,
pirolu,furanie
furanieiitiofenie
tiofenie
Jednoreagentowe indeksy reaktywności
Funkcja Fukui’ego akrylanu metylu
fi f - (r)
Dwureareagentowe indeksy reaktywności
Uwzględniają obecność drugiego reagenta;
Zależą od wzajemnej orientacji reagentów
w danym kompleksie
Dwureareagentowe indeksy reaktywności
Kompleksy akrylanu metylu
z palladowym katalizatorem diiminowym
fi -
Dwureareagentowe indeksy reaktywności
Dwureagentowe funkcje Fukui’ego (FF CT)
akrylanu metylu w kompleksach π i σ
fi -