Post. Nauk Med., 1993, t. VI, 37-39
Ewa Zbrojkiewicz, Janusz S. Zbrojkiewicz, Sławomir Graff, Andrzej Głąbiński, Artur Kozłowski
Zastosowanie hodowli komórek wyizolowanych z płynu mózgowo-rdzeniowego
w cytodiagnostyce neurologicznej
II Katedra i Zakład Patofizjologii Śl. AM w Katowicach
Kierownik: prof. dr hab. n. med. F. Zych
I Katedra i Klinika Neurologii Śl. AM w Katowicach
Kierownik: prof. dr hab. n. med. A. Wajgt
Oddział Neurologiczny Centralnego Szpitala Górniczego w Katowicach
Ordynator: prof. dr hab. n. med. Z. Kazibutowska
Zakład Farmakologii Śl. AM w Katowicach
Kierownik: prof. dr hab. n. med. H.l. Trzeciak
Streszczenie
Przedstawiono próby zastosowania hodowli in vitro komórek
wyizolowanych z płynu mózgowo-rdzeniowego w cytodiagnostyce neurologicznej. Powyższą metodykę użyto w celu potwierdzenia rozpoznania nowotworów ośrodkowego
układu nerwowego lub oceny ich wrażliwości w celowanej
chemioterapii. Wiarygodność uzyskiwanych wyników polegała na możliwości namnażania i identyfikacji komórek
nowotworowych. W identyfikacji komórek nowotworowych
wykorzystano kryteria podane przez Barkera i Stanforda lub
zmodyfikowaną skalę Papanicolaou.
Nowszą metodą rozpoznawania komórek była ich identyfikacja immunocytochemiczna z zastosowaniem przeciwciał monoklonalnych. Wykazano istotną wyższość opisanych
metod z zastosowaniem hodowli komórek nad bezpośrednimi metodami cytologicznymi w cytodiagnostyce neurologicznej.
Pleocytoza płynu mózgowo-rdzeniowego (pmr) towarzyszy wielu chorobom ośrodkowego układu nerwowego. Znajdujące się w nim komórki pochodzą nie tylko ze ścian
przestrzeni płynowych, lecz także z przestrzeni okołonaczyniowych Virchowa-Robina (4). Pojawienie się dodatkowej
liczby komórek często wiąże się z uszkodzeniem bariery
krew-mózg.
Pierwsze badania dotyczące hodowli komórek wyodrębnionych z pmr pochodziły z lat sześćdziesiątych obecnego
stulecia (4, 5, 9, 10, 17). Były to prace Lumsdena (1960) i
Sayka (1966), a polegały na próbie hodowania komórek
nowotworowych. Muller i wsp. (1967, 1970, 1971) zmodyfikowali dotychczasowe warunki prowadzenia hodowli,
wprowadzając sposoby intensywnego namnażania komórek
w warunkach in vitro. Powyższe udoskonalenie, jak możliwość zagęszczania pmr, uwiarygodniło ocenę cytologiczną
nawet przy nieznacznej pleocytozie. W związku z tym
zwiększył się stopień prawdopodobieństwa znalezienia nawet nielicznych komórek nowotworowych (18). Dla potwierdzenia cytochemicznej tożsamości komórek wymagane było
wykonanie kilku odczynów barwnych, a następstwie czego
wyłoniła się konieczność dysponowania jeszcze większą
liczbą komórek. Dlatego w dalszym ciągu udoskonalano
metodę ich namnażania i wzrostu w hodowli in vitro (1, 2,4,
5, 7, 9, 11, 14, 17).
Istnieją różne możliwości wykorzystania hodowli komórkowej w cytodiagnostyce neurologicznej, a mianowicie:
1. Możliwość uzyskania znacznej liczby komórek do
przeprowadzenia wybiórczych odczynów histochemicznych.
2. Możliwość potwierdzenia wzrostu nowotworowego
przy jednoczesnym przeciwwskazaniu do wykonania biopsji
mózgu.
3. Możliwość określenia wrażliwości lekowej w indywidualnej i celowanej chemioterapii przeciwnowotworowej.
4. Możliwość wewnątrzkomórkowej replikacji antygenów wirusowych w niektórych neuroinfekcjach.
Dotychczas opracowano różne sposoby zagęszczania komórek z pmr (1, 2, 4, 5, 7, 9, 11, 14, 17). Najczęściej pmr
poddaje się powolnemu odwirowaniu, w celu uzyskania
„wzbogaconego koncentratu komórkowego." Następnie
przenosi się komórki do płynu odżywczego. Zagęszczanie w
metodzie Sayka (4, 18) polega na zastosowaniu komory
sedymentacyjnej skonstruowanej przez autora.
Namnażanie komórek z pmr nie jest zabiegiem trudnym
technicznie, pod warunkiem zachowania jałowości w czasie
całego cyklu hodowlanego. Najczęściej używanym podłożem
jest pożywka Eagle'a (MEM) z dodatkiem surowicy cielęcej
w stężeniach 5-20% (1,2, 5, 7, 11). Jałowo pobrany materiał
komórkowy umieszcza się w szklanych lub plastykowych
naczyniach hodowlanych, np. w rurkach Leightona (1, 2, 7.
17), butelkach Brockwaya (17) lub na szkiełkach nakrywkowych umieszczonych na szalkach Petriego (1, 6). Całość
inkubuje się w temperaturze 37°C, w atmosferze zawierającej
95% powietrza i 5% C02 (1, 4, 6, 14). Poprzez regulowany
dopływ powyższej mieszaniny gazów uzyskuje się optymalną
wartość pH niezbędną do wzrostu i namnażania się komórek
w płynie odżywczym. Często stosuje się prostsze techniki
polegające na namnażaniu komórek w zamkniętym naczyniu
z pożywką (2, 5, 7, 17). Istnieją takie bardziej złożone
metody inkubacji, które niezależnie od dopływu egzogennego C02 wymagają zastosowania roztworów buforowych
lub związków chemicznych umożliwiających komórkom
zwiększoną syntezę endogennego C02, np. pirogronianu sodu
(1). Stosuje się również inne podłoża, np. płyn Eagle'a w
modyfikacji Dulbecco (DMEM), podłoże Pucka, a nawet
naturalny płyn mózgowo-rdzeniowy (1,17). Czas potrzebny
do namnożenia się komórek o optymalnej liczbie przeciętnie
wynosi 6-12 dni.
Na uwagę zasługuje technika namnażania komórek nowotworowych opisana przez Sano i wsp. (7, 18). Autorzy
zastosowali filtry membranowe typu Millipore jako podłoża
do wzrostu komórek. Stwierdzili nie tylko znaczny stopień
namnażania się komórek, lecz również ich rozprzestrzenianie się na sąsiednie powierzchnie szklanego naczynia. Oczywiście u podstaw tej i innych metod leży wyjątkowa zdolność
komórek nowotworowych do proliferacji. Jednak należy
zaznaczyć, że wśród komórek występujących w pmr spotyka
się wiele komórek atypowych i zidentyfikowanie nowotworu
38
nie jest sprawą łatwą. Dodatkowym utrudnieniem jest
zjawisko „maskowania się" komórek nowotworowych w
wypadku występowania niewielkiej ich liczby przy równoczesnej znacznej pleocytozie.
Barker i Stanford (2) podali kryteria umożliwiające ocenę
złośliwości wyhodowanych komórek, a mianowicie:
1. Występowanie więcej niż 5 komórek w polu widzenia,
przy powiększeniu immersyjnym (ok. 1000 x).
2. Obecność rozet komórkowych (więcej niż 3 połączone
komórki).
3. Występowanie więcej niż jednego jądra w komórce.
4. Występowanie więcej niż trzech jąderek w komórce;
5. Stwierdzenie stosunku powierzchni jądra do cytoplazmy większego niż 0,5 (tj. pole jądra większe niż połowa pola
komórki);
6. Występowanie różnorodnych pod względem morfologicznym komórek (wzrost wielopostaciowy);
7. Obecność silnie zasadochłonnej cytoplazmy;
Komórki spełniające więcej niż cztery kryteria zaliczane są
do złośliwych; spełniające mniej niż cztery kryteria są
określane jako wątpliwe. Natomiast komórki nie spełniające
żadnego z powyższych kryteriów określa się jako łagodne.
Pomijając dwa pierwsze kryteria oparte na liczbie komórek
występujących w polu widzenia, pozostałe można określić
jako wewnątrzkomórkowe zmiany morfologiczne.
Wielu badaczy próbowało klasyfikować komórki wg
zmodyfikowanej skali Papanicolaou dla pmr, tj.:
1° brak komórek atypowych;
2° komórki z pojedynczymi cechami atypii;
3° komórki z licznymi cechami atypii;
4° komórki atypowe podejrzane jako nowotworowe;
5C komórki nowotworowe o ustalonym typie histologicznym.
Powyższe kryteria oceny złośliwości wyhodowanych komórek nowotworowych straciły na aktualności wobec możliwości użycia specyficznych przeciwciał monoklonalnych w
nowoczesnych metodach immunocytochemicznych (20).
Metody te umożliwiają przeprowadzenie dokładnej klasyfikacji komórek nowotworowych dzięki posiadanym przez nie
antygenom, które niejednokrotnie są markerami danego
rodzaju komórek. Najczęściej wykorzystuje się przeciwciała
monoklonalne skierowane przeciwko białkom filamentów
pośrednich, takich jak: cytokeratyna, desmina, wimentyna,
kwaśne białko filamentów glejowych, białka neurofilamentów oraz włókienka neuronalne. Dla różnicowania komórek
pmr opracowano zestaw przeciwciał składający się ze znaczników dla tkanki neuroektodermalnej, cytokeratyny nabłonkowej, neoplastycznych neuroblastów i przeciwciała panleukocytarnego. Umożliwia on wstępne różnicowanie
między pierwotnymi guzami mózgu, przerzutami nowotworowymi, chłoniakami i białaczkami. Istnieje ponadto
możliwość dokładnego rozpoznania różnicowego nowotworu
z użyciem innych zestawów przeciwciał monoklonalnych
(np. różnicowanie między astrocytoma, oligodendroglioma i
ependymoma). Jednak dla uzyskania sukcesu diagnostycznego niezbędna jest wystarczająca ilość materiału komórkowego, stąd konieczność namnażania komórek in vitro.
Poszukiwano innych bezpośrednich dowodów potwierdzających tożsamość komórek nowotworowych uzyskiwanych w hodowli in vitro w porównaniu do komórek występujących w guzach mózgu.
Rosenblum i wsp. (14) namnażali komórki uzyskiwane z
biopsji mózgu. Uzyskany materiał poddawali trypsynizacji
lub specyficznemu działaniu enzymatycznemu (pronaza,
kolagenaza, DNAza). Następnie komórki namnażali in vitro,
uzyskując trójwymiarowe, wielokomórkowe agregaty
(sferoidy). Komórki te posiadały wiele cech złośliwości.
E. Zbrój kiewicz i wsp.
Niektóre z nich o średnicy większej niż 250 mikrometrów
zawierały ogniska martwicy łącznie z obszarami
bezkomórkowcj macierzy. Ze względu na ich duże wymiary,
można było je badać techniką histologiczną, podobnie jak
materiał tkankowy. Wykazano również, że komórki
uzyskiwane ze złuszczających się powierzchniowych warstw
guza były podobne do komórek wyhodowanych z bioptatu
guza mózgu. Dlatego w ocenie morfologicznej tychże
komórek nowotworowych, uzyskiwanych z hodowli
traktowano je podobnie jak komórki badanego guza mózgu.
Z kolei Kajikawa i wsp. (7) prowadzili hodowle komórek
uzyskiwanych z pmr pacjentów, u których wcześniej rozpoznano glejaki. W 37% hodowli stwierdzono komórki nowotworowe. Podobne badania prowadzono z nowotoworami
dającymi przerzuty do O.U.N. i uzyskano zgodność rozpoznania u 40% badanych pacjentów.
Macki wsp. (2) prowadzili podobne obserwacje, uzyskując
23% pozytywnych wyników w grupie 35 przypadków pierwotnych i przerzutowych nowotworów wewnątrzczaszkowych. Największy odsetek pozytywnych wyników (46%)
uzyskali Sano i wsp. (2) w grupie pacjentów z glejakami.
Na uwagę zasługuje fakt, że charakter proliferacji komórek glejaka, złuszczonych do pmr był podobny do proliferacji
komórek glejowych w hodowli tkankowej (6,14). Natomiast
komórki złuszczone z nowotworów nabłonkowych (przerzutowych) często ulegały degeneracji w hodowli. Dlatego
też bezpośrednie badanie cytologiczne nowotworów pochodzenia nabłonkowego jest bardziej miarodajne od hodowli komórkowej np. gruczolakoraka (adenocarcinoma). W
innych typach nowotworów, np. w mięsaku, czerniaku lub
brodawczaku splotu naczyniówkowego, stwierdzono wzrost
komórek w hodowli (2).
Odmiennym problemem diagnostycznym jest zróżnicowanie komórek nienowotworowych występujących w pmr, a
ulegających wzrostowi w hodowli. Do takich elementów
morfotycznych można zaliczyć limfocyty i monocyty (5,10).
Proliferujące komórki monocytarno-histiocytarne przyjmują
w hodowli kształt wielokątny lub pólksiężycowaty oraz
zmieniają swoje położenie na płytkach hodowlanych. Niektóre typy tych hodowli były podobne do fibroblastów,
natomiast inne zawierały komórki olbrzymie. Powstawanie
tych ostatnich tłumaczy się reakcją na niekorzystne warunki
hodowli (np. zmiana pH, wahania temperatury, itp.). Komórki monocytarno-histiocytarne stwierdzono również w pmr w
przypadkach przewlekłych procesów zapalnych w OUN.
Muller i wsp., stosując metodę hodowli komórek wyizolowanych z pmr oraz technikę immunofluorescencji, stwierdzili wewnątrzkomórkową obecność antygenów wirusa nagminnego zapalenia ślinianek przyusznych, zwłaszcza w
przypadkach wtórnego zajęcia układu nerwowego (11).
Dlatego hodowle komórek nowotworowych stosunkowo
łatwo można było porównać z ich formami wyjściowymi. Z
kolei komórki nienowotworowe były trudne w identyfikacji
morfologicznej (1, 4, 5, 10, 11).
Z drugiej strony za ograniczonym stosowaniem badań
cytologicznych pmr w nowotworach OUN przemawia stosunkowo niski odsetek wyników pozytywnych mieszczących
się w granicach 1,9-33% (3). Niska wykrywalność komórek
nowotworowych zależy od wielu czynników. Podstawowym
kryterium jest anatomiczne umiejscowienie nowotworu,
gdyż nie zawsze dochodzi do rozsiewu komórek nowotworowych do przestrzeni płynowych. Innym ważnym czynnikiem jest struktura biologiczna nowotworu. Oponiaki mają
wysoki stopień spoistości, co powoduje, że tylko niektóre
komórki są w stanie oderwać się od głównej masy guza i
przeniknąć do pmr. Inne nowotwory, zwłaszcza nisko
zróżnicowane i szybko rosnące, wskutek wolniejszej prolife-
Zastosowanie hodowli komórek z płynu mózg.-rdz.
racji naczyń krwionośnych, w porównaniu ze wzrostem
guza, zawierają ogniska rozpadu i martwicy. W tych nowotworach spoistość guza jest o wiele mniejsza i komórki z
powierzchni guza łatwiej złuszczają się do pmr (3). Z kolei z
przypadkach procesów wieloogniskowych umiejscowionych
w oponach miękkich, takich jak np. rakowatość opon,
czerniakowatość opon czy też nacieki białaczkowe, wykrywalność sięga 100%.
W przypadku uzasadnionego podejrzenia wewnątrzczaszkowego procesu rozrostowego najczęściej rezygnuje się z
nakłucia lędźwiowego, często pomimo braku przeciwwskazań. Dlatego też większość pozytywnych wyników
stanowią rozpoznania przypadkowe. Szybki rozwój komputerowych technik diagnostycznych (np. tomografia komputerowa - TK) również nie forsuje badań pmr. Także brak
zgody pacjenta na nakłucie lędźwiowe uniemożliwia wykonanie badań cytologicznych. Warto jednak wspomnieć, że
w monitorowaniu meningioz białaczkowych badanie cytologiczne pmr jest metodą z wyboru. Zdarza się, że nowoczesne metody neuroobrazowania OUN. dają wynik fałszywie
dodatni. Wielokrotnie porównywano obrazy TK z wynikami badań autopsyjnych, Nie tak rzadko znajdowano przypadki fałszywie dodatnie, bądź fałszywie ujemne (12, 19).
Dlatego wydaje się, że TK częściej należałoby weryfikować
innymi badaniami dodatkowymi. Przykładem może być
opisany przypadek pierwotnego czerniaka wewnątrzczaszkowego, w którym TK głowy wykazała mnogie ogniska
krwotoczne, obustronna angiografia szyjna dała wynik
negatywny, a badanie cytologiczne pmr ujawniło liczne
komórki czerniaka, co zostało następnie potwierdzone histopatologicznie (19).
Reasumując, wprowadzenie oceny morfologicznej komórek wyhodowanych in vitro jest wielce przydatne w diagnostyce neurologicznej, jednak nie decyduje o ostatecznym
rozpoznaniu. Przydatność diagnostyczna techniki hodowli
39
komórek wyizolowanych z pmr znajduje coraz szersze
zastosowanie praktyczne (2, 7, 14). Dalszym osiągnięciem
było wzbogacenie techniki identyfikacyjnej przez użycie
przeciwciał monoklonalnych (20).
Z innych zastosowań na uwagę zasługują próby wykorzystania hodowli in vitro do oceny wrażliwości komórek na
działanie leków przeciwnowotworowych. Dotychczas nie
przeprowadzano badań na komórkach pochodzących z pmr,
lecz wykorzystano komórki z biopsji cienkoigłowej mózgu
(14, 16). Znanym zjawiskiem jest występująca oporność
komórek nowotworowych na cytostatyki in vivo, pomimo
ich wrażliwości w badaniach in vitro. Wyjaśnienie mechanizmów tego zjawiska utrudnia fakt braku całkowitej znajomości biologii nowotworów układu nerwowego (15). Często
wrażliwość komórek nowotworowych jest odmienna w badaniach in vivo i in vitro. Skuteczność terapii przeciwnowotworowej zależy przede wszystkim od stężenia leku cytostatycznego lub jego metabolitów w komórce nowotworowej. Natomiast nieskuteczność in vivo może wynikać z braku
dostępności biologicznej leku, ze zbyt niskiego stężenia leku
w komórce, czy wreszcie z istnienia enzymatycznych mechanizmów oporności. Przykładem niwelacji oporności enzymatycznej jest stosowanie kwasu etakrynowego, który odwraca
oporność wywołaną przez transferazę S-glutationu (13).
Hodowla komórek nowotworowych wyizolowanych z
pmr stanowi kolejny krok w celu wyjaśnienia biologii
nowotworów O.U.N., a jej wykorzystanie w monitorowanej
terapii nowotworów mózgu znajduje coraz szersze zastosowanie kliniczne (8).
Wzbogacenie cytodiagnostyki neurologicznej przez wprowadzenie hodowli komórek pochodzących z pmr jest korzystne zarówno pod względem diagnostycznym, jak i leczniczym. Wydaje się, że należy oczekiwać dalszych modyfikacji metodycznych poprawiających skuteczność diagnostyki
pmr.
E. Z b r o j kiewicz, J.S. Zb ro j ki e wi c z , S. G r a f f, A. Gł ą b i ń s ki , A. K o z ł o w s k i
The use of culturs of cells isolated from cerebrospinal fluid in neurological diagnosis
Summary
Trials are reported of using in vitro cultured cells isolated from the
cerebrospinal fluid in neurological cytodiagnosis. The method was
applied for confirming the diagnosis of central nervous system
neoplasms or for the assessment of their sensitivity to targeted
chemotherapy. The reliability of the obtained results was owed
mainly to the possibility of growing and identification of malignant
cells. For the identification of the malignant cells the Barker-Stanford criteria or the modified Papanicolau scalę were used.
A newer method for the diagnosis of cells was their immunocytochemical identification using monoclonal antibodies. The presented
methods were superior to direct cytological methods in neurological
cytodiagnosis.
Piśmiennictwo
I. Adams R.L.: Celi culture for biochemists. Elsevier (North
Holland, Biomedical Press, 1980. - 2. Black PM., Callahan L.V.,
Kornblitk P.L.: J. Neurosurg. 1978, 49, 697. - 3. Bubik M. i wsp,:
Wiad. Lek. 1985,4,295.-4. Dommasch D., Mertenss H.: Cerebrospinalflussigkeit. Georg Thieme Verlag, Stuttgart-New York, 1980.
- 5. Dommasch D.: J. Neurol. 1975,209,103. - 6. Gilden D.H. i wsp.:
J Neurol. Sci., 1976, 29, 177. - 7. Kajikawa H. i wsp.: Acta Cytol.
1977, 21, 162. - 8. Liikmark J., Peterson C.: Ciin. Pharmacokinet.
1991, 21, 213. - 9. Lumsden CE:. Tissue culture of brain tumors.
- W: Handbook of Clinical Neurology (eds), Vinken P.J. i Bruyn
G.W., North Holland, Amsterdam-Oxford, 1974,672. -10. Malashkia Y.A., Geladze M.G.: Neurology, 1976, 26, 1081.
II. Muller W.K., Yersteeg J., van der Kuip L:. Z. Neurol. 1972,
202, 159.- 12. Musiol A. i wsp.: Some aspectsofCT diagnosis in the
cerebrovascular diseases. W: Neuroimaging, Gustav Fischer Yerlag,
Stuttgard, New York 1985, 161. - 13. Phillips P.C.: Neurol.-Clin.,
1991, 9 (2), 383. - 14. Roscnbhm M.L. i wsp.: J. Neurosurg., 1983,
58, 170. - 15. Schuster J.M., Friedman H.S., Bigner D.D.: Neu-rolClin., 1991, 9(2), 375. - 16. Siherman J.F. i wsp.: Cancer, 1986,
58,1117. - 17. Wilson Ch. B., Barker M.\ Neurology, 1966, 16, 1064.
- 18. Zbrojkiewicz J.S., Szeliga-Centarska M:. Pol. Tyg. Lek., 1986,
10,292. - 19. Zbrojkiewicz J.S. i wsp.: Pol. Tyg. Lek., 1987,45,1427. 20. Zbrojkiewicz J.S., Głąbiński A., Graff S:. Pol. Tyg. Lek., 1988,
23, 731.
Pracę otrzymano: 1992.03.02,
Adres autorów: Ewa Zbrojkiewicz, ul. Radockiego 254 m. 4,
40-645 Katowice.
POLSKI TYGODNIK LEKARSKI 1988.
T. XLIII. Nr 23
ARTYKUŁ REDAKCYJNY
JANUSZ S. ZBROJKIEWICZ, ANDRZEJ GŁĄBIŃSKI, SŁAWOMIR GRAFF
Zastosowanie przeciwciał monoklonalnych
w cytodiagnostyce onkologicznej
płynu mózgowo-rdzeniowego
(Z I Katedry i Kliniki Neurologii SI. AM w Katowicach; kierownik: doc. dr hab. n. med. A. Wajgt i Oddziału Neurologicznego Centralnego
Szpitala Górniczego w Katowicach; kierownik: doc. dr hab. n. med. Z. Kazibutowska)
SŁOWA KLUCZOWE: przeciwciała monoklonalne; cytodiagnostyka onkologiczna; płyn mózgowo-rdzeniowy
Wykrycie przeciwciał monoklonalnych przyśpieszyło rozwój nauk medycznych. Obecnie wykorzystuje się je zarówno w
badaniach doświadczalnych (immunologia, genetyka), jak i klinicznych (w tym w diagnostyce onkologicznej,
mikrobiologicznej, serologicznej) oraz w seroterapii nowotworów (11).
Wielką zaletą przeciwciał monoklonalnych jest ich homogenność. Immunoglobuliny są bardzo różnorodne (klasy,
podklasy, allele). Przeciwciała monoklonalne są pod tym względem bardzo swoiste i charakteryzują się:
- swoistością izotypową, dotyczącą poszczególnych klas i podklas immunoglobulin w obrębie tego samego gatunku
(swoistość gatunkowa);
- swoistością idiotypową, związaną z obecnością odpowiednich ugrupowań antygenowych w części wiążącej przeciwciała.
Jest ona uwarunkowana sekwencją aminokwasów obszaru zmiennego cząsteczki immunoglobuliny ( 8, 13 ).
Stosowane od lat przeciwciała heterogenne nie mają tych zalet, a tym samym ich swoistość jest znacznie mniejsza.
Wytwarzanie przeciwciał monoklinalnych przebiega w następujących etapach:
a) kilkakrotna immunizacja myszy wybranym antygenem.
732
Przeciwciała monoklonalne
b) pozyskanie śledziony uodpornionej myszy i wyodrębnienie z niej limfocytów B,
c) fuzja limfocytów z komórkami szpiczaka myszy w
celu uzyskania hybryd,
d) selekcja hybryd,
e) hodowla wybranych klonów in vivo lub in vitro (8).
Klon wytawarzający przeciwciała określa się jako
hybrydoma. Obecnie przeciwciała monoklonalne są
dostępne na rynku w formie preparatów, produkowanych
m.in. przez Amersham, Becton-Dickinson, Coulter, Dako,
Labsystems, Miles, Sigma.
Metody uwidaczniania kompleksów antygen-przeciwcialo w preparatach histologicznych
i cytologicznych
W celu jak najlepszego uwidocznienia kompleksów
antygen-przeciwciało rozwinięto wiele technik immunologicznych. Metody te można ogólnie podzielić, w
zależności od sposobu uwidaczniania kompleksów, na
histochemiczne, w których substancją wykrywaną jest
najczęściej enzym, i fluorescencyjne, w których kompleksy
są znakowane fiuoresceiną. Metody histochemiczne mają
przewagę nad fluorescencyjnymi, ponieważ przy ich
stosowaniu potrzebny jest zwykły mikroskop świetlny.
Istnieje jeszcze wiele innych metod identyfikacyjnych z
użyciem przeciwciał monoklonalnych opartych na
elektroforezie białek, immunofiksacji i technikach
immunoblottingu.
Zależnie od mechanizmu powstawania połączeń
immunologicznych, techniki te można podzielić na:
a) bezpośrednie,
b) pośrednie,
c) z użyciem kompleksów:
peroksydaza-antyperoksydaza
awidyna-biotyna.
Większość z tych technik może być stosowana w
modyfikacji histochemicznej lub fluorescencyjnej. Ze
względu na wymienione korzyści, częściej używane są
metody histochemiczne.
Najczęściej stosuje się w nich jako znacznik enzym
peroksydazę, która ma wiele zalet:
1) jest bardzo trwała oraz łatwo osiągalna w czystej
postaci, a więc jest niewielkie prawdopodobieństwo
zanieczyszczeń,
2) niewielkie rozmiary jej cząsteczki nie przeszkadzają w
łączeniu się przeciwciał,
3) aktywność peroksydazy endogennej jest niewielka,
4) istnieje wiele związków, które w reakcji z peroksydazą
dają barwny produkt końcowy,
5) jest tania.
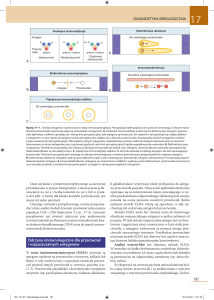
Immunoperoksydazowa metoda bezpośrednia polega na
reakcji antygenu ze swoistym przeciwciałem (np.
monoklonalnym) sprzężonym z peroksydazą (ryc. 2a).
Następnie stosuje się barwnik, który ujawnia obecność
peroksydazy, a więc pośrednio i antygenu. Badanie metodą
bezpośrednią można wykonać bardzo szybko, z małym
prawdopodobieństwem reakcji nieswoistych. Główną wadą
tej metody jest to, że do lokalizacji każdego antygenu
potrzebne jest inne, sprzężone z peroksydazą, przeciwciało.
Metoda ta jest stosowana m.in. do wykrywania
immunoglobulin,
dopełniacza
i
kompleksów
immunologicznych, uzyskanych z bioptatów nerkowych i
skórnych, np. w układowym toczniu rumieniowatym (1).
Metoda pośrednia wymaga zastosowania dodatkowego
przeciwciała. Swoiste przeciwciało (tzw. pierwotne) wiąże
się z antygenem. Do wykrycia tego kompleksu stosuje się
drugie przeciwciało, które jest połączone z peroksydazą.
Następnie dodaje się barwnik, jak w metodzie bezpośredniej.
Zaletą metody pośredniej jest to, że różnorodne przeciwciała
pierwotne, pochodzące jednak od danego gatunku, można
wykryć za pomocą jednego przeciwciała wtórnego,
znakowa-
Przeciwciała monoklonalne
nego peroksydazą, które jest skierowane przeciwko
immunoglobulinom tego gatunku. Wadą natomiast jest
większe
prawdopodobieństwo
wystąpienia
reakcji
nieswoistych. Głównym zastosowaniem tej metody jest
identyfikowanie przeciwciał w surowicach chorych z
różnymi
schorzeniami
autoimmunologicznymi,
bakteryjnymi i pasożytniczymi (1, 7).
Metoda PAP wymaga zastosowania 3 odczynników:
pierwszego przeciwciała skierowanego przeciwko poszukiwanemu antygenowi, wtórnego przeciwciała oraz
kompleksu PAP, składającego się z enzymu peroksydazy i
przeciwciała przeciwko niemu. Wtórne, tzw. łączące
przeciwciało jest zdolne do połączenia pierwotnego
przeciwciała z kompleksem PAP, ponieważ oba pochodzą
od tego samego gatunku zwierząt (ryc. 2c). Enzym
peroksydazą jest dalej wykrywany za pomocą reakcji
barwnej. Korzyścią takiego skomplikowania metody jest
zwiększenie jej czułości. Jednym z ważniejszych
zastosowań tej metody jest określanie pochodzenia
komórek i tkanek nowotworowych na podstawie
identyfikacji swoistych antygenów komórkowych (1, 7).
Metoda awidyna-biotyna wykorzystuje dużą zdolność
glikoproteiny
awidyny
do
nieimmunologicznego
przyłączania cząsteczek witaminy — biotyny. Tak jak w
metodzie PAP, używane są 3 odczynniki. Pierwszym z nich
jest przeciwciało skierowane przeciwko poszukiwanemu
antygenowi. Drugie przeciwciało, związane z biotyną, jest
zdolne do przyłączania pierwszego. Trzecim składnikiem
jest kompleks, składający się z peroksydazy połączonej z
awidyną-biotyną. Wolne miejsca na cząsteczce awidyny
zezwalają na połączenie z biotyną na drugim przeciwciele
(ryc. 2d). Również i w tym przypadku peroksydazą, a więc i
poszukiwany antygen, są ujawniane za pomocą
odpowiedniego barwnika. Silne powinowactwo awidyny do
biotyny zwiększa czułość metody w porównaniu z innymi,
w których występuje przeciwciało sprzężone z peroksydazą
(metoda bezpośrednia i pośrednia). Jest to metoda
wprowadzona niedawno i jak dotąd służy do oznaczania
białek wirusów i fllamentów pośrednich (1, 7).
Ostatnio pojawia się coraz więcej prac, porównujących
opisane metody. Sternberg i Sternberg uważają, że metoda
PAP jest czulsza od metody awidyna-biotyna w zwykłych
rozcieńczeniach przeciwciała. Natomiast w miarę wzrostu
stopnia rozcieńczania jej przewaga nad metodą awidynową
jest mniej wyraźna. Dodatkową zaletą metody PAP miałoby
być umożliwienie zróżnicowania neurofilamentów o dużym
i małym stopniu fosforylacji, czego nie można osiągnąć za
pomocą metody awidyna-biotyna. Inną wadą tej ostatniej
jest jej nieprzydatność do oznaczania stężenia antygenu, czy
porównywania miejsc o dużym i małym stężeniu antygenu
(12).
Ważnym zagadnieniem towarzyszącym wszystkim
metodom immunocytochemicznym, jest prawdopodobieństwo wystąpienia nieswoistych połączeń przeciwciała z
antygenami tkankowymi. Nawet używając przeciwciał
monoklonalnych
bardzo
wybiórczo
działających,
udokumentowano przypadki reakcji krzyżowych. Aby temu
zapobiec,
często
przeprowadza
się
próby
monowybiórczości. Wykorzystuje się w tym celu m.in.
techniki
precypitacji
w
żelu,
unieczynnienia,
immunoprecypitacji czy metody z użyciem znaczników
radioaktywnych (7).
Kolejnym istotnym zagadnieniem jest możliwość
wystąpienia zafałszowań pochodzących z samej tkanki czy
komórki badanej. Używając znaczników fluorescen-
733
cyjnych należy brać pod uwagę autofluorescencję
lipofuscyny, a przy metodach peroksydazowych —
aktywność peroksydazową lizosomów. Aby umknąć
błędów, należy wiedzieć, które struktury w obrębie
badanego materiału mają determinanty te same lub zbliżone
do poszukiwanego antygenu (7).
Zastosowanie przeciwciał monoklonalnych w
diagnostyce neuroonkologicznej
W diagnostyce nowotworów układu nerwowego
większość badaczy zwraca uwagę na dużą przydatność
oznaczania filamentów pośrednich — układu włókienek o
średnicy 10 nm, które stanowią zrąb c y t o s k e 1 e t o n u
obok mikrotubul (20-25 nm) i mikrofilamentów (poniżej 10
nm). Wyróżniono 5 grup filamentów pośrednich, a każda z
nich doczekała się już swoich przeciwciał monoklonalnych.
Są przeciwciała monoklonalne skierowane przeciwko
białkom następujących filamentów pośrednich (4 rodzaje
białek oraz neurofilamenty):
a) cytokeratynie (tonofibryle) występującej w komórkach
nabłonkowych i wywodzącej się z nabłonków, np.:
carcinoma basocellulare, transitional cell carcinoma,
adenocarcinoma, chordoma, synovial sarcoma;
b) desminie, występujące głównie w mięśniach
szkieletowych, gładkich i mięśniu sercowym oraz guzach i
przerzutach
pochodzenia
miogennego,
np,
rhabdomyosarcoma, leiomyosarcoma;
c) wimetnynie, występujące głównie w komórkach
tkanki łącznej, tj. guzach i przerzutach pochodzenia
mezenchymalnego, np.: sarcoma, lymphoma, melanoma,
schwannoma, endothelioma;
d) kwaśnemu białku filamentów glejowych (GFAP),
charakterystycznemu dla komórek glejowych, a tym samym
guzów i przerzutów pochodzenia glejowego np.:
astrocytoma, ependymoma. Oligodendrocyty GFAP nie
zawierają.
e) neurofilamentom (neurofibryllom) — włóknom
neuronów spotykanych także w przypadkach pheochromocytoma i neuroblastoma.
Neurofilamenty są głównymi składnikami cystoskeletonu komórek nerwowych. Występują w formie
uporządkowanych sieci. System ich połączeń i rozgałęzień
wypełnia cytoplazmę perikarionu, aksonów i dendrytów.
Białka neurofilamentów ssaków są biochemicznie i
immunologicznie różne od białek neurofilamentów ptaków,
płazów i ryb. Odznaczają się dużą swoistością
polipeptydów. Wyodrębniono kilka frakcji neurofilamentów
o masie cząst. 200 000, 160 000, 69 000 i 68 000.
Przedostatnia z frakcji jest charakterystyczna dla aksonów.
Frakcja 200000 jest typowa dla guzów i przerzutów
pochodzących
z
układu
współczulnego,
np.
ganglioneuroblastoma. Frakcja 160000, podobnie jak
68000, także wykazuje związek z guzami układu
współczulnego, przy czym pierwsza z nich daje również
reakcje krzyżowe w przypadkach raków i mięsaków.
Przeciwciała monoklonalne przeciw poszczególnym
frakcjom neurofilamentów nie dają reakcji krzyżowych
między sobą, przykładowo — przeciwciała monoklonalne
przeciw neurofilamentom frakcji 68 000 nie wykrywa
polipeptydów frakcji 200 000. Niektóre z wymienionych już
firm produkują zestawy przeciwciał monoklonalnych
skierowanych przeciwko filamentom pośrednim (6, 10).
W razie potrzeby zestaw przeciwciał monoklonalnych
stosowanych w diagnostyce może zostać zwiększony,
Obecnie są juz dostępne na rynku preparaty
734
Przeciwciała monoklonalne
przeciwciał monoklonalnych skierowane przeciwko prawie
wszystkim rodzajom komórek. Poza strukturami swoistymi
cystoskeletonu antygenem dla przeciwciał monoklonalnych
mogą być także inne elementy struktury komórkowej oraz
produkty syntezy komórki. Dotyczy to zwłaszcza komórek
układu limfatycznego, przeciwko którym istnieje najbogatszy
zestaw przeciwciał monoklonalnych.
Przydatność przeciwciał monoklonalnych
w cytodiagnostyce onkologicznej płynu mózgowo-rdzeniowego
Badania cytoonkologiczne płynu mózgowo-rdzeniowego
należą do najtrudniejszych działów cytodiagnostyki.
Trudności powodowane są zarówno niewielką liczbą
elementów komórkowych w płynie mózgowo--rdzeniowym,
jak i problemami związanymi z ich wychwytem w celu
sporządzenia
bogatokomórkowego
cytogramu
oraz
trudnościami w samej ocenie uzyskanej populacji
komórkowej (2, 15).
Część problemów została rozwiązana z chwilą wprowadzenia sączenia przez filtry membranowe, co umożliwia
wychwyt prawie 100% komórek z płynu mózgowordzeniowego, tym samym zwiększając możliwość znalezienia
w badanej populacji komórkowej gniazd proliferacyjnych, a
nawet pojedynczych komórek nowotworowych (9, 14).
Nawet jeżeli komórki nowotworowe są obecne, to ich
rozpoznanie, a zwłaszcza ustalenie typu nowotworu, od
którego pochodzą, jest trudne, nierzadko spotyka się nawet
opinie, że jest to niemożliwe. Doświadczony cytolog może
czasem zróżnicować niektóre rodzaje nowotworów, jak:
adenocarcinoma,
melanoma
czy
medulloblastoma,
przeważnie jednak ogranicza się do stwierdzenia obecności
komórek „podejrzanych jako nowotworowe". W przypadku
mało
zróżnicowanych
nowotworów,
zwłaszcza
ze
współistniejącym procesem zapalnym i rozpadowym,
nierzadkie są rozpoznania fałszywie ujemne. Czasami, ze
względu na obecność w płynie mózgowo-rdzeniowym
komórek mezenchymy, ependymy i splotu naczyniówkowego
lub przypadkowej obecności komórek nabłonkowych czy
fragmentów szpiku kostnego, zdarzają się rozpoznania
fałszywie dodatnie (2, 15). Próbowano wyeliminować te
niedogodności
przystosowując
do
potrzeb
analizy
cytologicznej techniki fluorescencyjne, autoradiografię czy
mikroskopię elektronową. Jednak metody te ze względu na
koszty, czasochłonność oraz braki aparaturowe nie poprawiły
w sposób istotny sytuacji.
Szansą na znaczne zmniejszenie trudności w identyfikacji
komórek nowotworowych wydaje się zastosowanie
przedstawionych technik immunohistochemicznych czy
immunofluorescencyjnych
z
użyciem
przeciwciał
monoklonalnych. Do chwili obecnej ukazało się na świecie
zaledwie kilka prac, których autorzy próbowali zestawić
uniwersalny panel przeciwciał monoklonalnych dla potrzeb
cytoonkologii płynu mózgowo-rdzeniowego.
Dużą przydatność wykazał zestaw składający się ze
znaczników dla tkanki neuroektodermalnej, cytokeratyny
nabłonkowej, neoplastycznych neuroblastów i przeciwciała
pan-leukocytarnego. Próbki płynu mózgowo-rdzeniowego
zagęszczano przez wirowanie i dzielono na kilka porcji, które
nakładano
na
uprzednio
przygotowane
szkiełka
mikroskopowe. Po przepłukaniu buforowanym roztworem
0,9% NaCl na każde szkiełko nakładano jedno z przeciwciał
monoklonalnych o odpowiednim stężeniu i inkubowano przez
30
min w komorze wilgotnej w temperaturze pokojowej. Po
dalszym płukaniu i inkubowaniu przez 30 min z kozią antymysią immunoglobuliną sprzężoną z fluoresceiną preparat
zamykano w 90% glicerolu i oceniano w mikroskopie
fluorescencyjnym.
Oprócz
metod
pośredniej
immunofluorescencji, w badaniach tych używano również 4stopniowej techniki immunoperoksydazowej.
Użycie powyższego zestawu przeciwciał pozwalało na
dokładne
różnicowanie
komórek
nowotworowych
pochodzenia nabłonkowego, limfoidalnego i neuroektodermalnego. W dalszej kolejności używano dodatkowych
przeciwciał monoklonalnych w celu uzyskania bardziej
szczegółowych informacji, np. odnośnie do fenotypu
chłoniaka albo do wykrycia kwaśnego białka filamentów glejowych (GFAP). Podczas badań okazało się, że przeciwciała
monoklonalne przeciw cytokeratynie nie reagują z komórkami
pochodzącymi z przerzutu anaplastycznego raka sutka — był
to jedyny fałszywie ujemny wynik uzyskany przy tym
zestawie
przeciwciał.
Ostatecznie
nowotwór
ten
zidentyfikowano używając przeciwciał monoklonalnych
przeciwko nabłonkowemu antygenowi proliferaeyjnemu. Używając przeciwciał monoklonalnych, Coakham i wsp. uzyskali
prawidłowe rozpoznanie w 16 spośród 17 analizowanych
przypadków. Spośród 14 przypadków badanych rutynową
techniką cytologiczną w 10 znaleziono komórki
nowotworowe, a dokładnie sklasyfikowano tylko 3 przypadki.
Różnica jest zatem istotna (3, 4). Pozostałe doniesienia miały
charakter kazuistyczny (5).
Godny podkreślenia jest fakt, że antygeny komórkowe są
stosunkowo trwałe, np. w przypadku cytokeratyny struktura
antygenowa pozostaje trwała przez co najmniej 3 dni.
Właściwość ta umożliwia dłuższe przechowywanie próbek
płynu mózgowo-rdzeniowego lub ich transportu do
wyspecjalizowanego laboratorium cytologicznego.
Opisane przeciwciała monoklonalne umożliwiały wstępne
różnicowanie komórek w płynie mózgowo--rdzeniowym na
pierwotne guzy mózgu, przerzuty, chłoniaki i białaczki.
Istnieje także możliwość dalszego, dokładniejszego
rozpoznania różnicowego przy użyciu innych zestawów
przeciwciał monoklonalnych, np. różnicowania między
astrocytoma, oligodendroglioma i ependymoma.
Należy przypuszczać, że techniki immunocytologiczne
przyniosą istotny postęp diagnostyczny. Zastosowane w
przeciętnie wyposażonym laboratorium diagnostycznym
pozwolą na wczesne wykrycie i dokładną charakterystykę
komórek nowotworowych w płynie mózgowo-rdzeniowym.
PIŚMIENNICTWO
1. Bourne J.A.:Handbook of Immunoperoxidase Staining Methods. DAKO
Corp., USA 1983. — 2. Bubik M. i wsp.: Wartość analizy cytologicznej płynu
mózgowo-rdzeniowego w diagnostyce nowotworów śródczaszkowych. Wiad.
Lek., 1985, 3, 295. — 3. Coakham H.B. i wsp.: Carcinomatous meningitis
diagnosed with monoclonal antibo-dies. Brit. Med. J., 1984, 288, 1272. — 4.
Coakham H.B. i wsp.: Use of monoclonal antibody panel to identify malignant
cells in cerebrospinal fluid. Lancet, 1984,19,1095. — 5. Hancock W.W., Medley
G.: Monoclonal antibodies to identify tumor cells in CSF. Lancet, 1983, 24, 739.
— 6. Kawiak J. i wsp.: Składniki cytoszkieletu, w: Podstawy cytofizjologii.
PWN, Warszawa 1985. — 7. Landis D.M.D.. Promise and pitfalls in
immunocytochemistry, TINS, 1985, 7, 312. — 8. Mackiewicz S.: Przeciwciała
monoklonalne, w: Immunologia. PZWL, Warszawa 1986. — 9. Musioł A. i
wsp.: Zastosowanie mikroskopii elektronowej transmisyjnej i skaningowej w
badaniach cytologicznych płynu mózgowo-rdzeniowego. Neur. Neurochir, Pol.,
1985, 4, 312. — 10. Ostrowski K., Kawiak J.: Szkielet komórki, w:
Cytofizjologia. PZWL, Warszawa 1985.