Wykład 7
Sprzężenie spin-spin
Przesunięcie chemiczne
Sprzężenie spin-spin
mechanizm kontaktowy Fermiego
Znak jest dodatni lub
ujemny
Duża rozpiętość wielkości: -20 ... +40 Hz
- efekty podstawnikowe
- silna zależność
kątowa
- Jcis<Jtrans
- przy szybkim obrocie
uśrednienie J
Powyżej 3 wiązań stałe są
najczęściej małe (<3 Hz) i
rozszczepienie często
niewidoczne.
3J
CH-CH,
równanie Karplusa
Tzw. „oddziaływanie przez przestrzeń”
Jedno ze przęgających się jąder musi posiadać wolną parę
elektronową, a odległość musi być mniejsza niż suma promieni
van der Waalsa.
Tzw. „oddziaływanie przez przestrzeń”
OMe
N
Te
JTeH = 70 Hz.
HN
N
OMe
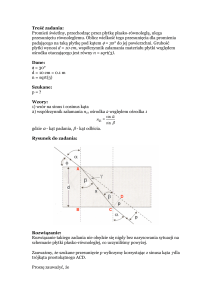
Które z widm jest zmierzone przy większej częstotliwości podstawowej?
Przypisz piki A, M, X protonom pierścienia.
Odp:
100 MHz
200 MHz
Nie zawsze sprzężenia dalekiego zasięgu sa widoczne.
Przypisz sygnały.
Odp:
Jaki to izomer bromobenzaldehydu?
Jaki to układ spinowy?
Jaki to izomer nitrofenolu?
co to za
multiplet?
Przypisz widmo związkowi
Odp:
1. Widmo 1H NMR 1,3-dioksanu (dla powolnej inwersji
pierścienia) zawiera 3 multiplety o stałych geminalnych
wynoszących -6.1, -11.2, -12.9 Hz. Przypisz sygnały.
2
O
O
6
4
5
2. Z jakich multipletów składa się widmo aldehydu
propionowego?
CH3-CH2-CHO
3
2 1
3. Nazwij układy spinowe:
a) CH3-CH2-CHO
b) CH3-C(O)-O-CH2-CH3
O
c) CH3-CHCl-CH3
d) I-CH2-CH2-COOH
e) CH3-C(O)-CH3
f)
O
CH3
Stałe sprzężenia 13C-1H i 13C-13C
Stałe sprzężenia 1H-13C
są podstawą interpretacji widm 2-wymiarowych 1H-13C HMQC i HMBC, pomocnych
w określaniu struktury związków organicznych.
1H-13C
HMQC
1J
CH
HMBC
2,3,4J
CH
Stałe sprzężenia 1H-13C
UWAGA!
Nie zawsze stała sprzężenia JCH maleje wraz ze wzrostem odległości
(liczonej jako ilość wiązań).
Na 2J działają przeciwstawne efekty i może ona mieć różne znaki lub
być bliska 0.
H
Związki aromatyczne:
zazwyczaj 2JCH < 3JCH (zazwyczaj trans)
benzen:
1
7.4 Hz
Stałe sprzężenia 1JHC
• zależność od hybrydyzacji węgla (większy udział s wzrost J)
H3C CH3
H2C CH2
1J
125 Hz
167 Hz
CH =
1J
CH = 162 Hz w cyklopropanie
HC CH
250 Hz
• efekty podstawników – addytywność; podstawnik elektroujemny wzrost 1J.
Dla węgli sp2 efekty podstawników są większe (podobnie aromatyczne)
- dla podstawnika F w HFC=CH2
DJ = 44 Hz, inny wpływ cis vs trans
w CH3F
DJ = 24 Hz
B. duży jest efekt a w aldehydach:
O
N
H3C
H
1
O
H3C
JCH = 173
HO
H
H3C
191
O
H
222 Hz
Stałe sprzężenia 2JHC i 3JHC
Dla sprzężeń geminalnych 2JCH i wicynalnych 3JCH, zależności są podobne jak dla
sprzężeń H-H.
gC/gh 1/4, ale relacja JCH/JHH jest większa z powodu większej gęstości elektronowej wokół
jądra 13C.
O
JCH stanowi typowo 60-70% JHH
H3C
O
H
H
H
Wszystkie czynniki wpływające na JHH są obecne w sprzężeniach JCH.
- geometria (kąt, kąt dwuścienny)
- rząd wiązania (hybrydyzacja atomów)
- podstawniki
-8,5 Hz
H
Br
H
Br
H
H
H
H
7,5 Hz
W olefinach efekt podstawnika
działa w przeciwnych
kierunkach na stałe cis i trans.
Stałe sprzężenia 13C-13C
Do wyznaczenia potrzebne wzbogacenie 13C.
Znaczne zróżnicowanie 1JCC w zależności od rzędowości wiązania.
Zachowuje się podobnie jak 1JCH lecz jest mniejsze (bo g13C < g1H).
Korelacja z 1JCH:
1
1J
1
C-CH3 0,27 JCH (gC/gh /4) jest spełniona dla szerokiej gamy związków.
C
C
35-40 Hz
C
C
65-75
C
C
170-175
CN
80.3
Uwaga - wiązanie pojedyncze, ale pomiędzy węglami o hybrydyzacjach sp i sp2
(np. benzonitryl) nie będzie typowe dla wiązania pojedynczego sp3-sp3.
Podobnie dla 2JCH i 3JCH
Silna zależność
od hybrydyzacji
węgli tworzących
wiązanie C.C.
Stała przez 2 wiązania
jest mniejsza niż przez 3
wiązania
Podstawnik na
centralnym węglu
silnie wpływa na 2J.
Na 2J działają
przeciwstawne efekty i
może ona mieć różne znaki
lub być bliska 0.
W olefinach efekt
podstawnika działa w
przeciwnych kierunkach
na stałe cis i trans.
Dlatego dla wielopodstawionych
olefin, stałe sprzężenia, jako
addytywne, mogą być bardzo
zróżnicowane. (cis-dichloroetylen
2J
CH = 15,4 Hz, trans: < 0,3 Hz)
d
Wkłady w stałą ekranowania 1H:
d=
Bwzorca - Bpróbki
Bwzorca
6
10 ppm
Bpróbki = B0-sB0 = (1 − s)Bo
σ = σlok + σel. + σmagn.. + σW + σrozp
sąsiadów
1. Lokalny - dla protonu tylko diamagnetyczny. σlok = σdia + σpara
2. Sąsiadów:
a) zmiany gęstości elektronowej dzięki efektom σel
i) indukcyjnemu
ii) mezomerycznemu
b) cyrkulacje elektronów sąsiednich grup pod wpływem pola Bo,
zmieniające lokalne pole Blok. σmagn
3. Wpływ pola elektrycznego i efekty Van der Waalsa σW
4. Wpływ rozpuszczalnika σrozp
Diamagnetyzm i paramagnetyzm
1. Wpływ lokalny - pochodzący od elektronów mierzonego jądra
Bo
sferyczny rozkład elektronów diamagnetyzm
zaburzenie symetrii sferycznej cząsteczki zmiejsza ef.
diamagnetyczny i wokół jądra występuje również efekt
paramagnetyczny.
DB
Bo
DB
obniżenie B
wzrost B
Diamagnetyczne przesunięcie linii - przesłanianie
Paramagnetyczne przesunięcie linii - odsłanianie
Atom H - jedyny posiadający tylko elektrony s. Wkład paramagnetyczny elektronów
wodoru wynosi 0.
Jest to podstawowa przyczyna małego zakresu dH - ok. 10 ppm (nie dotyczy
paramagnetyków, np. niektórych kompleksów metali przejściowych);
dla porównania: 13C NMR: 200 ppm; cięższe jądra - jeszcze więcej
Wkłady w stałą ekranowania 1H:
1. Lokalny - dla protonu tylko diamagnetyczny. σlok = σdia + σpara
2. Sąsiadów:
a) zmiany gęstości elektronowej dzięki efektom σel
i) indukcyjnemu
ii) mezomerycznemu
b) cyrkulacje elektronów sąsiednich grup pod wpływem pola Bo,
zmieniające lokalne pole Blok. σmagn
3. Wpływ pola elektrycznego i efekty Van der Waalsa σW
4. Wpływ rozpuszczalnika σrozp
Efekt indukcyjny
Wpływ diamagnetycznego ekranowania na przesunięcie chemiczne jest bezpośrednio
widoczny w szeregu związków typu CH3X, podobnieCH3-CH2-X;
CH4 (d: 0,13) – CH3I (2,16) – CH3Br (2,68) – CH3OH (3,38) – CH3F (4,26)
- jeśli rośnie elektroujemność X gęstość el. wokół H maleje
- ekranowanie dimagn. maleje przesunięcie chem. rośnie
Ale dla CH3-CH2-X zależność jest odwrotna!
Liczba wyjątków jest spora; wynika z obecności el. p sąsiadujących atomów, które wnoszą wkład
paramagnetyczny; ponadto istnieją inne efekty anizotropowe wiązań C-H i C-X.
efekt na większe odległości:
nitropropan - Dd = 3,45
0,72
0,12
Zasada addytywności Shoolery’ego
wpływy kilku grup funkcyjnych na przes. chemiczne sumują się
H
gęstość el. wokół jądra wodoru:
CHCl3
CH2Cl2
CH3Cl
CH4
odsłonięte
10
9
8
7
6
5
4
3
2
1
0 ppm
Odchylenie od reguły Shoolery’ego i innych reguł addytywności wynika z oddziaływania
elektronowego i sterycznego blisko położonych podstawników.
reg. addytywności
obowiązuje także
dla innych jąder, np.
13C NMR: d = 77,0
C
dC = 53,0
dC = 25,1
dC = -2,6
Efekt przesłaniania można rozłożyć na udziały
poszczególnych atomów i grup atomów.
Ilościowy wpływ podstawnika - doświadczalna stała podstawnika czyli inkrement - różnica
między przesunięciem protonu w związku niepodstawionym a przesunięciem w związku
podstawionym tym podstawnikiem.
dla związków typu CH2XY oraz CHXYZ: dH = 0,23 + S inkr.
(dCH4)
Shooleery 1959 rok
Dokładność ok. 0,3 ppm dla CH2XY, gorzej dla CHXYZ.
dla olefin dH :
Zcis
H
dC=C-H= 5,25 + Zgem + Zcis + Ztrans
C=C
Ztrans
Zgem
(dC2H4)
różny wpływ na d w zależności od położenia:
wyciąganie el. vs. donacja el.
inne efekty dominują na bliskie odl.
(wyciąganie indukcyjne) lub dalsze
odległości (dominuje koniugacja).
podstawnik
Zgem
Zcis
Ztrans
OR (R alif.)
Ar
Cl
F
1.22
1.38
1.08
1.54
–1.07
0.36
0.18
–0.40
–1.21
–0.07
0.13
–1.02
Zastosowanie
Dziś reguły te mają zastosowanie w
programach komp. do obliczania
przesunięć chemicznych na podstawie
wzorów.
Obecnie przy przypisywaniu pików
stosuje się częściej inne techniki,
m.in. dwuwymiarowe.
Stosując te reguły (programy) należy
zdawać sobie sprawę z ich
ograniczonej dokładności (dla blisko
położonych sygnałów zawodzi).
Wpływ dalej położonych grup
uwzględniany jest w bardziej
złożonych wzorach (a, b, g).
Addytywność w podstawionych benzenach
1. W podstawionych benzenach poszczególne podstawniki wnoszą swój wkład w
przesunięcie protonów w pierścieniu. Czego się spodziewasz:
a) podstawniki silnie wyciągające elektrony (-NO2,- COOMe)
- odsłaniają protony prawda / fałsz
- powodują zwiększenie d prawda / fałsz
- wymieniony efekt jest najsilniejszy w pozycjach orto / meta / para
b) grupy elektronodonorowe (-NH2, -OH)
- powodują przesunięcie górno- / dolnopolowe
- efekt jest najsłabszy w pozycji orto / meta / para
OH
+
OH
+
+
OH
OH
-
-
zwiększenie gęstości el. (ładunek
ujemny) zwiększa przesłanianie,
obniża przesunięcie chemiczne
Przypisz związek poniższemu widmu 1H NMR.
A
O
O
O
O
C
B
O
O
D
2. Przypisać sygnały arylowe w widmach:
- aldehyd benzoesowy
Bromonitrobenzen ma piki w 1H
NMR przy d 8,38; 8,16; 7,80;
7,36. Który to izomer - o, m, p?
Przypisać piki 1,2,4trimetylobenzenu z zakresu
aromatycznego 13C NMR:
136,1; 135,0; 133,1; 130,4,
129,5; 126,4.
- aldehyd para-metoksybenzoesowy
Wkłady w stałą ekranowania 1H:
Blok = Bo-DB = (1 − s)Bo
σ = σlok + σel. + σmagn.. + σW + σrozp
sąsiadów
1. Lokalny - dla protonu tylko diamagnetyczny. σlok = σdia + σpara
2. Sąsiadów:
a) zmiany gęstości elektronowej dzięki efektom σel
i) indukcyjnemu
ii) mezomerycznemu
b) cyrkulacje elektronów sąsiednich grup pod wpływem pola Bo,
zmieniające lokalne pole Blok. σmagn
3. Wpływ pola elektrycznego i efekty Van der Waalsa σW
4. Wpływ rozpuszczalnika σrozp
Aromatyczność
Model pierścieniowego prąd kołowego
prąd aromatyczny
(diamagnetyczny)
indukowane pole magn.
e-
zmniejszenie Blok.
działającego na jądro
— przesłanianie
zmniejszenie przesunięcia
zwiększenie Blok.
— odsłanianie
zwiększenie przesunięcia
Aromatyczność, równanie McConnela
Można obliczyć w przybliżony sposób wpływ prądu aromatycznego na
przesunięcie chemiczne w punkcie P:
odl. od środka pierść.
Dd (ppm) = m(1-3cos2)/r3
kąt z osią
przesłaniane
_
moment magnetyczny, zależy od wielkości
pierścienia i jego rodzaju;
Dd = 0 dla = 54,7°
Dd < 0 dla < 54,7
Dd > 0 dla > 54,7
kąt magiczny
benzen: m = 27, rH = 2,5 A, = 90, Dd = 1,7
Ddexp = 1,4 ppm (dbenz-d1,3-cykloheksadienu)
+
+
odsłaniane
_
stożek anizotropii, Dd
Furan - aromatyczność
stara skala
Addytywność wkładu pierścienia
Dla pierścieni skondensowanych, płaskich, ich wkład sumuje się;
zakładamy prostą zależność Dd od r dla każdego pierścienia z osobna
Dd (ppm) = m(1-3cos2)/r3
a
a
b
g
b
Zadanie: jaka jest relacja między przesunięciami protonów a, b, g
Dd(a) > Dd(b),
d(a) > d(b),
7.78
7.42
Dd(g) > Dd(a)> Dd(b),
d(g) > d(a)> d(b),
8.31
7.91
7.39
Aromatyczność - przykłady
[18]-anulen
[10]-paracyklofan