Ćwiczenie 5
T: Zasady doboru testów laboratoryjnych w diagnozowaniu i monitorowaniu cukrzycy
Zagadnienia teoretyczne:
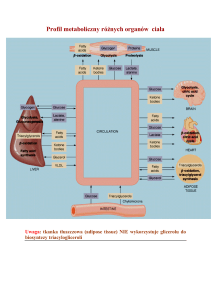
Profil badań stosowanych w diagnostyce w cukrzycy: glikemia na czczo > 125 mg/dl ,
glikemia przygodna > 200 mg/dl, glikemia w 120 min DTTG > 200 mg/dl. Profil badań
stosowanych w monitorowaniu leczenia cukrzycy - dobowy profil glikemii, hemoglobina
HbA1c, fruktozamina (retrospektywna ocena poziomu glikemii), ciała ketonowe (ważne w
monitorowaniu
cukrzycowej
cukrzycy typu 1). Profil badań stosowanych w różnicowaniu śpiączki
(nieketonowa
śpiączka
hipermolarna,
śpiączka
ketonowa,
śpiaczka
mleczanowa, hipoglikemia) - poziom glikemii na czczo, glukoza w moczu (glukozuria), ciała
ketonowe w surowicy (ketonemia) i w moczu (ketonuria), badanie gazometryczne (pH,
HCO3-, luka anionowa), jonogram (Na, K), mleczany.
Ćwiczenie praktyczne:
Oznaczanie glukozy (krzywa cukrowa). Oznaczanie HbA1c. Oznaczanie transportu
cewkowego glukozy.
A. Oznaczanie stężenia glukozy w surowicy krwi metodą enzymatyczną
Aparatura i sprzęt laboratoryjny:
spektrofotometr, probówki Eppendorf, pipety automatyczne
Materiał badany i odczynniki:
surowica badana
wzorzec glukozy – 100 mg/dL
odczynnik roboczy do oznaczania stężenia glukozy (zestaw BioMaxima)
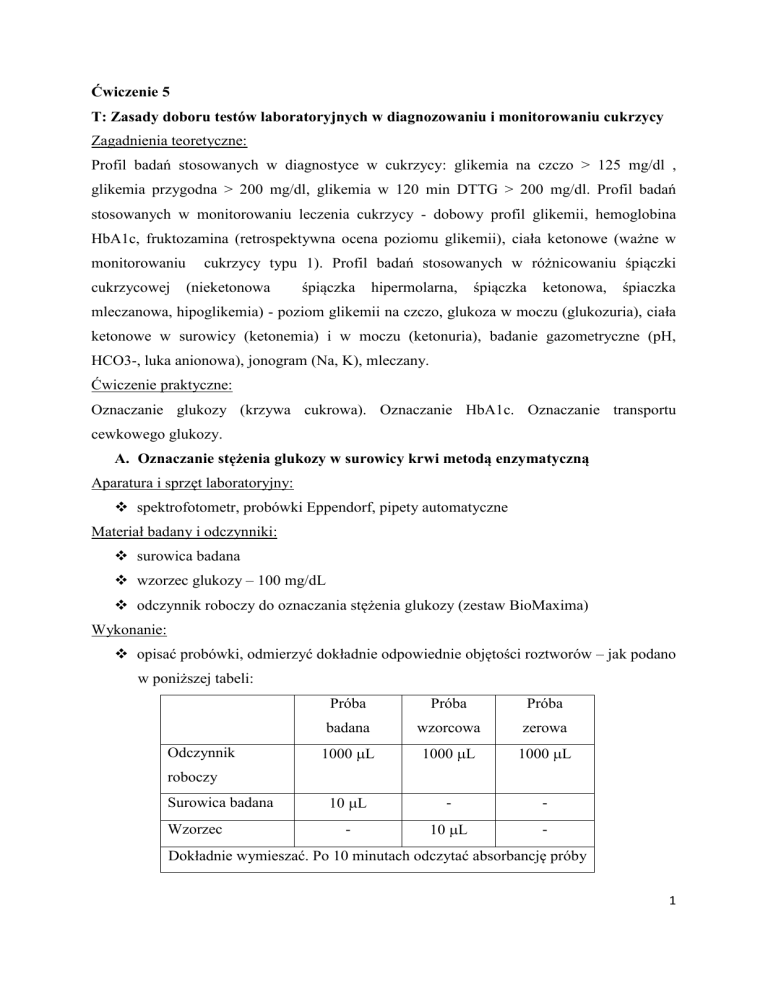
Wykonanie:
opisać probówki, odmierzyć dokładnie odpowiednie objętości roztworów – jak podano
w poniższej tabeli:
Odczynnik
Próba
Próba
Próba
badana
wzorcowa
zerowa
1000 L
1000 L
1000 L
10 L
-
-
-
10 L
-
roboczy
Surowica badana
Wzorzec
Dokładnie wymieszać. Po 10 minutach odczytać absorbancję próby
1
badanej (AB) i wzorcowej (AW) (=500 nm) wobec próby zerowej.
UWAGA! Oznaczenie wykonujemy jednocześnie we wszystkich próbach badanych =>
surowicach otrzymanych z krwi pobranej na czczo, po 1 i 2 godzinach od obciążenia glukozą.
Obliczenia:
obliczyć stężenie glukozy ze wzoru:
stężenie glukozy [mg/dL] =
∙ stężenie wzorca
W
B. Oznaczanie HbA1c
Aparatura i sprzęt laboratoryjny:
spektrofotometr, probówki Eppendorf, pipety automatyczne, mieszadło
Materiał badany i odczynniki:
surowica badana
wzorzec hemoglobiny glikowanej
odczynnik A z żywicą
odczynnik B lizujący (zestaw BioMaxima)
Wykonanie:
A. Przygotowanie hemolizatu
opisać probówki – wzorzec, kontrola, badana i odmierzyć do każdej 500 L
odczynnik lizującego (odczynnik B)
dodać 100 L dobrze wymieszanej próbki krwi, wzorca lub kontroli do
odpowiednich probówek, wymieszać
pozostawić na 5 min.
B. Izolowanie hemoglobiny glikowanej
dodać 70 L hemolizatu do probówki z żywicą (odczynnik A)
umieścić separatory z filtrem w probówkach tak, aby gumowy mankiet był na
wysokości ok. 1 cm ponad poziomem płynu
mieszać bez przerwy 5 min. na mieszadle
wpychać separator z filtrem do probówki do momentu aż żywica będzie ściśle
upakowana
przelać supernatant do nowej probówki
2
odczytać absorbancję próby badanej i wzorcowej i kontrolnej (= 415 nm)
wobec wody dejonizowanej jako próby ślepej
Te odczyty dotyczą hemoglobiny glikowanej
C. Frakcja hemoglobiny całkowitej
odmierzyć 5,0 ml wody dejonizowanej do probówek (W, K, B)
dodać 20 L hemolizatu (z etapu A3), wzorca i kontroli do odpowiednich
probówek
odczytać absorbancję próby badanej i wzorcowej i kontrolnej (= 415 nm)
wobec wody dejonizowanej jako próby ślepej
Te odczyty dotyczą hemoglobiny całkowitej
Obliczenia:
RB
% Hb glik. (Pr. badanej) =
x CW
RW
A Hb glik. (badanej)
RB =
A Hb całk. (badanej)
A Hb glik. (wzorca)
RW =
A Hb całk. (wzorca)
A. Oznaczanie transportu cewkowego glukozy
Aparatura i sprzęt laboratoryjny:
spektrofotometr, probówki Eppendorf, pipety automatyczne, minutnik
Materiał badany i odczynniki:
surowica
mocz z dobowej zbiórki (DZM)
wzorzec glukozy (100 mg/dL)
odczynnik roboczy (BioMaxima)
Wykonanie:
3
opisać probówki, odmierzyć dokładnie odpowiednie objętości roztworów – jak podano
w poniższej tabeli:
Próba badana
Próba badana
Próba
Próba
- surowica
- mocz
wzorcowa
zerowa
10 L
-
-
-
Mocz
-
10 L
-
-
Wzorzec glukozy
-
-
10 L
-
1000 L
1000 L
1000 L
1000 L
Surowica badana
Odczynnik roboczy
Zawartość probówek wymieszać i inkubować 10 minut w temperaturze pokojowej
Zmierzyć absorbancję prób badanych i próby wzorcowej wobec próby zerowej ( = 500 nm)
Obliczenia:
obliczyć stężenie glukozy w surowicy i moczu
Apróby badanej
∙ Cwzorca [mg/dL]
PG / UG=
Awzorca
PG / UG – stężenie glukozy w surowicy / moczu [mg/dL]
Cwzorca – stężenie wzorca (100 mg/dL)
Apróby badanej - absorbancja próby badanej (surowicy/moczu)
Awzorca – absorbancja wzorca
obliczyć wartość transportu maksymalnego glukozy (TmG)
TmG = PG ∙ CLkr - UG ∙ V
PG – stężenie glukozy w surowicy [mg/mL]
UG – stężenie glukozy w moczu [mg/mL]
CLkr – klirens kreatyniny [mL/min]
V – objętość minutowa moczu [mL/min] = DZM/1440 min
4