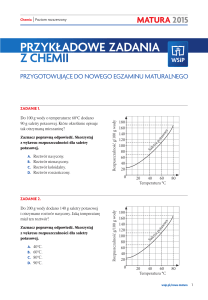
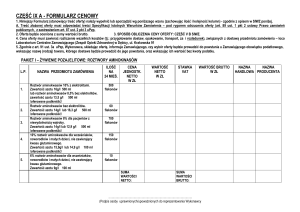
Lek Zarzio został wprowadzony na rynek w 2009 roku przez firmę Sandoz. Jest to lek
biopodobny będący białkiem rekombinowanym - odpowiednikiem ludzkiego czynnika
wzrostu kolonii granulocytów. Zarzio jest lekiem stosowanym w leczeniu neutropenii,
określanej jako nieprawidłowy, niski poziom neutrofilów we krwi. Neutropenia jest
częstym powikłaniem wśród pacjentów z chorobą nowotworową poddanych
chemioterapii lub leczeniu mieloablacyjnemu, poprzedzającemu przeszczepienie szpiku.
Lek Zarzio został opracowany i wyprodukowany przez firmę Sandoz w Kundl w Austrii.
Firma Sandoz jest częścią grupy Novartis i posiada ponad dwudziestoletnie
doświadczenie w biotechnologicznej produkcji białek, służąc jako międzynarodowe
centrum rozwojowe biofarmaceutyków dla grupy Novartis. Cały proces badań i
produkcji prowadzony jest z zachowaniem wysokich standardów technicznych i
jakościowych firmy Novartis. Ścisła współpraca z Novartis gwarantuje także ciągłą
wymianę najnowszych odkryć i doświadczeń naukowych.
W laboratoriach badawczych specjaliści opracowywują procesy technologiczne
wymagane do produkcji i testują je w warunkach laboratoryjnych. Dopiero kiedy każdy
szczegół zostanie dopracowany i uzyskane zostaną pożądane wyniki, proces jest
przenoszony do właściwego zakładu produkcyjnego. Za pomocą inżynierii genetycznej
specjaliści przekształcają komórki bakteryjne, pobudzając je do wytwarzania
określonych biologicznych substancji czynnych. Komórki są następnie zamrażane i
przechowywane w tak zwanych bankach komórek.
W wyspecjalizowanym laboratorium komórki pobrane z banku są używane do produkcji
paru litrów tak zwanych starterów bakteryjnych. Odbywa się to w ściśle kontrolowanych
i sterylnych warunkach. Zamknięta w hermetycznym pojemniku mieszanina wkracza w
stadium fermentacji.
Pozostając w sterylnych warunkach, starter zawierający genetycznie zmodyfikowane
komórki bakteryjne przenoszony jest do bioreaktora. W płynnym, odżywczym roztworze
o dokładnie ustalonych parametrach objętość mieszaniny jest zwiększana do określonej
ilości wstępnej, zanim zostanie przeniesiona do drugiego, większego bioreaktora, gdzie
produkowana jest biologiczna substancja czynna.
Aby zapewnić pomyślny przebieg procesu należy jednocześnie kontrolować i korygować
wiele parametrów.
Biotechnologiczna produkcja biologicznej substancji czynnej w Kundl spełnia
najbardziej rygorystyczne standardy jakościowe. Oznacza to, że wszystko, z
uwzględnieniem najdrobniejszego szczegółu, musi przebiegać perfekcyjne. Nasi
pracownicy są doskonale wyszkoleni. Dbają o to, aby cały proces przebiegał sprawnie i
mają ogromny wkład w nasz sukces. Co więcej, całe nasze wyposażenie, instalacje i
procedury spełniają międzynarodowe standardy dobrej praktyki wytwarzania.
Międzynarodowy nadzór medyczny potwierdza spełnianie tych wymogów w trakcie
regularnych kontroli.
Materiał komórkowy używany w procesie produkcji biofarmaceutyków nie stanowi
zagrożenia dla ludzi i środowiska. Komórki nie mogą przetrwać poza ochronnym
środowiskiem bioreaktora. W trakcie całego procesu zachowane są najwyższe środki
bezpieczeństwa.
Wszelkie odpady biologicznie powstałe podczas produkcji są sterylizowane z użyciem
pary. Po wstępnym oczyszczeniu, woda ściekowa trafia do przyzakładowej oczyszczalni
ścieków i jest przez cały czas ściśle monitorowana. Zarządzanie odpadami posiada
certyfikaty Systemu Ekozarządania i Audytu Unii Europejskiej (EMAS) oraz ISO-14001.
Pod koniec procesu fermentacji otrzymywany jest wodny roztwór zawierający komórki
bakteryjne z biologiczną substancją czynną, oraz szereg innych składników. Przy użyciu
wirówki, komórki bakteryjne są oddzielane od reszty materiału, zanim pożądana
substancja czynna zostanie wyodrębniona z samych komórek.
Cały proces produkcji jest stale i konsekwentnie nadzorowany. Poza monitoringiem
komputerowym każdej serii, na poszczególnych etapach produkcji pobierane są próbki,
które poddaje się analizie jakościowej. Nawet kilka lat po wyprodukowaniu cała partia
lub każda pojedyncza seria mogą zostać zidentyfikowane.
Na koniec procesu, biologiczna substancja czynna jest oddzielana od niepożądanych
składników za pomocą wielu analiz chromatograficznych. Po przejściu kilku etapów
oczyszczania czysty, wodny i aktywny roztwór czynnika jest pozyskiwany i zamrażany w
temperaturze minus dwudziestu stopni Celsjusza.
Ostateczny proces produkcji leku odbywa się w Niemczech. Dla celów transportowych
butelki zawierające roztwór leku są pakowane w specjalne, izolacyjne pudełka.
Proces opracowania i produkcji biofarmaceutyków jest niezwykle złożony i wymagający.
Odkąd Sandoz wyprodukował w 1980 roku jedno z pierwszych białek
rekombinowanych, jesteśmy wiodącą firmą w branży leków biopodobnych. Leki
biopodobne są przystępnymi cenowo biofarmaceutykami o wysokiej jakości, które
wychodzą naprzeciw rosnącym zapotrzebowaniom rządów, płatników, lekarzy i
pacjentów. Dysponując trzema lekami biopodobnymi na rynku i kolejnymi w
przygotowaniu, Sandoz, wraz ze swoją macierzystą firmą Novartis, odgrywają wiodącą
rolę w rozwoju, produkcji i promocji tej obiecującej klasy leków.
Roztwór jest przenoszony do linii gdzie napełniane są ampułkostrzykawki, tak by były
gotowe do użycia. W procesie produkcyjnym montowany jest także nowatorski system
zabezpieczający igłę. Specjalnie zaprojektowana supernowoczesna maszyna napełniająca
zapewnia, że każda ampułkostrzykawka zawiera taką samą, odgórnie ustaloną ilość
roztworu. Mimo to, poziom napełnienia ampułkostrzykawek jest dokładnie
monitorowany aby zagwarantować najwyższą jakość. W trakcie całego procesu nie
dochodzi do bezpośredniego kontaktu człowieka z biofarmaceutykiem ani
ampułkostrzykawkami.
Na koniec, ampułkostrzykawki są ponownie kontrolowane optycznie i pakowane
zgodnie z przepisami obowiązującymi w poszczególnych krajach dostawy.