© Pediatr Med Rodz 2013, 9 (3), p. 287–291
Agnieszka Terlikowska-Brzósko1, Bolesław Kalicki2,
Witold Owczarek1, Elwira Paluchowska1, Karolina Kapusta2,
Agnieszka Rustecka2, Anna Jung2, Robert Zdanowski3
Received: 05.11.2013
Accepted: 13.11.2013
Published: 29.11.2013
Zespół Comèla-Nethertona u 14-miesięcznego dziecka
Comèl-Netherton syndrome in a 14-month-old child
Klinika Dermatologiczna, Wojskowy Instytut Medyczny w Warszawie. Kierownik Kliniki: dr hab. n. med. Witold Owczarek
Klinika Pediatrii, Nefrologii i Alergologii Dziecięcej, Wojskowy Instytut Medyczny w Warszawie. Kierownik Kliniki: prof. dr hab. n. med. Anna Jung
3
Zakład Medycyny Regeneracyjnej, Wojskowy Instytut Higieny i Epidemiologii. Kierownik Zakładu: dr n. med. Robert Zdanowski
Adres do korespondencji: Klinika Dermatologiczna CSK MON WIM, ul. Szaserów 128, 04-141 Warszawa
Praca finansowana ze środków własnych
1
2
Streszczenie
Zespół Comèla-Nethertona (OMIM 256500) jest schorzeniem uwarunkowanym genetycznie o autosomalnie rece‑
sywnym typie dziedziczenia, opisanym niezależnie przez Comèla (w 1949 roku) i Nethertona (w 1958). Chorobę
powoduje mutacja zlokalizowana na chromosomie 5q32 genu SPINK5, który koduje inhibitor proteinaz seryno‑
wych LEKTI. Kliniczne rozpoznanie opiera się na współistnieniu triady objawów: rybiej łuski linijnej okrążającej,
zaburzeń budowy łodyg włosów i atopowego zapalenia skóry. Chorzy rodzą się z objawami erytrodermii lub ery‑
trodermii ichtiotycznej bądź z zespołem dziecka kolodionowego. Dzieci z erytrodermią wrodzoną wymagają wni‑
kliwej obserwacji i diagnostyki w celu wykluczenia niedoborów odporności. W różnicowaniu należy uwzględnić
infekcje, szczególnie gronkowcowe i drożdżakowe. W wieku niemowlęcym przyczyną erytrodermii mogą być: łojo‑
tokowe zapalenie skóry, atopowe zapalenie skóry, łuszczyca, mastocytoza, świerzb, łupież czerwony mieszkowy.
Reakcje polekowe w najmłodszej grupie wiekowej nie występują tak często jak u dorosłych. Terapia zespołu Comèla-Nethertona uzależniona jest od wieku pacjenta, jego stanu ogólnego oraz nasilenia zmian skórnych. Podstawową
formę leczenia stanowi właściwa pielęgnacja skóry, nawilżanie, stosowanie środków odkażających. W przypadku
zaostrzeń dopuszcza się krótkotrwałe użycie miejscowych glikokortykosteroidów. Omawiamy przypadek 14-mie‑
sięcznego chłopca, u którego rozpoznano zespół Comèla-Nethertona. U opisywanego pacjenta przeprowadzono
diagnostykę immunologiczną – wysokie stężenie IgE stwierdzono już w 4. miesiącu życia. Początkowo rozpozna‑
wano atopowe zapalenie skóry. Zmiany skórne były nietypowe, przejściowo z obecnością rumienia wokół otworów
naturalnych i na dystalnych częściach kończyn, co wskazywało na acrodermatitis enteropathica. Podczas dalszej
diagnostyki stwierdzano łojotokowe zapalenie skóry, stany rumieniowe i atopowo-łojotokowe zapalenie skóry.
Dopiero pojawienie się typowego złuszczania i zmian we włosach umożliwiło prawidłowe rozpoznanie.
Słowa kluczowe: zespół Comèla-Nethertona, LEKTI, erytrodermia wrodzona, włosy bambusowe, atopowe zapa‑
lenie skóry
Summary
Comèl-Netherton syndrome (OMIM 256500) is an autosomal recessive, hereditary disease, independently
described by Comèl (1949) and Netherton (1958). It is caused by a SPINK5 gene mutation, located on chromo‑
some 5 at position 5q32. SPINK5 encodes a serine proteinase inhibitor LEKTI. The clinical diagnosis of ComèlNetherton syndrome is based on the classic presentation of a triad of: ichthyosis linearis circumflexa, trichorrhex‑
is invaginata with bamboo hair and atopic dermatitis. Babies are born with symptoms of erythrodermia,
ichthyosiform erythroderma or with collodion membrane. Patients with congenital erythroderma require careful
observation and diagnosis to exclude immunodeficiency. Differential diagnoses include infections, particularly
staphylococcal and fungal. Main causes of erythodermia in infants are: seborrhoeic dermatitis, atopic dermatitis,
psoriasis, mastocytosis, scabies and pityriasis rubra pilaris. Adverse drug reactions are less common in children
than in adults. Therapy for Comèl-Netherton syndrome depends on the age of patients, their general condition and
severity of skin lesions. Symptomatic treatment involves emollients and keratolytics to assist with moisturizing the
skin. Exacerbations of skin lesions may require short-term use of topical corticosteroids. We report the case
of a 14-month-old boy with Comèl-Netherton syndrome. The initial diagnosis was atopic dermatitis due to high
serum levels of IgE in immunological evaluation at the age of 4 months. Another misdiagnoses were: acroderma‑
Pediatr Med rodz Vol 9 Numer 3, p. 287–291
287
P r ac e k a z u i s t yc z n e / c a s e r e p o r t s
titis enteropathica due to atypical presentation of erythema around natural orifices and distal ends of the limbs,
seborrhoeic dermatitis, erythema and states atopic-seborrhoeic dermatitis. Final diagnosis of Comèl-Netherton
syndrome was made due to the presentation of a typical exfoliation and bamboo hair.
Key words: Comèl-Netherton syndrome, LEKTI, congenital erythroderma, bamboo hair, atopic dermatitis
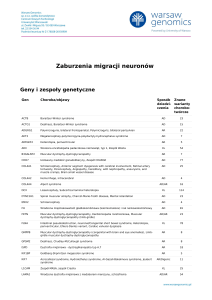
WSTĘP
W
288
1949 roku Comèl opisał różnokształtne, wę‑
drujące erytrodermiczne zmiany skórne, na
których obrzeżu występowała charakterystycz‑
na podwójna łuska, nazwana rybią łuską linijną okrąża‑
jącą (ichthyosis linearis circumflexa, ILC)(1). W 1958 roku
Netherton opisał wygląd łamliwych włosów u dziewczyn‑
ki z erytrodermią, określając je jako „włosy bambusowe”
(bamboo hair, trichorrhexis invaginata)(2). Kolejni autorzy
zauważyli, że oba zaburzenia współistnieją ze sobą. Poza
rybią łuską linijną okrążającą i włosami bambusowymi
objawem zespołu Comèla-Nethertona jest również ato‑
powe zapalenie skóry z wysokim poziomem IgE całko‑
witego(3). Chorobę wywołuje mutacja genu SPINK5 (serine peptidase inhibitor, Kazal type 5), który koduje białko
LEKTI (lympho-epithelial Kazal-type-related inhibitor),
będące inhibitorem proteinaz serynowych, zwłaszcza ka‑
likrein: 5., 7. i 14. LEKTI jest poliproteiną zbudowaną
z 1064 aminokwasów, tworzących 15 aktywnych domen.
Obecność tego białka stwierdza się w komórkach limfa‑
tycznych oraz nabłonkach.
W warstwie ziarnistej naskórka LEKTI wydzielane jest
do przestrzeni międzykomórkowej, gdzie łączy się z ka‑
likreinami, uniemożliwiając im przedwczesną degrada‑
cję połączeń międzykomórkowych. Wraz ze spadkiem pH
przy powierzchni naskórka dochodzi do dysocjacji kom‑
pleksu LEKTI–kalikreiny. Wolna kalikreina, uaktywnio‑
na przez transbłonową peptydazę – matryptazę przyczy‑
nia się do fizjologicznego złuszczania powierzchownych
komórek naskórka. Efektem mutacji w genie SPINK5 jest
brak funkcjonalnego LEKTI – skutkuje to przedwczesną
aktywnością kalikrein, co klinicznie manifestuje się jako
nieprawidłowe złuszczanie(4,5).
W zespole Comèla-Nethertona charakterystyczne są czę‑
ste infekcje. Podatność na zachorowania tłumaczono de‑
fektem bariery nabłonkowej(6) i wrodzonym niedoborem
antyciał przeciw polisacharydowym antygenom bakteryj‑
nym(7) oraz zaburzeniem odporności i nieprawidłową od‑
powiedzią na antygeny(8). W 2012 roku pojawiła się nowa
hipoteza, okazało się bowiem, że LEKTI stanowi czą‑
steczkę transportową dla dermicydyny – proteiny prze‑
ciwbakteryjnej(9). Na powierzchni naskórka dermicydyna,
uwolniona z połączenia z LEKTI i uaktywniona przez ka‑
tepsynę G, pełni funkcję obronną przeciw: Staphylococcus aureus, Staphylococcus epidermidis, Escherichia coli,
Enterococcus faecalis i Candida albicans. U osób z zespo‑
łem Comèla-Nethertona brakuje LEKTI, zaś obecność
dermicydyny stwierdza się jedynie w dolnych warstwach
naskórka, a nie na jego powierzchni, co upośledza obro‑
nę przeciwbakteryjną(9).
OPIS PRZYPADKU
Dziecko niespokrewnionych rodziców z ciąży I, porodu I,
urodzone w 39. Hbd siłami natury, ważące 3900 g, o dłu‑
gości ciała 60 cm, w dobrym stanie ogólnym – ocenione
na 9 pkt w skali Apgar. Z wywiadu z rodzicami wynika‑
ło, że pacjent od urodzenia miał erytrodermiczne zmiany
skórne ze złuszczaniem (brak dokumentacji fotograficz‑
nej). Z powodu żółtaczki noworodkowej dziecko leczo‑
no fototerapią, a z uwagi na stany gorączkowe i podwyż‑
szone parametry stanu zapalnego podawano mu doustnie
antybiotyki. Wykluczone zostało zakażenie CMV. Stwier‑
dzono obecność przeciwciał w klasie IgM przeciw Toxoplasma gondii. W badaniu ECHO serca uwidoczniono foramen ovale. Wyniki badania ultrasonograficznego jamy
brzusznej i przezciemieniowe mózgu były prawidłowe.
W 4. tygodniu życia pacjent był diagnozowany z powodu
braku przyrostu masy ciała – rozpoznano atopowe zapa‑
lenie skóry i niedokrwistość. Kolejna hospitalizacja mia‑
ła miejsce w 4. miesiącu życia – zdiagnozowano wów‑
czas łojotokowe zapalenie skóry oraz stany rumieniowe.
Ze względu na obecność zmian rumieniowo-złuszczają‑
cych wokół ust, oczu, w okolicy anogenitalnej i na kończy‑
nach wysunięto podejrzenie acrodermatitis enteropatica.
Wykonano badania dodatkowe – stężenie cynku oraz IgA
(81 mg/dl, N: 10–96 mg/dl) mieściły się w granicach nor‑
my. Natomiast stwierdzono podwyższone stężenie immu‑
noglobulin w klasach IgM (169 mg/dl, N: 25–120 mg/dl),
IgG (885 mg/dl, N: 190–860 mg/dl), IgE (102,8 U/ml,
N: 0–15 U/ml). Konsultujący neurolog nie stwierdził nie‑
prawidłowości. Okulista rozpoznał niedrożność kanali‑
ków łzowych, laryngolog – zapalenie ucha zewnętrznego.
Z powodu utrzymującego się złuszczania na podło‑
żu rumieniowym w obrębie dłoni, stóp i głowy, w tym
powiek (rys. 1), oraz rumienia w okolicy pieluszko‑
wej, z towarzyszącym powiększeniem węzłów szyjnych,
w 5. miesiącu życia dziecka przeprowadzono kolejne ba‑
dania w celu pogłębienia diagnostyki. Stwierdzono nie‑
dokrwistość przy prawidłowych stężeniach ferrytyny
(101,8 ng/ml, N: 20–200 ng/ml) i transferryny (248 mg/dl,
N: 200–360 mg/dl) oraz podwyższone stężenie immuno‑
globulin w klasach IgM (177 IU/ml, N: 13–127 IU/ml)
i IgE (142,7 U/ml, N: 0–15 U/ml) przy prawidłowym stę‑
żeniu immunoglobulin klas IgA (23 IU/ml, N: 0–53 IU/ml)
Pediatr Med rodz Vol 9 Numer 3, p. 287–291
P r ac e k a z u i s t yc z n e / c a s e r e p o r t s
Rys. 1. Zmiany skórne o charakterze złuszczania na podłożu
rumieniowym u 14-mięsięcznego pacjenta Kliniki Pediatrii, Nefrologii i Alergologii Dziecięcej WIM
Rys. 2. Zmiany skórne z charakterystycznym grubopłatowym
złuszczaniem u 14-mięsięcznego pacjenta Kliniki Pediatrii, Nefrologii i Alergologii Dziecięcej WIM
i IgG (57 IU/ml, N: 22–95 IU/ml). Cytometria przepływo‑
wa wykazała obniżoną ilość limfocytów T – zarówno po‑
mocniczych, jak i supresorowych. Zawartość procentowa
limfocytów B, komórek NK i neutrofilów była prawidłowa.
Wykluczono zaburzenia funkcji tarczycy. Stężenia witami‑
ny 25(OH)D (31,4 ng/ml) i fosfatazy zasadowej (199 U/l,
N < 320 U/l) mieściły się w granicach normy. W wymazie
ze skóry wyhodowano Staphylococcus aureus. Rozpozna‑
no atopowo-łojotokowe zapalenie skóry i zalecono lecze‑
nie miejscowymi antybiotykami, preparatami odkażający‑
mi oraz środkami natłuszczającymi.
W 14. miesiącu życia – z powodu uogólnionego stanu
zapalnego skóry ze złuszczaniem, z towarzyszącą infek‑
cją górnych dróg oddechowych – dziecko zostało przyjęte
do Kliniki Pediatrii, Nefrologii i Alergologii WIM. W wy‑
wiadzie rodzinnym u dzieci siostry ojca pacjenta stwier‑
dzono częste infekcje dróg oddechowych i skazę atopo‑
wą. Przy przyjęciu chłopca chorobę zdiagnozowano jako
erytrodermię z cechami rybiej łuski okrążającej. Na owło‑
sionej skórze głowy zaobserwowano nasilone złuszcza‑
nie; włosy były matowe, krótkie, boczne części brwi prze‑
rzedzone. Badanie pediatryczne wykazało cechy infekcji
górnych dróg oddechowych. Po zastosowaniu antybioty‑
ku ogólnie i miejscowo objawy infekcji układu oddecho‑
wego ustąpiły, stan skóry się poprawił, pozostały jednak
rozsiane plamy rumieniowe z grubopłatowym złuszcza‑
niem (rys. 2). Badanie w mikroskopie świetlnym włosów
pobranych z owłosionej skóry głowy uwidoczniło typowe
dla zespołu Nethertona włosy bambusowe (rys. 3).
Cztery tygodnie po wypisaniu z oddziału rodzice zgło‑
sili się z dzieckiem do Poradni Przyklinicznej z powodu
nasilenia złuszczania i rumienia. Obserwowano wówczas
ogniska rybiej łuski linijnej okrążającej (rys. 4). W celu
potwierdzenia klinicznego rozpoznania zespołu Comèla-Nethertona wykonano badanie genetyczne. Stosując me‑
todę sekwencjonowania DNA, przeprowadzono analizę
molekularną sekwencji 4 eksonów spośród 33: 3., 8., 17.,
26. genu SPINK5, wraz z otaczającymi sekwencjami in‑
tronowymi. Patogenna mutacja 2468insA była obecna
w jednym allelu genu SPINK5. Wynik ten nie potwier‑
dzał rozpoznania, ale też nie wykluczał, ponieważ istnia‑
ła możliwość występowania mutacji w innych regionach
genu niż te, które były badane. Planowane jest poszerze‑
nie diagnostyki genetycznej.
Rys. 3. Obraz mikroskopowy typowych dla zespołu Nethertona
włosów bambusowych u 14-mięsięcznego pacjenta Kliniki Pediatrii, Nefrologii i Alergologii Dziecięcej WIM
Rys. 4. Ogniska rybiej łuski linijnej okrążającej u 14-mięsięcznego pacjenta Kliniki Pediatrii, Nefrologii i Alergologii
Dziecięcej WIM
Pediatr Med rodz Vol 9 Numer 3, p. 287–291
289
P r ac e k a z u i s t yc z n e / c a s e r e p o r t s
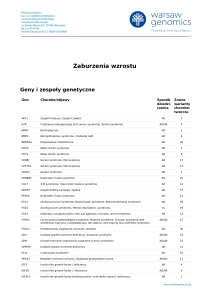
OMÓWIENIE
290
Zespół Comèla-Nethertona częściej dotyczy płci żeń‑
skiej (OMIM), choć w polskim opisie 6 przypadków
z 2003 roku nie stwierdzono predylekcji do tej choroby
u żadnej płci(10). Chorzy rodzą się z objawami erytroder‑
mii lub erytrodermii ichtiotycznej bądź z zespołem dziec‑
ka kolodionowego (collodion baby – skóra po urodzeniu
wygląda jak pokryta folią). Wśród najczęstszych przyczyn
erytrodermii u noworodków zespół Nethertona jest wy‑
mieniany po wrodzonych zaburzeniach odporności i róż‑
nych postaciach rybiej łuski(11). W różnicowaniu należy
uwzględnić infekcje, szczególnie gronkowcowe (staphylococcal scalded skin syndrome, SSSS) i drożdżakowe(12).
Lista schorzeń wieku niemowlęcego, które mogą być przy‑
czyną erytrodermii, obejmuje także łojotokowe zapalenie
skóry, atopowe zapalenie skóry, łuszczycę, mastocyto‑
zę, świerzb, łupież czerwony mieszkowy. Reakcje poleko‑
we w najmłodszej grupie wiekowej są rzadsze niż u doro‑
słych; pojawiają się głównie po antybiotykach. Nie zawsze
mają podłoże alergiczne – na przykład w zespole czerwo‑
nego człowieka, gdy dochodzi do poszerzenia naczyń na
skutek gwałtownego uwolnienia histaminy sprowokowa‑
nego szybkim wlewem dożylnym, szczególnie wankomy‑
cyny(12). W niektórych przypadkach przyczyna erytroder‑
mii pozostaje niewyjaśniona.
Dzieci z erytrodermią wrodzoną wymagają wnikliwej ob‑
serwacji i diagnostyki w celu wykluczenia niedoborów od‑
porności. U opisywanego pacjenta przeprowadzona zo‑
stała diagnostyka immunologiczna – utrzymującą się
nieprawidłowością był wysoki poziom IgE, stwierdzony
już w 4. miesiącu życia. Początkowo rozpoznawano atopo‑
we zapalenie skóry. Zmiany skórne były nietypowe, przej‑
ściowo z obecnością rumienia wokół otworów naturalnych
i na dystalnych częściach kończyn, co wskazywało na acrodermatitis enteropathica. Kolejne diagnozy stwierdzały łojo‑
tokowe zapalenie skóry, stany rumieniowe i atopowo-łojo‑
tokowe zapalenie skóry. Dopiero pojawienie się typowego
złuszczania i zmian we włosach umożliwiło ustalenie pra‑
widłowego rozpoznania. Zmiany w łodygach włosów mogą
być obecne od urodzenia, lecz częściej pojawiają się w póź‑
niejszym okresie. Oprócz włosów bambusowych (trichorrhexis invaginata), w których w poszerzoną część proksymal‑
ną jest wgłębiona zaokrąglona część dystalna, stwierdza się
włosy skręcone wzdłuż długiej osi (pili torti) i rozszczep wę‑
złowaty włosów (trichorrhexis nodosa), gdy w obrębie łodygi
włosa pojawia się struktura przypominająca wyglądem dwa
wbite w siebie pędzelki(13). U niektórych pacjentów istnie‑
je większe prawdopodobieństwo wystąpienia patologii we
włosach brwi niż na owłosionej skórze głowy(14,15). Makro‑
skopowo włosy na skórze głowy są łamliwe, gorzej rosną,
a w obrębie brwi są przerzedzone(13). W rozpoznaniu zespo‑
łu pomocne mogą być badania immunohistochemiczne lub
immunofluorescencyjne, w których nie stwierdza się ekspre‑
sji LEKTI w naskórku(16). Badanie histopatologiczne wy‑
cinków skórnych nie jest patognomoniczne, obserwowane
objawy są bowiem łuszczycopodobne(17). W odróżnieniu od
wrodzonych niedoborów odporności w zespole nie wystę‑
pują nacieki limfocytarne ani martwica keratynocytów(11).
Rozpoznanie choroby potwierdza badanie genetyczne wy‑
kazujące mutację w genie SPINK5. Opisano letalne przy‑
padki, w których dzieci nie przeżywają pierwszego roku
życia. Zgon następuje na skutek ciężkich powikłań infekcyj‑
nych z odwodnieniem hipernatremicznym. W przypadkach
łagodnych, tak jak u opisywanego chłopca, dochodzi jedy‑
nie do okresowego zaostrzania się zmian skórnych, których
nasilenie słabnie z wiekiem(10). U tych pacjentów szczególną
uwagę należy zwrócić na profilaktykę zakażeń bakteryjnych
(zwłaszcza S. aureus) oraz grzybiczych i wirusowych. Wska‑
zana jest profilaktyka zakażeń HPV, gdyż opisywano licz‑
ne zmiany z metaplazją nowotworową na ich podłożu(18,19).
Terapia zespołu jest uzależniona od wieku pacjenta, jego
stanu ogólnego i nasilenia zmian skórnych. Podstawą jest
właściwa pielęgnacja skóry, nawilżanie oraz stosowanie
środków odkażających(20). W przypadku zaostrzeń ulgę
przynosi krótkotrwałe użycie miejscowych glikokortyko‑
steroidów. Pimekrolimus, w odróżnieniu od takrolimusu,
jest lepiej tolerowany i w mniejszym stopniu wchłania się
do krążenia(20). Należy mieć na uwadze, że uszkodzona ba‑
riera naskórkowa przyczynia się do większego niż zazwy‑
czaj wchłaniania z powierzchni skóry. Ryzyko jatrogen‑
nego zespołu Cushinga jest większe, aczkolwiek trudno
osiągnąć taką dawkę glikokortykosteroidów stosowanych
miejscowo, która mogłaby go wywołać. Opisywano dobre
efekty leczenia fototerapią, jednak z zachowaniem ostroż‑
ności, ze względu na immunosupresyjne i kancerogenne
działania uboczne tej metody(21). Jako profilaktykę zaka‑
żeń kancerogennymi typami HPV należy propagować im‑
munizację(22). Terapią przyszłości może być postępowanie
oddziałujące na patomechanizm: suplementacja dermicy‑
dyny oraz blokowanie matryptazy (patrz: Wstęp). Czeka‑
my na nowe rozwiązania.
PIŚMIENNICTWO:
BIBLIOGRAPHY:
1.
2.
3.
4.
5.
6.
7.
Comèl M.: Ichthyosis linearis circumflexa. Dermatologica
1949; 98: 133–136.
Netherton E.: A unique case of trichorrhexis nodosa; bamboo
hairs. AMA Arch. Derm. 1958; 78: 483–487.
Grimbacher B., Belohradsky B.H., Holland S.M.: Immuno‑
globulin E in primary immunodeficiency diseases. Allergy
2002; 57: 995–1007.
Sales K.U., Masedunskas A., Bey A.L. i wsp.: Matriptase ini‑
tiates activation of epidermal pro-kallikrein and disease onset
in a mouse model of Netherton syndrome. Nat. Genet. 2010;
42: 676–683.
Ishida-Yamamoto A., Igawa S., Kishibe M.: Order and disor‑
der in corneocyte adhesion. J. Dermatol. 2011; 38: 645–654.
Elias P.M., Wakefield J.S.: Therapeutic implications of a bar‑
rier-based pathogenesis of atopic dermatitis. Clin. Rev. Aller‑
gy Immunol. 2011; 41: 282–295.
Stryk S., Siegfried E.C., Knutsen A.P.: Selective antibody defi‑
ciency to bacterial polysaccharide antigens in patients with
Netherton syndrome. Pediatr. Dermatol. 1999; 16: 19–22.
Pediatr Med rodz Vol 9 Numer 3, p. 287–291
P r ac e k a z u i s t yc z n e / c a s e r e p o r t s
8.
9.
10.
11.
12.
13.
14.
15.
Renner E.D., Hartl D., Rylaarsdam S. i wsp.: Comèl-Nether‑
ton syndrome defined as primary immunodeficiency. J. Aller‑
gy Clin. Immunol. 2009; 124: 536–543.
Bennett K., Heywood W., Di W.L. i wsp.: The identification
of a new role for LEKTI in the skin: The use of protein ‘bait’
arrays to detect defective trafficking of dermcidin in the skin
of patients with Netherton syndrome. J. Proteomics 2012; 75:
3925–3937.
Rosińska-Borkowska D., Nieżurawska G., Łukomska M.:
Zespół Nethertona u sześciorga dzieci. Przegl. Dermatol.
2003; 90: 107–112.
Pruszkowski A., Bodemer C., Fraitag S. i wsp.: Neonatal and
infantile erythrodermas: a retrospective study of 51 patients.
Arch. Dermatol. 2000; 136: 875–880.
Ott H., Hütten M., Baron J.M. i wsp.: Neonatal and infantile
erythrodermas. J. Dtsch. Dermatol. Ges. 2008; 12: 1070–1086.
Mirmirani P., Huang K.P., Price V.H.: A practical, algorithmic
approach to diagnosing hair shaft disorders. Int. J. Dermatol.
2011; 50: 1–12.
Powell J., Dawber R.P., Ferguson D.J., Griffiths W.A.: Nether‑
ton’s syndrome: increased likelihood of diagnosis by examin‑
ing eyebrow hairs. Br. J. Dermatol. 1999; 141: 544–546.
Boussofara L., Ghannouchi N., Ghariani N. i wsp.: Nether‑
ton’s syndrome: the importance of eyebrow hair. Dermatol.
Online J. 2007; 13: 21.
16. Diociaiuti A., Castiglia D., Fortugno P. i wsp.: Lethal Nether‑
ton syndrome due to homozygous p.Arg371X mutation
in SPINK5. Pediatr. Dermatol. 2013; 30: 65–67.
17. Fartasch M., Williams M.L., Elias P.M.: Altered lamellar body
secretion and stratum corneum membrane structure
in Netherton syndrome. Arch. Dermatol. 1999; 135: 823–832.
18. Weber F., Fuchs P.G., Pfister H.J. i wsp.: Human papillomavi‑
rus infection in Netherton’s syndrome. Br. J. Dermatol. 2001;
144: 1044–1049.
19. Fölster-Holst R., Swensson O., Stockfleth E. i wsp.: ComèlNetherton syndrome complicated by papillomatous skin
lesions containing human papillomaviruses 51 and 52 and
plane warts containing human papillomavirus 16. Br. J. Der‑
matol. 1999; 140: 1139–1143.
20. Dyer J.A., Spraker M., Williams M.: Care of the newborn with
ichthyosis. Dermatol. Ther. 2013; 26: 1–15.
21. Osmola-Mańkowska A., Silny W., Dańczak-Pazdrowska A.
i wsp.: A case of a Comél-Netherton syndrome patient treated
with UVA1 phototherapy. Post. Dermatol. Alergol. 2011; 5:
418–421.
22. Fleckman P., Newell B.D., van Steensel M.A., Yan A.C.: Topi‑
cal treatment of ichthyoses. Dermatol. Ther. 2013; 26: 16–25.
Doppelherz® aktiv
Witamina D 800
60 tabletek
Dawka witaminy D 800 I.U.
jest zalecana przez ekspertów
klinicznych do codziennego
stosowania przez cały rok,
wg najnowszych rekomendacji
klinicznych z 2013 r.
Dla dzieci i dorosłych.
Opakowanie na 2 miesiące stosowania!
Odporność przez cały rok!
291*
Pediatr Med rodz Vol 9 Numer 3, p. 287–291
* Wytwarzanie wg standardu WHO.