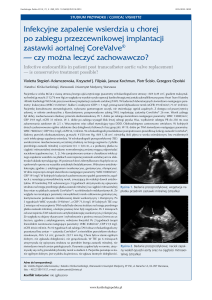
a baterie zazwyczaj umieszcza w okolicy prawego górnego kwadrantu brzucha.
Urządzenie HeartMate LVAD (Thoratec Corp., Pleasanton, CA)
wykorzystuje konfigurację identyczną jak w systemie Novacor (ryc.
228-2). Różnica między nimi polega na użyciu innych materiałów
do produkcji i skłonności do powikłań zakrzepowo-zatorowych.
W przypadkach obu tych urządzeń możliwe jest funkcjonowanie
pacjenta poza szpitalem i oczekiwanie na przeszczep w warunkach
domowych.
Nowsze urządzenia, obecnie w trakcie badań klinicznych, składają się z szeregu kilkunastu pomp pobierających krew z koniuszka
lewej komory, mających zasadniczo takie same połączenia z układem krążenia, lecz o istotnie mniejszych rozmiarach, mniejszej
ilości części składowych niż wcześniejsze urządzenia oraz umożliwiających niepulsacyjny przepływ krwi. Wszystkie nadal wymagają
połączeń z systemami zasilania pozaustrojowymi.
CELE
Przewiduje się, że rozwój wynalazków na polu systemów wspomagających serce długoterminowo przebiegnie dwutorowo. Po pierwsze
nowa generacja pomp będzie prawdopodobnie mniejsza i prostsza
Left battery
omitted for clarity
PIŚMIENNICTWO UZUPEŁNIAJĄCE
Deng MC et al: Mechanical circulatory support device database of
the International Society for Heart and Lung Transplantation:
Third annual report—2005. J Heart Lung Transplant 24:1182,
2005
Garnier JL et al: Treatment of post-transplant lymphomas with
anti-Bcell monoclonal antibodies. Recent Results Cancer Res
159:113, 2002
Gray NA Jr, Selzman CH: Current status of the total artificial
heart. Am Heart J 152:4, 2006
Hunt SA et al: ACC/AHA 2005 guideline update for the diagnosis
and management of chronic heart failure in the adult: A report of
the American College of Cardiology/American Heart Association
Task Force on Practice Guidelines (Writing committee to update
the 2001 guidelines for the evaluation and management of heart
failure). Available at http://www.acc.org/clinical/guidelines/failure//index.pdf
Mancini D et al: Use of rapamycin slows progression of cardiac
transplantation vasculopathy. Circulation 108:48, 2003
Taylor DO et al: Registry of the International Society for Heart and
Lung Transplantation: Twenty-second official adult heart transplant report—2005. J Heart Lung Transplant 224:945, 2005
wady serca
229 Wrodzone
u dorosłych
John S. Child
Wrodzone wady serca (congenital heart disease – CHD) dotyczą
około 1% wszystkich żywych urodzeń w populacji ogólnej, ale występują u około 4% potomstwa kobiet z wrodzonymi wadami serca.
Spora grupa dotkniętych nimi dzieci, szacowana obecnie na > 85%,
osiąga wiek dorosły dzięki pomyślnemu postępowaniu farmakologicznemu i/lub chirurgicznemu albo ze względu na dobrą tolerancję
zmian fizjologii serca i naczyń. Obecnie w Stanach Zjednoczonych
żyje ponad 800 000 dorosłych operowanych lub nie z powodu wrodzonej wady serca, przewyższając liczbę dzieci z wrodzoną wadą
serca.
Aorta
Zewnętrzny układ
zasilania
Łącznik i
filtr cewnika
Serce
LVAD
Poziom
skóry
Układ sterowniczy
RYC. 228-2. Wykres przedstawiający system wspomagania lewej komory
typu HeartMate. (Przedruk za: Thoratec Corp., Pleasanton, CA, za pozwoleniem.
ETIOLOGIA
Ogólnie rzecz biorąc, wrodzone wady rozwojowe serca są rezultatem niewłaściwego rozwoju embrionalnego prawidłowej struktury
lub braku przekształcenia jej poza wczesny etap embrionalnego czy
płodowego rozwoju. Do ich powstania prowadzą złożone czynniki genetyczne i środowiskowe. Poznane aberracje chromosomalne i mutacje pojedynczych genów są przyczynami mniej niż 10%
wszystkich wad rozwojowych serca.
Obecności wady serca – jako składowej zajęcia wielu układów
w zespołach Downa, Turnera, trisomii 13-15(D1) i 17-18(E) – można się spodziewać w niektórych ciążach poprzez wykrycie nieprawidłowych chromosomów w komórkach płodu uzyskanych z płynu
owodniowego albo biopsji kosmówki. Identyfikacja zaburzeń enzymatycznych, charakterystycznych dla zespołu Hurlera, homocystynurii czy glikogenozy typu II, w takich komórkach także może
pozwalać na przewidywanie wady serca.
PATOFIZJOLOGIA
Zmiany anatomiczne i fizjologiczne w sercu i krążeniu, spowodowane określoną wrodzoną nieprawidłowością sercowo-krążeniową,
nie pozostają niezmienne, lecz raczej ulegają progresji od życia prenatalnego do dorosłego. I tak, wady rozwojowe, które są łagodne lub
nie zostały wykryte w dzieciństwie, mogą stać się klinicznie objawo-
ROZDZIAŁ 229 Wrodzone wady serca u dorosłych
WYNIKI
Stosowanie tego typu urządzeń w Stanach Zjednoczonych jest ograniczone głównie do pacjentów we wstrząsie po operacji kardiochirurgicznej i jako terapia pomostowa dla transplantacji serca. Wyniki ich wykorzystania w terapii pomostowej są dobre, z prawie 75%
przyjęciem się przeszczepu u młodych biorców w ciągu pierwszego
roku po operacji; chorzy ci mają bardzo dobre współczynniki przeżywalności potransplantacyjnej.
Opublikowane wyniki badania REMATCH (Randomized Evaluation of Mechanical Assistance in the Treatment of Heart Failure)
w 2001 roku pokazały nieznaczną poprawę przeżywalności pacjentów niekwalifikowanych do przeszczepu serca w schyłkowym
stadium niewydolności serca, zrandomizowanych do wszczepienia
HeartMate LVAD (choć z wysokim wskaźnikiem powikłań, w szczególności neurologicznych), w porównaniu z terapią farmakologiczną, tym samym wzrosło na nowo zainteresowanie stosowaniem tych
urządzeń jako alternatywy transplantacji. FDA zaaprobowało użycie jednego z tych urządzeń właśnie w tym wskazaniu. To z kolei
w 2002 roku skłoniło ISHLT do prowadzenia bazy Mechanicznych
Urządzeń Wspomagających Serce W rejestrze mieszczą się dobrowolnie składane informacje z 60 międzynarodowych centrów i od
655 pacjentów na podstawie ostatniej publikacji. Zaledwie 12% tych
chorych miało wszczepione urządzenie z zamiarem stałego, dożywotniego użycia z wskaźnikiem przeżywalności na poziomie 65%
w ciągu sześciu miesięcy i 34% w ciągu roku.
w budowie, jak również – co ważniejsze – całkowicie wszczepia- 1619
na w ciało ludzkie. Po drugie w niedalekiej przyszłości planuje się
zwiększenie wykorzystania pomp nowej generacji jako stałego (docelowego) leczenia pacjentów ze schyłkową niewydolnością serca
zdyskwalifikowanych do transplantacji serca. Ostatecznie, oczekuje
się, że unowocześnione urządzenia wspomagające staną sie realną
alternatywą dla biologicznego przeszczepu serca, nawet u chorych
kwalifikujących się do przeszczepu, i pozwolą rozwiązać problem
nieadekwatnego zapotrzebowania na przeszczep do liczby dawców.
1620 we w wieku dorosłym. Na przykład czynnościowo prawidłowa dwupłatkowa zastawka aortalna może ulec pogrubieniu i zwapnieniu,
prowadząc do objawowego zwężenia aortalnego; dobrze tolerowany
przeciek z lewa na prawo ubytku przegrody międzyprzedsionkowej
może nie powodować dekompensacji krążenia z nadciśnieniem
płucnym (lub bez) aż do czwartej czy piątej dekady życia.
CZĘŚĆ 9
Choroby układu sercowo-naczyniowego
Nadciśnienie płucne. Często towarzyszy ono wielu wrodzonym wadom
serca, a stan łożyska naczyniowego płuc zazwyczaj jest głównym
wyznacznikiem: manifestacji klinicznej, przebiegu i wykonalności
zabiegu chirurgicznego. Wzrost ciśnienia w tętnicach płuc wynika
ze zwiększenia przepływu i/lub oporu płucnego, ten ostatni spowodowany jest czasami wzrostem napięcia naczyń, lecz zwykle powstaje wskutek zamykających zarostowych zmian strukturalnych
wewnątrz łożyska naczyniowego płuc. Ponieważ zarostowe zmiany naczyń płucnych mogą być czynnikiem warunkującym ocenę
wskazań do operacji, ważne jest ilościowe określenie i porównanie
przepływów płucnego i układowego u pacjentów z ciężkim nadciśnieniem płucnym. Przyczyny choroby zarostowej naczyń płucnych
są nieznane, chociaż na proces ten mogą wpływać: wzrastający przepływ płucny krwi i ciśnienie w tętnicach płucnych, podniesienie ciśnienia w żyłach płucnych, erytrocytoza, układowe niedotlenienie,
kwasica oraz krążenie oskrzelowe. Określenie zespół Eisenmengera stosuje się w odniesieniu do osób z dużym połączeniem między
dwoma krążeniami na poziomach aortalno-płucnym, komorowym
lub przedsionkowym i dwukierunkowym bądź przeważającym
przeciekiem z prawa na lewo spowodowanym wysokooporowym
i zarostowym nadciśnieniem płucnym. Leki rozszerzające tętnice
płucne oraz zarówno transplantacja jednego płuca i korekcja wady
serca lub całkowita transplantacja serca i płuc wydają się obiecujące
w zmniejszeniu objawów choroby (patrz rozdz. 228 i 260).
Erytrocytoza. Przewlekłe niedotlenienie w siniczych wadach serca
powoduje erytrocytozę na skutek wzrostu produkcji erytropoetyny
(patrz rozdz. 35). Powszechnie używany termin „policytemia” jest
błędny, gdyż liczba białych krwinek jest prawidłowa, a liczba płytek krwi pozostaje w normie albo jest obniżona. Pacjenci z sinicą
i erytrocytozą mogą mieć wyrównany lub nie poziom hematokrytu.
Erytrocytoza wyrównana z hematokrytem o właściwym nasyceniu
żelazem rzadko powoduje objawy nadmiernej lepkości przy hematokrycie mniejszym niż 65% i czasami przy jego wartości 70% lub
więcej. Terapeutyczne upusty krwi rzadko są niezbędne w wyrównanej erytrocytozie. I przeciwnie pacjent z niewyrównaną erytrocytozą nie może osiągnąć równowagi z niestabilnym rosnącym hematokrytem i nawracającymi symptomami nadmiernej lepkości krwi.
Terapeutyczna flebotomia, broń obosieczna, pozwala na przejściowe
zmniejszenie objawów, lecz powoduje brak stabilności hematokrytu
i pogłębia problem przez utratę żelaza. Symptomy niedoboru żelaza są zwykle nie do odróżnienia od objawów nadmiernej lepkości;
narastające symptomy po kolejnym upuście krwi zwykle są wywołane niedoborem żelaza z mikrocytozą niedobarwliwą. Niedobór
żelaza powoduje zwiększoną liczbę mniejszych (mikrocytarnych)
niedobarwliwych erytrocytów, które mają mniejszą zdolność przenoszenia tlenu i są mniej podatne na odkształcenia w mikrokrążeniu. Ponieważ takie mikrocyty są mniej zdolne do odkształceń
w mikrokrążeniu i jest ich więcej w stosunku do objętości osocza,
lepkość jest większa niż dla odpowiadającego hematokrytu z mniejszą ilością większych bogatych w żelazo odkształcalnych komórek.
Jako taka, erytrocytoza z niedoborem żelaza powoduje narastanie
objawów wynikające ze zmniejszonego dowozu tlenu do tkanek.
We wrodzonych siniczych wadach serca hemostaza jest nieprawidłowa – częściowo ze względu na wzrost objętości krwi i przekrwione naczynia włosowate, zaburzenia funkcji płytek krwi, wrażliwość
na kwas acetylosalicylowy bądź niesteroidowe leki przeciwzapalne
oraz zaburzenia w wewnątrz- i zewnątrzpochodnym układzie krzepnięcia. Doustne środki antykoncepcyjne są przeciwwskazane u kobiet z sinicą z powodu wzrostu ryzyka rozwoju zakrzepicy naczyń.
Ryzyko udaru jest największe u dzieci poniżej 4. roku życia z siniczą wadą serca i niedoborem żelaza, często z odwodnieniem jako
czynnikiem pogarszającym stan. Przeciwnie dorośli z siniczą wadą
serca nie wykazują zwiększonego ryzyka wystąpienia udaru, chyba
że dokonuje się nadmiernych, nieprzemyślanych upustów krwi lub
niewłaściwego dawkowania kwasu acetylosalicylowego czy antykoagulantów albo rozwijają się tachyarytmie nadkomorowe lub infekcyjne zapalenie wsierdzia.
Objawy nadmiernej lepkości mogą pojawić się u każdego pacjenta z sinicą i erytrocytozą, jeśli odwodnienie powoduje zmniejszenie
objętości osocza. Flebotomia, wskazana przy objawach nadmiernej
lepkości niewywołanej odwodnieniem czy niedoborem żelaza, jest
prostym ambulatoryjnym zabiegiem usunięcia 500 ml krwi w czasie
powyżej 45 minut z izowolumetrycznym uzupełnieniem solą fizjologiczną. Szybki upust krwi bez uzupełnienia objętości jest przeciwwskazany. Nasycanie żelazem w niewyrównanej erytrocytozie
z nadmierną jego utratą łagodzi objawy niedoboru, lecz musi odbywać się stopniowo w celu uniknięcia nagłego wzrostu hematokrytu
i wynikającej stąd nadmiernej lepkości.
Ciąża. Fizjologiczne zmiany podczas prawidłowej ciąży (patrz rozdz.
7) są w stanie wywoływać objawy subiektywne i dane kliniczne,
które mogą błędnie sugerować chorobę serca. Zdrowie matki jest
szczególnie narażone, jeśli występuje u niej schorzenie układu sercowo-naczyniowego, współistniejące z chorobą naczyń płucnych
i nadciśnieniem płucnym (czyli zespołem Eisenmengera lub zwężeniem zastawki mitralnej) bądź z przeszkodą w przepływie lewokomorowym. Istnieje ryzyko zgonu matki w przypadku każdej
występującej u niej wady rozwojowej, która może powodować niewydolność serca lub hemodynamicznie ważne zaburzenia rytmu.
U kobiet ze zwężeniem aorty czy zespołem Marfana należy obawiać
się rozwarstwienia aorty. Pacjentki z siniczą wadą serca, nadciśnieniem płucnym oraz zespołem Marfana nie powinny zachodzić
w ciążę; osoby z anomaliami możliwymi do korekcji należy ostrzec
przed konsekwencjami ciąży z wadą nieskorygowaną w stosunku do
przeprowadzenia zabiegu i ciąży w późniejszym czasie. Wpływ ciąży
na pacjentki po operacji zależy od rezultatu zabiegu, łącznie z obecnością i ciężkością pozostałości wady, następstwami oraz powikłaniami. W takich przypadkach antykoncepcja jest ważnym tematem
rozmów. U kobiet, u których ciąża jest bezwzględnie przeciwwskazana, powinno rozważyć się podwiązanie jajowodów.
BAKTERYJNE ZAPALENIE WSIERDZIA
(Patrz rozdz. 118). Rutynowa profilaktyka przeciwbakteryjna zalecana jest wszystkim pacjentom z: wrodzoną anomalią serca po operacyjnej korekcie wady i nieoperowanym w przypadku wszystkich
zabiegów dentystycznych, zabiegów operacyjnych w obrębie przewodu pokarmowego i moczowo-płciowego oraz niektórych procedur diagnostycznych np. sigmoido- i cystoskopii. Kliniczny i bakteriologiczny profil infekcyjnego zapalenia wsierdzia u pacjentów
z wrodzoną wadą serca zmienił się wraz z pojawieniem się kardiochirurgii oraz protez sztucznych i biologicznych. Dwa główne czynniki predysponujące do bakteryjnego zapalenia wsierdzia to podatny
składnik sercowo-naczyniowy oraz źródło bakteriemii. Profilaktyka
obejmuje działania zarówno chemioterapeutyczne (antymikrobiotyczne), jak i niechemioterapeutyczne (higieniczne). Niezbędna jest
systematyczna dbałość o czystość skóry i opieka stomatologiczna.
WYSIŁEK FIZYCZNY
Wskazania do uprawiania sportów są uwarunkowane rodzajem
ćwiczeń oraz postacią i ciężkością wrodzonej wady układu sercowo-naczyniowego. Pacjenci z anomaliami charakteryzującymi się
utrudnionym przepływem lewokomorowym, jeśli jest on cięższy od
nieznacznego do umiarkowanego, ryzykują omdlenia, lub nawet nagłą śmierć. W przypadku tetralogii Fallota nieoperowanej wywołany
ćwiczeniami izotonicznymi spadek oporu naczyń obwodowych, zależny od utrudnienia przepływu prawokomorowego, nasila przeciek
z prawa na lewo, powoduje wzrost hipoksemii oraz zwiększenie subiektywnego uczucia duszności wskutek odpowiedzi ośrodka oddechowego na zmiany stężeń gazów i pH krwi.
OPIS POSZCZEGÓLNYCH WAD SERCA
W tabelach 229-1, 229-2 i 229-3 zamieszczono podział wrodzonych
wad serca na: złożone, umiarkowane i proste. Celem tych tabeli jest
sugerowanie konieczności konsultacji kardiologicznej lub specjalnej
opieki w przypadku zaawansowanej wady wrodzonej serca. Pacjenci
ze złożoną wadą wrodzoną (w skład której wchodzą w większości
zoperowane odmienności anatomiczne, obejmujące CHD) powinni być monitorowani przez wyspecjalizowane centra leczenia wad
serca u dorosłych. Umiarkowane wady serca należy wstępnie konsultować, a następnie okresowo kontrolować kardiologicznie. Proste
wady wrodzone mogą podlegać kontroli internistycznej, choć wskazana jest okresowa ocena kardiologiczna.
TABELA 229-1
Wrodzone wady złożone u dorosłych
Wrodzone wady sinicze (wszystkie rodzaje)
Zespół Eisenmengera
Anomalia Ebsteina
Tetralogia Fallota lub atrezja tętnicy płucnej (wszystkie rodzaje)
Przełożenie wielkich naczyń
Pojedyncza komora, atrezja zastawek mitralnej lub trójdzielnej
Dwuujściowa komora
Przetrwały pień tętniczy
Operacje Rastelliniego i Fontana
TABELA 229-2
Częściowo złożone wady wrodzone u dorosłych
TABELA 229-3
Proste wady wrodzone u dorosłych
Nie związane z procedurami leczniczymi
Niepowikłane wrodzone wady zastawki aortalnej
Umiarkowana wada wrodzona zastawki mitralnej (z wyjątkiem zastawki
namiotowej, wypadania płatków zastawki mitralnej)
Niepowikłane małe ubytki przegrody międzyprzedsionkowej
Umiarkowana stenoza zastawki płucnej
Po procedurach leczniczych
Wcześniej podwiązany lub obliterowany przetrwały przewód tętniczy
Skorygowany ubytek przegrody międzyprzedsionkowej typu ostium
secundum albo zatoki żylnej
Skorygowany ubytek przegrody międzykomorowej
NIESINICZE WRODZONE WADY SERCA Z PRZECIEKIEM Z LEWA NA PRAWO
Ubytek przegrody międzyprzedsionkowej. Jest to powszechna anomalia
serca u dorosłych, częściej występująca u kobiet. Postać typu sinus
venosus umiejscawia się wysoko w przegrodzie międzyprzedsionkowej, w pobliżu ujścia żyły głównej górnej, i często jest związana
z nieprawidłowym połączeniem żył z prawego płuca i łącza żyły
głównej górnej z prawym przedsionkiem. Anomalie typu ostium
primum są postacią ubytku przegród przedsionkowej i komorowej,
które występują w bezpośrednim sąsiedztwie zastawek przedsionkowo-komorowych, z których każda może być zniekształcona lub
niedomykalna. Ubytki ostium primum pojawiają się zwykle u pacjentów z zespołem Downa, choć bardziej złożone ubytki przegród
serca z częstym ubytkiem zastawki przedsionkowo-komorowej i tylnej części przegrody międzykomorowej są bardziej znamienne dla
tej nieprawidłowości chromosomalnej. Najczęstszy ubytek przegrody międzyprzedsionkowej dotyczy dołu owalnego, leży w środkowej
części przegrody i przyjmuje postać typu ostium secundum. Nie
należy mylić tej postaci ubytku z przetrwałym otworem owalnym.
Anatomiczne zarośnięcie otworu owalnego następuje zwykle po
jego czynnościowym zamknięciu wkrótce po urodzeniu, lecz pozostały otwór możliwy do przejścia cewnikiem jest odmianą prawidłową; ubytek przegrody międzyprzedsionkowej oznacza prawdziwy
brak części przegrody przedsionkowej oraz drożność anatomiczną
i czynnościową.
Wielkość przecieku z lewa na prawo przez ubytek przegrody
przedsionkowej zależy od: rozmiaru ubytku, właściwości rozkurczowych obydwu komór oraz oporu względnego krążenia płucnego
i systemowego. Przeciek z lewa na prawo powoduje rozkurczowe
przeciążenie prawej komory i wzrost przepływu płucnego krwi.
Pacjenci z ubytkiem przegrody międzyprzedsionkowej nie mają
zwykle objawów we wczesnym okresie życia, chociaż mogą mieć
u nich miejsce niewielki niedorozwój fizyczny i większa podatność na zakażenia układu oddechowego; symptomy ze strony serca
BADANIE FIZYKALNE Badanie ujawnia zazwyczaj widoczny impuls uderzenia prawej komory i wyczuwalne tętnienie tętnicy płucnej. Pierwszy
ton serca jest prawidłowy bądź rozszczepiony, z akcentowaniem
składowej zamknięcia zastawki trójdzielnej. Zwiększony przepływ
przez zastawkę płucną odpowiada za śródskurczowy szmer wyrzucania nad pniem płucnym. Drugi ton serca jest szeroko rozdwojony
i pozostaje stały niezależnie od oddechu. Śródrozkurczowy turkoczący szmer najgłośniejszy w czwartej przestrzeni międzyżebrowej
i wzdłuż lewego brzegu mostka odzwierciedla zwiększony przepływ
przez zastawkę trójdzielną. U pacjentów z ubytkiem ostium primum
mruk koniuszkowy i szmer holosystoliczny wskazują na współistnienie niedomykalności zastawki mitralnej lub trójdzielnej bądź
ubytku w przegrodzie międzykomorowej.
Objawy dostępne w badaniu fizykalnym zmieniają się, gdy wzrost
oporu naczyniowego płuc prowadzi do zmniejszenia przecieku
z lewa na prawo. Szmer zarówno z zastawki płucnej, jak i trójdzielnej nasilają się, składowa płucna drugiego tonu serca i skurczowego tonu wyrzucania są zaakcentowane, obydwie składowe drugiego tonu serca mogą się łączyć i pojawia się szmer rozkurczowy fali
zwrotnej z zastawki płucnej. Rozwojowi przecieku z prawa na lewo
towarzyszą sinica i pałeczkowatość palców.
U dorosłych z ubytkiem przegrody międzyprzedsionkowej
oraz migotaniem przedsionków dane stwierdzone w badaniu fizykalnym mogą być mylone z objawami zwężenia zastawki mitralnej
z nadciśnieniem płucnym, ponieważ szmer przepływu przez zastawkę trójdzielną i szeroko rozdwojony drugi ton serca mogą być
omyłkowo wzięte za, odpowiednio, szmer rozkurczowy zwężenia
mitralnego i mitralny „klik otwarcia”.
ELEKTROKARDIOGRAM. U pacjentów z ubytkiem ostium secundum EKG
najczęściej wykazuje odchylenie osi elektrycznej serca w prawo i zespół rSŕ w pierwszym odprowadzeniu przedsercowym, reprezentujący opóźnioną aktywację tylnopodstawnej części przegrody międzykomorowej oraz powiększenie drogi przepływu prawokomorowego. Czasami może pojawić się ektopowy rozrusznik w obrębie
przedsionka lub blok przedsionkowo-komorowy I stopnia u pacjentów z ubytkiem typu sinus venosus. U osób z ubytkiem typu ostium
primum blok prawej odnogi pęczka Hisa znamiennie towarzyszy
odchyleniu osi elektrycznej serca w lewo oraz skierowaniu do góry
i rotacji zespołu QRS w kierunku przeciwnym do ruchu wskazówek
zegara w płaszczyźnie czołowej. W każdym typie ubytku może występować różnego stopnia przerost prawego przedsionka i komory
w zależności od wysokości ciśnienia w tętnicy płucnej. RTG klatki
piersiowej ujawnia: powiększenie prawego przedsionka i komory,
rozszerzenie pnia płucnego i jego gałęzi oraz wzmożony rysunek
naczyniowy płuc.
ECHOKARDIOGRAM. Badanie to wykazuje rozszerzenie pnia płucnego
i prawej komory oraz przedni (paradoksalny) lub spłaszczony ruch
przegrody międzykomorowej w czasie skurczu w przypadku obecności znacznie zwiększonego przeciążenia objętościowego prawej
komory. Ubytek może być bezpośrednio uwidoczniony w dwuwymiarowej echokardiografii z kolorowym Dopplerem, które zastąpiły
cewnikowanie serca jako test potwierdzenia ubytku przegrody międzyprzedsionkowej. Echokardiografia przezprzełykowa jest wskazana, jeśli obraz przezpiersiowy wydaje się dwuznaczny, co często ma
miejsce w ubytku sinus venosus (ryc. 229-1). Cewnikowanie serca
wykonuje się, gdy: istnieją niezgodności w danych klinicznych, jeżeli podejrzewa się wysokie nadciśnienie płucne bądź połączenie kilku
wad rozwojowych albo możliwa jest choroba naczyń wieńcowych.
LECZENIE UBYTKU PRZEGRODY MIĘDZYPRZEDSIONKOWEJ
Korekcja chirurgiczna, zwykle z zastosowaniem łaty z osierdzia lub materiału protezującego lub przezskórnie wprowadzanymi urządzeniami
ROZDZIAŁ 229 Wrodzone wady serca u dorosłych
Ubytek przegrody międzyprzedsionkowej typu ostium primum lub
sinus venosus
Nieprawidłowy spływ żył płucnych, całkowity albo częściowy
Kanał przedsionkowo-komorowy (całkowity lub częściowy)
Ubytek przegrody międzykomorowej, złożony (np. współwystępowanie
braku lub nieprawidłowych zastawek bądź z przeszkodami w drodze
odpływu z komory, niedomykalność aortalna)
Koarktacja aorty
Stenoza zastawki płucnej (umiarkowana do ciężkiej)
Istotne hemodynamicznie lejkowate ujście prawej komory
Niedomykalność zastawki płucnej (umiarkowana do ciężkiej)
Przetrwały przewód tętniczy Botalla (niezamknięty) – umiarkowany do
dużego
Przetoka zatoki Valsalvy/tętniak
Stenoza aortalna pod- lub nadzastawkowa
i układu oddechowego pojawiają się u wielu starszych osób. Powy- 1621
żej czwartej dekady życia u znacznej liczby chorych rozwijają się:
przedsionkowe zaburzenia rytmu serca, nadciśnienie w tętnicach
płucnych, przeciek dwukierunkowy, a następnie z lewa na prawo
oraz niewydolność serca. W przypadku pacjentów narażonych na
przewlekły niedobór tlenu w środowisku albo przebywanie na dużych wysokościach istnieje tendencja do pojawiania się nadciśnienia
płucnego w młodszym wieku. U niektórych starszych osób przeciek
z lewa na prawo przez ubytek wzrasta w miarę jak rosnące nadciśnienie systemowe i/lub choroba niedokrwienna naczyń wieńcowych prowadzą do zmniejszenia podatności lewej komory.
1622
CZĘŚĆ 9
Choroby układu sercowo-naczyniowego
RYC. 229-1.* Ubytek przegrody międzyprzedsionkowej typu ostium secundum. Przezprzełykowy echokardiogram ubytku przegrody międzyprzedsionkowej typu ostium secundum i jego zamknięcia przyrządowego. A. Ubytek przegrody międzyprzedsionkowej (ASD) pomiędzy lewym (LA)
i prawym przedsionkiem (RA). B. Urządzenie wprowadzone przezskórnie zamknęło ubytek. IVC (inferior vena cava) – żyła główna dolna; SVC (superior
vena cava) – żyła główna górna.
zamykającymi, jeżeli ubytek jest określonego rozmiaru i kształtu, powinna
być doradzana wszystkim pacjentom z niepowikłanym ubytkiem przegrody międzyprzedsionkowej, u których istnieje znaczący przeciek z lewa na
prawo, czyli ze stosunkiem przepływu płucnego do systemowego, przekraczającym około 2,0:1,0. Można przewidywać doskonałe rezultaty przy niskim
ryzyku, nawet u osób powyżej 40. roku życia, jeśli nie występuje nadciśnienie płucne. U pacjentów z ubytkiem typu ostium primum rozszczepione,
zniekształcona i niedomykalna, zastawki mitralne mogą wymagać korekcji
dodatkowo do zamknięcia ubytku w przegrodzie międzyprzedsionkowej za
pomocą łaty. Operacji nie należy przeprowadzać u osób z małym ubytkiem
i nieznacznym przeciekiem z lewa na prawo albo zaawansowaną chorobą
naczyń płucnych bez znaczącego przecieku z lewa na prawo.
Pacjenci z ubytkiem przegrody międzyprzedsionkowej, typu sinus venosus lub ostium secundum, rzadko umierają przed piątą dekadą życia. W czasie
piątej i szóstej dekady częstość narastających objawów, nierzadko prowadzących do ciężkiego inwalidztwa, znacznie wzrasta. Postępowanie medyczne
powinno obejmować: natychmiastowe leczenie zakażeń układu oddechowego, leki przeciwarytmiczne w przypadku migotania przedsionków czy
tachykardii nadkomorowej i zwykłą terapię nadciśnienia, choroby niedokrwiennej bądź niewydolności serca (patrz rozdz. 227), jeżeli powikłania te
są obecne. Zagrożenie bakteryjnym zapaleniem wsierdzia jest dość niskie,
dopóki ubytek nie jest powikłany niedomykalnością zastawek albo nie był
niedawno korygowany za pomocą łaty (patrz rozdz. 118).
Ubytek przegrody międzykomorowej. Ubytki przegrody międzykomorowej są częste jako odosobniona anomalia i składowa kombinacji wad
rozwojowych. Otwór zazwyczaj jest pojedynczy i położony w części
błoniastej przegrody. Zaburzenie czynnościowe zależy głównie od
jego rozmiaru oraz stanu łożyska naczyniowego płuc. Najczęściej
u dorosłych widzi się tylko ubytki o małych lub umiarkowanych
rozmiarach, jako że ogromna większość pacjentów z pojedynczymi
dużymi ubytkami pozostaje pod opieką medyczną i często chirurgiczną w bardzo wczesnym okresie życia.
Istnieje szerokie spektrum historii naturalnej ubytku w przegrodzie międzykomorowej, począwszy od samoistnego zamknięcia, a skończywszy na powstaniu zastoinowej niewydolności serca
i śmierci we wczesnym niemowlęctwie. W spektrum tym mieszczą
się: możliwość zamknięcia naczyń płucnych, utrudnienia odpływu
prawokomorowego, fali zwrotnej w zastawce aortalnej i bakteryjnego zapalenia wsierdzia. Samoistne zamknięcie jest częstsze u pacjentów urodzonych z małym ubytkiem przegrody międzykomorowej
i występuje u większości osób we wczesnym dzieciństwie.
Pacjenci z dużym ubytkiem w przegrodzie międzykomorowej
oraz nadciśnieniem płucnym są narażeni na największe ryzyko
powstania utrudnienia przepływu płucnego. Dlatego duże ubytki
powinny być korygowane chirurgicznie we wczesnym okresie życia, kiedy nie ma zmian w naczyniach płucnych lub są one jeszcze
odwracalne. U osób z poważnymi zmianami w naczyniach płucnych
(zespół Eisenmengera) na objawy w dorosłym życiu składają się:
duszność wysiłkowa, ból w klatce piersiowej, omdlenia i krwioplucie. Przeciek z prawa na lewo prowadzi do: sinicy, pałeczkowatości
palców i erytrocytozy. U wszystkich pacjentów stopień, do którego
wzrasta opór naczyń płucnych przed operacją, jest czynnikiem decydującym o dalszym rokowaniu. Jeżeli wynosi jedną trzecią albo
mniej wartości systemowej, dalszy rozwój zmian w naczyniach
płucnych po zabiegu należy do rzadkości. Niemniej jednak jeśli
przed operacją istnieje umiarkowany lub poważny wzrost oporu
naczyń płucnych, równie częsty jest brak zmian, jak i ich progresja
po zabiegu.
Utrudnienie drogi odpływu prawokomorowego rozwija się u około 5-10% pacjentów z umiarkowanym do znacznego przeciekiem
z lewa na prawo w niemowlęctwie. Z czasem nasila się utrudnienie
drogi odpływu podzastawkowego prawokomorowego, objawy zaczynają przypominać bardziej zmiany kliniczne w tetralogii Fallota.
U około 5% chorych niedomykalność zastawki aortalnej wynika
z niedostatku tkanki zastawki bądź wypadnięcia płatka przez ubytek
międzykomorowy; fala zwrotna krwi przez zastawkę aortalną wikła
i zazwyczaj dominuje w przebiegu klinicznym schorzenia.
Echokardiografia dwuwymiarowa ze spektralnym lub kolorowym
badaniem Dopplerem zwykle może określić liczbę oraz lokalizację
ubytków w przegrodzie międzykomorowej i wykryć towarzyszące
anomalie. Badania hemodynamiczne i angiograficzne mogą być wykorzystane do oceny stanu łożyska naczyniowego płuc oraz wyjaśnienia szczegółów zmienionej anatomii.
LECZENIE UBYTKU PRZEGRODY MIĘDZYKOMOROWEJ
Leczenie operacyjne nie jest polecane pacjentom z prawidłowym ciśnieniem w tętnicach płucnych, z niewielkim przeciekiem (stosunek przepływu
płucnego do systemowego < 1,5 do 2,0:1,0). Korekcja chirurgiczna jest wskazana, kiedy istnieje umiarkowany do poważnego przeciek z lewa na prawo
ze stosunkiem przepływu płucnego do systemowego > 1,5:1,0 bądź 2,0:1,0,
przy braku nadmiernie wysokich wartości oporu naczyniowego płuc.
Przetrwały przewód tętniczy. Przewód tętniczy jest naczyniem prowadzącym z rozgałęzienia pnia płucnego do aorty nieco dystalnie od
odejścia lewej tętnicy podobojczykowej. W warunkach prawidłowych kanał naczyniowy jest drożny u płodu, lecz zamyka się natychmiast po urodzeniu. Przepływ przez przewód jest uwarunkowany
zależnością ciśnienia i oporu pomiędzy krążeniami płucnym a systemowym oraz polem przekroju i długością przewodu. U większości
dorosłych z tą anomalią ciśnienie w tętnicach płucnych jest prawidłowe, a gradient i przeciek z aorty do pnia płucnego utrzymują się
podczas cyklu pracy serca, prowadząc do powstania charakterystycznego mruku i ciągłego szmeru „maszynowego” z późnoskurczową akcentacją w górnym lewym brzegu mostka. U dorosłych
urodzonych z dużym przeciekiem z lewa na prawo przez przewód
tętniczy zazwyczaj rozwijają się: utrudnienie przepływu płucnego
(zespół Eisenmengera) z nadciśnieniem płucnym, przeciek z prawa
na lewo i sinica. Poważne zmiany w naczyniach płucnych powodują
odwrócenie przepływu przez przewód, odtlenowana krew przecieka
do aorty zstępującej, a palce kończyn dolnych, ale nie górnych, stają
się sinicze i pałeczkowate, jest to objaw zwany odwróconą sinicą.
Wiodące przyczyny śmierci u dorosłych z przetrwałym przewodem
to niewydolność serca i bakteryjne zapalenie wsierdzia; czasami
ciężkie zmiany naczyń płucnych mogą powodować: tętniakowate
rozszerzenie, zwapnienie i pęknięcie przewodu.
LECZENIE PRZETRWAŁEGO PRZEWODU TĘTNICZEGO
Przecieki z opuszki aorty do prawego serca. Trzy najczęstsze przyczyny
przecieków z opuszki aorty do prawego serca to: wrodzony tętniak
zatoki Valsalvy aorty z przetoką, przetoka tętniczo-żylna naczyń
wieńcowych i nieprawidłowe odejście lewej tętnicy wieńcowej od
pnia płucnego. Tętniak zatoki Valsalvy aorty polega na oddzieleniu bądź braku połączenia między mięśniówką aorty a pierścieniem włóknistym zastawki aortalnej. Pęknięcie pojawia się zwykle
w trzeciej lub czwartej dekadzie życia; najczęściej przetoka aortalno-sercowa jest między prawym płatkiem zastawki z prawą komorą,
lecz czasami, jeżeli zmiana dotyczy tylnego/niewieńcowego płatka,
przetoka drąży do prawego przedsionka. Nagłe pęknięcie powoduje:
ból w klatce piersiowej, skaczące tętno, ciągły szmer akcentowany
podczas rozkurczu oraz przeciążenie objętościowe serca. Diagnozę
potwierdza się echokardiografią dwuwymiarową i dopplerowską;
cewnikowanie serca określa ilościowo przeciek z lewa na prawo,
a aortografia piersiowa uwidacznia przetokę. Postępowanie lecznicze wskazane jest w: niewydolności serca, zaburzeniach rytmu bądź
bakteryjnym zapaleniu wsierdzia. Podczas operacji tętniak zostaje
zamknięty lub amputowany, a ściana aorty jest ponownie łączona
z sercem albo szwem bezpośrednim, albo za pomocą protezy.
Przetoka tętniczo-żylna naczyń wieńcowych, rzadka anomalia, polega na połączeniu między tętnicą wieńcową a jedną z jam serca, zazwyczaj zatoką wieńcową albo prawym przedsionkiem czy komorą.
Przeciek jest zwykle niewielki, przepływ krwi przez mięśniówkę nie
ulega upośledzeniu. Możliwe powikłania obejmują: bakteryjne zapalenie wsierdzia, powstanie skrzepliny z zamknięciem lub dystalnym zatorem, pęknięcie tętniakowatej przetoki oraz, rzadko, nadciśnienie płucne i zastoinową niewydolność serca. Głośny powierzchowny ciągły szmer w dolnej bądź środkowej części brzegu mostka
z reguły skłania do dalszego diagnozowania pacjentów bez innych
widocznych objawów. Echokardiografia dopplerowska uwidacznia
miejsce przecieku; jeżeli miejsce jego powstania jest proksymalne,
może być wykryte w echokardiografii dwuwymiarowej. Angiografia
(klasyczna z użyciem cewnika dotętniczego, tomografia komputerowa naczyń lub rezonans magnetyczny) pozwala na ocenę rozmiaru
i właściwości anatomicznych przebiegu przetoki, która może zostać
zamknięta szwem chirurgicznym lub obliteracją za pomocą cewnika
dotętniczego.
Trzecia anomalia powodująca przeciek do prawego serca to nieprawidłowe odejście lewej tętnicy wieńcowej od pnia płucnego. Zawał
mięśnia sercowego oraz zwłóknienie często prowadzą do śmierci
w pierwszym roku życia, chociaż około 20% pacjentów dożywa wieku dorosłego i dłużej bez korekcji chirurgicznej. Rozpoznanie opiera się na elektrokardiograficznych objawach przednio-bocznego
zawału mięśnia sercowego i przerostu lewej komory. Postępowanie
operacyjne u dorosłych polega na wszczepieniu pomostu z tętnicy
piersiowej wewnętrznej lub żyły odpiszczelowej, omijającego tętnicę
wieńcową.
NIESINICZE WRODZONE WADY SERCA BEZ PRZECIEKU
Wrodzone zwężenie ujścia aorty. Wady rozwojowe, które powodują
utrudnienie odpływu lewokomorowego, obejmują: wrodzone zastawkowe zwężenie aorty, samoistne/odosobnione zwężenie po-
ZASTAWKOWE ZWĘŻENIE AORTY. Dwupłatkowa zastawka aortalna występuje
częściej u mężczyzn niż u kobiet. Wrodzona zastawka aortalna dwupłatkowa, która początkowo może funkcjonować prawidłowo, jest
jedną z najczęstszych wrodzonych wad serca i może nie być rozpoznana we wczesnym etapie życia. Z czasem dwupłatkowa zastawka
aortalna może powodować zwężenie bądź niedomykalność zastawki
lub predysponować do infekcyjnego zapalenia wsierdzia. Wrodzoną
zastawkę dwupłatkową trudno różnicować z wtórnie zmienionymi
płatkami zastawki dającymi obraz zastawki dwupłatkowej u pacjentów starszych w związku ze zmianami poreumatoidalnymi albo
zwyrodnieniowym wapnieniem zastawki. Dynamika przepływu
krwi wpływająca na zniekształconą sztywną zastawkę aorty zwykle
prowadzi do pogrubienia płatków i – w późniejszym życiu – ich
zwapnienia. Przeszkoda istotna hemodynamicznie powoduje przerost koncentryczny ściany lewej komory. Często dochodzi do poszerzenia aorty wstępującej, mylnie nazywanego „postenotycznym”,
w związku ze zmianami histologicznymi w obrębie błony środkowej
tętnicy, podobnie jak w zespole Marfana, mogącymi prowadzić do
rozwarstwienia aorty. Kliniczna manifestacja i nieprawidłowości hemodynamiczne zostały omówione w rozdziale 230.
LECZENIE ZASTAWKOWEGO ZWĘŻENIA AORTY
Postępowanie lecznicze w przypadku wrodzonego zastawkowego zwężenia aorty obejmuje profilaktykę bakteryjnego zapalenia wsierdzia oraz
– u pacjentów ze zmniejszoną rezerwą serca – podawanie glikozydów naparstnicy, diuretyków i ograniczenie sodu w trakcie oczekiwania na zabieg.
Jeżeli istnieje znaczne zwężenie aorty, niewskazana jest forsowna aktywność
fizyczna, nawet gdy objawy nie występują, a udział osób z łagodniejszymi
postaciami zwężenia w sportach wyczynowych powinien być ograniczony.
Wymiana zastawki aortalnej jest wskazana u dorosłych z krytycznym utrudnieniem przepływu, tj. powierzchnią zastawki < 0,45 cm2/m2 i objawami
wtórnymi do dysfunkcji lewej komory lub niedokrwienia mięśnia sercowego
czy zaburzeniami hemodynamicznymi, wynikającymi z nieprawidłowej funkcji lewej komory. U dzieci, młodzieży i młodych dorosłych z bezobjawowym
krytycznym zwężeniem aortalnym bez zwapnienia zastawki bądź takich właściwości często przydatna jest plastyka zastawki aorty balonem (patrz rozdz.
240). Jeśli operacja u dorosłych pacjentów jest przeciwwskazana z powodu
schorzeń wikłających, jak nowotwór czy niewydolność nerek lub wątroby,
walwuloplastyka balonowa może umożliwić krótkotrwałą poprawę. Procedura ta może stanowić pomost do wymiany zastawki aorty u osób z ciężką
niewydolnością serca.
ZWĘŻENIE PODZASTAWKOWE AORTY. Najczęstszą postacią zwężenia podaortalnego jest odmiana przerostu idiopatycznego, zwanego także
kardiomiopatią przerostową, która występuje u około jednej trzeciej pacjentów przy urodzeniu i została omówiona w rozdziale 231.
Samoistna/odosobniona postać zwężenia podaortalnego polega na
obecności błoniastej przepony bądź włóknistego pierścienia otaczającego drogę odpływu lewej komory tuż pod podstawą zastawki
aorty. Siła wyrzucanego strumienia krwi przez zastawkę, odbitego
od zwężenia, oddziałuje na spodnią część płatków, powodując nasilenie procesów włóknienia, i pogłębia niedomykalność zastawki.
Echokardiografia wykazuje przeszkodę podaortalną; badanie dopplerowskie uwidacznia zawirowania proksymalnie do zastawki aorty i dodatkowo określa ilościowo gradient ciśnienia oraz wielkość
fali zwrotnej w aorcie. Leczenie polega na wycięciu błony bądź pierścienia włóknistego.
ZWĘŻENIE NADZASTAWKOWE AORTY. Na tę anomalię składają się umiejscowione lub rozproszone przewężenia aorty wstępującej, zaczynające
się tuż powyżej poziomu tętnic wieńcowych, na górnej granicy zatok
Valsalvy. W przeciwieństwie do innych postaci zwężenia aorty tętnice wieńcowe są: narażone na podniesione ciśnienia panujące wewnątrz lewej komory, często rozszerzone i kręte, jak również podatne na przedwczesny rozwój procesów miażdżycowych. U większości
pacjentów pojawienie się tej anomalii wiąże się z nieprawidłowością
regionu chromosomu 7., kodującego białko elastyny.
Koarktacja aorty. Przewężenie bądź zaciśnięcie światła aorty mogą
występować wszędzie wzdłuż jej przebiegu, lecz najczęściej w pobliżu przyczepu więzadła tętniczego dystalnie od odejścia lewej tętnicy
podobojczykowej. Koarktacja dotyczy 7% pacjentów z wadą wrodzoną serca, jest dwukrotnie częstsza u mężczyzn niż u kobiet i zazwyczaj ma miejsce u osób z dysgenezją gonad (np. w zespole Tur-
ROZDZIAŁ 229 Wrodzone wady serca u dorosłych
Przy braku poważnych zmian w naczyniach płucnych i dominującego
przecieku krwi z lewa na prawo przetrwały przewód powinien być chirurgicznie podwiązany lub przecięty. Zamknięcie podczas cewnikowania serca
przy użyciu zwojów, zacisków, czopów i protez w kształcie parasola jest powszechną metodą terapeutyczną, zależną od określonego kształtu defektu.
Obecnie operacje torakoskoskopowe są eksperymentalne. Zabieg należy
odłożyć na kilka miesięcy u osób leczonych z powodu bakteryjnego zapalenia wsierdzia, ponieważ przewód może pozostawać nieco obrzękły i kruchy.
daortalne, zwężenie nadzastawkowe i kardiomiopatię przerostową 1623
zawężającą (patrz rozdz. 231).