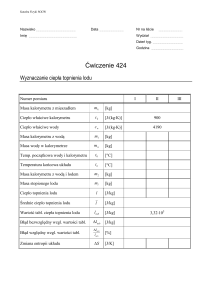
Politechnika Wrocławska
Materiały metaliczne i procesy
metalurgiczne - laboratorium
Ćwiczenie nr 4
Wyznaczanie ciepła właściwego metali.
J. Kapała, B. Salamon
Wprowadzenie i cel ćwiczenia.
Kalorymetria jest działem nauki, która swym zakresem obejmuje metody i przyrządy
stosowane do określania efektów energetycznych przemian fizykochemicznych. Narzędzia,
które służą do ilościowego oznaczenia tych efektów nazywane są kalorymetrami. Różnice w
budowie i sposobie działania wspomnianych urządzeń, determinują ich przeznaczenie w pomiarach termodynamicznych.
Celem ćwiczenia 1 jest wyznaczenie ciepła właściwego metalu, w warunkach stałego
ciśnienia, przy pomocy kalorymetru Calveta, metodą ‘drop calorimetry’.
Celem ćwiczenia 2 jest wyznaczenie ciepła rozpuszczania soli w wodzie, w warunkach
stałego ciśnienia, przy pomocy kalorymetru Calveta, metodą ‘kruszenia ampuły’.
Budowa i oprzyrządowanie kalorymetru.
W aluminiowym bloku kalorymetru znajdują się dwie cylindryczne komory, w których
umieszczone są termostosy. Oba termostosy stanowią bliźniaczą konstrukcję – są połączone
różnicowo, co zapewnia większą stabilność termiczną układu i pozwala na eliminację
ewentualnych zakłóceń termicznych z zewnątrz. Jest to równoważne także z tym, że
rejestrowana siła termoelektryczna wynika wyłącznie z różnicy temperatur powodowanej
efektami cieplnymi w celi pomiarowej. Termostosy są zbudowane z dysków korundowych,
które oplecione są termoparami Pt/Pt-Rh(10%). Wewnętrzne połączenia termopar pozostają
w ścisłym kontakcie z komorą kalorymetru, poprzez cienkościenną warstwę korundu,
natomiast połączenia zewnętrzne termopar są w kontakcie z blokiem kalorymetru. Każdy
termostos jest tworzony przez 750 termopar, co determinuje dużą czułość tego urządzenia, a
zatem dużą dokładność pomiaru wielkości efektu termicznego [1]. Schematyczny przekrój
bloku kalorymetru został przedstawiony na rys. 1. Siła elektromotoryczna termostosu jest
mierzona przy użyciu multimetru FLUKE 8808A przy jednosekundowym interwale, a sygnał
termiczny z termostosów jest rejestrowany graficznie przy pomocy komputera. Natomiast
temperatura bloku kalorymetru jest stabilizowana przez programator EUROTHERM 2404,
który utrzymuje temperaturę standardową z dokładnością około 0,01 K [2].
Rys. 1. Schematyczny przekrój poprzeczny kalorymetru Calveta.
ĆWICZENIE 1 (wyznaczanie ciepła właściwego metalu)
Do kratownicy, umieszczonej nad kalorymetrem, jest przymocowany specjalnie
zaprojektowany piecyk, który służy do ogrzewania próbki i materiału wzorcowego, zanim
znajdą się we wnętrzu celi pomiarowej.
Zasada oznaczenia efektu energetycznego.
Przed rozpoczęciem pomiaru, należy uruchomić program zbierający dane FLUKE
8808A. Próbkę metalu, o dokładnie znanej masie m, należy ogrzać w piecyku do temperatury
Tm. Temperaturę Tm proszę wyznaczyć na podstawie danych dla termopar typu K
oznaczanych przez NIST, z zależności [3]:
𝑇𝑚 = 273,9139 + 25,38 ∙ 𝑢
(1),
gdzie u to napięcie termoelektryczne termopary, odczytane z woltomierza.
Następnie ogrzaną próbkę, wprowadza się do celi pomiarowej, poprzez wysunięcie
zawleczki przy piecyku. Pomiar ciepła właściwego metalu jest przeprowadzany w
temperaturze 298,15 K (Tk). Powstający efekt energetyczny zostaje zarejestrowany w postaci
termogramu, będącego zależnością siły termoelektycznej na termostosie w funkcji czasu o
określonej powierzchni S1. Przykładowy termogram znajduje się na rys. 2. Na idealnym
termogramie linia bazowa początkowa i końcowa utrzymują się na tym samym poziomie.
Rys. 2. Przykładowy termogram z zarejestrowanym efektem towarzyszącym wprowadzeniu do celi
pomiarowej próbki (S1) i materiału wzorcowego (S2). Zaznaczone elementy: A – linia bazowa
początkowa, B – zarejestrowany efekt, C – linia bazowa po wystąpieniu efektu.
Następnie proszę wykonać kalibrację pomiaru, przy użyciu szafiru, czyli α-Al2O3
produkcji NIST, jako materiału wzorcowego. W przypadku pomiaru ciepła molowego
substancji wzorcowej, należy postąpić identycznie jak w przypadku badanej próbki metalu.
Efekt cieplny, który jest opisany powierzchnią na termogramie, jest wprost proporcjonalny
do wielkości ciepła wydzielonego lub pochłoniętego w celi eksperymentalnej. Zmianę
entalpii materiału wzorcowego (ΔHmw = Qp) przy stałym ciśnieniu, o określonej masie, przy
założeniu, że zmiany energii kinetycznej próbki podczas wprowadzania do celi pomiarowej są
pomijalnie małe, a w momencie znalezienia się w celi kalorymetru szafir miał temperaturę
Tmw, proszę wyznaczyć z zależności:
𝑇𝑘
𝑚
∆𝐻𝑚𝑤 = ∫𝑇𝑚𝑤 𝑀 ∙ 𝐶𝑝,𝑚 (𝑇)𝑑𝑇
(2),
gdzie m, M są odpowiednio masą i masą molową materiału wzorcowego, a ciepło molowe
α-Al2O3 opisywane jest zależnością:
𝐶𝑝,𝑚 = −21,473 + 0,46176 ∙ 𝑇 − 4,1885 ∙ 10−4 ∙ 𝑇 2 + 1,1033 ∙ 10−14 ∙ 𝑇 3
(3)
Dokładnie wyznaczona wartość ciepła wydzielonego przez materiał wzorcowy,
pozwala z prostej proporcji obliczyć wartość ciepła właściwego badanego metalu,
zakładając, że w przedziale temperatur ∆T = Tm – Tk ciepło molowe substancji badanej nie
zależy od temperatury. W związku z tym zależność (2) przyjmuje postać:
∆𝐻𝑚 = 𝑚 ∙ 𝐶𝑝,𝑚 ∆𝑇
(4)
Sprawozdanie.
Sprawozdanie, wykonane jedno na grupę, powinno zawierać:
opis przeprowadzonego ćwiczenia,
uzyskane termogramy: dla badanego metalu i materiału wzorcowego, wraz z
scałkowanymi powierzchniami S1 i S2,
obliczenia dotyczące ciepła molowego materiału wzorcowego i na tej podstawie
obliczonej jego zmiany entalpii (ΔHmw),
wyprowadzenie zależności pomiędzy zmianą entalpii materiału wzorcowego (ΔHmw),
a zmianą entalpii badanego metalu (ΔHm),
obliczenie ciepła właściwego badanego metalu, a następnie skonfrontowanie
otrzymanej wartości z danymi literaturowymi, by na tej podstawie zaproponować
nazwę badanego metalu.
ĆWICZENIE 2 (wyznaczanie ciepła rozpuszczania soli w wodzie)
Przygotowanie preparatu do badań polega na naważeniu niewielkiej ilości soli (ok. 0,5
g) i umieszczeniu jej w ampule. Ampułę zamyka się zatapiajac ją w palniku acetylenowym
tak, aby nie stopić preparatu. Zatopioną ampułę umieszcza się w celi pomiarowej razem z
rozpuszczalnikiem. Po ustabilizowaniu warunków w kalorymetrze (ok. 12 h) ampułę kruszy
się rejestrując efekt energetyczny. Drugim etapem ćwiczenia jest przeprowadzenie kalibracji
kalorymetru w sposób identyczny jak w ćwiczeniu 1.
Ze względu na czasochłonność badania, ćwiczenie jest wykonywane w ten sposób, że
grupa zaczyna od skruszenia wcześniej przygotowanej ampuły umieszczonej zawczasu w
kalorymetrze, następnie w czasie rejestracji termogramu przygotowuje preparat dla grupy
następnej. Lista czynności:
wykonanie ampuły szklanej
załadowanie ampuły badaną solą
zatopienie ampuły
umieszczenie ampuły w celi pomiarowej i dodanie rozpuszczalnika
umieszczenie celi w komorze kalorymetru, stabilizacja termiczna kalorymetru
stłuczenie ampuły i rejestracja termogramu
zrzucenie zważonego materiału wzorcowego
Sprawozdanie.
Sprawozdanie, wykonane jedno na grupę, powinno zawierać:
opis przeprowadzonego ćwiczenia,
uzyskane termogramy: dla badanego metalu i materiału wzorcowego, wraz z
scałkowanymi powierzchniami S1 i S2,
obliczenia dotyczące ciepła molowego materiału wzorcowego i na tej podstawie
obliczonej jego zmiany entalpii (ΔHmw),
wyprowadzenie zależności pomiędzy zmianą entalpii materiału wzorcowego (ΔHmw),
a zmianą entalpii badanego metalu (ΔHm),
Zagadnienia do kartkówki.
definicje: ciepło właściwe, ciepło molowe, ciepło rozpuszczania, entalpia, termostos,
termopara, termogram,
opis zasady działania i budowy kalorymetru Calveta.
Bibliografia:
1. Calvet E, Prat H. Microcalorimètrie; applications physico-chimiques et biologiques, Paris:
Masson & Cie; 1956.
2. Salamon B, Kapała J, Gaune-Escard M. Instrumentation and calibration of the Calvet
calorimeter; Enthalpy of solution of PrBr3 at standard conditions. J Therm Anal Calorim; 2012.
3. Guide to thermocouple and resistance termometry, TC Ltd; Issue 6.1, United Kingdom; 2009.
4. Atkins P. W. Chemia Fizyczna. PWN;2001.