Elektronowa struktura atomu
Anna Pietnoczka
BUDOWA ATOMU
CZĄSTKA
SYMBOL
WYSTĘPOWANIE
MASA
ŁADUNEK
ELEKTRYCZNY
PROTON
p+
jądro atomowe
około 1 u
+1
NEUTRON
n0
jądro atomowe
około 1u
Brak
ELEKTRON
e-
powłoki
elektronowe
Około 1/ 1840 u
-1
Atom jest elektrycznie obojętny.
Poziomy energetyczne w atomie
Zjoniz. atom
n=3
n=2
n=1
Widmo helu
- 3.4 eV
E = - 13.6 eV
1
En = −13.6eV ⋅ 2
n
n- główna liczba kwantowa
n = 1,2,3,4,5,…;
Równanie Schrödingera
∂ 2Ψ ∂ 2Ψ ∂ 2Ψ 8π 2 m
+ 2 + 2 + 2 ( E + V )Ψ = 0
2
∂x
∂y
∂z
h
Równanie podaje przestrzenną zależność funkcji falowej Ψ
od stanu energetycznego układu i masy elektronu.
x, y, z – współrzędne elektronu,
m – masa elektronu,
E – energia całkowita układu,
V – energia potencjalna układu,
h – stała Planca.
Orbital atomowy
Zgodnie z teorią Schrödingera:
• stan elektronu w atomie opisuje funkcja falowa ψ, nazwana orbitalem,
•kwadrat tej funkcji daje prawdopodobieństwo znalezienia elektronu w danym obszarze
wokół jądra,
•energia elektronów jest kwantowana a geometryczne kształty orbitali wskazują na
przestrzenny rozkład prawdopodobieństwa znalezienia elektronu opisanego danym
orbitalem.
•Każdy stan kwantowy elektronu jest opisany za pomocą czterech liczb kwantowych, tj.
główna liczba kwantowa - n, poboczna liczba kwantowa - l, magnetyczna liczba kwantowa m i magnetyczna spinowa liczba kwantowa - ms
Funkcja falowa ψ jest amplitudą prawdopodobieństwa w punkcie przestrzeni określonym
współrzędnymi x, y, z. W przypadku elektronu funkcja falowa ψ określa zatem
prawdopodobieństwo znalezienia tej cząstki w określonym miejscu przestrzeni wokół
atomu, a także określa najbardziej prawdopodobne wartości jego energii.
2
p = Ψ ∆V ⇒ ∫ Ψ 2 dV = 1
V
Liczby kwantowe
n – główna liczba kwantowa, określa przede wszystkim energię elektronu w atomie.
Główna liczba kwantowa może przybierać tylko wartości równe liczbom naturalnym: n = 1,
2, 3, .....
l – poboczna liczba kwantowa, kwantuje moment pędu związany z ruchem elektronu w
polu jądra. Dla danego n wartości l wynoszą: 0, 1, 2, ..., (n-1).
m – magnetyczna liczba kwantowa, decyduje o możliwych wartościach składowej
momentu pędu w wyróżnionym kierunku. Dla danego l możliwe wartości m wynoszą: 0,
±1, ± 2, ..., ± l.
s – spinowa liczba kwantowa, kręt elektronu, może przyjmować wartości ±1/2.
Zakaz Pauliego
Możliwe są tylko takie stany elektronowe w atomie, w których
żaden elektron nie ma identycznych wszystkich czterech
liczb kwantowych.
Graficzny zapis orbitalu
Obrazem graficznym orbitalu jest fragment przestrzeni, w której prawdopodobieństwo
znalezienia elektronu jest duże.
Każdy orbital ma inny kształt i orientację przestrzenną, a zajmujący go elektron
charakteryzuje się inną energia.
Orbital typu p
Orbital typu d
Orbital typu s
Orbitale typu s mają
kształt kuli
Orbital p jest trójkrotnie
zdegenerowany, ze względu
na równoczesność
energetyczną orbitali px, py i
pz.
Orbital d jest
pięciokrotnie
zdegenerowany, a f
siedmiokrotnie.
Rozwiązania r. Schrödingera
Orbitale
Orbital
es
n = 1, 2, 3, .....
l = 0, 1, 2, ..., (n-1)
m = 0, ±1, ± 2, ..., ± l
s = ±1/2
n
l
m
s
Liczba stanów
1 (K)
0 (s)
0
±1/2
2
2 (L)
0 (s)
1 (p)
0
0, -1, +1
±1/2
±1/2
2
6
3 (M)
0 (s)
1 (p)
2 (d)
0
0, -1, +1
0, -1, -2, +1, +2
±1/2
±1/2
±1/2
2
6
10
4 (N)
0 (s)
1 (p)
2 (d)
3 (f)
0
0, -1, +1
0, -1, -2, +1, +2
0, -1, -2, -3, +1, +2, +3
±1/2
±1/2
±1/2
±1/2
2
6
10
14
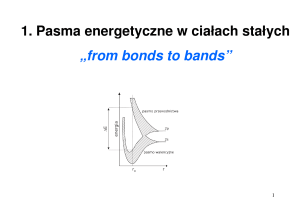
Kolejność poziomów energetycznych w atomie:
E
6p
5d
4f
6s
5p
4d
5s
4p
3d
4s
3p
Tlen - 8 elektronów
3s
2p
2s
1s2
2s2 p6
K, 19 elektronów
1s
1s2
2s2 p6
3s 2p6
4s1
Numer grupy –
Liczba elektronów walencyjnych
Numer okresu Liczba powłok
elektronowych
BUDOWA ATOMU, A POŁOŻENIE PIERWIASTKA
W UKŁADZIE OKRESOWYM
Liczba powłok
elektronowych 4
nr okresu 4
Liczba atomowa 35
nr grupy 7
Liczba elektronów
walencyjnych 7
brom
35
Br
79,904
Liczba protonów 35
Masa atomowa 80u
Liczba elektronów 35
Liczba nukleonów 80
Konfiguracja elektronowa:
K2L8M18N7
Liczba neutronów
80-35 = 45
Li
Na
K
Rb
Cs
Na
•Wzrost
Wzrost promienia atomowego
(wzrost liczby powłok
elektronowych)
•Wzrost
Wzrost aktywności chemicznej
•Wzrost
Wzrost zdolności oddawania
elektronów
Mg
Al
Si
F
Cl
Br
I
P
•Wzrost
Wzrost promienia atomowego
•Zmniejszanie
Zmniejszanie się aktywności
chemicznej
•Zmniejszanie
Zmniejszanie się zdolności
przyjmowania elektronów
•Wzrost
Wzrost charakteru
metalicznego
CHARAKTER CHEMICZNY PIERWIASTKÓW GRUP GŁÓWNYCH
S
•Wzrost właściwości niemetalicznych
•Zmniejszanie się właściwości metalicznych
•Zwiększanie się liczby elektronów walencyjnych
•Zmniejszanie się wielkości promienia atomowego
Cl
Wiązania chemiczne
Kwantowa teoria wiązania chemicznego
Teoria ta zakłada, że podczas powstawania wiązania chemicznego chmury elektronowe orbitali
(zawierających niesparowany elektron) każdego z wiążących się atomów przenikają się lub
nakładają nawzajem i powstają w ten sposób tzw. orbitale molekularne.
Schemat wiązania s-s
Kwantowa teoria wiązania chemicznego
Schemat wiązania p-p
Kwantowa teoria wiązania chemicznego
Schemat wiązania s-p
Orbitale molekularne tworzą się z orbitali atomowych poprzez
kombinację funkcji falowych
Wiązania chemiczne
Typy:
Wiązania jonowe
Wiązania kowalencyjne
Wiązania metaliczne
Wiązania Van der Wallsa
Wiązania wodorowe
W tworzeniu wiązań chemicznych biorą udział elektrony walencyjne. Atomy
pierwiastków łącząc się ze sobą dążą do uzyskania konfiguracji najbliższego gazu
szlachetnego.
Wiązania jonowe
Wiązania jonowe występują w układach złożonych z atomów skrajnie różniących się
elektroujemnością.
W czasie powstawania wiązania jonowego atom pierwiastka elektrododatniego oddaje, a
atom pierwiastka elektroujemnego przyłącza elektrony. Tworzą się dwa jony o
różnoimiennych ładunkach, przyciągające się dzięki działaniu sił elektrostatycznych.
•Typowym przykładem jest tu kryształ NaCl powstający w wyniku transferu
elektronu z sodu do chloru
⇒ Struktura elektronowa atomu Na 1s2 2s2 2p6 3s1
⇒ Struktura elektronowa atomu Cl
Na
Cl
+
1s2 2s2 2p6 3s2 3p5
–
+
–
Chlorek sodu
•Każdy jon Na+ jest otoczony przez 6
jonów Cl-.
•Każdy jon Cl- jest otoczony przez 6
jonów Na+.
•
Sieć powierzchniowo centrowana
WŁAŚCIWOŚCI ZWIĄZKÓW Z WIĄZANIEM JONOWYM:
• Występują w stałym stanie skupienia, tworząc sieć krystaliczną.
• Mają wysokie temperatury wrzenia i topnienia (duża energia
kohezji (2-4 eV/ atom)).
•Niskie przewodnictwo elektryczne (brak swobodnych elektronów).
•Przeźroczyste dla światła widzialnego (energia pomiędzy
najbliższymi poziomami większa niż 3 eV).
•Stopione lub rozpuszczone w wodzie przewodzą prąd elektryczny,
gdyż zawierają zdolne do poruszania się kationy i aniony.
Wiązanie kowalencyjne
Elektron w jednym atomie przyciągany jest przez jądro drugiego. Wiązanie tworzy się poprzez
uwspólnienie elektronów
H
+
H
H H
Η2
Wiązanie kowalencyjne
Cl
+
Cl
Cl Cl
Cl
Cl
Cl2
Wiązania kowalencyjne
Wiązanie kowalencyjne spolaryzowane
WŁAŚCIWOŚCI ZWIĄZKÓW Z WIĄZANIEM KOWALENCYJNYM
•Najwyższa wartość energii wiązania.
•Występują we wszystkich trzech stanach skupienia (stałym,
ciekłym i gazowym),
•W stanie stałym tworzą sieć krystaliczną,
•Tworzone
za
pomocą
silnych,
(kierunkowych) wiązań - kruche.
zlokalizowanych
•Wysoka temperatura topnienia i wrzenia - twarde.
• Izolatory lub półprzewodniki (temperatura, absorpcja
promieniowania uaktywnia przewodnictwo elektryczne).
Wiązanie metaliczne
Wiązanie to występuje w metalach. Elektrony walencyjne atomów metalu mogą swobodnie
poruszać się między dodatnimi rdzeniami atomowymi stanowiąc tzw. zdelokalizowany gaz
elektronowy.
Uporządkowany ruch elektronów to przepływ prądu elektrycznego.
WŁAŚCIWOŚCI ZWIĄZKÓW Z WIĄZANIEM METALICZNYM
•Wysoka lub średnia temperatura topnienia.
•Dobre przewodnictwo elektryczne i cieplne.
• Charakteryzują się wysoką plastycznością.
•Połysk metaliczny (odbicie światła widzialnego na swobodnych
elektronach).
Wiązania wodorowe
Jest to słabe oddziaływanie elektrostatyczne
pomiędzy
elektroujemnym
atomem
(akceptorem), a atomem wodoru, który jest
kowalencyjnie połączony z innym atomem
elektroujemnym (donorem). W wiązaniu tym
wodór pełni rolę mostka łączącego dwa
elektroujemne atomy.
Wiązania wodorowe
Jest to słabe oddziaływanie elektrostatyczne pomiędzy elektroujemnym atomem (akceptorem),
a atomem wodoru, który jest kowalencyjnie połączony z innym atomem elektroujemnym
(donorem). W wiązaniu tym wodór pełni rolę mostka łączącego dwa elektroujemne atomy.
WŁAŚCIWOŚCI ZWIĄZKÓW Z WIĄZANIEM WODOROWYM
•Bardzo niska energia wiązania.
•Niska temperatura topnienia.
•Łatwość polimeryzacji.
• Przewodnictwo protonowe.
•Ma kluczowe znaczenie w procesach biologicznych
ponieważ nie tylko występuje w wodzie, ale także w
kwasach nukleinowych DNA
Wiązania wodorowe: woda vs. lód
Struktura lodu
Wiązania Van der Waalsa
Wiąz pomiędzy dipolami elektrycznymi stałymi
albo indukowanymi lub chwilowymi, powstającymi
w wyniku zmiany rozkładu ładunku w cząsteczce.
WŁAŚCIWOŚCI ZWIĄZKÓW Z WIĄZANIEM
VAN DER WAALSA
•Bardzo niska energia wiązania
•Niska temperatura topnienia
•Miękkie, ściśliwe
• Łatwo ścieralne struktury warstwowe (grafit)
Wiązanie
Energia
wiązania
[eV]
kowalencyjne
7 -12
jonowe
7 - 10
metaliczne
1-4
wodorowe
0.2 – 0.4
Van der Waalsa
0.1 – 0.2
Właściwości ciał stałych
- wysoka temperatura topnienia
- twarde lub średniotwarde
- izolatory lub półprzewodniki
- wysoka temperatura topnienia
-twarde, kruche, bezbarwne
- przewodnictwo jonowe
- wysoka lub średnia temperatura
topnienia
- połysk metaliczny
- dobre przewodnictwo elektryczne i
cieplne
- niska temperatura topnienia
- łatwość polimeryzacji
- przewodnictwo protonowe
- niska temperatura topnienia
- miękkie
- ściśliwe
„Za przełomowe badania nad grafenem”
Nagroda Nobla z Fizyki 2010
Andriej Gejm
Konstantin Nowosiołow
Grafen – z wywiadu A.Geima
• „Wyobraźcie sobie kartkę papieru ale milion razy cieńszą.
Jest to grubość grafenu.
• Wyobraźcie sobie materiał trwardszy od diamentu. To jest
twardość grafenu (w płaszczyźnie).
• Wyobraźcie sobie materiał bardziej przewodzący niż miedź.
Jest to przewodnictwo grafenu.
• Wyobraźcie sobie urządzenie badające te same własności
fizyczne jak urządzenie, które mają naukowcy w CERN, ale
takie małe, że zmieści się na twoim biurku. Grafen pozwoli
to zrealizować.”
Grafen – struktura plastra miodu
•Jedna z alotropowych form węgla
•Zbudowany z pojedynczej warstwy
atomów węgla tworzących połączone
pierścienie sześcioczłonowe
•Atomy węgla tworzą płaską,
praktycznie dwuwymiarową sieć,
której struktura przypomina plaster
miodu.
•Długość wiązań węgiel-węgiel wynosi
ok. 0,142 nm
Grafen
Obraz grafenu w elektronowym mikroskopie transmisyjnym
Grafen – podstawowe własności
• Bardzo dobry przewodnik ciepła
– około 5000 W/mK
• srebro: 429 W/mK
• Bardzo mały opór elektryczny
• Bardzo wysoka ruchliwość elektronów
– 200 000 cm²/Vs (w temperaturze pokojowej przy założeniu
jedynie rozpraszania na fononach)
• Krzem: 1500 cm²/Vs,
• Arsenek galu 8500 cm²/Vs
• Olbrzymia prędkość przepływu elektronów
– (1/300) c
• możliwość badania efektów relatywistycznych dla
elektronu poruszającego się w przewodniku
cd. Grafen – podstawowe własności
• Prawie przeźroczysty
– Pochłania 2,3 % światła
• Nie przepuszcza nawet atomów helu
• Bardzo mocny
– 100 razy więcej niż stał
• Elastyczny
– Daje się rozciągać o 20 %.
• Nie można otrzymać w stanie wolnym
– jest nietrwały i łatwo tworzy struktury trójwymiarowe (np.
fulereny czy nanorurki)
• Otrzymuje się metodami mikromechanicznymi.
– wyizolować można struktury o grubości od jednej do kilku
warstw osadzonych na nośniku