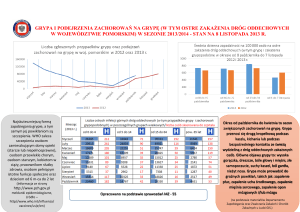
Uploaded by
common.user1645
Notatki z Patofizjologii - ŚUM Zabrze

ŚUM ZABRZE Patofizjologia Skrypt uczelniany 2018 Skrypt napisany przez starsze roczniki na podstawie prezentacji przedstawianych na zajęciach przez kadrę naukową Katedry Patofizjologii i Endokrynologii, w skład której wchodzą: prof. dr hab. n.med. Bogdan Marek dr hab. n. med. Joanna Głogowska-Szeląg dr hab. n. med. Lucyna Siemińska dr hab. n. med. Dariusz Kajdaniuk dr hab. n. med. Mariusz Nowak dr. n. med. Janusz Strzelczyk dr n med. Wanda Foltyn dr n med. Violetta Rosiek Edycja 2018: Krzysztof Stós - uzupełnione braki z pliku „PATOFIZJOLOGIA - Skrypt” - Hematologia: dodane tabelki - Blok z endokrynologii: miejscami na czerwono lub niebiesko dopisane informację z podręczników Damjanova/ Badowskiej oraz powklejane przydatne (dla zrozumienia tematu) tabelki ze skryptu od diagnostyki - napisana na nowo notatka z wykładu z HTZ i wykładu wydalniczego - temat z układu krążenia jest trochę zmieniony, także trzeba na zajęciach słuchać i notować, gdyż nie chciało mi się już tego tutaj edytować ;) BLOK Z PATOFIZJOLOGII OGÓLNEJ 5 TKANKA ŁĄCZNA REUMATOIDALNE ZAPALENIE STAWÓW RZS TOCZEŃ RUMIENIOWATY UKŁADOWY LE TWARDZINA UKŁADOWA TU ZAPALENIE SKÓRNO-MIĘŚNIOWE. ZAPALENIE WIELOMIĘŚNIOWE ZESPÓŁ SJOGRENA (Z. SUCHOŚCI) ZESPÓŁ REITERA (REAKTYWNE ZAPALENIE STAWÓW) ŁUSZCZYCOWE ZAPALENIE STAWÓW (ŁZS) ZESZTYWNIAJĄCE ZAPALENIE STAWÓW KRĘGOSŁUPA (ZZSK) DNA MOCZANOWA HEMATOLOGIA NIEDOKRWISTOŚĆ Niedokrwistość z niedoboru żelaza Niedokrwistość Megaloblastyczna Niedokrwistość Hemolityczna Tabelki APLAZJA SZPIKU BIAŁACZKA Ostra białaczka szpikowa Przewlekła białaczka szpikowa Ostra białaczka limfoblastyczna Przewlekła białaczka limfoblastyczna Przewlekła białaczka B komórkowa ZIARNICA ZŁOŚLIWA - CHŁONIAK HODKINA SZPICZAK MNOGI SKAZY KRWOTOCZNE Osoczowe Płytkowe Naczyniowe 5 5 8 10 11 12 12 13 14 17 19 21 21 22 24 25 27 27 28 29 29 30 30 30 30 31 31 31 31 UKŁAD ODDECHOWY ASTMA Astma Oskrzelowa Astma Atopowa Astma Nieatopowa Astma Aspirynowa PRZEWLEKŁA OBTURACYJNA CHOROBA PŁUC (POCHP) Przewlekłe zapalenie płuc Rozedma OSTRE ZAPALENIE OSKRZELI RAK PŁUCA Rak płaskonabłonkowy Rak drobnokomórkowy Gruczolakorak Rak wielkokomórkowy NIEWYDOLNOŚĆ ODDECHOWA 32 32 32 33 34 34 35 35 36 37 38 39 40 40 40 41 1 UKŁAD KRĄŻENIA OTYŁOŚĆ CHOROBA NIEDOKRWIENNA SERCA Ostre zespoły wieńcowe Skrzepliny Zawał mięśnia sercowego Wstrząs kardiogenny NIEWYDOLNOŚĆ KRĄŻENIA Niewydolność mięśnia sercowego Niewydolność lewokomorowa Niewydolność prawokomorowa Obrzęki sercowe Obrzęk płuc Zator tętnicy płucnej Nadciśnienie płucne KARDIOMIOPATIE Zaburzenia rytmu serca Skurcze przedwczesne = ekstrasystolie Migotanie przedsionków (AF) Trzepotanie przedsionków (AFI) Migotanie komór (VF) WADY SERCA 43 44 46 47 48 49 49 50 50 51 52 53 53 53 54 55 55 56 56 57 57 58 NADCIŚNIENIE TĘTNICZE NADCIŚNIENIE PIERWOTNE PRZEŁOM NADCIŚNIENIOWY (NADCIŚNIENIE ZŁOŚLIWE) NADCIŚNIENIE WTÓRNE POCHODZENIA NERKOWEGO NADCIŚNIENIE POCHODZENIA ENDOKRYNNEGO 59 60 63 63 64 65 UKŁAD POKARMOWY REFLUKS ŻOŁĄDKOWO-PRZEŁYKOWY ACHALAZJA ZESPÓŁ PLUMMERA-VINSONA ŻOŁĄDEK I DWUNASTNICA - FIZJOLOGIA ZAPALENIE ŻOŁĄDKA CHOROBA WRZODOWA ŻOŁĄDKA I DWUNASTNICY CHOROBA MENETRIERA CELIAKLIA ZESPÓŁ JELITA DRAŻLIWEGO CHOROBA HIRSCHPRUNGA (MEGACOLON) WRZODZIEJĄCE ZAPALENIE JELITA GRUBEGO (COLITIS ULCEROSA) CHOROBA LEŚNIOWSKIEGO-CROHNA OSTRE ZAPALENIE WĄTROBY PRZEWLEKŁE ZAPALENIE WĄTROBY OSTRE ZAPALENIE TRZUSTKI PRZEWLEKŁE ZAPALENIE TRZUSTKI NOWOTWORY PRZEWODU POKARMOWEGO - CZYNNIKA RYZYKA 66 66 67 68 68 68 69 70 71 72 73 74 75 75 77 78 78 79 2 BLOK Z ENDOKRYNOLOGII 80 TARCZYCA FIZJOLOGIA EUTYREOZA I STANY NIEPRAWIDŁOWE DIAGNOSTYKA WOLE NIETOKSYCZNE (OBOJĘTNE) WOLE GUZKOWE NADCZYNNE ZAPALENIE TARCZYCY NIEDOCZYNNOŚĆ TARCZYCY NADCZYNNOŚĆ TARCZYCY CHOROBA GRAVESA-BASEDOVA OFTALMOPATIA GRAVESA RAK TARCZYCY 80 80 80 82 83 84 84 86 88 89 89 90 GOSPODARKA WAPNIOWO-FOSFORANOWA FIZJOLOGIA NIEDOCZYNNOŚĆ PRZYTARCZYC PRAWDZIWA NIEDOCZYNNOŚĆ PRZYTARCZYC RZEKOMA (ZESPÓŁ ALBRIGHTA) NADCZYNNOŚĆ PRZYTARCZYC PIERWOTNA NADCZYNNOŚĆ PRZYTARCZYC WTÓRNA NADCZYNNOŚĆ PRZYTARCZYC TRZECIORZĘDOWA 91 91 95 96 96 97 97 OŚ PODWZGÓRZE-PRZYSADKA NIEDOCZYNNOŚĆ PRZEDNIEGO PŁATA PRZYSADKI NIEDOCZYNNOŚĆ TYLNEGO PŁATA PRZYSADKI MOCZOWKA PROSTA Polidypsja psychogenna: NADCZYNNOŚĆ TYLNEGO PŁATA PRZYSADKI Zespół nadmiernego wydzielania wazopresyny (Zespół Schwartza-Barttera, SIADH) Gruczolaki przysadki Prolaktinoma AKROMEGALIA: ZESPÓŁ CUSHINGA 98 99 100 100 100 101 101 102 103 109 113 NADNERCZA FIZJOLOGIA HIPERKORTYZOLEMIA (ZESPÓŁ CUSHINGA) PIERWOTNA NIEDOCZYNNOŚĆ KORY NADNERCZY (CHOROBA ADDISONA) WTÓRNA NIEDOCZYNNOŚĆ KORY NADNERCZY PIERWOTNY HIPERALDOSTERONIZM (ZESPÓŁ CONNA) GUZY RDZENIA NADNERCZY = PHEOCHROMOCYTOMA INCIDENTALOMA NADNERCZY RAK NADNERCZY ZESPÓŁ NELSONA 114 114 117 119 122 122 123 125 125 125 3 CUKRZYCA FIZJOLOGIA CUKRZYCA CUKRZYCA TYPU 1 CUKRZYCA TYPU 2 CUKRZYCA TYPU 3 CUKRZYCA TYPU MODY I LADA CUKRZYCA CIĘŻARNYCH (GDM) INNE PATOLOGIE DIAGNOSTYKA POWIKŁANIA CUKRZYCY Makroangiopatia: Mikroangiopatie cukrzycowe: Neuropatia cukrzycowa STANY NAGŁE W CUKRZYCY 126 126 129 131 132 135 135 136 138 138 141 141 142 144 144 WYKŁADY 146 GUZY NEUROENDOKRYNNE - AKTUALNY STAN WIEDZY GUZY NEUROENDOKRYNNE TRZUSTKI WRODZONY PRZEROST NADNERCZY (WPN) HIPERKALCEMIA POZAPRZYTARCZYCOWA (NOWE 2018) WYBRANE ZAGADNIENIA PATOLOGII GONAD HORMONALNA TERAPIA ZASTĘPCZA PATOFIZJOLOGIA UKŁADU WYDALNICZEGO STANY ZAGROŻENIA ŻYCIA W ENDOKRYNOLOGII AIDS OSTEOPOROZA - ASPEKTY PATOFIZJOLOGICZNE I KLINICZNE 146 148 153 158 159 162 165 175 179 183 4 Blok z patofizjologii ogólnej Tkanka łączna Reumatoidalne Zapalenie Stawów RZS Układowa choroba tkanki łącznej Niespecyficzne, symetryczne zapalenie stawów Występowanie zmian pozastawowych i powikłań narządowych Prowadzi do niepełnosprawności, postępującego inwalidztwa lub przedwczesnej śmierci Częstość występowania: 0,5-2% Mechanizm Zniszczenie powierzchni stawowych, uszkodzenie więzadeł Równoczesne procesy naprawcze powstawanie zmian włóknistych i kostnych = anykloza Ziarnina reumatoidalna wnikanie do stawy = niszczenie chrząstki i kości powstawanie zmian patologicznych = łuszczek Łuszczka - zbita tkanka łączna z licznymi fibroblastami i naczyniami krwionośnymi Objawy podstawowe - postać układowa 1. Guzki reumatoidalne 2. Zmiany w płucach 3. Zmiany w nerkach 4. Zmiany w przewodzie pokarmowym 5. Zapalenie naczyń (vasculitis) - od aorty do kapilar 6. Limfadenopatia = powiększone węzły chłonne, wątroba, śledziona Objaw podstawowy wskazuje na układową postać choroby. Występuje z różną częstotliwością, często prowadzi do zgonu. Patogeneza 1. Kobiety:mężczyźni (3:1) 2. Choroba dzieci i dorosłych (u dzieci inny objaw kliniczny) 3. Szczyt zachorowań 40-50 lat 4. Częstość w populacji 0,5-2% 5. Rozpoznawalne > 16 r.ż 6. Postać seropozytywna = obecność czynnika RF (reumatoidalnego) 60-70% seropozytywnych Etiopatogeneza 1. Etiologia nieznana 2. Choroba wieloczynnikowa Zaburzenia autoimmunologiczne Czynniki genetyczne i hormonalne Infekcje bakteryjne i wirusowe = każda infekcja może zakończyć się RZS Zaburzenia immunologiczne Charakterystyczny kompleks immunologiczny w błonie maziowej 1) Aktywacja dopełniacza i przyciąganie granulocytów obojętnochłonnych 2) Fagocytoza kompleksów przez leukocyty 3) Uwolnienie chemicznych mediatorów zapalenia (to one podtrzymują proces zapalny) 5 Inicjacja i podtrzymywanie zapalenia Antygen limfocyty T odpowiedź uwolnienie limfokin (IL-2, IFN-γ) indukcja makrofagów do wytwarzania cytokin prozapalnych (IL-1, TNF-α) Następstwa Fibroblasty śródbłonek naczynia osteoklasty Aktywacja fibroblastów (w celu utrzymania procesu zapalnego) Stymulacja śródbłonka do proliferacji Nowotworzenie naczyń = Angiogeneza Aktywacja osteoklastów = kość przy powierzchni stawowej objęta jest procesem zapalnym Przewlekłe zapalenia pobudza rozrost błony maziowej i doprowadza do powstania tzw łuszczki dochodzi do uszkodzenia stawu i rozrostu nowotworowego Czynniki genetyczne i hormonalne Najczęstsza rola antygeny HLA klasy II na makrofagach, głównie DR4 (przy obecności DR4 najcięższy przebieg choroby, wczesna destrukcja stawów) wysokie miano czynnika RF objawy pozastawowe Istotny wpływ estrogenów = choroba głównie kobiet po menopauzie hipoestrogenizm Czynniki infekcyjne wirus EBV, slow-wirusy Obraz kliniczny A. Okres wczesny - pierwszy rok choroby > liczony od 1 wizyty u lekarza 1) Objawy prodromalne = paragrypowe (zmęczenie, spadek masy ciała, sztywność stawowomieśniowa) 2) Powoli narastające, symetryczne obrzęki stawów śródręczno-paliczkowych (MCP), paliczkowych bliższych (PIP), nadgarstkowych i skokowych (jeśli chodzi o stopy tu zmiany są większe i wcześniejsze, tylko pacjent ich nie zauważa) 3) Obrzęki symetryczne trwające > 6 tygodni, wrzecionowate i stałe 4) Sztywność poranna, trwająca > 1h (u 60% chorych) 5) Guzki podskórne (u 3,5% chorych), łączą się z obecnością czynnika RF Rozwój zmian poprzedzony złym samopoczuciem, zmęczeniem, osłabieniem, stanem podgorączkowym. Postać pełnoobjawowa rozwija się w ciągu tygodni/miesięcy. Badania laboratoryjne Okres wczesny Okres późny 1. ↑ OB 1. Znaczny ↑ OB i CRP 2. (+) RF IgM (u 85%) 2. (+) RF (u 85%) 3. Niedokrwistość 3. Niedokrwistość normocytarna, hipochromatyczna 4. ↑ γ-globulin i α2-globulin w surowicy 4. ↑ γ-globulin i α2-globulin w surowicy 5. W RTG osteoporoza przystawowa, nadżerki 5. W RTG brak zmian lub osteoporoza powierzchni stawowych, zwężenie szpary stawowej, przystawowa anykloza (zesztywnienie) stawów, geody 6. Przeciwciała przeciwko cytrulinowemu 6. p/c anty-CCP niewysokie miano peptydowi (anty-CCP) specyficzne dla RZS B. Okres późny - po roku od 1 wizyty Objawy kliniczne jak w okresie wczesnym bardziej nasilone Zmiany obejmują większe stawy: łokciowy, kolanowy, odcinek szyjny kręgosłupa 6 Kryteria diagnostyczne 4 z 7 = rozpoznanie ; kryteria 1-4 muszą trwać co najmniej 6 tyg 1. Sztywność poranna stawów i wokół stawów > 1h aż do poprawy 2. Obrzęk lub wysięk w 3 stawach stwierdzony przez lekarza (jednoczesny) 3. Zapalenie co najmniej 1 stawu ręki (MCP, PIP, nadgarstkowy) 4. Symetryczne zapalenie stawów charakteryzujące jednoczasowość i jednoimienność 5. Guzki reumatoidalne nad wyniosłościami kostnymi po stronie wyprostnej lub okolicach stawu 6. Obecność RF 7. Zmiany radiologiczne w postaci nadżerek i osteoporozy okołostawowej kości ręki Kryteria prognostyczne 1. Aktywne zapalenie stawów (>6 obrzękniętych i >6 bolesnych) 2. OB > 30 3. CRP > 2,0 mg/dL 4. Obecny RF Kryteria złej prognozy 1. Początek choroby w młodym wieku 2. Wysokie stężenie RF 3. Obrzęk > 20 stawów 4. Guzki reumatoidalne, zapalenie stawów, episcleritis, scleritis, śródmiąższowa choroba płuc, zapalenie naczyń, zespół Felty Objawy pozastawowe 1. Guzki reumatoidalne - podskórne (łączą się z obecnością czynnika RF). Występują w okolicy wyprostnej stawów łokciowych, okolicy rąk, pośladków, wzdłuż ścięgna Achillesa, na potylicy oraz narządach wewnętrznych (serca, opłucna, OUN) dają objawy podobne do guzów, jeżeli chodzi o ucisk i bolesność, przesuwalne postać seropozytywna niesymetryczne usuwane chirurgicznie 2. Zmiany w sercu (zapalenie osierdzia, mięśnia sercowego, wsierdzia, naczyń wieńcowych, zaburzenia przewodzenia) 3. Zmiany w płucach pojawiają się samoistnie Śródmiąższowe zapalenie płuc głównie u mężczyzn = włóknienie płuc przez odkładanie się kompleksów autoimmunologicznych w kapilarach płucnych Zajęcie stawów poprzedza wystąpienie zmian w płucach w 90% przypadków Rzadziej występuje u kobiet zarostowe zapalenie oskrzelików z zapaleniem płuc = niewydolność oddechowa Zapalenie naczyń płucnych przez odkładanie się kompleksów immunologicznych - objawy kliniczne i w RTG jak w zapaleniu samoistnym nadciśnienie płucne Guzki najczęściej u mężczyzn pojedyncze albo mnogie (różnicować z gruźlicą i nowotworami) 4. Zmiany w nerkach (amyloidoza ze skutkiem śmiertelnym, dochodzi do niewydolności nerek; zapalenia śródmiąższowe, odmiedniczkowe) Amyloidoza - odkładanie białka w kłębuszkach nerkowych 5. Uogólnione zapalenie naczyń (vasculitis) - gorączka, spadek masy ciała, plamica i wybroczyny na skórze, owrzodzenia i martwica naczyń, mono- i polineuropatia 7 Toczeń rumieniowaty układowy LE Choroba zapalna, ciężka, wieloukładowa, postępująca, o zmiennym przebiegu klinicznym i rokowaniu Dochodzi do zajęcia wielu narządów wewnętrznych i odkładania kompleksów immunologicznych Zaburzenia immunologiczne prowadzą do nadmiernej produkcji autoprzeciwciał Kobiety : mężczyźni 9:1 Najczęściej między 20 a 40 r.ż Wpływ 1. Hormonów (estrogeny, prolaktyna) 2. Czynników genetycznych HLA-B8, DR2, DR3 większa zachorowalność u bliźniąt jednojajowych i w rodzinach u krewnych 3. Środowiska = niekorzystny wpływ promieni świetlnych 4. Czynników chemicznych = leki, pył krzemionkowy (kosmetyki), aminy aromatyczne (barwniki żywności, ubrań) 5. Zakażeń wirusowych (EBV, herpes) Etiopatogeneza 1. Nie w pełni wyjaśniona 2. Zachwianie równowagi immunologicznej = spadek liczby i aktywności limfocytów T 3. Powstawanie autoprzeciwciał narządowo nieswoistych, skierowanych przeciwko różnym antygenom jądra i cytoplazmy 4. Odkładanie kompleksów immunologicznych w tkankach 5. Aktywacja dopełniacza - proces zapalny Obraz kliniczny Początek najczęściej nagły Objawy ogólne Gorączka o charakterze septycznym Spadek masy ciała Nudności, osłabienie Skóra i błony śluzowe Zmiany u 75% chorych Klasyczny rumień motylkowy grzbietu nosa i policzków Rumień krążkowy (wysypka grudkowa, pęcherzykowa) na kończynach, dekolcie, twarzy, nasilający się po ekspozycji na światło Zmiany w obrębie opuszek palców: zaczerwienienie, zapalenie, martwica Zmniejszony objaw Raynauda u 20% chorych Nadmierne wypadanie włosów, zwłaszcza przy zaostrzeniu choroby Drobne, niebolesne owrzodzenia błony śluzowej jamy ustnej u 25% chorych Stawy i mięśnie Bóle i/ lub obrzęki stawów u 90% chorych Zapalenie stawów o charakterze lotnym, wędrującym, bez destrukcji Rzadko zapalenie mięśni, przy niskich wartościach enzymów mięśniowych, częściej bóle rzekomomięśniowe jak w grypie (raz są, a raz ich nie ma) Układ sercowo-naczyniowy u 20-60% chorych zapalenie osierdzia (suche i wysiękowe) - najczęściej przebieg subkliniczny, zapalenie mięśnia serocwego, wsierdzia (zawał), naczyń wieńcowych, uszkodzenie aparatu zastawkowego, serce płucne, nadciśnienie tętnicze 8 Układ oddechowy u 60% chorych zapalenie opłucnej (suche lub wysiękowe), obustronne Rzadziej zapalenie miąższu płucnego Choroba śródmiąższowa płuc, nadciśnienie płucne (choroba zakrzepowo-zatorowa, płucny zespół Raynauda) Układ pokarmowy Zapalenie otrzewnej Zapalenie małych naczyń tętniczych - ostre bóle jamy brzusznej Układ wydalniczy Zajęcie nerek - poważne następstwo choroby, dotyczy 50% chorych, zwłaszcza młodych Kłębkowe zapalenie nerek tzw osad teleskopowy moczu (erytrocyty, leukocyty, wałeczki szkliste) + białkomocz > 0,5g/dobę doprowadza to do niewydolności nerek Nadciśnienie tętnicze Nerczyca OUN poważne następstwo choroby Około 75% chorych Objawy ograniczonego uszkodzenia mózgu (zaburzenia świadomości, depresja, pobudzenie, apatia) Psychozy Udary mózgu Napady drgawek Objawy neuropsychiczne czynnik obciążający rokowanie Badanie laboratoryjne 1. Zaburzenia hematologiczne triada penii (hematologiczna) - JEDYNA choroba zapalna, która ma penie! 2. Niedokrwistość normochromiczna z retikulocytozą 3. ↓ stężenia dopełniacza 4. ↑ OB., CRP (ale nie tak wysokie jak w RZS) 5. ↑ γ-globulin i α2-globulin w surowicy 6. Przeciwciała przeciwjądrowe ANA1/2/3! (anty-natywnyDNA/Sm/limfocytotoksyczne, antyfosfolipidowe) 7. Komórki LE (komórki wtrętowe w krwi, występują wyłącznie w toczniu) 8. (+) test reumatoidalny u 30% chorych 9. P/c dla nukleosomu NuHi przeciwciała markerowe! 10. RTG klatki piersiowej i zajętych stawów 11. EKG Poza fazą ostrą miana przeciwciał obniżają się, zmniejsza się ich częstość występowania, maleje ich swoistość. Powikłania Zajęcie nerek i OUN Oportunistyczne infekcje - główna przyczyna zgonu (przyczyna limfopenii, erytropenii) LE polekowy Ponad 80 leków dających objawy tocznia Leki indukujące toczeń polekowy 1) Hydralazyna 4) Prokainamid 5) D-penicylamina 2) Penicylina 3) Sulfonamidy 6) Doustne leki antykoncepcyjne Obraz kliniczny podobny do tocznia układowego. Rzadsze występowanie objawów skórnych, nerkowych oraz z OUN, objawy cofają się po odstawieniu leków 9 Twardzina układowa TU Przewlekła choroba zapalna o podłożu autoimmunologicznym, postępująca, występująca przed menopauzą. Kobiety : mężczyźni 3:1 Najczęściej w 30-50 r.ż. Etiologia nieznana, ale inna niż w pozostałych kolagenozach. Przebieg procesu chorobowego w sklerodermii początek w naczyniach 1) uszkodzenie śródbłonka i nadmierna agregacja trombocytów 2) obrzęk śródmiąższowy i nadprodukcja kolagenu 3) proliferacja komórek mięśniowych w naczyniach 4) Zwężenie światła naczyń i zmniejszenie łożyska naczyniowego Etiologia - zaburzenia immunologiczne A. Humoralne: przeciwciała przeciwjądrowe i hipergammaglobulinemie B. Komórkowe: nacieki okołonaczyniowe limfocytów T U 90% chorych nieprawidłowości chromosonalne Objawy sklerodermii u 65% chorych zespół Raynauda (napadowy skurcz tętniczek palców w odpowiedzi na ciepło lub zimno) – często pierwszy objaw bóle stawów, obrzęk rąk najbardziej charakterystyczne to: symetryczne twardnienie skóry kończyn, twarzy, tułowia => skóra zbyt ciasna, napięta, gładka, brak mimiki twarzy, zanik zmarszczek, zanik przydatków skóry i czerwieni wargowej) u 40% chorych sklerodaktylia, zanik, przydatków skóry, teleangiektazja rozległość zmian skórnych koreluje z ryzykiem wystąpienia zmian narządowych u 35% chorych polyartralgia z obrzękami i sztywnością stawów rąk, nadgarstków, kolan i stawów skokowych, przykurcze stawowe, zwłaszcza w stawach międzypaliczkowych dalszych obecność naparstkowych blizn na opuszkach palców, często z resorpcją ostatnich paliczków lub bolesnych owrzodzeń, zwapnienie podskórne, ubytek tkanek w obrębie opuszek palców u 90% chorych zaburzenia połykania z powodu zaniku mięsni gładkich i włóknienia ich ściany z powodu włóknienia ścian jelit – zespół złego wchłaniania oraz zgaga, wzdęcia, kolki jelitowe, biegunki lub/i zaparcia (jelito upchane w za ciasnej jamie brzusznej) zmiany w sercu prowadzące do postępującej niewydolności w krążeniu (zapalenie osierdzia, zaburzenia rytmu, nadciśnienie tętnicze złośliwe-nie chce się uregulować) u 70% zmiany w układzie oddechowym z powodu włóknienia tkanki łącznej (zmiany restrykcyjne) – duszność wysiłkowa, przewlekły kaszel, ból w klatce piersiowej (zajęcie opłucnej), niewydolność oddechowa restrykcyjna zmiany w nerkach – nagłe pojawienie się objawów: skąpomocz lub bezmocz, niewydolność nerek, nadciśnienie tętnicze złośliwe => świadczy o aktywnym przebiegu choroby, pacjenta nie da się uratować Badania laboratoryjne w sklerodermii 1. hipergammaglobulinemia 2. ↑ OB 3. przeciwciała przeciwjądrowe swoiste dla skleroderum (Scl 90% tj. ACA, Scl-70, anty-RNA polimerazowe III) 4. ↑ stężenia IgG i IgM 5. u 30% chorych (+) RF 6. mierna niedokrwistość 10 Inne badania wykorzystywane w diagnostyce sklerodermii charakterystyczny obraz w kapilaroskopii (o charakterze mikroangiopatii – obszary awaskularyzacji lub megakapilary) - drzewiasto rozgałęziające się naczynia palców!! histopatologiczne badanie wycinka skóry!! badanie RTG przewodu pokarmowego z papką barytową (sztywność przewodu) -> pasaż jelitowy RTG klatki piersiowej i badanie czynnościowe układu oddechowego Zapalenie skórno-mięśniowe. Zapalenie wielomięśniowe Są to nabyte, idiopatyczne, przewlekłe, zapalne choroby mięśni z zajęciem skóry lub nie. W 1/3 przypadków przebiega z innymi chorobami tkanki łącznej (RZS, toczeń rumieniowaty, twardzina). W 1/10 przypadków ma podłoże nowotworowe (nowotwór złośliwy). Kobiety :mężczyźni 3:1 po 40 roku życia u osób z antygenem HLA-DR3 etiologia nieznana – prawdopodobnie zakażenie. Objawy kliniczne 1. początek choroby ostry, z gorączką, postępującym zajęciem mięśni (najczęściej proksymalnych) kończyn górnych i dolnych 2. rzadziej powolny początek 3. symetryczne, postępujące osłabienie i bóle mięśni kończyn górnych i dolnych (zaburzenia wstawania, chodzenia, unoszenia rąk itd.) 4. zajęcie mięśni krtani, gardła, przełyku – dysfonia, dysfagia 5. osłabienie przepony – zaburzenia wentylacji 6. typowe zmiany skórne – zapalenie skórno-mięśniowe (ciemnoczerwony rumień z obrzękiem twarzy, sinoczerwone zabarwienie powiek, rumień i przerost naskórka nad wyniosłościami kostnymi (objaw Gottrona) => objaw kliniczny zapalenia skórno-mięśniowego, jeśli go nie ma, to mamy do czynienia z zapaleniem wielomięśniowym 7. zespół Raynauda 8. odkładanie soli wapnia w tkance podskórnej, mięśniach, powięziach 9. vasculitis 10. bóle lub zapalenie stawów 11. u 70% chorych zmiany w sercu - zapalenie mięśnia sercowego, tachykardia, zaburzenia rytmu serca i blok A-V 12. u 50% chorych zmiany w płucach - śródmiąższowa choroba płuc, włóknienie płuc Badania diagnostyczne zapalenia skórno-mięśniowego i wielomięśniowego -zmiany w EMG świadczące o pierwotnym uszkodzeniu mięśni- kiedy są zaburzenia czuciowe i ruchowe w przewodnictwie -zmiany zwyrodnieniowe i martwica mięśni w biopsji Badania laboratoryjne - wzrost stężenia enzymów mięśniowych- aldolaza, fosfokinaza keratynowa, ASPAT - ↑ OB. - leukocytoza- stąd proces zapalny - ↑ γ i α2-globulin - u 50% (+) RF - przeciwciała przeciwjądrowe i mięśniowo specyficzne MSA 11 Zespół Sjogrena (z. Suchości) Przewlekła, układowa egzokrynopatia o nieznana etiologia, charakteryzująca się naciekiem limfatyczny w tkankach gruczołów wydzielania zewnętrznego, prowadząca do upośledzenie lub całkowitej utrata funkcji gruczołów. Obejmuje gruczoły łzowe i ślinowe Kobiety : mężczyźni 9:1 szczyt zachorowań 40-50rż częstość: 0,6-4% pierwotny- jedna z najczęściej występujących chorób tkanki łącznej wtórny- występuje w przebiegu innych chorób autoimmunizacyjnych Pierwotny (pSS) nacieki gruczołów wydzielania zewnętrznego przez limfocyty głównie T, którym towarzyszą limfocyty B odpowiedzialne za produkcję przeciwciał oraz komórki plazmatyczne Za inicjację zapalenia prawdopodobnie odpowiedzialne są wirusy Antygeny HLA-B8, DRw52, DR3, DR5 Objawy z jamy ustnej ◦ suchość dłużej niż 3 miesiące, powiększenie ślinianek (głównie przyusznych), konieczność używania płynów przy połykaniu suchego pokarmu ◦ spadek ilości i jakości śliny = nasilona próchnica, zakażenia grzybicze i zapalenia śluzówki jamy ustnej oczne ◦ suchość oczu odczuwana codziennie dłużej niż 3 miesiące ◦ nawracające wrażenie piasku pod powiekami ◦ zaczerwienienie ◦ konieczność używania substytucji łez przynajmniej 3x/dobę powolna destrukcja gruczołów wydzielania zewnętrznego = przyczyna suchości w górnych drogach oddechowych, pochwie oraz zapalenia trzustki objawy niezwiązane z zajęciem gruczołów wydzielania zewnętrznego: ◦ ogólne osłabienie, złe samopoczucie, zmęczenie, okres spadku masy ciała, stany podgorączkowe, bóle/zapalenia stawów, objaw Raynauda, suchość skóry, powiększenie węzłów chłonnych, wątroby, zmiany w płucach bądź nerkach, vasculitis, polineuropatię, transformacja nowotworowa w kierunku chłoniaków Badania w celu rozpoznania zespołu suchości Sjorgena testy oczne (schirmera, barwienie różem bengalskim, zielenią lissaminy) gruczoły ślinowe - sialometria (pomiar produkcji śliny <1,5ml/15min), sialografia, USG! (obraz plastra miodu), scyntygrafia badanie histopatologiczne: naciek limfocytarny wycinka z dolnej wargi obecność przeciwciał anty-Ro/SS-A, anty-La/SS-B = korelują z objawami suchości Zespół Reitera (Reaktywne Zapalenie Stawów) Seronegatywne zapalenie stawów, schorzenie przewlekłe, z wyraźnymi fazami zaostrzeń i remisji częściej u mężczyzn niż kobiet i dzieci etiologia nieznana- prawdopodobnie osobnicza reakcja na infekcje Klebsiella, Yersinia, Chlamydia, Salmonella, Ureaplasma może ewoluować w kierunku ŁZS, ZZSK, rzadziej RZS- ważne są predyspozycje genetyczneobecność HLA-B27 12 Objawy Triada ze strony narządu ruchu – zapalenie wędrujące stawów, najczęściej stawów dużych, śródstopno-paliczkowych 1 (MPT 1), nadgarstkowych, kolanowych i krzyżowo-biodrowych oraz zapalenie przyczepów ścięgien, więzadeł (zapalna kalkanopatia) wzroku – zapalenia spojówek, tęczówki, zapalenie ciałka rzęskowego, naczyniówki lub nerwu wzrokowego; układu moczowego – zapalenie cewki, pęcherza moczowego; zapalenie jąder, najądrzy, pęcherzyków nasiennych, gruczołu krokowego; zapalenie szyjki macicy Tym zmianom mogą towarzyszyć bolące owrzodzenia jamy ustnej, keratodermia, zmiany paznokci oraz zmiany w układzie krążenia (zapalenie mięśnia sercowego, osierdzia)-> zmiany w układzie krążenia mogą być jednym z pierwszych objawów zespołu Reitera. Kryteria diagnostyczne zespołu Reittera 1. Seronegatywne asymetryczne zapalenie stawów (głównie kończyn dolnych) + 1 lub więcej objawów pozastawowych 2. często źródłem zakażenia dolny odcinek p.pokarmowegobiegunki z domieszkami śluzu/krwi 3. postać pełno/niepełnoobjawowa- zapalenie stawów jest objawem stałym Łuszczycowe Zapalenie Stawów (ŁZS) Przewlekła choroba zapalna stawów u chorych z łuszczycą, należy do spondyloartropatii (zapaleń stawów) seronegatywnych = nieobecny czynnik reumatoidalny RF kl. IgM. częstość występowania łuszczycy w populacji ok. 2% częstość występowania postępującego procesu zapalnego stawów ok.25% częstość występowania równocenna u kobiet i mężczyzn w postaci osiowej (zajęte stawy kręgosłupa) → mężczyźni: kobiety 3:1 rozpoczyna się między 20-50 rokiem życia, u młodzieży między 9-12 (tu dwa skoki choroby) Zmiany skórne są wcześniejsze niż stawowe u 2/3 chorych, łuszczycowe zmiany paznokci u 80% chorychczęściej u chorych z przewagą zmian skórnych, u 1/3 chorych jako pierwsze zmiany stawowe. Brak istotnej korelacji między rozległością zmian skórnych a występowaniem zapalenia stawów. W ciężkiej łuszczycy – proces zapalny stawów bardziej agresywny i szybsze zmiany destrukcyjne stawów Czynniki genetyczne w ŁZS rodzinna występowanie 50 razy częściej u dzieci rodziców chorych na ŁZS istotne oznaczenie antygenów zgodności tkankowej w postaci z zajętym kręgosłupem i stawami krzyżowo-biodrowymi = antygen HLA-B27, w postaci nadżerkowej (RZS-podobnej) – HLA-DR4, w postaci z zajęciem stawów dystalnych, obwodowych- HLA-DR7 – ciężki przebieg Wpływ na inicjację mają urazy i infekcje wirusowe/bakterie W HIV wzrost zmian skórnych i stawowych co wskazuje na ważną rolę limfocytów Th1 13 Podział ŁZS na 5 podtypów (Moll i Wright) 1. asymetryczna, nielicznostawowa, występowanie > 50%, najczęściej zajęte zapalnie stawy palców rąk i stop oraz pochewki ścięgien, zaczerwienienie, obrzek i ból całego palca (palec kiełbaskowaty) 2. z dominującym zajęciem dystalnych stawów międzypaliczkowych, 5-10% → zmiany łuszczycowe paznokci, objaw „naparstka” = zagłębienie w płytce stawowej 3. okaleczająca (arthritis mutilans), występowanie u 5% chorych, najczęściej zajęte zapalnie stawy palców rąk i stóp, osteoliza, skrócenie paliczków i tzw. palce teleskopowe 4. wielostawowa, przypominająca RZS z zajęciem bliższych stawów międzypaliczkowych, nadgarstkowych, Występuje u 15-25% → zmiany destrukcyjne stawów 5. osiowa – typowe asymetryczne zapalenie stawów krzyżowo-biodrowych oraz kręgosłupa, syndesmofity, występowanie od 20-40%. Kryteria diagnostyczne obecność łuszczycy wywiad w kierunku łuszczycy skóry i paznokci również w rodzinie zapalenie stawów klasyczne objawy zapalenia stawów krzyżowo-biodrowych lub kręgosłupa, asymetryczne nieobecność czynnika reumatoidalnego Objawy kliniczne zapalenie stawów obwodowych + uczucie sztywności rano zapalenie stawów międzypaliczkowych dalszych niesymetryczne zapalenie stawów krzyżowo-biodrowych lub kręgosłupa zapalenie palców (dactylitis) zapalenie przyczepów ścięgien do kości (głównie Achillesa) pozastawowe: ▪ zmiany w narządzie wzroku (zapalenia tęczówki, oraz błony naczyniowej) ▪ ogólne uczucie znużenia, zaburzenia nastroju, objawy depresyjne ▪ sporadyczne wady zastawki aortalnej ▪ zmienny obraz choroby = okresy zaostrzeń i remisji, choroba prowadzi do niepełnosprawności, bo ma podłoże radiologiczne (ważna rola badań obrazowych) zmiany radiologiczne ▪ asymetryczność zmian ▪ nieobecność osteopenii okołostawowe w zajętych chorobowo stawach ▪ zajecie dystalnych paliczków ▪ akroosteoliza dystalnych paliczków ▪ skrócenie paliczków ▪ deformacja typu „ołówek w kubku” ▪ ankyloza kości dystalnych od stawów śródstopno-paliczkowych ▪ asymetryczne zmiany zapalne stawów krzyżowo-biodrowych i kręgosłupa Zesztywniające Zapalenie Stawów Kręgosłupa (ZZSK) Druga pod względem częstości zapalna choroba stawów zwykle początek w drugiej lub trzeciej dekadzie życia (15-40 roku życia) Częstość występowania 0.2-1% Przebieg zmienny (epizody bólowe i bezbólowe) Często brak specyficznego leczenia (sanatoria, oddziały rehabilitacyjne). 14 Objawy ZZSK 5-7 lat od pierwszych objawów choroba jest zwykle nierozpoznawalna, brak objawów ewidentnych wymagających skierowania do reumatologa ból zapalny krzyża ▪ powolny początek dolegliwości, trwa od kilku miesięcy do kilku lat, poranna sztywność, ból pojawia się w nocy lub nad ranem, ból ustępuje po wysiłku fizycznym!!! lub po wstaniu z łóżka i gimnastyce (odróżnienie od innych schorzeń zapalnych), ból nie zmniejsza się po odpoczynku. Zbyt późno pacjent kierowany jest przez lekarza rodzinnego do specjalisty z niespecyficznymi objawami bólu krzyża ▪ widoczne cechy radiologiczne w stawach krzyżowo-biodrowych pojawiają się późno Algorytm dla ZZSK przewlekły ból > 3miesecy oraz pierwsze objawy przed 45 rokiem życia ▪ Sztywność ▪ ból w nocy lub ▪ poprawa po poranna > 30min wcześniej rano ćwiczeniach HLA-B27: u 90% populacji z tym antygenem nigdy nie rozwija się SpA (spondyloartropatia) sacroilitis w RTG bądź RM Jeśli 1 objaw z trzech->skierowanie do reumatologa Postać młodzieńcza różni się od postaci dorosłej częstszym zajęciem stawów biodrowych i związanym z tym wcześniejszym wskazaniem do endoprotezowania stawu biodrowego, w postaci dorosłej rzadziej. 2-3 razy częstsze ZZSK u mężczyzn (cięższy przebieg) niż u kobiet. Ryzyko wystąpienia choroby 10%, u bliskich krewnych 30%. Brak środka profilaktycznego, zapobiegającego ZZSK przed wystąpieniem pierwszych objawów. Zmiany radiologiczne przy ZZSK staw biodrowo-krzyżowy: wcześnie pseudorozszerzone szpary stawów biodrowo-krzyżowych wywołane przez nadżerki, potem dochodzi do zwężenia szpary stawowej zmiany w odcinku lędźwiowym kręgosłupa: wapnienie więzadeł, kwadratowienie i demineralizacja trzonów, 1-2 pseudosmofity zmiany w odcinku szyjnym kręgosłupa: bolesność przy ruchach głowy, ograniczona ruchomość -> usztywnienie, możliwe złamania przy niewielkich ruchach, może dojść do uszkodzenia rdzenia kręgowego i ośrodka oddechowego zajęcie odcinka piersiowego, stawów żebrowo-krzyżowych i żebrowo-poprzecznych: hiperkifoza odcinka piersiowego, bóle klatki piersiowej przy oddychaniu, ograniczona ruchomość klatki piersiowej, zmiana toru oddychania z piersiowego na brzuszny, spadek pojemności życiowej płuc, przesunięcie obręczy barkowej do przodu Kryteria nowojorskie rozpoznania ZZSK radiologiczne: zapalenie stawów krzyżowo-biodrowych o stopniu II bądź większym, obustronnie lub o stopniu III lub IV jednostronnie kliniczne: ▪ ból krzyża i sztywnienie tej okolicy trwające > 3mce, ustępujące podczas ćwiczeń, ale nie są łagodzone przez odpoczynek ▪ ograniczenie ruchomości odcinka lędźwiowego kręgosłupa, zarówna w płaszczyźnie strzałkowej jak i czołowej ▪ ograniczenie ruchomości klatki piersiowej w odniesieniu do wartości skorelowanej z płcią i wiekiem Rozpoznanie : musi być spełnione kryterium radiologiczne oraz przynajmniej dwa z trzech klinicznych 15 Diagnostyczne kryterium spondyloartropatii wg Amora: objawy przedmiotowe i podmiotowe: nocny ból w części lędźwiowej, piersiowej i/lub sztywność poranna=1 asymetryczne zapalenie kilustawowe=2 niespecyficzny ból posladków=1 alternatywny obustronny ból posladków=2 meningokokowe zapalenie cewki moczowej/szyjki macicy < miesiąca przed początkiem zmian stawowych=1 biegunka w ciągu miesiąca przed początkiem zmian stawowych=1 aktywna lub stwierdzona w wywiadzie łuszczyca/przewlekła choroba jelit=2 objawy radiologiczne: zapalenie stawów krzyżowo-biodrowych (stadium >=2 jeśli obustronne, >=3 jeśli jednostronne)=3 czynniki genetyczne: obecność B27 i/lub wywiad rodzinny w kierunku spondylitis, zespołu Reitera=2 odpowiedź na leczenie: ustąpienie bólu w ciągu 48h po podaniu NLPZ (niesteroidowe leki przeciwzapalne) i/lub szybki nawrót (48h) po ich odstawieniu=2 >6 duże prawdopodobieństwo choroby Zaawansowane ZZSK brak lordozy lędźwiowej zmniejszenie wzrostu pochylenie do przodu odcinka piersiowego i szyjnego wysklepienie brzucha do przodu łagodny przykurcz zgięciowy w stawach biodrowych zwiększenie odległości potylica-ściana (zdrowy odchyla głowę do tyłu, chory do przodu) Powikłania ZZSK amyloidoza sercowe: zaburzenie przewodnictwa – blok II i III stopnia część osób wymaga stymulatora zapalenie aorty – częstość nieznana częstość zmian w zastawkach aorty wynika z czasu trwania ZZSK – 4%<15lat, 10%>30lat osteoporoza niska masa kostna już we wczesnym etapie choroby spowodowana zapaleniem złamania kręgosłupa często wynikiem minimalnego urazu (kichniecie, gwałtowny skręt). Złamania kręgosłupa aż w 75% przypadków prowadzące do ciężkich zaburzeń neurologicznych Test Scholera- zdolność do zgięcia odcinka lędźwiowego 16 Dna moczanowa Krystalopatia Bogata symptomatologia Objawy dny moczanowej Kostno-stawowe Układ krążenia (MIC-choroba niedokrwienna serca, miażdżyca, nadciśnienie) Układ moczowy (kamica, zapalenie śródmiąższowe nerek) Współistniejąca cukrzyca typu 2, otyłość Postać ostra jednostawowa poprzedzona 10-letnim okresem bezobjawowej klinicznie hiperurykemii Napad ostrego zapalnie I stawu śródstopno-paluchowego w nocy lub nad ranem (po alkoholu, posiłku bogatym w puryny) Nefropatia dnawa- skutek odkładania złogów moczanów w tkance śródmiąższowej rdzenia i piramid nerkowych Kamica nerkowa- 1000krotny wzrost ryzyka choroby +nadciśnienie, cukrzyca typu 2niewydolność nerek Nadciśnienie, insulinooporność lub cukrzyca, hiperTG, niskie stężenie HDL- zespół metaboliczny Choroba metaboliczna XXI wieku Dna moczanowa + zespół metaboliczny + otyłość Etiopatogeneza Zachorowalność: 1-2% całej populacji 8% u mężczyzn 3% u kobiet po 65rż Choroba ogólnoustrojowa, niszczy stawy, nerki, przyspiesza rozwój MIC i miażdżycy Przebieg klinicznie najczęściej bezobjawowy przy hiperurykemii powyżej 7mg/dlodkładanie mikrokryształków w ścianach naczyńspadek elastyczności, usztywnienie, miażdżyca Hiperurykemia u kobiet po menopauzie (hypoestrogenizm) Zapalenie stawów w dnie moczanowej Z powodu krystalizacji i fagocytozy kryształów moczanu sodu w płynie stawowym oraz powstania złogów kryształów we wszystkich (z wyjątkiem mózgu) narządach organizmunieodwracalne uszkodzenie Stan zapalnyIl-6, TNF-α Higroskopijne kryształu moczanu sodu wiążą się bezpośrednio z CD14 powierzchniową molekułą leukocytów poprzez toll receptor 2 i 4pobudzenie leukocytówfagocytoza oraz aktywacja leukocytów i kaskada procesów zapalnych Kryształy moczanu sodu wiążą białka- IgG, dopełniacz=interakcje z receptorem na powierzchni leukocytów Podział dny moczanowej Pierwotna Spadek wydzielania kwasu moczowego lub wzrost produkcji związanej z nadmiernym spożyciem puryn, alkoholu, występowaniem zespołu metabolicznego Wtórna Skutek zażywania leków lub występowania stanów prowadzących do hiperurykemii 17 Przyczyny dny moczanowej wtórnej 1. Zespoły mieloproliferacyjne 2. Niewydolność nerek 3. Zaburzenia funkcji cewek nerkowych 4. Zatrucie ołowiem 5. Łuszczyca 6. Defekty enzymatyczne lub zespoły związane ze wzrostem spichrzania glikogenu 7. Niektóre antybiotyki 8. Cyklosporyny 9. Diuretyki 10. Kwas acetylosalicylowy do 300mg Co przemawia za dną moczanową Płeć męska Przebyty napad zapalenia stawów w wywiadzie Zaczerwienienie stawu rozwijające się w ciągu 1 dnia Zajęcie I stawu MPI Nadciśnienie lub inne choroby układu krążenia Stężenia kw. moczowego > 5,88mg/dl Standard diagnostyczny w dnie moczanowej Stwierdzenie wewnątrzkomórkowo położonych kryształów moczanu sodu Wykluczenie zakażenia Wykluczenie innych krystalopatii Trudność diagnostyczna Dna u kobiet pomenopauzalnychostre zapalenie stawów ręki i skokowychbadanie USG Różnicowanie dny moczanowej 1. Choroby układowe 2. Cellulitis 3. Reumatoidalne zapalenie stawów 4. Ostra sarkoidoza 5. Amyloidoza 6. Zapalenie pochewek ścięgnistych Okresy choroby dny moczanowej 1. Bezobjawowa hiperurykemia 2. Napady zapalenia stawów 3. Okres międzynapadowy 4. Przewlekłe zapalenie stawów Ostre dnawe zapalenie stawów różnicujemy z bakteryjnym zapaleniem stawów pseudodną Diagnostyka dny moczanowej Nadżerki kostne w pobliżu złogów moczanu RTG- duże brzeżne nadżerki kostne (halabardowe), brak osteopenii okołostawowej DECT- dual Energy computed tomography- wizualizacja złogów moczanu, różnicowanie chemiczne depozytów, potwierdzenie złogów w miejscach atypowych lub o małej średnicy, monitorowanie leczenia Podwójny zarys hiperechogenicznej nieregularnej linii z kryształów moczanu sodu na powierzchni chrząstki stawowej nad hiperechogeniczną linią kości szczególnie w stawie MPI 18 Hematologia Układ erytroblastyczny Komórki pnia → komórka macierzysta mieloidalna → proerytroblast → erytroblast zasadochłonny → erytroblast wielobarwliwy → erytroblast ortochromatyczny → retikulocyt → erytrocyt. Rozmiary erytrocytów - normocyty: 7,2 ± 0,5 μm - mikrocyty: <6,0 μm - makrocyty: >9,0 μm Anizocytoza - jednoczesne występowanie krwinek czerwonych o różnych rozmiarach. MCHC Średnie stężenie Hb w krwince - normochromia 32-38%, - hypochromia<30%, - hyperchromia>40% Poikilocytoza - różnorodność erytrocytów: - sferocyty - kuliste - eliptocyty - owalne - leptocyty - spłaszczone - drepanocyty - sierpowate - schistocyty – fragmenty erytrocytów - akantocyty – kolczaste - stomatocyty – z wąskim przejaśnieniem - lakrymocyty – kształt łez - echinocyty – krótkie wypustki 19 Czynniki wpływające na erytropoezę: 1) żelazo 2) witamina B12 3) witamina B6 4) kwas foliowy 5) erytropoetyna Układ granulocarny Komórka pnia → komórka macierzysta mieloidalna → mieloblast → promielocyt → mielocyt → metamielocyt → granulocyt obojętnochłonny Układ płytkotwórczy Komórka pnia → komórka macierzysta mieloidalna → megakarioblast → promegakariocyt → megakariocyt → płytki krwi - pula krążąca 65% - pula śledzionowa 35% Układ monocyty - makrofagi Komórka pnia → komórka macierzysta mieloidalna → monoblast → promonocyt → monocyt → makrofag Układ chłonny Komórka pnia → komórka macierzysta limfoidalna → limfoblast → prolimfocyt → limfocyt średni i mały → limfocyt duży. Plazmocyty Plazmoblast → proplazmocyt → plazmocyt. Inne komórki szpiku - komórki tuczne - osteoblasty - osteoklasty - komórki śródbłonka - komórki nabłonka Badanie układu czerwonokrwinkowego Kobiety / Mężczyźni o Hb = 12-16g/ 13-18 g% o E = 3,6-5/ 4,2-5,4 mln/ml o Ht = 36-45% / 40-54% - MCV = 80-92 μm3 MCHC = 31-38% retikulocyty = 5-15 ‰ Fe = 18 - 21μmol/l TIBC = 44,8-73,4 μmol/l (zdolność wiązania żelaza przez białka surowicy). Badania układu białokrwinkowego - leukocytoza 3,5-9,0 G/l - rozmaz krwi obwodowej: - pałki 3-5% - neutrofile 50-70% - eozynofile 2-4% bazofile 0-1% 20 - limfocyty 25-40% monocyty 2-8% Niedokrwistość – zmniejszona liczba erytrocytów – małe erytrocyty – mało hemoglobiny w erytrocytach Podział niedokrwistości pokrwotoczne spowodowane zaburzeniami erytropoezy o zaburzenie syntezy hemu niedobór żelaza zaburzenie utylizacji żelaza o upośledzenie syntezy DNA niedobór wit.B12 niedobór folianów hemolityczne o rozpad krwinek – czas życia krótszy niż 120 dni hipo- i aplastyczne o uszkodzenie szpiku Niedokrwistość z niedoboru żelaza Etiologia przewlekle krwawienia o obfite miesiączki, patologiczne krwawienia z dróg rodnych o krwawienie z przewodu pokarmowego zwiększone zapotrzebowanie o ciąża (III trymestr) o okres szybkiego wzrostu niedostateczna podaż żelaza o diety eliminacyjne zaburzenia wchłaniania żelaza o stan po resekcji żołądka o zanikowy nieżyt błony śluzowej żołądka o żołądkowo-jelitowe zespoły zaburzonego wchłaniania zaburzenia transportu o zmniejszenie stężenia transferyny zaburzenia wewnątrzustrojowej gospodarki żelazem o gromadzenie Fe w ukł. siateczkowo - śródbłonkowym w przebiegu zakażeń i nowotworów Objawy 1. osłabienie, uczucie zmęczenia, duszność wysiłkowa, tachykardia 2. bóle głowy, trudności z koncentracją, senność 3. łamliwość paznokci, wypadanie włosów 4. objawy ze strony przewodu pokarmowego a. zaburzenia łaknienia, dysfagia, pieczenie, wygładzenie języka, zajady b. wzdęcia, odbijanie, zaparcia, biegunki. Badanie fizykalne – bladość skóry, błon śluzowych, zmiany troficzne skóry i przydatków – ukł. krążenia - zmiany osłuchowe nad sercem, objawy niewydolności krążenia 21 Badania dodatkowe – ↑ OB – morfologia – ↓ Hb – ↓ Er – ↓ MCV – ↓ MCH – rozmaz krwi obwodowej – mikrocytoza – hipochromia – anizocytoza – poikilocytoza – anulocytoza (brak Hb w krwinkach) – ↓ retikulocytów – ↓ Fe, ↑ TIBC – ↓ ferrytyna - mielogram o zahamowanie zasadochłonne - wzrost odsetka erytroblastów zasadochłonnych – na tym poziomie erytropoezy do erytrocytów wbudowywane jest żelazo i Hb - próba doustnego obciążenia żelazem o 1g siarczanu żelaza o zdrowi ↑ Fe max o 35μg% w 180min o chorzy ↑ Fe >50% przy prawidłowym wchłanianiu przy upośledzonym wchłanianiu – płaska krzywa Niedokrwistość Megaloblastyczna Etiopatogeneza niedobór kwasu foliowego lub wit. B12 desynchronizacja w dojrzewaniu komórek krwi o upośledzenie syntezy DNA o prawidłowa synteza RNA i białek. Przyczyny niedoboru witaminy B12 zaburzenia wchłaniania o zanik błony śluzowej żołądka o przeciwciała przeciw czynnikowi Castle'a i komórkom okładzinowym (niedokrwistość AddisonaBiermera) o stan po resekcji żołądka o rak żołądka o zespoły złego wchłaniania (celiakia, stany po resekcji jelita cienkiego, choroba Crohna) o leki - neomycyna, kwas paraaminosalicylowy, hydantoina zwiększone zużycie o zakażenia pasożytami o nieprawidłowa flora bakteryjna w jelicie cienkim nieprawidłowe odżywianie 22 Przyczyny niedoboru kwasu foliowego zaburzenia wchłaniania o celiakia, sprue (choroba tropikalna z zaburzeniem wchłaniania), stany poresekcyjne jelit i żołądka o enteropatia cukrzycowa, choroba Crohna o alkoholizm o leki przeciwdrgawkowe i barbiturany zwiększone zużycie i nadmierna utrata o ciąża i okres laktacji o przewlekłe choroby zakaźne- gruźlica, bakteryjne zapalenie wsierdzia, malaria o zwłóknienie szpiku o ostre choroby rozrostowe układu krwiotwórczego o złośliwe nowotwory lite (rak chłoniak) zmniejszona podaż o niedożywienie zaburzenie metabolizmu kwasu foliowego o antagoniści kwasu foliowego np. metotreksat Objawy związane z niedokrwistością ze strony przewodu pokarmowego ze strony układu nerwowego o parestezje - zaburzenia czucia o ataksja - trudności z chodem o objawy piramidowe Badania dodatkowe ↑ OB morfologia o ↓ Er o ↑ Hb o ↑ MCV o ↑ MCH rozmaz krwi obwodowej o hiperchromia o makrocytoza o megalocytoza o leukopenia z przesunięciem w prawo szeregu granulocytów mielogram o hematopoeza megaloblastyczna ↓ wit. B i kwasu foliowego w surowicy ↓ kwasowości soku żołądkowego obecność przeciwciał przeciw czynnikowi wewnętrznemu w surowicy, w soku żołądkowym, w bioptacie błony śluzowej żołądka test Schillinga o ocena przyswajalności witaminy B12 podanej domięśniowo, doustnie o oceniamy wydalaną witaminę B12 z moczem o powinno być >15%. 23 Niedokrwistość Hemolityczna Etiopatogeneza – złożona – wspólną cechą jest skrócony czas życia erytrocytów <120 dni Podział – wrodzona – autoimmunohemolityczna – nieimmunologiczne zespoły hemolityczne. Niedokrwistość hemolityczna wrodzona nieprawidłowość błony komórkowej o sferocytoza, eliptocytoza, akantocytoza hemoglobinopatie o niedobór dehydrogenazy glukozo-6-fosforanowej i kinazy pirogronianowej Niedokrwistość hemolityczna o podłożu immunologicznym – alloprzeciwciała (zespoły poprzetoczeniowe) – autoprzeciwciała (choroby o podłożu immunologicznym, chłoniaki, leki). Nieimmunologiczne zespoły hemolityczne – fragmentaryzacja erytrocytów (tętniaki, wady zastawkowe, protezy zastawkowe i naczyniowe) – zaburzenia homeostazy (mocznica, niewydolność wątroby) – zatrucia chemiczne (związki aromatyczne, ołów) – hipersplenizm Objawy triada objawów o niedokrwistość o żółtaczka (bilirubina z rozpadu hemoglobiny) o hepatosplenomegalia ↑ OB morfologia ↓Er ↓Hb ocena morfologiczna krwinek, ocena typu hemoglobiny ↓ czasu przeżycia erytrocytów, ↓ oporności osmotycznej i mechanicznej retikulocytoza >15‰ cechy hemolizy o ↑ Fe o ↑ bilirubiny o obecność wolnej Hb we krwi i w moczu o ↓ wolnej haptoglobiny w surowicy mielogram o odnowa erytroblastyczna test antyglobulinowy (odczyn Coombsa) ocena swoistości przeciwciał 24 Tabelki Niedokrwistości Etiologia Objawy Badania dodatkowe Morfologia Rozmaz krwi Mielogram Z niedoboru żelaza 1. Przewlekłe krwawienia 2. ↗ zapotrzebowanie 3. ↘ niedostateczna podaż 4. X zaburzenia wchłaniania/ transportu/ gospodarki Megaloblastyczna Niedokrwistości i aplazja Hemolityczna 1. ↘ kw foliowego lub B12 > to co obok B12 - pasożyty i flora B11 - ciąża, gruźlica, malaria B12 - zanik bł.śluz = Addison-Biermer = anemia złośliwa = p/c anty IF Rak żołądka, (i B11) celiakia, ch.Crohna 2. Desynchronizacja w dojrzewaniu komórek krwi (x DNA, ok RNA i białka) Złożona; <120 dni Er Wrodzona > X błona i hemoglobinopatie Immunolog > allo (z.poprzetocz) lub auto-p/c (chłoniaki, leki, autoimm) Nieimmuno > fragmentaryzacja Er, X homeostazy, zatrucia chemiczne, hipersplenizm 1. Ogólne > osłabienie, uczucie zmęczenia = senność, bole głowy, trudności z koncentracją, 2. Oddechowy > duszność wysiłkowa, tachykardia 3. Krążenie > zmiany osłuchowe serca, niewydolność tachykardia 4. Skóra > łamliwość paznokci, wypadanie włosów; objaw szkiełka zegarkowego 5. Przewód pokarmowy > wygładzenie języka, zaburzenia łaknienia, dysfagia, pieczenie, , wzdęcia, odbijanie, zaparcia, biegunki 1. ↗ OB i TIBC (wiąz Fe) 2. ↘ Fe i ferrytyny 3. ↘ retikulocytów 4. Doustne obciążenie Fe (1g FeSO4) 1. Ogólne > związane z niedokrwistością Objawy psychiatryczne > zaburzenia f.poznawcz, depresje, mania, urojenia 2. OUN – parestezje - zaburzenia czucia – ataksja - trudności z chodem – objawy piramidowe > nieprawidłowe odruchy ścięgniste - objawy pozapiramidowe > ↘ napięcia mięśniowego, zaburzenia widzenia/słuchu 5. Przewód pokarmowy > język Huntera, utrata smaku i jak obok Triada objawów 1. Niedokrwistość 2. Żółtaczka 3. Hepatosplenomegalia 1. 2. 3. 4. ↗ OB. I p/c anty-IF ↘ kw foliowego i B12 ↘ kwasowości soku żołąd Test Schillinga (B12 z moczem) 1. 2. 3. 4. 1. ↘ Er 2. ↘ Hb 3. ↘ MCV 4. ↘ MCHC 1. ↘ mikrocytoza 2. ↘ hipochromia 3. Anizocytoza 4. Poikilocytoza 5. Anulocytoza (brak Hb) ↗erytroblasów zasadochłonnych 1. 2. 3. 4. 1. 2. 3. 4. ↘ Er ↗ Hb ↗ MCV ↗ MCHC ↗ Hiperchromia ↗ Makrocytoza ↗ Megalocytoza ↘ leukopenia 1. ↘ Er 2. ↘ Hb (oraz wolna Hb w sur) 3. ? MCV 4. ? MCHC ↗ retukolocytoza >15 promili Początkowo ↗ a potem ↘ (wyczerpanie mechanizmu kompen) Hematopoeza megaloblastyczna ↗ OB. ↗ Fe I bilirubina (z hemolizy) ↘ HPT, cz.życia, oporności osm Test a/globu = odczyn Coombsa Odnowa erytroblastyczna 25 Syderoblastyczna i ch. przewklekłych - X wytwarz. Hemu - gromadzenie Fe w mitochond = syderoblasty pierścieniowate - ↘ hemu w Hb 1. Niedokrwistość 2. Przeładowanie żelazem - osłabienie - ↘ libido - ból stawów 3. Gromadzenie Fe i melaniny w skórze - ↘prod Er ↗ prod cytokin i hepacydyny Przyczyny - zakażenia b/p/g > Fe magazynowane przez kom s-ś wokół zmian - nowotwory złośliwe - ch. autoimmuno > RZS > SLE > układowe zapal naczyń Aplazja szpiku 1. wrodzone a) choroba Fanconiego b) niedokrwistość Blackfana – Diamonda 2. nabyte – toksyczne, polekowe – choroby wirusowe (WZW), bakteryjne (dury) i pasożytnicze (malaria) – w przebiegu nowotworów – postać idiopatyczna 1. Niedokrwistość 2. zakażenia (następstwa leukopenii) > zakażenia i infekcje oportunistyczne jak w AIDS - głownie angina, infekcje migdałkow 3. Skaza krwotoczna małopłytkowa PRCA - wybiórcza aplazja czerwonokrwinkowa - ostra przemijająca - przewklekła ? OB ↗ Fe i ferrytyny Żelazo w szpiku obecne ? OB ↘ Fe ↗ ferrytyna lub N (norma) 1. 2. 3. 4. ↗ OB. Brak retikulocytów Biopsja szpiku > aspirat ubogokom Trepanobiopsja szpiku i ocena histopatologiczna 1. ↘ Er 2. ↘ Hb 3. ↘ lub N MCV 4. ↘ MCHC 1. ↘ Er 2. ↗ Hb (>9g%) 3. ↘ lub N MCV 4. ↘ lub N MCHC 1. 2. 3. 4. 1. 2. ↘ Er ↘ Hb ↘ Leu ↘ płytek krwi Pancytopenia > brak elem morfotycz Względna limfocytoza brak Białaczki i skaza krwotoczna Ostra Przewlekła limfoblastyczna limfoblastyczna (ALL) (CLL) Białaczki Ostra szpikowa (AML) Przewlekła szpikowa (CML) Etiologia Czynniki ryzyka – promieniowanie jonizujące – benzen – chemioterapia – rozpuszczalniki organiczne – herbicydy - 25% białaczek dorosłych - rzadko u dzieci - częściej u mężczyzn - zespół mieloprolif - prom jonizujące - ch22 > ch9, gen BCRABL (kinaza tyrozynowa) - 20% białaczek dorosłych - 75% białaczek u dzieci - klonalne choroby limfoproliferacyjne > wczesne stadia LB/LT Objawy 1. Ogólne - gorączka, osłabienie, nocna potliwość - bole kostno-stawowe 1. Ogólne związane z leukocytozą - ból w prawym i lewym podżebrzu - ↘ masy ciała = ↗ metabolizmu - leukostaza > priapizm = bolesny wzwód > objawy hipoksemii > ból głowy > zaburzenia widzenia 2. Odporność upośledzona - zakażenia - objawy pancytopenii > powiększenie węzłów chłonnych, wątroby, śledziony 3. Niedokrwistość - bladość powłok - objawy skazy krwotocznej małopłytkowej (wylewy podskórne, krwawienia z nos) 4. Tkanki - przerostowe zapalenie dziąseł - zanik skory właściwej 5. OUN > nacieki opon mózgowordzeniowych Badania dodatkowe Morfologia Mielogram/ Leczenie ↗ OB. – rozmaz: obecność komórek blastycznych > komórek białaczkowych, brak form pośrednich - tzw. przerwa białaczkowa 1. ↘ Er 2. ↘ Hb 3. ↗Leu 4. ↘ płytek krwi – 30-100% komórek stanowią kom, białaczkowe Chłoniak Hodkinga = ziarnica złośliwa Szpiczak mnogi Skazy krwotoczne - u dorosłych 65-70 lat - klonalne choroby limfoproliferacyjne – choroba tkanki limfoidalnej; et. nieznana Czynniki ryzyka – związki chemiczne – promieniowanie jonizujące – predyspozycje genetyczne – pochodzi z plazmocytow, w kościach płaskich, długich – produkcja białka monoklonalnego – 14% chorob nowotworowych układu krwiotworczego – częściej występuje u osob starszych i et. nieznana Jak po lewej? ALE częściej występuje powiększenie węzłów chłonnych Ogólne - potliwość, gorączka – spadek masy ciała – powiększone węzły chłonne, wątroba, śledziona - nacieki w skórze – dolegliwości bólowe – kości, objawy hiperkalcemii – objawy neurologiczne – ucisk na korzenie nerwowe – nawrotowe zakażenia drog oddechowych i nerek – niewydolność nerek – zespół nadmiernej lepkości – niedokrwistość – małopłytkowość – niedokrwistość – małopłytkowość 1. objawy ogólne – gorączka – spadek masy ciała – potliwość 2. lokalizacja poza układem chłonnym 3. charakterystyczne cechy a) rozwój w węzłach chłonnych b) komórki Reed, Sternberga, Hodgkina Skazy krwotoczne osoczowe – niedobor osoczowych czynnikow krzepnięcia – hemofilia A – niedobor czynnika VIII, prawidłowa liczba płytek krwi – krwawienia do stawow z mięśni – wykrywalna w badaniach genetycznych – nabyte – zespoły wykrzepiania wewnątrznaczyniowego – zużycie czynnikow krzepnięcia – choroby wątroby Rozpoznanie triada objawow – ↑ plazmocytow w szpiku – ogniska osteolizy w kościach – białko M we krwi i w moczu Skazy krwotoczne płytkowe – zmiana liczby i/lub funkcji płytek – objawy – samoistne krwawienia i wylewy 4. objawy związane z węzłami chłonnymi a) powiększone, twarde, nieprzesuwalne b) powiększenie wątroby i śledziony ↗ OB. - brak przerwy białaczkowej ? OB - rozmaz: limfoblasty > przerwa białaczkowa ↗Leu >100 000/μl ↗ komórek linii neutrofilopoetycznej we wszystkich stadiach ↘ zaham linii erytopoetycznej - chemioterapia - po remisji > allo-HCT lub auto-HCT ↗Leu ↗ przewaga komórek blastycznych ↘ zaham linii erytopoetycznej i megakariocytowej - chemioterapia - przeszczep sz. HCT lub kom macierz Szpik: komórki chłoniakowe u 6% - bad. histopatologiczne - bad. Immunofenotypowe = markery ↗Leu > 30 000/μl – niedokrwistość – małopłytkowość - niedokrwistość lub norma - małopłytkowość - eozynofilia - chemioterapia - radioterapia - inhibitory kinaz BCR-ABL 26 ↗ OB. (3-cyfrowe!) – ↑ plazmocytow w szpiku – hipergammaglobulinemia – białko M we krwi –↘ Leu leukopenia – niedokrwistość normocytowa – małopłytkowość – rulonizacja erytrocytow Skazy naczyniowe – wrodzone lub nabyte – nieprawidłowa budowa ścian naczyń – postaci – plamice – Henocha-Schoenleina – polekowa Diagnostyka – czas krwawienia i krzepnięcia – czas trombinowy i protrombinowy – czas kaolinowo – kefalinowy – liczba płytek krwi – fibrynogen Aplazja szpiku Zanik szpiku. Zaburzenie różnicowania się komórek macierzystych szpiku, co prowadzi do pancytopenii (brak elementów morfotycznych krwi) Przyczyny wrodzone o choroba Fanconiego o niedokrwistość Blackfana – Diamonda nabyte o toksyczne, polekowe o choroby wirusowe (WZW), bakteryjne (dury) i pasożytnicze (malaria) o w przebiegu nowotworów o postać idiopatyczna Objawy niedokrwistość zakażenia (następstwa leukopenii) o zakażenia i infekcje oportunistyczne jak w AIDS - głównie angina, infekcje migdałków skaza krwotoczna małopłytkowa Badania dodatkowe - ↑ OB - morfologia o ↓↓Er o ↓↓ Hb o ↓↓ Leu o ↓↓ płytek krwi - brak retikulocytów - rozmaz krwi obwodowej o względna limfocytoza - biopsja szpiku o aspirat ubogokomórkowy - trepanobiopsja szpiku i ocena histopatologiczna Leczenie przeszczepianie komórek krwiotwórczych (HCT) o przeszczep szpiku kostnego (BMT) o przeszczep macierzystych komórek krwiotwórczych z krwi obwodowej (PBSCT) o – mobilizacja komórek macierzystych ze szpiku do krwi obwodowej za pomocą czynników wzrostu (G-CSF), objaw uboczny – ból kostny izolacja komórek jednojądrzastych z krwi obwodowej za pomocą separatora komórkowego Białaczka złośliwy nowotwór układu krwiotwórczego rozrost jednego klanu komórek wywodzących się z wczesnych stadiów hematopoezy – komórki białaczkowe dominują w szpiku i we krwi obwodowej oraz tworzą nacieki w różnych narządach (np. w kościach – objawy bólowe miejscowe) Białaczki - klasyfikacja ostra białaczka szpikowa (AML) przewlekła białaczka szpikowa (CML) ostra białaczka limfoblastyczna (ALL) przewlekła białaczka limfoblastyczna (CLL) 27 Ostra białaczka szpikowa Etiopatogeneza czynniki ryzyka o promieniowanie jonizujące o benzen o chemioterapia o rozpuszczalniki organiczne o herbicydy Objawy ogólne o gorączka, osłabienie, nocna potliwość związane z upośledzoną odpornością o zakażenia związane z niedokrwistością o bladość powłok objawy skazy krwotocznej małopłytkowej o wylewy podskórne, krwawienia z nosa przerostowe zapalenie dziąseł bóle kostno-stawowe zanik skóry właściwej nacieki opon mózgowo-rdzeniowych objawy pancytopenii o powiększenie węzłów chłonnych, wątroby, śledziony Badania dodatkowe - ↑ OB - morfologia o ↓↓ Er o ↓↓ Hb o ↑↑ Leu o ↓↓ płytek krwi - rozmaz krwi obwodowej o – obecność komórek blastycznych – komórek białaczkowych, brak form pośrednich - tzw. przerwa białaczkowa - mielogram - 30-100% komórek stanowią kom, białaczkowe Leczenie chemioterapia po remisji – przeszczep szpiku o allo-HCT auto-HCT 28 Przewlekła białaczka szpikowa 25% białaczek dorosłych rzadko występuje u dzieci częściej u mężczyzn zespół mieloproliferacyjny – klonalny rozrost prekursorów granulocytów Etiologia znaczenie promieniowania jonizującego u 95% chorych – chromosom Philadelphia o chromosom 22., translokacja genu ABL z chromosomu 9 o – gen BRC-ABL koduje nieprawidłowe białko – kinazę tyrozynową BRC-ABL odpowiedzialną za transformację nowotworową Objawy związane z leukocytozą o utrata masy ciała (↑ metabolizmu) o leukostaza – zaburzenia przepływu krwi w mikrokrążeniu o priapizm – bolesny wzwód – może być pierwszym objawem o objawy hipoksemii, ból głowy, zaburzenia widzenia o ból w prawym i lewym podżebrzu nacieki białaczkowe o skóra, OUN, układ kostny, serce, układ oddechowy Badania krew o znaczna leukocytoza o ↑ komórek linii neutrofilopoetycznej we wszystkich stadiach o ↑ OB szpik o przytłumienie linii erytropoetycznej Leczenie chemioterapia przeszczep szpiku inhibitory kinazy BRC-ABL Ostra białaczka limfoblastyczna nowotwór układu limfopoetycznego występujący głównie u dzieci Objawy częściej występuje powiększenie węzłów chłonnych Badania krew o leukocytoza (limfoblasty), niedokrwistość, neutropenia o rozmaz – limfoblasty, przerwa białaczkowa szpik przewaga komórek blastycznych 29 Przewlekła białaczka limfoblastyczna klonalne choroby limfoproliferacyjne u dorosłych – 65-70 lat Objawy spadek masy ciała potliwość, gorączka powiększone węzły chłonne, wątroba, śledziona Badania krew o o o limfocytoza > 30 000/μl niedokrwistość małopłytkowość Przewlekła białaczka B komórkowa Ziarnica złośliwa - Chłoniak Hodkina choroba tkanki limfoidalnej charakterystyczne cechy o rozwój w węzłach chłonnych o komórki Reed, Sternberga, Hodgkina Etiologia nieznana czynniki ryzyka o związki chemiczne o promieniowanie jonizujące o predyspozycje genetyczne Objawy związane z węzłami chłonnymi o powiększone, twarde, nieprzesuwalne powiększenie wątroby i śledziony objawy ogólne o gorączka o spadek masy ciała o potliwość lokalizacja poza układem chłonnym Badania krew o może być prawidłowa o niedokrwistość o małopłytkowość o eozynofilia szpik o komórki chłoniakowe u 6% chorych badanie histopatologiczne węzłów chłonnych na komórki Reed, Sternberga, Hodgkina badania immunofenotypowe – markery Szpiczak mnogi pochodzi z plazmocytów, w kościach płaskich, długich produkcja białka monoklonalnego 14% chorób nowotworowych układu krwiotwórczego częściej występuje u osób starszych etiologia nieznana 30 Objawy dolegliwości bólowe o kości, objawy hiperkalcemii objawy neurologiczne o ucisk na korzenie nerwowe Badania krew o o o o nawrotowe zakażenia dróg oddechowych i nerek niewydolność nerek zespół nadmiernej lepkości o o o o ↑ OB (3-cyfrowe!) leukopenia niedokrwistość normocytowa małopłytkowość rulonizacja erytrocytów ↑ plazmocytów w szpiku hipergammaglobulinemia białko M we krwi Rozpoznanie triada objawów o ↑ plazmocytów w szpiku o ogniska osteolizy w kościach białko M we krwi i w moczu Skazy krwotoczne skazy krwotoczne o osoczowe stany nadkrzepliwości o o płytkowe naczyniowe Osoczowe niedobór osoczowych czynników krzepnięcia hemofilia A o niedobór czynnika VIII, prawidłowa liczba płytek krwi o krwawienia do stawów z mięśni o wykrywalna w badaniach genetycznych nabyte o zespoły wykrzepiania wewnątrznaczyniowego – zużycie czynników krzepnięcia choroby wątroby Płytkowe zmiana liczby i/lub funkcji płytek objawy o samoistne krwawienia i wylewy Naczyniowe wrodzone lub nabyte nieprawidłowa budowa ścian naczyń postaci o plamica Schönleina-Henocha o Diagnostyka czas krwawienia i krzepnięcia czas trombinowy i protrombinowy czas kaolinowo – kefalinowy 31 polekowa liczba płytek krwi fibrynogen Układ oddechowy Astma Astma Oskrzelowa Zespół charakteryzujący się zmiennym i odwracalnym upośledzeniem drożności dróg oddechowych, któremu najczęściej towarzyszy nadreaktywność oskrzeli. – przewlekła choroba zapalna dróg oddechowych – ponad 70% astmy dorosłych ma początek przed ukończeniem 6 roku życia – tło zapalne polegające na nacieku śluzówki oskrzeli komórkami zapalnymi – eozynofilami – mastocytami – limfocytami T z równoczesnym włóknieniem pod nabłonkiem oskrzeli. Występowanie – genetyczne – próg reaktywności oskrzeli obniżony – skurcz po słabych bodźcach – nadreaktywność oskrzeli – czynnik ryzyka astmy – przewlekłe zaburzenia czynności dróg oddechowych Czynniki ryzyka – atopia – dieta – dym tytoniowy – zakażenia układu oddechowego – zanieczyszczenia powietrza oddechowego Czynnik kluczowy Rozlane, zmienne i odwracalne upośledzenie drożności dróg oddechowych wywołane zapaleniem. Charakterystyka – nadreaktywność oskrzeli – duża zmienność dobowa przepływu powietrza wydechowego – obturacja = skurcz oskrzeli – prawidłowe wdechy, problem z wydechem – komórki zapalne za pośrednictwem mediatorów zapalenia powodują obrzęk ściany oskrzeli i przesiąkanie płynu z naczyń Różnicowanie 1. Mukowiscydoza 2. Zaburzenia odporności 3. Wady wrodzone w obrębie płuc, oskrzeli, układu krążenia 4. Stan po aspiracji ciała obcego 5. Zaburzenia wytwarzania śluzu lub pracy nabłonka rzęskowego Objawy kliniczne 1. Triada objawów – świszczący oddech – duszność napadowa – kaszel z wykrztuszaniem lub bez 2. Ucisk w klatce piersiowej Objawy podmiotowe – tachypnoe = wzrost częstości oddechów – tachykardia (100-120/min) – rozlane świsty w klatce piersiowej – wydłużony wydech – użycie dodatkowych mięśni oddechowych – tętno paradoksalne – nadmierne poty – sinica, ostra kwasica (↑ pCO2) → stany ciężkie Objawy nawracają od młodości Nasilenie wieczorem i nocą Duża dynamika i zmienność objawów klinicznych ↓ jakości życia w czasie zaostrzeń 32 Kryteria rozpoznania większe o astma u rodziców o AZS (atopowe zapalenie skóry) rozpoznane u dziecka przez lekarza o nadwrażliwość na alergeny wziewne mniejsze o obwodowa eozynofilia >4% o nadwrażliwość na pokarmy o świszczący oddech niezwiązany infekcją z Astma u dorosłych najczęściej po zakażeniach wirusowych (świszczący oddech) może pojawić się ciężka, słabo reagująca na leczenie astma narażenie zawodowe o może ustąpić po usunięciu szkodliwego czynnika – atopowa Podział – nieatopowa – aspirynowa Astma Atopowa genetyczna skłonność do produkcji ↑ IgE w odpowiedzi na alergeny obojętne czynniki ryzyka = alergen na który dana osoba jest uczulona narząd docelowy gdzie zachodzi reakcja alergen-IgE = błona śluzowa oskrzeli sezonowość – wiosna/jesień Alergia - zmienna, nadmierna odpowiedź immunologiczna u osób nadwrażliwych, skierowana przeciwko bodźcom zewnętrznym, które u zdrowych ludzi nie wywołują żadnych reakcji Choroby atopowe o katar sienny o alergiczny nieżyt spojówek o IgE-zależna alergia na pokarmy o Atopowe zapalenie skóry (AZS) o Astma atopowa Astma oskrzelowa - mechanizm Reakcja alergenu ze swoistymi IgE przytwierdzonymi na powierzchni komórek tucznych w oskrzelach powoduje uwolnienie o mediatorów skurczu oskrzeli - histaminy i tryptazy → wczesna reakcja bronchospastyczna (rozwija się w ciągu kilku minut i ustępuje po godzinie) o mediatorów zapalenia - leukotrienów i prostaglandyn rozwój procesu zapalnego po 2-3h od kontaktu z alergenem i reakcja późnej fazy, której szczyt przypada po 6-8h; w tej fazie u osoby predysponowanej zapalenie zwiększa jeszcze nadreaktywność oskrzeli i wywołuje częstsze napady duszności o mediatorów chemotaktycznych wabienie innych komórek zapalnych 33 Astma Nieatopowa Czynnik odpowiedzialny za początek choroby u osoby predysponowanej to najczęściej infekcja wirusowa lub bakteryjna zapalenie oskrzeli już nadreaktywnych i objawy duszności astmatycznej Nie jest uwarunkowana genetycznie Niezależnie od patomechanizmu proces zapalny jest odpowiedzialny za ujawienie lub wzrost nadreaktywności oskrzeli, a w konsekwencji wywołuje Charakteryzuje napady duszności Świszczący oddech spowodowany skurczem rozlanym mięśni gładkich i obrzękiem śluzówki oskrzeli Doprowadza to do Obturacji oskrzeli lub zwężenia i ograniczenia przepływu powietrza wydechowego W astmie obturacja oskrzeli ma charakter całkowicie albo w znacznym stopniu odwracalny spontanicznie lub pod wpływem leków rozkurczających Astma Aspirynowa U około 10% chorych na astmę oskrzelową zażycie aspiryny lub innych niesteroidowych leków przeciwzapalnych (NLPZ) wyzwala Napad duszności Niealergiczny wodnisty wyciek z nosa Nastrzyknięcie spojówek oczu Zaczerwienienie skóry twarzy u tułowia zwykle choroba ukryta przez wiele lat częściej występuje u kobiet i zaczyna się zazwyczaj w średnim wieku nie występuje u dzieci i osób bez atopii pojawia się po zażyciu NLPZ lub aspiryny (ok. 10% chorych), które wcześniej były dobrze tolerowane (napad po 1-3h) charakterystyczną cechą aspirynowego nieżytu nosa jest ewolucja w kierunku rozwoju polipów nosa o charakterze mnogim; zajmujących prawie wszystkie zatoki Objawy kliniczne objaw początkowy – uporczywy, nie poddający się antybiotykoterapii wodnisty nieżyt błony śluzowej nosa o charakterze przewlekłym (całorocznym), zazwyczaj towarzyszy mu nasilona blokada nosa oraz nawracające bakteryjne zapalenie zatok silne bóle głowy utrata węchu zaburzenia snu nawracające infekcje górnych dróg oddechowych Po przyjęciu aspiryny lub NLPZ po 0,5-3h dochodzi do napadu astmatycznego towarzyszących objawów ze strony nosa i oczu U niektórych chorych na astmę mogą wystąpić groźne reakcje uogólnione, prowadzące do wstrząsu, a w konsekwencji powikłań do śmierci Błona śłuzowa oskrzeli jest obficie nacieczona przez Eozynofile Aktywne limfocyty T Komórki tuczne 34 Patomechanizm o ↑ leukotrienów cysteinylowych → skurcz oskrzeli, ↑ przepuszczalności naczyń, obrzęk błony śluzowej nosa i oskrzeli, rekrutacja eozynofilów i neutrofilów o ↓ PGE2 (przez NLPZ) która ma ochronny wpływ na oskrzeli, ↓leukotrieny, zapobiega skurczom Rozpoznanie i leczenie o przebieg ciężki o leczenie sterydami (ponad 50% pacjentów) o częste powikłania o podstawowe kryterium rozpoznania = (+) próba prowokacyjna aspiryną o W astmie - spirometria zmienność FEV1 i PEFR (szczytowy przepływ powietrza wydechowego), dobowe wahanie o 20% = charakterystyczne dla astmy o Ocena gazometrii podczas przedłużającego się ataku astmy Przewlekła obturacyjna choroba płuc (POChP) – Przewlekła choroba charakteryzująca się trwałym upośledzeniem drożności oskrzeli (obniżenie FEV1) – Zespół postępującego, słabo odwracalnego upośledzenia przepływu powietrza, które postępuje zwłaszcza u osób nadal palących papierosy – Towarzyszy jej nadreaktywność oskrzeli i trwałe upośledzenie drożności oskrzeli – występuje po 50 roku życia u kobiet i mężczyzn – choroba o małej dynamice, stałe pogarszanie jakości życia, depresja, śmierć około 60 roku życia Patogeneza – palenie – zanieczyszczenie środowiska pracy – infekcje układu oddechowego – palenie bierne do 3 roku życia – nawracające infekcje oskrzelowo-płucne – czynniki klimatyczne – utajona, przetrwała infekcja adenowirusem Dym tytoniowy - mechanizm działania 1) Uwolnienie czynników chemotaktycznych IL-8 i LT B4 2) Zatrzymanie granulocytów w naczyniach włosowatych - selektyny, adhezyny 3) Wędrówka granulocyta do pęcherzyka płucnego i ścian oskrzela - uwolnienie elastazy 4) Niszczenie włókien elastycznych pęcherzyków płucnych 5) ROZEDMA POChP jest zespołem dwóch schorzeń – rozedma płuc + przewlekłe zapalenie oskrzeli – choroba nieuleczalna, inwalidztwo oddechowe Przewlekłe zapalenie płuc Jest to stan związany z występowaniem u chorego kaszlu przez co najmniej 3 miesiące, przez min. 2 lata. przerost gruczołów śluzowych i komórek kubkowych w ścianie dużych oskrzeli z metaplazją nabłonka jednowarstwowego, urzęsionego w wielowarstwowy płaski nacieki komórkowe w ścianie drobnych oskrzeli, przerost mięśni gładkich i włóknienie 35 Podział 1. Proste przewlekłe zapalenie oskrzeli – nie stwierdza się cech skurczu oskrzelowego, np. kaszel palacza 2. Skurczowe przewlekłe zapalenie oskrzeli – okresowo lub stale stwierdza się objawy skurczu 3. Astmatyczne przewlekłe zapalenie oskrzeli – okresowo objawy zbliżone do napadu astmy Rozedma Trwałe powiększenie przestrzeni powietrznych, obwodowych od oskrzelika końcowego – zniszczenie ścian pęcherzyków Następstwa rozedmy utrata sprężystości płuc rozdęcie płuc zniszczenie przyczepów przegród międzypęcherzykowych do ścian drobnych oskrzeli Objawy kliniczne POChP – duszność o stałym charakterze, postępująca, zazwyczaj poranna – wyzwalana często przez zimne powietrze – kaszel z plwociną śluzową lub ropną – przewlekły kaszel – objaw poprzedzający duszność – trudności z oddychaniem – przyspieszony, płytki oddech – świsty – sina skóra – utrata masy ciała – brak łaknienia – stałe pogarszanie stanu chorego Rozpoznanie badanie spirometryczne o nieodwracalny spadek wentylacji płuc o potwierdzenie obturacji o FEV1 = natężona objętość wydechowa o FVC = natężona pojemność życiowa o stosunek FEV1/FVC – wskaźnik Tiffenau (<70% - POChP) Wskaźnik mierzony po 15-20 min. od podanej dawki 2 wdechów Salbutamolu tzw.próba rozkurczowa Przyrost FEV1 (l) < 12% ( po Salbutamolu) (200ml) o badanie w zaciszu choroby, po podaniu salbutamolu – tzw. próba rozkurczowa Badanie przedmiotowe Oddychanie o tor górnożebrowy, używanie dodatkowych mięśni wdechowych (m.szyi) i wydechowych (m.brzucha) o Zapadanie się dolnych żeber podczas wdechu o wydech przez zwężone usta Kl. Piersiowa o Beczkowata o obniżenie dolnych granic płuc o cichy szmer oddechowy o wydech wydłużony,świsty i furczenia o rzężenia(rzadko) Badania dodatkowe – RTG – EKG – cor pulmonale – morfologia, hematokryt – gazometria – pulsoksymetria – wysycenie krwi tętniczej tlenem (norma > 95%) 36 Dwa typy kliniczne a) TYP A - Pink puffer PP- różowy dmuchacz - duża duszność przy niewielkim wysiłku - cechy rozdęcia płuc, dominuje hiperwentylacja - obniżenie masy ciała - prawidłowe PaO2 - serce płucne rzadko,brak sinicy, obrzęków b) TYP B - Blue bloater BB-silny obrzękniety - mała duszność przy wysiłku fizycznym - dobry stan odżywienia - sinica, obrzęki - hipoksemia,hiperkapnia - senność,apatia - cechy serca płucnego - Najczęściej jest typ mieszany łączący cechy A i B Najczęściej występuje typ mieszany łączący cechy A i B (C) POChP - Mała dynamika choroby i narastanie objawów - Stałe pogorszenie jakości życia - Niewydolność oddechowa po 60 r.ż. - Depresja! Zaostrzenie POChP – nasilenie duszności – bardziej ropny charakter plwociny – wzrost objętości plwociny – konieczna antybiotykoterapia Ostre zapalenie oskrzeli Przyczyny – zakażenie wirusowe – zakażenie bakteryjne – zakażenie mykoplazmatyczne – osłabienie organizmu – oziębienie – drażnienie dróg oddechowych (dymy) Zmiany zapalne mogą dotyczyć dróg oddechowych na całej długości lub ich części. Objawy kliniczne – gorączka (nie musi wystąpić) – kaszel – suchy, najczęściej w nocy, nieproduktywny kaszel szczekający w zapaleniu tchawicy – chrypka i bezgłos – występuje w zapaleniu krtani, elementem leczenia jest niemówienie i niepodawanie Ca (działanie wysuszające) – – – – – skąpe wykrztuszanie świsty, furczenia, szmery stan astmatyczny (u dzieci z zapaleniem oskrzelików) osłabienie bóle mięśniowe 37 Rak płuca nowotwór nabłonkowy wywodzący się z błony śluzowej oskrzela (najczęściej wywodzi się z oskrzeli dużych) najczęściej występujący nowotwór u mężczyzn, coraz częściej chorują kobiety i młodzież obu płci najczęściej występuje w wieku około 50r.ż przyrost zachorowań w wieku 30-40lat kilka różnych typów morfologicznych i biologicznych Ustalenie typu histologicznego = podstawowe znaczenie w planowaniu leczenia! Planowanie leczenia zależy od: – typu histologicznego (jego ustalenie ma podstawowe znaczenie) – stopnia zaawansowania choroby – stanu fizycznego chorego Przyczyny 1) palenie papierosów ( związek u 80-90% chorych), w mniejszym stopniu fajek 2) narażenie zawodowe (koksownie, gazownie, zakłady azbestowe, kopalnie Ni/Cu/U) 3) zanieczyszczenie powietrza (pył węglowy, spaliny silników, zanieczyszczenia przemysłowe) 4) predyspozycje genetyczne (wzrost stężenia enzymu metabolizującego węglowodory w płucach) Objawy 1. płucne a. kaszel suchy, potem z plwociną b. zapalenie płuc nawracające, z charakterystycznym nasileniem stanu zapalnego i remisją po leczeniu objawowym, związane z zaburzoną wentylacjąi zastojem wydzieliny c. duszność alarmująca chorego, gdy pojawia się nagle, stopień duszności jest różny, ustępuje przy remisji stanu zapalnego d. ból w klatce piersiowej wywołany przez podrażnienie zaatakowanego oskrzela, objaw częsty, nasila się przy kaszlu, zależy od umiejscowienia guza e. stany podgorączkowe do 37,5* f. krwioplucie wynik owrzodzenia błony śluzowej nabłonka oskrzela, dopiero okresowe krwioplucie jest objawem patognomicznym dla raka 2. związane z uciskiem na węzły chłonne śródpiersiowe (znaczne zaawansowanie choroby) a. chrypka nacieczenie lub ucisk nerwu błędnego b. zespół żyły głównej górnej ucisk przez pakiety zmienionych węzłów chłonnych utrudniający odpływ krwi z górnych części ciała pacjent jest czerwony c. obrzęki twarzy, szyi, kończyn górnych → duszność d. dysfagia nacieczenie przełyku, trudności w przełykaniu 3. ogólne a. spadek masy ciała b. spadek energii c. senność 4. d. e. f. znużenie apatia objawy wegetatywne pozapłucne przedmiotowe i podmiotowe, z daleka od umiejscowienia guza pierwotnego lub przerzutów a. zespoły hormonalne wydzielanie ektopowe hormonów przez raka płuca (PTH, ACTH) b. neuromiopatie zaburzenia czucia, drętwienia, paraplegie, niedowłady, drżenia c. objawy kostne pałeczkowatość palców rąk, ból d. nadkrzepliwość zapalenie żył e. objawy skórne pokrzywki, czyraki, wysypki grudkowe, zaczerwienienia, owrzodzenia, zmiany troficzne f. objawy hematologiczne - ↑ Leu, ↓Er, obraz morfologii jak w białaczce 38 Rozpoznanie – badanie cytologiczne plwociny – badanie cytologiczne wydzieliny oskrzelowej lub punktatu guza – badanie histologiczne wycinka – badanie histologiczne węzła pobranego w mediastinoskopii – badanie mikroskopowe preparatu operacyjnego – biopsja ogniska przerzutowego Postępowanie Bez morfologicznego potwierdzenia nie ma rozpoznania! Mówimy wtedy jedynie o podejrzeniu. – wywiad – rola decydująca w rozpoznaniu, na jego podstawie można podejrzewać, gdy brak jest objawów klinicznych – badanie fizykalne – w okresie zaawansowanym nie wnosi wiele do rozpoznania, niezbędne przy podejrzeniu – RTG klatki piersiowej – AP + boczne, ewentualnie z papką barytową w przełyku – RTG-skopia – TK, NMR – bronchoskopia, bronchografia, mediastinoskopia – badanie cytologiczne plwociny – biopsja cienkoigłowa – przydatna w guzach obwodowych – biopsja Daniels'a = mediastinoskopia mięśnia pochyłego szyi wykonywana u chorych z powiększonymi węzłami chłonnymi w okolicy twarzy Podział Typy podstawowe 1. Płaskonabłonkowy 2. Drobnokomórkowy 3. Gruczolakorak 4. Wielkokomórkowy 2-4% wszystkich 5. Rakowiak 6. Gruczołowo-płaskonabłonkowy 7. Rak z gruczołów odoskrzelowych Rak płaskonabłonkowy - do 50% przypadków - umiejscowienie-przywnękowe - wzrasta wewnątrz- i zewnątrz oskrzelowo - charakterystyczne-szerzenie się drogą bezpośredniej inwazji - w wyniku zwężenia oskrzela=niedodma z zapaleniem Objawy kliniczne: charakterystyczny kaszel z odkrztuszaniem(z powodu upośledzenia drożności oskrzela), duszność, wzrost temperatury,częste zapalenia płuc, stosunkowo częste krwioplucie. Przerzuty: częste, stosunkowo późne,głównie do kl.piersiowej.Typ najlepszy co do rokowania. Leczenie: głównie operacyjne. 39 Rak drobnokomórkowy - 20-25% przypadków - najczęściej występuje przed 40 r.ż. - umiejscowienie:przywnękowe,ektopowo wydziela hormony polipeptydowe =rozmaite zespoły hormonalne - u większości chorych objawy kliniczne nie przekraczają 3 m-cy i zależą głównie od ucisku Objawy kliniczne:duszność i ból w kl.piersiowej,zespół żyły głównej górnej. - Mniejsza tendencja do uniedrożnienia oskrzela od wewnątrz. Przerzuty:drogą chłonną do kl.piersiowej i krwiopochodną do OUN, wątroby, trzustki, nadnerczy.Wielka złośliwość ! Leczenie: głównie chemioterapia, operacyjne- ograniczone Gruczolakorak -15-20% przypadków -często występuje u młodych mężczyzn -umiejscowienie:obwodowe=objawy kliniczne nie są wyraźne -niejednokrotnie dopiero pojawienie się przerzutu prowadzi do wykrycia raka płuca -mnogość podtypów histologicznych Przerzuty: drogą krwiopochodną do wątroby, mózgu,nerki,płuca przeciwległego WYRÓŻNIĆ należy podtyp-rak oskrzelowo-pęcherzykowy -występuje u osób przed 30 r.ż ( zarówno u kobiet jak i mężczyzn) -umiejscowienie:obwodowe, nacieka opłucną trzewną, o dużej wielopostaciowości WYKRYWANY RTG u osób bez objawów klinicznych! -przerzuty przez nacieczenie do płuca przeciwległego,wątroby, mózgu,kości Rak wielkokomórkowy - 10% przypadków - umiejscowienie: obwodowe i przywnękowe - mało zróżnicowany - często nacieka opłucną - bardzo szybki wzrost=wcześnie przerzuty do śródpiersia Pojęcie w/w raka obejmuje guzy bez cech płaskonabłonkowych lub gruczołowych 40 Niewydolność oddechowa Termin zbiorczy dla wielu zjawisk dotyczących nie tylko układu oddechowego, lecz wielu zaburzeń ogólnoustrojowych pogorszenie wymiany gazowej. Zaburzenia oddychania, oprócz zaburzeń oddechowych (odma, rozedma, zapalenia) związane są także z: – niewydolnością krążenia – chorobami neurologicznymi – zmianami starczymi – zmianami w aparacie kostno-mięśniowym klatki piersiowej Definicja Jest to stan pogorszenia wymiany gazowej w płucach, w którym dochodzi do hipoksemii (spadek pO2) lub hipoksemii z hiperkapnią (wzrost pCO2 we krwi tętniczej). Jedyną pewną metodą rozpoznawania niewydolności oddechowej jest badanie gazometryczne krwi tętniczej lub kapilarnej Tło fizjologiczne – depresja układu oddechowego – upośledzenie czynności oddechowej (zatrucia, guzy mózgu) – porażenie lub osłabienie mięśni oddechowych lub nerwów (zapalenie przednich rogów rdzenia) – zaburzenia stabilności klatki piersiowej (urazy, choroby płuc, opłucnej, oskrzeli) – nadmierna praca oddechowa (wzrost oporów przepływu tkanek, wzrost zapotrzebowania wentylacyjnego) – zaburzenia stosunku wentylacji płuc do ich perfuzji (przeciek krwi w wadach serca, wzrost przestrzeni martwej) – pogorszenie transportu tlenu przez krew – złe wykorzystanie tlenu przez tkanki Podział na podstawie wymiany gazowej · Typ I – niewydolność oddechowa częściowa – hipoksemiczna - hipoksemia pO2< 60 mmHg · Typ II – niewydolność oddechowa całkowita - hipoksemia pO2< 60 mmHg oraz hiperkapnia pCO2> 45 mmHg Podział na podstawie mechaniki oddychania 1. Zaporowa (obturacyjna) = skutek zmniejszenia sprężystości tk. płucnej lub zwężenia oskrzeli (albo obu przyczyn) zwężenie światła oskrzeli z powodu zalegania wydzieliny wysięku (stany zapalne) lub procesu nowotworowego stany kurczowe oskrzeli (astma, spastyczny nieżyt oskrzeli, POCHP) ucisk na oskrzele z zewnątrz (nowotwory) ciała obce zmniejszona lub prawidłowa pojemność życiowa mała natężona objętość wydechowa 1-sekundowa 2. Ograniczająca(restrykcyjna) = Charakteryzuje się ograniczeniem rozprężania płuc , choroby śródmiąższowe płuc zmiany płucne (zwłóknienia)= kolagenozy, sarkoidoza, przewlekłe ś. zapalenie płuc, zapalenie oskrzelików, zapalenia naczyń etc. zmiany opłucnej (zrosty, odma, wysięk) zmiany w kl.piersiowej (urazy, złamania żeber) zespół błon szklistych (ARDS) miastenia twardzina układowa porażenie nerwów międzyżebrowych i przeponowych mała pojemność życiowa płuc natężona objętość wydechowa1-sekundowa 41 Podział ze względu na czas wystąpienia objawów 1. Ostra Zaburzenia występują w ciągu: = minut -zator tętnicy płucnej, odma opłucnej, ciało obce = godzin-stan astmatyczny = dni- ostra niewydolność oddechowa dorosłych ARDS Potencjalnie odwracalna Objawy towarzyszące - silna duszność i sinica 2. Przewlekła Zaburzenia występują w ciągu kilku miesięcy lub lat: = kolagenozy,choroby śródmiąższowe płuc,POCHP, zmiany w odcinku piersiowym kręgosłupa(nadmierna kifoza piersiowa, skoliozy,złamania kręgosłupa), choroby mięśni lub układu nerwowego (miastenia,SM) Nie jest w pełni odwracalna dotyczy zaawansowanych chorób płuc. Postępowanie: 1) Usunięcie przyczyny 2) Podanie tlenu 3) Korygowanie pH (wodorowęglany lub oddychanie mechaniczne) 4) Zwalczenie skurczu oskrzeli 5) Rozrzedzenie i usunięcie wydzieliny oskrzelowej (odsysanie, nawadnianie, KI) 6) Zwalczenie infekcji (antybiotyk) 7) Zwalczenie niewydolności krążeniowej (leki nasercowe i moczopędne) Leczenie Poprawa wentylacji Poprawa utlenowania Wyprowadzenie ze wstrząsu Opanowanie zaburzeń rytmu 42 Układ krążenia Czynniki ryzyka chorób układu krążenia: 1. płeć (ochronne działanie estrogenów) 2. wiek (K > 55 r.ż. , M > 65 r.ż) 3. palenie tytoniu 4. zaburzenia lipidowe (dyslipidemia: podwyższone stężenie LDL, TAG, zmniejszone stężenie HDL) 5. wzrost stężenia CRP, fibrynogenu, LpA 6. niskie stężenie witaminy D 7. hiperhomocysteinemia 8. nadciśnienie tętnicze ( > 140/90, choć jeśli wspólistnieją inne czynniki ryzyka, wartocs ta wynosi 130/85) 9. zaburzenia gospodarki węglowodanowej (odporność insulinowa) 10. otyłość (brzuszna); BMI > 30 (25-30 → nadwaga) 11. nieprawidłowe odżywianie 12. siedzący tryb życia, mała aktywność fizyczna 13. stres, depresja 14. obciążenie rodzinne chorobami układu krążenia (brat, ojciec < 55 r.ż ; siotra, matka > 65 r.ż) 15. obecność choroby sercowo-naczyniowej lub innej na podłożu miażdżycy 16. PCOS u kobiet (zespół policystyczny jajników) 17. Markery: adiponektyna, leptyna, insulina, proinsulina, WKT, PAI-I, ALT, IL-6 Estrogeny i choroby układu krążenia - Bezpośredni wpływ estrogenów na naczynia zwiększona synteza NO działanie naczyniorozszerzające - korzystny wpływ na profil lipidowy - wzrost cholesterolu HDL - spadek cholesterolu całkowitego i LDL - korzystny wpływ na gospodarkę węglowodanową, a ich niskie poziomy sprzyjają hiperglikemii i insulinooporności - efekt antyoksydacyjny (zahamowanie oksydacji LDL) - terapia hormonalna obniża glikemię na czczo i poprawia wrażliwość insulinową Zwiększone ryzyko chorób układu krażenia u kobiet występuje przez: menopauzę przedwczesne wygaśniecie funkcji jajnikow PCOS (sprzyja rzowojowi odporności insulinowej, dyslipidemii, cukrzycy, zespołowi metabolicznemu) LDL cholesterol – cholesterol o niskiej gęstości, „zły” - frakcja odpowiedzialna jest za powstawanie blaszki miażdżycowej (<135mg.dl, 3.5mmol/l) HDL cholesterol - dobry cholesterol o wysokiej gęstości, usuwa cholesterol z blaszek miażdżycowych i transportuje do wątroby, gdzie ulega wydzieleniu i reutylizacji M > 40 mg/dl . >0,9 mmol/l K > 50 mg/dl , > 1,3 mmol/l Dyslipidemia niski HDL podwyższony LDL hipertriacyloglicerolemia 43 Otyłość Otyłość brzuszna (centralna, trzewna, androidalna ) → nadmierna ilość tkanki tłuszczowej w okolicy jamy brzusznej jest czynnikiem rozwoju chorób układu krążenia Ocena stopnia otyłości WHR = obwód w pasie K>0.85, M:>0.95 czulszy i niezależny od BMI wskaźnik oceniający otyłość obwód w talii/obwód w biodrach osobnik szcupły metobolicznie chory (prawidłowe BMI, nieprawidłowe WHR) osobnik otyły metabolicznie chory (nieprawidłowe BMI i WHR) BMI = Waga/wzrost2 o 20-25 norma o >25 nadwaga o >30 otyłość o 35-40 otyłość patologiczna Ciśnienie tętnicze optymalne < 120/80 mmHg prawidłowe 120-129/80-84 mmHg wysokie prawidłowe 130-139/85-89 mmHg DYSFUNKCJA ENDOTELIUM Czynniki uszkadzające śródbłonek 1. hiperglikemia 2. zmodyfikowane lipoproteiny LDL (oxy-LDL) 3. uszkodzenie mechaniczne (nadciśnienie tętnicze) 4. dym tytoniowy 5. wolne rodniki 6. adipocytokiny (leptyna, TNF-α, rezystyna, adiponektyna) Dysfunkcja endotelium często kojarzy się z otyłością, stanami zapalnymi czy opornością insulinową. Sródbłonek produkuje 1. tlenek azotu NO ◦ działanie wazodylatacyjne ◦ przeciwzakrzepowe ◦ antyproliferacyjnie ◦ syntezowany z L-argininy pod wpływem syntazy NO 2. prostacyklina 3. bradykinina 4. PGE2 5. Adiponektyna 6. Trombomodulina 7. Czynnik Von Willebranda 8. PAI-1 Dysfunkcja - zachwianie równowagi pomiędzy czynnikami działającymi ochronnie (wazodilatatory) a związkami o działaniu naczyniokurczącym (adenozyna, aminy katecholowe, agiotensyna II, endotelina). Osłabiona jest również działalność antykoagulacyjna. Skłonność prozakrzepowa. 44 Endotelium – aktywny udział w odpowiedziach immunologicznych uwalnianie czynników zapobiegającym stanom zapalnym dysfunkcja endotelium – wzmożona ekspresja molekuł adhezyjnych Dysfunkcja endotelium - występowanie CHNS - choroba niedokrwienna mięśnia sercowego zawał mięśnia sercowego nadciśnienie tętnicze otyłość palenie papierosów cukrzyca hiupercholesterolemia zespół metaboliczny oporność insulinowa stany zapalne depresje starzenie się po menopauzie Dysfunkcja endotelium wynikająca z uszkodzenia śródbłonka prowadzi do rozwoju miażdżycy. W wyniku dysfunkcji dochodzi do: obkurczenia naczynia tworzenia zakrzepu adhezji aktywowanych makrofagów, miocytów, limfocytów T przerostu i proliferacji komórek mięśniówki gładkiej odkładaniu lipidów (makrofagi przekształcają się w komórki piankowate) Remodeling – przebudowa drobnych tętniczek oporowych Zespół metaboliczny Obejmuje: - dyslipidemię - nadciśnienie tętnicze - oporność insulinową - otyłość brzuszną Rozwija się u osób z predyspozycjami genetycznymi, brakiem aktywności fizycznej, otyłością, złą dietą. Czynniki prowadzące do zespołu metabolicznego (przynajmniej 3 - obwód talii + 2) obwód w talii (M>94cm, K>80cm) TAG (>150mg/dl), HDL (M<40mg.dl, K<50mg/dl) Ciśnienie tętnicze RR > 130/85 mmHg glikemia na czczo (>100mg/dl ; >5,6 mmol/l lub cukrzyca typu II) Zespół metaboliczny prowadzi do rozwoju: choroby wieńcowej zawału serca cukrzycy nowotworów (rak prostaty, jelita grubego, piersi) chorób naczyniowych mózgu niepłodności u kobiet dysfunkcji mitochondriów i tkanki tłuszczowej zmian w produkcji leptyny i adiponektyny Oraz prawdopodobnie do nadciśnienia tętniczego, otyłości, insulinooporności, dyslipidemii Po menopauzie zmienia się masa i rozmieszczenie tkanki tłuszczowej (wpływ estrogenów i androgenów) 45 Choroba niedokrwienna serca Zespół objawów chorobowych będących następstwem przewlekłego niedostatecznego zaopatrzenia komórek mięśnia sercowego w tlen. Zachwianie równowagi między zapotrzebowaniem mięśnia sercowego na tlen i możliwością dostarczenia tlenu do mięśnia. Przyczyny: 1. Wieńcowe Zmiany organiczne Skurcz naczynia Objawy 1. Brak objawów - nie ma niedotlenienia 2. Dusznica bolesna 2. Pozawieńcowe zmiany organiczne skurcz naczynia przerost mięśnia sercowego niedokrwistość 3. Duszność 4. Zawał mięśnia serocwego 5. Arytmia 6. Dysfunkcja lewej niewydolność krążenia komory, Dusznica bolesna (bóle wieńcowe) Ból trwa krótko, w większości przypadków czas trwania nie przekracza 10 minut, ale zwykle jest krótszy. Ważną cechą jest jego powiązanie z wysiłkiem, określonymi czynnościami lub stresem Stosunek do wysiłku - objawy zwykle nasilają się wraz ze zwiększonym wysiłkiem, np. chodzeniem po schodach lub pod wiatr i znikają w ciągu kilku minut, kiedy wysiłek ulegnie zmniejszeniu Inne czynniki - zaostrzenie objawów po ciężkostrawnym posiłku lub porannej toalecie. Nitraty (nitrogliceryna) podjęzykowe najczęściej szybko łagodzą objawy dławicy Ból spowodowany niedokrwieniem mięśnia sercowego najczęściej jest umiejscowiony w klatce piersiowej, blisko mostka, ale może być także odczuwany w innej okolicy od nadbrzusza do żuchwy, pomiędzy łopatkami lub też w którejkolwiek kończynie górnej aż do nadgarstka i palców. Opisywań jest zwykle, jako ucisk lub ciężkość (nie jest to ból „przeszywający”), czasem dławienie, ściskanie lub pieczenie. Objawom bólowym może towarzyszyć krótki (spłycony) oddech, uczucie zmęczenia, osłabienia, mdłości, czkawka, niepokój lub strach przed śmiercią. WYWIAD, metody rozpoznania CHNS a) Badania nieinwazyjne Spoczynkowy elektrokardiogram 12-odprowadzeniowy Prawidłowe spoczynkowe EKG – często – taki zapas nie wyklucza niedokrwienia Obniżenie odcinka ST w trakcie niedokrwienia! EKG wysiłkowe Wentrikulografia izotopowa Zapis EKG 24 godz - Holter (nieme niedokrwienie) PET b) Badania inwazyjne Angiografia wieńcowa - koronografia Blaszki miażdzycowe: stabilne – maja gruba pokrywę włóknistą, są często uwapnione, nie są podatne na rozerwanie o znaczne przewężenie światła – bóle odczuwalne, ale brak zagrożenia zawałem niestabilne – cienka pokrywa włóknista, nie są uwapnione, przepełnione cholesterolem, są miękkie i pod wpływem czynnika uszkadzającego łatwo ulegają pęknięciu; na ioch bazie rozwija się niestabilna choroba wieńcowa bądź też zawal mięśnia sercowego o nieznaczne przewężenie światla – bóle mogą być nieodczuwalne, ale po pęknięciu może dojść do rozwoju zawału mięśnia sercowego 46 Zwężenie tętnic wieńcowych R - średnica światła tętnicy ; P - pole przekroju a) Nieistotne - R < 50% ; P < 75% - bez objawów, spoczynkowy przepływ wieńcowy niezmieniony b) Istotne - R = 50-80% ; P = 75-90% - rezerwa wieńcowa jest zmniejszona i dlatego wysiłek fizyczny może dawać objawy dławicy piersiowej = bóle! c) Krytyczne - R > 80% ; P = >90% - objawy w spoczynku Inne niż stabilna dławica piersiowa przyczyny bólu w klatce piersiowej: sercowo-naczyniowe: rozwarstwienie aorty, zator tętnicy płucnej, zapalenie osierdzia żołądkowo-przełykowe: refluks żołądkowo-przełykowy, zapalenie przełyku, pęknięcie przełyku, przepuklina rozworu przełykowego, choroba wrzodowa żołądka oddechowe: zapalenie płuc, zapalenie opłucnej, odma opłucnowa, odma śródpiersia mięśniowo-szkieletowe: zapalenie części chrzęstnych żebrem, złamanie żeber, bóle mięśni międzyżebrowych lub obręczy barkowej, kompresyjne złamania kręgów psychogenne: ból o charakterze czynnościowym inne choroby: dróg żółciowych, ostre zapalenie trzustki, półpasiec Charakterystyka bólu niedlawicowego może obejmować jedynie niewielka część lewej klatki piersiowej i utrzymywać się nawet przez kilka godzin lub nawet dni; zwykle nie zmniejsza się po zażyciu nitrogliceryny, a może być wywołana badaniem palpacyjnym (neuralgie międzyżebrowe) Ostre zespoły wieńcowe bez uniesienia odcinka ST bez martwicy mięśnia sercowego niestabilna choroba wieńcowa z martwicą zawał z uniesieniem odcinka ST z martwicą STEMI Ostry zespól wieńcowy rozwija się gdy obserwujemy: pęknięcie blaszki wzajemne oddziaływanie stanu zapalnego zwiększona aktywność pozakrzepowa Dochodzi do: 1. ↑ CRP 2. Stan prozapalny = TNF-α, IL-6, IL-8 3. Stan prozakrzepowy (rośnie fibrynogen, PAI-1) 4. Dysfunkcja endotelium 5. ↓ NO, ↑ ET-1 (endoteliny-1) 6. ↑ ekspresja cząsteczek adhezyjnych 7. ↑aktywności makrofagów Czynnikiem patogenetycznym w rozwoju ostrych incydentów wieńcowych jest skrzeplina powstająca w miejscu pęknięcia blaszki miażdżycowej 47 Ostry zespół wieńcowy obejmuje różne stany kliniczne Niestabilna dławica piersiowa ↓ ST (pęknięcie blaszki, zamykanie światła naczynia) Zawał mięśnia sercowego bez uniesienia ST (zamknięcie światła naczynia) Zawał mięśnia sercowego z uniesieniem ST Objawy OZW Silny ból zamostkowy (stenokardialny), niereagujący na nitraty W niestabilnej chorobie wieńcowej nie dochodzi do martwicy mięśnia sercowego (brak wzrostu aktywności enzymów świadczących o martwicy) W zawale mięśnia sercowego dochodzi do martwicy mięśnia sercowego (wzrost aktywności enzymów świadczących o martwicy) Skrzepliny białe – bogate w płytki (przyczyna ostrego niedokrwienia) tylko częściowo zwężają światło - skutek aktywacji płytek czerwone – bogate we włóknik (przyczyna zawału) - skutek osoczowej aktywacji i krzepnięcia Niestabilna blaszka ulega pęknięciu, powstaje skrzeplina. Nie zamykający światła naczynia skrzep prowadzi do niedotlenienia - bóle w klatce piersiowej w trakcie spoczynku. Pełne zamknięcie prowadzi do zawału serca (śmierć komórek). Aby ocenić czy jest martwica robimy EKG i koronografię. Markery biochemiczne zawału serca - makrocząsteczki uwalniane z mięśnia sercowego na skutek uszkodzenia/ śmierci komórek mioglobina (2-24h) CK-MB (kinaza kreatynowa, frakcja sercowa) (4-48h) ◦ enzym cytoplazmatycznyc - względnie szybkie uwalanienie do soocza po zniszczeniu miocytów (4-6 godzin.) ◦ okres półtrwania w osoczu (wartości normalne w ciąge 72-96 godz.) ◦ niespecyficzny dla serca! (Występuje w mięśniach szkieletowych, innych tkankach; szczególnie problematyczny w chorobach mięsnie, u maratończyków troponiny sercowe (2h - 4 dni) T i I = złoty środek ◦ większa czułość i swoistość niż dla CK-MB ◦ mała czułość w pierwszych godzinach (<6 godz.), powtórka po 8 godz., jeśli wynik ujemny Zmiany w EKG w ostrych zespołach wieńcowych: w niestabilnej chorobie wieńcowej dochodzi do obniżenia odcinka ST, mogą występować również głębokie, ujemne załamki T w zawale dochodzi do uniesienia odcinka ST, rozwija się tzw. fala Pardiego (V2 i V3), ulega poszerzeniu i pogrubieniu załamek Q, występują często wysokie szpiczaste załamki T; po upływie kilku dni rozwija się zespół QS (dziura elektryczna, po obecności, której możemy rozpoznać przebyty w przeszłości zawał mięśnia sercowego) 48 Zawał mięśnia sercowego martwica komórek mięśnia sercowego na określonym obszarze serca wywołana ostrym niedokrwienie. Śmierć komórek nie następuje natychmiast. Do całkowitej martwicy wszystkich zagrożonych kardiomiocytów dochodzi, co najmniej po upływie 46godzin lub później, w zależności od obecności dopływu krwi do niedokrwionej strefy przez krążenie oboczne, trwałego lub przerywanego zamknięcia tętnicy wieńcowej oraz wrażliwości komórek. Wyłączenie niedokrwionego obszaru z czynności kurczliwej. Upośledzenie pracy serca, jako pompy. Nie dojdzie do martwicy, jeśli zdąży rozwinąć się krążenie oboczne. Objawy: ból w klatce piersiowej (80%) - w okolicy zamostkowej (bezbólowe u np. cukrzyków), o charakterze ucisku, rozpierania, ściskania, promieniuje do lewej okolicy przedsercowej, żuchwy lub lewego ramienia tachykardia (60%) spadek RR (60%) nudność/wymioty (40%) bradykardia (30%) zastój żylny (30%) Powikłania arytmie – 85% wstrząs kardiogenny – 15% pęknięcie/tamponada serca – 1-2% tętniak pozawałowy niewydolność mięśnia sercowego późne powikłanie = zespół Dresslera (zapalenie osierdzia o przyczynie autoimmunologicznej, które doprowadza do gromadzenia się płynu w jamie osierdzia, pojawia się ból) niewydolność mięśnia sercowego zaburzenie rytmu ostra niewydolność lewokomorowa ostra hipotonia zastoinowa niewydolność lewokomorowa skrzepliny w lewej komorze serca Wstrząs kardiogenny - Zespół objawów wynikających z hiperperfuzji tkanek, co prowadzi do niedostatecznego dostarczania tlenu do komórek jest wynikiem dysproporcji między przepływem krwi przez tkanki a zapotrzebowaniem ustroju we wstrząsie dochodzi do ▪ niedotlenienia tkanek ▪ niewystarczającego odżywienia tkanek ▪ zaburzeń usuwania z tkanek produktów przemiany materii ▪ zachwiania podstawowych funkcji życiowych. We wstrząsie dochodzi do upośledzenia przepływu krwi przez ważne dla życia narządy (mózg, serce, płuc, wątroba, nerki). Rozwija się hipoksja i kwasica metaboliczna. 49 Przyczyny wstrząsu kardiogennego 1. Tachyarytmia 2. Zapalenie mięśnia sercowego 3. Uszkodzenie zastawek 4. Nagromadzenie płynu w worku osierdziowym 5. Zawał serca 6. Zator tętnicy płucnej Patofizjologia wstrząsu kardiogennego: uszkodzenie mięśnia zmniejszenie rzutu spadek ciśnienia tętniczego, zmniejszona perfuzja tkanek aktywacja baroreceptorów wzrost aktywności układu współczulnego (mechanizm kompensacyjny mający na celu utrzymać prawidłowy przepływ krwi kosztem niedokrwienia skóry, mięśni, nerek) obkurczenie tętniczek (nie dochodzi do tego w sercu, mózgu i płucach) niedokrwienie tkanek Wstrząs - mechanizm kompensacyjny Wzrost aktywności układu współczulnego Uwalnianie katecholamin o Obkurczenie tętniczek w obrębie skóry, jelit, mięśni o Utrzymany przepływ przez OUN, serca, płuca Objawy kliniczne: początkowo niepokój, później apatia skóra blada i chłodna, pokryta kroplami potu szybki oddech niskie ciśnienie tętnicze (skurczowe poniżej 80-90), później ciśnienie nieoznaczalne tony serca ciche, niemiarowe tętno bardzo szybkie oddech przyspieszony zmniejszona diureza (produkcja i wydalanie moczu - skąpomocz <20 ml/godz) Niewydolność krążenia - patologiczne zmniejszenie przepływu krwi przez tkanki pochodzenie sercowe, obwodowe Niewydolność mięśnia sercowego - zespół objawów patofizjologicznych i klinicznych wywołanych upośledzeniem funkcji serca jako pompy hipoperfuzja tkanek obwodowych Podział a) ostra/przewlekła b) lewokomorowa/prawokomorowa c) skurczowa (słabiej się kurczy, EF <40%)/rozkurczowa (upośledzona rozkurcz, przerost LK, EF w normie) Przyczyny: choroba niedokrwienna serca (lewokomorowej) zaburzenia rytmu serca zawał mięśnia sercowego wrodzona wada serca nadciśnienie tętnicze (lewokomorowej) wady zastawkowe cukrzyca blizna (np. pozawałowa) kardiomiopatia rozstrzeniowa, przerostowa upośledzenie mikrokrążenia sercowego 50 Reakcje ogólnoustrojowe w niewydolności mięśnia sercowego Aktywacja układu współczulnego Aktywacja układu RAA Wzmożona sekrecja wzopresyny Upośledzenie czynności serca jako pompy i hipoperfuzja tkanek Stymulacja układu sympatycznego Zwiększona siła skurczu mięśnia sercowego Zwiększony rzut Zwiększona częstotliwość akcji serca Poza sercem - dystrybucja krwi do serca, mózgu, płuc Stymulacja układu RA (renina-angiotensyna) Zmniejszony przepływ krwi przez nerki o Stymulacja receptorów B o Produkcja reniny o Przemiana angiotensynogenu o Angiotensyna I angiotensyna II Niewydolność lewokomorowa uszkodzenie miocytów lewej komory komora nie opróżnia się całkowicie/mniej krwi jest pompowane w trakcie skurczu LK początkowo mięsień kurczy się z większa siła (prawo Sterlinga) w miarę upływu czasu kurczliwość maleje krew zalega w jamie lewej komory (powiększenie sylwetki serca) wzrost ciśnienia późnorozkurczowego w LK gromadzenie krwi w lewym przedsionku zastój krwi w krążeniu płucnym Objawy kliniczne: duszność ◦ wysiłkowa ◦ w spoczynku ◦ w pozycji leżącej ◦ niekiedy występuje w postaci napadowej duszności nocnej (przebudzanie, nie potrafi spać na płasko, podkłada sobie dużo poduszek, prawie w pozycji półsiedzącej) osłabiona tolerancja wysiłku Badanie przedmiotowe tachykardia tachypnoe (oddech Cheyne Stokesa) osłuchiwaniem: trzeszczenia i rzężenia drobnobańkowe (ze względu na zastój płynów w krążeniu płucnym) kacheksja (wyniszczenie) Klasyfikacja kliniczna niewydolności mięśnia sercowego klasa I – bez ograniczeń aktywności fizycznej, zwykła aktywność nie powoduje zmęczenia, duszności i kołatania serca klasa II – niewielki ograniczenie aktywności fizycznej bez objawów w spoczynku, zwykła aktywność powoduje zmęczenia, duszności i kołatania serca klasa III – znaczne ograniczenie aktywności fizycznej, niewielka aktywność powoduje zmęczenie, duszności i kołatania serca klasa IV – każda aktywność powoduje zmęczenie, duszności i kołatania serca, objawy występują też w spoczynku 51 Reakcje ogólnoustrojowe w niewydolności mięśnia: aktywacja układu współczulnego aktywacja układu renina-angiotensyna-aldosteron (RAA) Powikłania migotanie przedsionków (napadowe lub utrwalone) ostra dekompensacja krążenia – obrzęk płuc uszkodzenie nerek - nefropatia uszkodzenie aparatu zastawkowego - niedomykalność zaostrzenie niewydolności serca Patofizjologia w niewydolności krążenia dysfunkcja lewej komory spadek pojemności minutowej spadek ciśnienia tętniczego krwi aktywacja baroreceptorów LK, łuki aorty, zatoki szyjnej aktywacja układu współczulnego, RAA, wazopresyny Niewydolność prawokomorowa Patofizjologia niewydolność PK wzrost ciśnienia w prawej komorze wzrost ciśnienia w prawym przedsionku wzrost ciśnienie w żyle głównej obrzęki obwodowe w okolicy kostek, podudzi (charakter plastyczny, ciastowaty, po przyciśnięciu znika dopiero po kilku sekundach), zastój w obrębie wątroby (przekrwienie bierne), wodobrzusze (przesieki w jamach: otrzewnowej, osierdziowej, opłucnowej) powiększenie śledziony Obrzęki sercowe mają charakter symetryczny, lokalizują się w najniżej położonych częściach ciała i mają charakter ciastowaty. Przyczyny niewydolność lewej komory pierwotne choroby płuc, zatorowość płucna choroby układu oddechowego (prowadzi do nadciśnienia) liczne zatory płuc (prowadzi do nadciśnienia) choroby prawego serca zawał prawej komory zwężenie prawego ujścia tętniczego niewydolność zastawki trójdzielnej Objawy obrzęki obwodowe zwiększone ciśnienie w żyłach obwodowych przepełnienie żył szyjnych powiększenie wątroby (zastój żylny - przekrwienie bierne wątroby) przyrost masy ciała przesięki w jamach - otrzewnowej, osierdziowej, opłucnowej nieżyt zastoinowy żołądka i jelit - brak apetytu 52 Obrzęki - nadmierne gromadzenie płynu w przestrzeniach śródtkankowych Przyczyny niewydolność serca niedobiałczenie ostre zapalenie kłębuszków nerkowych zwiększona przepuszczalność małych naczyń krwionośnych (obrzęki uczuleniowe) zatkanie naczyń chłonnych (obrzęki limfatyczne) niedrożność żył (zakrzepy żylne) Obrzęki sercowe Przyczyna: zatrzymanie sodu i wody w organizmie w wyniku aktywacji układu RAA Lokalizacja: najniżej położone części ciała - podudzia Obrzęk płuc Obrzęk płuc szybko przechodzi w ostrą niewydolność lewokomorową nagły wzrost ciśnienia w kapilarach płucnych powodujący przepełnienie naczyń i przenikanie płynu do przestrzeni śródmiąższowej i pęcherzyków płucnych, co manifestuje się sinicą, dusznościami, kaszlem Keśli ciśnienie w żyłach płucnych > 25-30 mmHg przenikanie osocza do zrębu płuc śródmiąższowy obrzęk płuc płyn zaczyna przenikać do pęcherzyków ostry pęcherzykowy obrzęk płuc hipoksemia, hiperkapnia Zawał mięśnia sercowego, nadciśnienie tętnicze, napadowe zaburzenia rytmu serca → wzrost ciśnienia żylnego i włośniczkowego → przepływanie płynu do przestrzeni śródmiąższowej i pęcherzyków płucnych Obraz kliniczny: 1. duszność 2. kaszel, pienista, podbarwiona krwią wydzielina 3. przymusowa pozycja siedząca 4. przyspieszenie oddechu i tętna 5. sinica 6. RTG - płyn w szczelinach międzypęcherzykowych 7. Linie Kerleya B Obrzęk rozpoznajemy radiologicznie, jeśli mamy typowy obraz kliniczny, obserwujemy zaćmienia w obrębie pół płucnych Zator tętnicy płucnej - zablokowanie przepływu przez tętnicę płucną przez materiał zatorowy niesiony z prądem krwi (najczęściej skrzeplina, fragment tkanki nowotworowej, powietrze, tłuszcz), co prowadzi do upośledzenia wymiany gazowej w płucach i przeciążenia prawej komory 53 Objawy Ból w klatce pierioswej Duszność i zasłabnięcie Spadek RR, wstrząs kardiogenny Sinica Tachykardia, tachypnoe Zakrzepica żylna Krwioplucie Różnicowanie silnego bólu w klatce Zator tętnicy płucnej OZW = ostry zespół wieńcowy Rozwarstwienie aorty Odma Przełyk Baretta Źródła skrzepliny, która daje zator 1. Żyły miednicy mniejszej 80% 2. Żyły udowe 70% 3. Żyły podudzia 50% Czynniki sprzyjające Zakrzepica żylna (przebyta) Zespół antyfosfolipidowy Żylaki kończyn dolnych Ciąża Okres poporodowy Antykoncepcja, HTZ Długotrwałe unieruchomienie Otyłość Palenie tytoniu Wiek Rozpoznanie RTG D-dimery we krwi Scyntygrafia EKG Angiografia tętnic płucnych Angiografia TK pnia płucnego i tętnic płucnych TK wielorzędowa Gazometria Nadciśnienie płucne - średnie ciśnienie w tętnicy płucnej > 25mmHg w spoczynku lub >30mmHg podczas wysiłku, podczas pomiarów hemodynamicznych. Podział 1. 2. 3. 4. 5. idiopatyczne, sporadyczne wtórne do niewydolności LK wtórne do chorób układu oddechowego (m.in., przewlekłej obturacyjnej choroby płuc) wtórne do schorzeń zatorowo-zakrzepowych inne (stany zapalne, przeszkody mechaniczne) Objawy duszność, zmęczenie bóle w klatce piersiowej, obwodowe obrzęki wtórne do niewydolności PK brak łaknienia, bóle w jamie brzusznej wtórne do niewydolności wątroby krwioplucie Nadciśnienie płucne wtórne do schorzeń układu oddechowego doprowadza do powstanie serce płucnego (zmiany w strukturze/funkcji PK) Patofizjologia serca płucnego 1. obkurczenie tętnic płucnych o hipoksja pęcherzyków o kwasica 2. redukcja łożyska naczyniowego o rozedma o zatorowość płucna 3. zwiększona krzepliwość krwi erytrocytoza 54 Kardiomiopatie - pierwotne schorzenia mięśnia sercowego, prowadzące do niewydolności Podział 1. Rozstrzeniowa = zastoinowa - istotne poszerzenie jam prawej lub lewej komory, wraz ze ścieńczeniem ściany, osłabienie skurczu, lewokomorowa niewydolność serca 2. Przerostowa - zawężenie wnętrza jam prawej lub lewej komory, wtórne do pogrubienia mięśniówki serca 3. Restrykcyjna - prawidłowa grubość przegrody <1 cm (w kardiomiopatii przerostowej do kilku cm) upośledzony rozkurcz, bo w ścianie odkładają się złogi Zaburzenia rytmu serca - zaburzenia częstości lub/i regularności oraz miejsca powstawania pobudzenia (ektopiczne) Przyczyny Miażdżyca naczyń wieńcowych (np. zawał) Zapalenie mięśnia sercowego Wady zastawkowe Pierwotne choroby mięśnia sercowego (kardiomiopatie) Nadciśnienie tętnicze Zaburzenia gospodarki mineralnej (niedobór potasu) Nadczynność tarczycy, gorączka Wzmożone napięcie nerwowe wywołane stresem Objawy Kołatanie serca Szybkie, niemiarowe bicie Zasłabnięcie Zaburzenie widzenia Zawroty głowy Niewydolność serca Bóle w klatce piersiowej Nagły zgon Podział 1. Upośledzone przewodnictwo (bloki) 2. Wzmożona bodźcotwórczość SVT/ VT/ VF/ AF/ AFI 3. Skurcze dodatkowe, przedwczesne (rytmy zastępcze) 1. Upośledzone przewodnictwo układu bodźcotwórczego bloki Zatokowo-przedsionkowy Przedsionkowo-komorowy (I, II, III stopnia) Śródkomorowy Może być Napadowe lub utrwalone Objawy Zatrzymanie krążenia Zawroty głowy Utrata przytomności Zasłabnięcie 2. Wzmożona bodźcotwórczość 55 Skurcze przedwczesne = ekstrasystolie 1. Nadkomorowe 2. Węzłowe 3. Komorowe Objawy zależą od tego Gdzie powstało nieprawidłowe ognisko wytwarzania bodźców elektrycznych Jak szybki jest rytm Jaki jest ogólny stan zdrowia pacjenta i stan jego układu krążenia U ludzi z niewydolnością serca częstoskurcz bardzo nasila jej objawy, u osób z miażdżycą tętnic wieńcowych wyzwala ból wieńcowy Objawy Duszność Omdlenie Ból wieńcowy Niewydolność krążenia I. Częstoskurcz nadkomorowy (SVT) Zatokowy - nadmierna pobudliwość w węźle zatokowym Przedsionkowy - wywołany przez nadpobudliwe ognisko w mięśniu przedsionków lub łączu przedsionkowo-komorowym HR > 140/min ~ wybitnie przyspieszona akcja serca Charakter napadowy/ utrwalony Załamki P są obecne, ale mogą być ukryte w załamek T Po każdym załamku P w równych odstępach występuje QRS Akcja komór do 260/min II. Częstoskurcz komorowy (VT) Wywołany przed nadpobudliwe ognisko w mięśniu komór (>140/min) Charakter napadowy Obserwujemy szerokie i zniekształcone QRS Załamki P obecne lub nie Migotanie przedsionków (AF) Częste, nieskoordynowane skurcze poszczególnych włókien mięśniowych przedsionków, spowodowane aktywnością licznych bodźcotwórczych ognisk pozatokowych Poszczególne pęczki włókien mięśniowych przedsionków kurczą się bezładnie i niezależnie od siebie z częstością 350-600/ min Nie wszystkie pobudzenia są przenoszone do mięśnia komór przez węzeł przedsionkowo-komorowy, komory serca kurczą się wolniej, ale niemiarowo Przyczyny Nadciśnienie tętnicze CHNS Nadczynność tarczycy Niedomykalność/ zwężenie zastawki mitralnej/ aortalnej Zaburzenia elektrolitowe Leki Kardiomiopatie Nadużycie alkoholu Zawał W konsekwencji AF udar mózgu, niewydolność lewokomorowa 56 Trzepotanie przedsionków (AFI) Ektopowe impulsy krążą w sposób nawrotny, zorganizowany po mięśniu przedsionków z częstością 250350/min Wytwarza się blok A-V przepuszczający do komory, co 2-3 impulsy Odstępy QRS równe Bodźce przewodzone regularnie Migotanie komór (VF) Szybkie (400-600/min), niemiarowe, nieskoordynowane skurcze poszczególnych włókien mięśniowych komór Najgroźniejsze zaburzenie rytmu serca Występuje u osób z poważną chorobą mięśnia sercowego (zawał) lub wikła zabiegi kardiochirurgiczne Nieefektywne hemodynamiczne skurcze - zatrzymanie krążenia Objawy niedokrwienia mózgu Po około 10s występuje utrata przytomności Po 30s pełne objawy śmierci klinicznej 3. Skurcze dodatkowe, przedwczesne (rytmy zastępcze) Pobudzenie z innego ośrodka niż fizjologiczny Pochodzenie o Nadkomorowe - zespół QRS wcześniej niż planowany, morfologia QRS identyczna o Komorowe - szeroki, zniekształcony zespół QRS Rytm o Bliźniaczy - skurcz fizjologiczny przeplata się z rytmem dodatkowym o Trojaczy - dwa skurcze fizjologiczne, jeden dodatkowy Etiologia: choroba mięśnia sercowego, też u ludzi zdrowych Sporadyczne skurcze dodatkowe - pacjent często nie odczuwa żadnych dolegliwości Często pojawiające się skurcze dodatkowe są przyczyną odczuwanego przez pacjenta dyskomfortu Skurcze dodatkowe mogą występować gromadnie, mogą łączyć się w szybki rytm określany mianem częstoskurczu Jeśli ognisko ektopowe w przedsionku, węźle przedsionkowo-komorowym lub komorze zacznie nagle wzbudzać się z częstością wyższą niż węzeł zatokowy, to narzuca ono swój rytm sercu. Mówimy wówczas o częstoskurczu napadowym. Napad częstoskurczu charakteryzuje się nagłym początkiem oraz dużą częstością, wynoszącą 160-220/min. 57 Wady serca Wrodzone lub nabyte nieprawidłowości anatomiczne budowy serca Nieprawidłowe połączenia pomiędzy jamami serca i/lub dużymi naczyniami bezpośrednio uchodzącymi od nich Nieprawidłowa budowa i funkcja zastawek Podział Proste = niedomykalność, zwężenie Złożone = niedomykalność i zwężenie dotyczące tej samej zastawki Niedomykalność najczęściej dotyczy zastawki mitralnej, aortalnej, trójdzielnej, a najrzadziej płucnej. Stenoza mitralna - Zwężenie powierzchni ujścia przedsionkowo-komorowego lewego Upośledzone napełnianie LK w czasie rozkurczu. Wpompowanie odpowiedniej ilości krwi do komory wymaga większego ciśnienia (gradient pomiędzy ciśnieniem w LP a ciśnieniem późnorozkurczowym rośnie) Przerost przedsionka Niewystarczające napełnianie LK = mniejsza objętość minutowa (SV) [CO = SV*HR] Prawidłowe ujście 4-6 cm2 Objawy <2,5 cm2 Zmniejszona tolerancja wysiłku Duszność Szmer rozkurczowy Stenoza aortalna - Zwężenie lewego ujścia tętniczego Patofizjologia - mechanizm 1. Utrudniony odpływ z lewej komory 2. Przeciążenie ciśnieniowe LK 3. Kompensacyjny koncentryczny przerost LK 4. Większa siła skurczu przez pewien czas pozwala na zachowanie dostatecznej obj minutowej (SV) 5. Większa masa mięśnia prowadzi do zwiększonego zapotrzebowania na tlen i zmniejszenia przepływu przez naczynia wieńcowe 6. Bóle dławicowe 7. Dysfunkcja skurczowa i wzrost ciśnienia rozkurczowego w LK 8. Zastój w krążeniu płucnym 9. Ograniczenie tolerancji wysiłku, duszność wysiłkowa 58 Nadciśnienie tętnicze Epidemiologia - w ogólnej populacji 30-45% ma nadciśnienie tętnicze - > 60 r.ż. 65% - jest to najczęstsza przyczyna udaru Kryterium rozpoznania nadciśnienia tętniczego: - ciśnienie skurczowe ≥ 140 mm Hg - ciśnienie rozkurczowe ≥ 90 mm Hg Izolowane nadciśnienie skurczowe ciśnienie skurczowe ≥ 140 rozkurczowe <90 Występuje u starszych osób i wiąże się ze zwiększonym ryzykiem chorób układu sercowo-naczyniowego Ciśnienie tętnicze - optymalne < 120/80 mmHg - prawidłowe <130 i <85 mm Hg - wysokie prawidłowe 130-139/85-89 mmHg Jednorazowy pomiar nie upoważnia do rozpoznania choroby – „zespół białego fartucha” Pomiary należy wykonywać - wielokrotne - zawsze w warunkach spoczynku - za pierwszym razem na obu kończynach Holter ciśnieniowy – najlepsza metoda rozpoznawania nadciśnienia tętniczego - średnia z czuwania 130/85 - średnia ze snu 120/75 3 stopnie nadciśnienia tętniczego, oparte na wartościach ciśnienia rozkurczowego (ciśnienie skurczowe [mm Hg]) łagodne 90-99 mmHg (140-159) umiarkowane 100-109 mmHg (160-179) ciężkie >110 mm Hg (>180) Nadciśnienie jest uwarunkowane przez objętość krwi pompowanej przez serce objętość wody w organizmie stanem czynnościowym tętnic zawartością soli w organizmie czynnością nerek 90% przypadków to tzw. nadciśnienie pierwotne. Tylko 10% przypadków to nadciśnienie wtórne, gdzie konkretna jednostka chorobowa jest jej powodem (akromegalia, nadczynność tarczycy, zespół Cushinga i inne zaburzenia hormonalne). 59 Nadciśnienie pierwotne Przyczyny pierwotnego – etiologia wieloczynnikowa predyspozycje genetyczne nadmierna aktywność układ RAA nadmierne spożycie sodu hiperinsulinemia/oporność retencja sodu w nerkach insulinowa nadmierna aktywność układu adipocytokiny współczulnego Patogeneza nadciśnienia w otyłości 1. układ współczulny 2. RAA 3. hiperlipoproteinemia 4. insulinooporność 5. zatrzymanie sodu stresy nadwaga (najczęściej brzuszna) palenie 6. hiperwolemia (zwiększona masa ciała – większa objętość krwi krążącej) 7. nieprawidłowe poziomy leptyny, adiponektyny Rola Na w rozwoju nadciśnienie tętniczego wielkość pożycia sody w pokarmach dodatnio koreluje z wysokością ciśnienia tętniczego osobnicy z niskim spożyciem sodu (<50mmol) nie chorują na nadciśnienie tętnicze Rola układu współczulnego zwiększona kurczliwość mięśnia sercowego oraz częstość akcji serca wazokonstrykcja wzrost uwalniania reniny wzrost reabsorbcji Na w nerkach i spadek przesączania kłębkowego Adiponektyna działa ochronnie, zapobiega rozwojowi cukrzycy i miażdżycy niskie stężenia efekty niskiego stężenia ◦ otyłość brzuszna, trzewna ◦ dysfunkcja endotelium ◦ nadciśnienie ◦ zmniejszona wazodylatacja ◦ cukrzyca typu II ◦ zmniejszona reaktywność naczyń ◦ oporność insulinowa ◦ oporność insulinowa ◦ choroba wieńcowa ◦ aterogeneza ◦ zwiększona produkcja TNF-alfa Nadmierne stężenia leptyny nadciśnienie - wzmożona aktywność układu współczulnego i RAA - agregacja płytek - gromadzenie wolnych rodników - oporność insulinowa - zahamowanie natriurezy - NO Rola układu renina-angiotensyna-aldosteron Aldosteron wpływ na nerki w cewce dalszej wzmożone wchłaniani Na+ ( i wydzielanie do światła cewki K i H) wpływ na serce ◦ wzrost zawartości kolagenu ◦ przerost mięśnia sercowego ◦ działanie arytmiogenne wpływ na naczynia krwionośne skurcz ◦ zwiększony napływ Na i Ca do komórek mięśniowych naczyń 60 Angiotensyna II działa bezpośrednio na naczynia powodując ich obkurczenie i wzrost oporu obwodowego działając na układ współczulny powoduje wazokonstrykcję zasadnicze działanie to stymulacja produkcji aldosteronu przez nadnercza, który następnie powoduje retencję sodu i wody w organizmie ( wolemia) AngII działa również na przysadkę powodując wzrost wydzielania wazopresyny ( wolemia) Hiperinsulinemia i oporność insulinowa (będące skutkiem otyłości typu trzewnego)prowadzą do aktywacji układu współczulnego, zwiększonej reabsorbcji Na w nerkach wykazują działanie mitogenne Insulina – w warunkach fizjologicznych działanie wazodylatacyjne (stymuluje uwalnianie NO) Toksyczny wpływ glukozy glikemia pobudza układ współczulny zmniejsza się produkcja NO, prostacykliny, zwiększa endoteliny-1 i tromboksanu A2 zwiększa się wytwarzanie wolnych rodników tlenowych oraz oksydowanych cząsteczek LDL powstają produkty glikacji białek Inne czynniki patogenetyczne w nadciśnienie tętniczym dysfunkcja śródbłonka (niedobór NO) endotelina 1 NPY medullipina kalikreina Endotelina 1 potężny wazokonstryktor zwiększone stężenie we krwi u osób z nadciśnienie tętniczym ma działanie prozakrzepowe Nadciśnienie w Polsce choruje 8,4mln polaków 33% nie jest świadomych swojej choroby częściej chorują mężczyźni niż kobiety (okres przedmenopauzalny, gdyż estrogeny rozszerzają naczynia krwionośne) nadciśnienie tętnicze jest chorobą przewlekłą nadciśnienie tętnicze jest często występującą chorobą, która może pozostawać nierozpoznana przez dłuższy czas Czynniki ryzyka wiek powyżej 60 r.ż. płeć męska obciążenia rodzinne cukrzyca typu 2 zaburzenia przemiany lipidów palenie papierosów otyłość brzuszna nadużywania alkoholu zmniejszona aktywność fizyczna Nadciśnienie w 90% współistnieje z różnymi zaburzeniami metabolicznymi i czynnikami ryzyka. Współistniejące choroby cukrzyca (15-20%) choroba wieńcowa niewydolność krążenia powikłania neurologiczne: udar mózgu upośledzenie czynności nerek (20-30%) 61 Ocena kliniczna chorych na nadciśnienie tętnicze ocena przyczyny (pierwotne, wtórne) ocena powikłań narządowych i metabolicznych ocena czynników ryzyka Bardzo często nie odczuwa się podwyższonego ciśnienia tętniczego i na ogół odkrywa się je przypadkowo. Nie ma żadnych specyficznych dla nadciśnienia objawów chorobowych. Wiele osób czuje się, mimo podwyższonego ciśnienia, przez długi czas dobrze. Objawy, które mogą być wymieniane przez pacjentów z nadciśnieniem, to: uczucie kołatania duszność bóle w okolicy serca pobudzenie lub zmęczenie oraz senność bóle i zawroty głowy Stadia rozwojowe stadium I - nadciśnienie bez zmian narządowych stadium II – nadciśnienie z niewielkimi zmianami narządowymi (przerost lewej komory, uszkodzenie nerek (białkomocz), retinopatie) stadium III – nadciśnienie z ciężkimi uszkodzeniami narządowymi (niewydolność lewokomorowa, niewydolność nerek, retinopatia nadciśnieniowa III-IV st., powikłania mózgowe np. udar mózgi) Powikłania wczesne – dysfunkcja śródbłonka, zwiększony opór w drobnych tętniczkach późne – sercowe, nerkowe, w OUN Nadciśnienie tętnicze a dysfunkcja śródbłonka Nadciśnienie tętnicze jest jednym z czynników uszkadzającym śródbłonek. Także hipercholesterolemia, cukrzyca, dym tytoniowy zmniejszają syntezę NO powodując dysfunkcję endotelium agregacja płytek zmniejszona wazodylatacja zapalenie remodeling = przebudowa drobnych tętniczek oporowych (hipertrofia komórek mięśniówki gładkiej, odkładanie kolagenu w przestrzeni pozakomórkowej) Powikłania sercowe przerost mięśnia sercowego niewydolność mięśnia sercowego (przewlekła i ostra) choroba niedokrwienna serca zaburzenia rytmu serca nagły zgon sercowy Powikłania OUN trwałe ubytki w istocie białej i szarej kory mózgowej ostre incydenty niedokrwień mózgu i wylewów krwi wewnątrzczaszkowych ostra encefalopatia nadciśnieniowa bez udaru Powikłania nerkowe nefropatia nadciśnieniowa (uszkodzenie nerek) niewydolność nerek o uszkodzeniu nerek świadczy białkomocz oraz podwyższone stężenie kreatyniny we krwi 62 Powikłania naczyniowe w nadciśnieniu tętniczym charakterystyczne są zmiany w naczyniach siatkówki, widoczne podczas badania dna oka na podstawie tych zmian można określić stopień zaawansowania choroby; w tym celu używa się klasyfikacji Keitha i Wegenera, określającej stadia zmian naczyniowych w dnie oka należy zlecić ekg, ukg, badanie dna oka Diagnostyka przy nadciśnieniu (powikłania narządowe) glukoza kwas moczowy lipidy badanie okulistyczne: badanie dna oka potas ukg: grubość przegrody kreatynina międzykomorowej badanie ogólne moczu usg tętnic szyjnych: obecność blaszki miażdżycowej ekg Przełom nadciśnieniowy (Nadciśnienie złośliwe) - - może pojawić się w każdym okresie nadciśnienia tętniczego pierwotnego jaki wtórnego charakteryzuje się gwałtownym uszkodzeniem naczyń krwionośnych przez znaczne podwyższenie ciśnienia rozkurczowe ryzyko rozwoju jest duże jeśli ciśnienie rozkurczowe >140 mmHg zmiany miejscowe ▪ dochodzi do rozległego, masowego uszkodzenia śródbłonka ▪ proliferacji komórek mięśniówki gładkiej ▪ agregacja płytek krwi zmiany uogólnione ▪ gwałtownego pobudzenie układu współczulnego i RAA zmiany te powodują dalszy przyrost ciśnienia i uszkodzenia naczyń to wszystko zwrotnie prowadzi do martwicy włóknikowatej ściany drobnych tętniczek i dalsze uszkodzenia naczyń Charakterystyka kliniczna przełomu nadciśnieniowego: ciśnienie tętnicze rozkurczowe zwykle powyżej 140 mmHg dno oka – charakterystyczne zmiany (wylewy krwawe, obrzęk tarczy nerwu wzrokowego) objawy neurologiczne – bóle głowy, pobudzenie lub senność, śpiączka, encefalopatia objawy krążeniowe – niewydolność serca objawy ze strony nerek – postępująca niewydolność nerek Nadciśnienie wtórne Wywiad wielotorbielowatość nerek nadużywanie leków p/bólowych przewlekłe zakażenia dróg moczowych przyjmowanie doustnych leków antykoncepcyjnych napady potliwości Badanie fizykalna pomiary antropometryczne osłuchiwanie ekg obrzęki 63 Podział nadciśnienia wtórnego pochodzenia endokrynnego o pheochromocytoma o akromegalia o nadczynność i niedoczynność tarczycy o zespól Cushinga o zespół Conna (pierwotny hiperaldosteronizm) o podaż hormonów egzogennych (estrogeny, glukokortykoidy, sympatykomimetyki) pochodzenia nerkowego o choroby miąższu nerek – głównie starci o choroba naczyń nerkowych - młodsi zwężenie tętnicy nerkowej zapalenie tętnic nerkowych inne (rzadkie) o koarktacja aorty o po zabiegach operacyjnych (stan przejściowy; przyczyny: ból, emocje, hipoksja, hiperkapnia) o porfiria o ciąża Pochodzenia nerkowego miąższowe choroby nerek są częsta przyczyna rozwoju ◦ ostre kłębuszkowe zapalenie nerek ◦ torbielowatość nerek ◦ odmiedniczkowe zapalenie nerek ◦ nefropatia cukrzycowa ◦ przewlekła niewydolność nerek ◦ nefropatia IgA (choroba Bergera) zwężenie tętnicy nerkowej ◦ jest przyczyną nadciśnienia w ok. 5% przypadków ◦ stanowi potencjalnie usuwalną przyczynę nadciśnienia tętniczego ◦ nieleczone prowadzi do rozwoju niewydolności niedokrwionej nerki ◦ zwężenie tętnicy nerkowej prowadzi do ▪ hipoperfuzji nerki ▪ niedokrwienia nerki ▪ aktywacji RAA ▪ nadciśnienie tętniczego ◦ przyczyny ▪ miażdżyca ▪ dysplazja tętnicy nerkowej (zwłóknienie błony wewnętrznej, zwłóknienie błony środkowej, przerost błony środkowej) – zmiany gł. u osób młodych, przed 30 r.ż., głównie kobiet ▪ ucisk przez guz wywodzący się spoza nerki 64 Nadciśnienie pochodzenia endokrynnego zespół Conna (pierwotny hiperaldoteronizm z niską aktywnością reninową osocza (ARO) ◦ przyczyny ▪ gruczolak ▪ przerost kory nadnercza ▪ rak kory nadnercza wytwarzający aldosteron ◦ hiperaldosteronizm ▪ retencja Na wolemii ▪ wrażliwość naczyń na działanie subst. presyjnych oporu obwodowego ▪ wydalania potasu hipokaliemia ◦ objawy ▪ nadciśnienie tętnicze ▪ hipokaliemia ▪ osłabienie mięśniowe ▪ bóle głowy ▪ wielomocz ▪ parestezje, kurcze mięśniowe pheochoromocytoma (guz chromochłonny nadnerczy) ◦ nadmierna produkcja amin katecholowych przez guz nadnerczaa)a także innych substancji o działaniu presyjnym: NPY, endotelina-1 ◦ mogą współwystępować inne choroby ▪ MEN IIA: guz chromochłonny, rak rdzeniasty tarczycy, nadczynność przytarczyc ▪ MEN IIB: guz chromochłonny, rak rdzeniasty tarczycy, nerwiaki, marfanoidalna budowa ciała ◦ objawy ▪ nadciśnienie tętnicze napadowe ▪ nadciśnienie tętnicze utrwalone ▪ wzmożona potliwość ▪ bladość skóry podczas napadu ▪ zaburzenia rytmu serca ▪ uczucie niepokoju zespół Cushinga nadczynność i niedoczynność tarczycy stosowanie estrogenów ◦ obydwie składowe leków antykoncepcyjnych (etinylestradiol + progesteron) w dużych dawkach mogą wywoływać wzrost RR ◦ niewielkie dawki – niewielki ryzyko nadciśnienia ◦ czas podawania (> 5lat wzrasta ryzyko) ◦ przyczyny nadciśnienia ▪ wzrost aktywności układu RAA ▪ insulinooporność z hiperinsulinizmem 65 Układ pokarmowy Przełyk – zwężenia fizjologiczne – przejście gardła w przełyk – rozdwojenie tchawicy – zwieracz dolny Refluks żołądkowo-przełykowy - definicja: zarzucanie kwaśnej treści pokarmowej z żołądka do przełyku z powodu niesprawności mechanizmu zamykania dolnego zwieracza przełyku refluks fizjologiczny: refluks występujący niekiedy u osób zdrowych, np. po posiłku obfitym w tłuszcze i wino (rozluźnienie siły skurczu) choroba refluksowa: często występujący refluks połączony z dolegliwościami zapalenie refluksowe przełyku: choroba refluksowa z makroskopowo dostrzegalnymi ubytkami nabłonka albo z histologicznie stwierdzonym nacieczeniem zapalnym błony śluzowej przełyku Patofizjologia refluksu żołądkowo-przełykowego: - osłabienie siły skurczu zwieracza dolnego przełyku (najczęściej) - wzrost ciśnienia śródbrzusznego ▪ ciąża (fizjologia) ▪ wodobrzusze (patologia) w niewydolności krążenia, wątroby, marskości wątroby Leki wzmacniające refluks β2-mimetyki leki przeciwcholinergiczne leki antykoncepcyjne azotany Objawy: - zgaga - puste odbijania - trudności w połykaniu - ból z okolicy nadbrzusza i za mostkiem (zwłaszcza w pozycji leżącej i po posiłkach) - posmak soli lub mydła w ustach po odbijaniu (świadczy o dużej patologii; w przepuklinie rozworu przełykowego dolegliwości mogą być podobne) - rzadko nudności i wymioty z domieszką krwi (zapalenie w dolnej części przełyku jest krwotoczne i naczynia są uszkodzone) - chrypka, suchy kaszel - spadek masy ciała Objawy zależą od: - czasu kontaktu zarzucanej treści żołądkowej z błoną śluzową przełyku - składu zarzucanej treści (np. wpływ pH) - odporności nabłonka przełyku na działanie czynników uszkadzających (nabłonek zazwyczaj dobrze sobie radzi z drażnieniem mechanicznym, gorzej z drażnieniem chemicznym) - liczby epizodów - perystaltyki przełyku - wydzielania śliny, która zobojętnia kwaśną treść żołądkową (oraz ogranicza czas kontaktu, bo spłukuje ściany przełyku) 66 Następstwa: - zapalenie błony śluzowej - owrzodzenia przełyku, rzadziej krwawienia - aspiracja treści żołądkowej podczas snu zachłystowe zap. płuc z. Mendehlssona - zwężenie przełyku (powodujący dysfagię i odynofagię – ból przy połykaniu) - przełyk Barreta (nabłonek wielowarstwowy płaski jest zastąpiony przez nabłonek walcowaty – wyspowo, miejscowo → stadium przednowotworowe) - gruczolakorak Występuje w przebiegu następujących chorób - twardzina - polineuropatia - cukrzyca - podczas stosowania niektórych leków (antykoncepcyjne, azotany, β2-mimetyki, leki antycholinergiczne, metyloksantyny) Diagnostyka: - endoskopia - RTG z papką barytową - 24- godzinne monitorowanie pH (złoty standard) - manometria przełyku (zwłaszcza przed zabiegiem) Achalazja Etiopatogeneza - brak lub niedobór komórek zwojowych splotu Auerbacha w ścianie przełyku, którego efektem jest: - brak perystaltyki w dolnych 2/3 przełyku - brak rozluźnienia wpustu w trakcie przechodzenia pokarmu - poszerzenie dolnej części przełyku i zaleganie pokarmu Przyczyny - autoimmunologiczne - infekcyjne (gł. wirusy neurotropowe) - czynniki środowiskowe - predyspozycje genetyczne Objawy - - bóle za mostkiem – tępy, uporczywy ból pacjent może trafić na ostry dyżur z podejrzeniem ostrego zespołu wieńcowego uczucie pełności za mostkiem, rzadko bóle kurczowe dysfagia (zmuszają pacjenta do częstego popijania) - wymioty (niestrawiony pokarm – charakterystyczne, brak domieszki soków żołądkowych) - Powikłania - zachłystowe zapalenie płuc z. Mendehlssona - zmniejszenie masy ciała - rak przełyku - zapalenie błony śluzowej przełyku - uchyłek dalszej części przełyku - krwawienia (rzadko) - ropień płuc przewlekły kaszel i krztuszenie się Diagnostyka - na zdjęciu RTG dolna część przełyku jest bardzo rozdęta, mało kontrastu przenika do żołądka - endoskopia - manometria przełyku Leczenie: operacyjne 67 Zespół Plummera-Vinsona – kobiety – 30-50 rok życia – stan przednowotworowy Objawy – dysfagia, trudności w połykaniu – zapalenie błony śluzowej języka, gardła i przełyku – zajady w kącikach ust – niedobór żelaza Powikłania - zwężenie przełyku (w wyniku włóknienia, nasilające dysfagię) - rak przełyku - zapalenie błony śluzowej Żołądek i dwunastnica - fizjologia Czynność wydzielnicza żołądka: - wydzielanie podstawowe BAO (n < 5 mmol HCl/godzinę) - wydzielanie trawienne MAO (n: 5-20 mmol HCl/godzinę) ▪ faza nerwowa (bodźce psychiczne, stres) ▪ faza żołądkowa (pokarm, rozciąganie okolicy odźwiernika) ▪ faza jelitowa (odruch jelitowo-żołądkowy – gastryna w klinice: pentagastryna) jelitowa, bombezyna; Prostaglandyny działają hamująco na cyklazę adenylanową odpowiedzialną za wydzielanie jonów wodorowych, zatem prostaglandyny hamują wydzielanie żołądkowe. Niesteroidowe leki przeciwzapalne (np. kwas acetylosalicylowy – ale nie paracetamol!) zmniejszają stężenie prostaglandyn, przyczyniając się do zwiększonego wydzielania jonów wodorowych i rozwoju choroby wrzodowej. Bariera śluzówkowa żołądka: - zdolność błony śluzowej żołądka do zapobiegania przenikaniu jonów wodorowych zgodnie z gradientem stężeń - wysokie pH w świetle żołądka, niskie w ścianie Budowa ściany żołądka: - trzy warstwy błony śluzowej: nabłonkowa, właściwa, mięśniowa - błona podśluzówkowa - trzy warstwy błony mięśniowej właściwej - warstwa podsurowicza i surowicza Zapalenie żołądka - wszystkie stany, w których dochodzi do uszkodzenia błony śluzowej żołądka, przez różne czynniki, niezależnie od tego, czy rzeczywiście stwierdza się odczyn zapalny w badaniu histologicznym Przyczyny zapalenia żołądka a) ostre - krwotoczne - wywołane przez H.pylori - ropowicze b) przewlekłe - przewlekłe zapalenie niezanikowe wywołane przez H. pylori - autoimmunologiczne niezanikowe - inne c) szczególne - reaktywne - inne np. eozynofilowe, limfocytarne, ziarniniakowe, nieinfekcyjne, infekcyjne 68 Choroba wrzodowa żołądka i dwunastnicy - - wrzód – ostro ograniczony ubytek obejmujący ▪ błonę śluzową ▪ błonę podśluzową ▪ blaszkę mięśniową błony śluzowej nadżerka – ubytek błony śluzowej żołądka nie obejmujący jej warstwy mięśniowej; nadżerki są zwykle mnogie i mogą powodować krwawienia z całej powierzchni (nadżerki krwotoczne) Patogeneza choroby wrzodowej: - uszkodzenie bariery śluzówkowej - zmniejszenie odporności błony śluzowej - zaburzenie równowagi pomiędzy czynnikami agresji a odpornością błony śluzowej Czynniki agresji: - Helicobacter pylori - leki (NLPZ) i używki (kofeina, alkohol) – spadek napięcia zwieracza - kwaśny sok żołądkowy - żółć – odsłania błonę śluzową żołądka - zaburzenia aktywności motorycznej żołądka i dwunastnicy - ostre owrzodzenie spowodowane sytuacja stresową (wrzód stresowy dotyczący ostrych stanów – krwotok, oparzenie, wstrząs wynika z centralizacji krążenia – niedokrwienie bł.śluzowej) Czynniki ochronne: - śluz - prostaglandyny - prawidłowa śluzowej sekretyna budowa i ukrwienie błony Czynniki wpływające na równowagę pomiędzy czynnikami agresji i obrony: 1. czynniki genetyczne (między innymi grupa krwi „0” częściej u chorych z owrzodzeniem dwunastnicy) 2. czynniki nerwowe (stres) 3. czynniki hormonalne (sterydy, hiperkortyzolemia, gastrinoma, nadczynność przytarczyc) 4. czynniki krążeniowe (zastój krwi, wstrząs, hipoksja, niedokrwienie błony ślizowej) 5. czynniki toksyczne (leki) 6. czynniki miejscowe (używki + zaburzenia wydzielania śluzu) Helicobacter pylori - kształt spiralny, witki, przenika do ściany - zawiera ureazę, która powoduje rozkład mocznika do CO2 i NH3 (neutralizacja HCl) - diagnostyka HP ▪ badanie endoskopowo bioptyczne (szybki test na ureazę, badanie histologiczne) ▪ test oddechowy z użyciem węgla C13 (po podaniu mocznika znakowanego C13, który ulega rozszczepieniu przez własną ureazę HP przeprowadza się pomiar znakowanego CO2 w powietrzu wydechowym) ▪ badanie serologiczne (przeciwciała w krwi, antygeny w kale) - kolonizację HP stwierdzono: ▪ u 92% chorych z wrzodem dwunastnicy ▪ u 70% chorych z wrzodem żołądka ▪ u około 50% zdrowych osób powyżej 50 roku życia ▪ częstość występowania HP zwiększa się wraz z wiekiem − Leczenie ▪ 2 antybiotyki (amoksycylina, metronidazol) przez 10-14 dni ▪ Inhibitor pompy protonowej przez 10-14 dni Więzadło Treitza - granica między górnym a dolnym odcinkiem przewodu pokarmowego 69 Choroba wrzodowa żołądka i dwunastnicy Patogeneza Wrzód żołądka - spadek napięcia nerwów błędnych - zmniejszenie motoryki żołądka - wzrost wydzielania gastryny - grupa krwi bez znaczenia stres i sezonowość prawdopodobnie też - starszy wiek - duże ryzyko zezłośliwienia Wrzód dwunastnicy - wzrost napięcia nerwów błędnych - wzrost motoryki żołądka - wzrost sekrecji HCl - grupa krwi „0” - młodszy wiek - stresy - sezonowość (najczęściej jesienią, ale mechanizm jest nieznany) - znikome ryzyko zezłośliwienia (wyjątek: zmiany w obrębie brodawki Vattera) Objawy - bóle po posiłku ulga po wymiotach spadek masy ciała - bóle głodowe ulga po posiłku apetyt Następstwa – duże ryzyko zezłośliwienia Diagnostyka W żołądku w badaniu endoskopowym zawsze, gdy stwierdzimy wrzody pobieramy wycinek (przynajmniej kilka). Po 6 tyg. kontrolna endoskopia – ryzyko zezłośliwienia. We wrzodach dwunastnicy nie robimy, nawet po leczeniu, kontrolnej endoskopii (chyba, że na brodawce Vattera) Powikłania choroby wrzodowej: - krwotok – częściej we wrzodach stresowych - fusowate wymioty - wrzód drążący, penetracja np. do trzustki - perforacja wrzodu (do światła otrzewnej ostry brzuch) - bliznowate zwężenie odźwiernika - nowotwór (w około 3% przypadków) JELITO CIENKIE I GRUBE Choroba Menetriera - idiopatyczny rozrost fałdów błony śluzowej żołądka w jamie odźwiernikowej lub trzonie żołądka - gastropatia przerostowa Epidemiologia - częściej u mężczyzn - po 50 r.ż. Objawy - ból w nadbrzuszu - nudności - wymioty - biegunka - zaburzenia wchłaniania - ↓masy ciała - krwawienia - po pewnym czasie hipoalbuminemia (obrzęki i przesięki do jam ciała) 70 Rozpoznanie - endoskopia - badanie histopatologiczne wycinka Rokowania - objawy mogą trwać przez wiele lat - ryzyko rozwoju raka 2-15% - prawdopodobnie większe ryzyko zakażeń przewodu pokarmowego i incydentów zakrzepowo-zatorowych Celiaklia - glutenozależna enteropatia, choroba trzewna, sprue nietropikalna - enteropatia zapalna jelita cienkiego o podłożu immunologicznym spowodowana trwałą nietolerancją glutenu, istotne są predyspozycje genetyczne Epidemiologia - bezobjawowo 1:300 – 1:800 - objawowo 1:3345 - 2x częściej u kobiet - najczęściej diagnozowana u dzieci (ale może pojawić się w każdym wieku) Współwystępowanie - cukrzyca typu I - autoimmunologiczne choroby tarczycy (ch. Hashimoto, ch. Gravesa-Basedowa) - zepół Downa - zespół Turnera - zespół Williamsa - niedobór IgA Rola czynników genetycznych HLA-DQ2 (90-95%) HLA-DQ8 (10-15%) Patogeneza gluten (frakcja białkowa) gliadyna (pszenica) sekalina (żyto) hordeina (jęczmień) 33-aminokwasowy fragment glutenu aktywuje ukł. imm. jest on oporny na sok żołądkowy i enzymy proteolityczne transport peptydu do blaszki właściwej gdzie działa transglutaminaza tkankowa powstaje ujemnie naładowany kw. glutaminowy w polipeptydzie co ułatwia łączenie się w kompleksy tworzą się kompleksy z DQ2 i DQ8(w mniejszym stopniu) stymulacja reakcji zapalnej: prezentacja limf. CD4+, aktywacja, produkcja cytokin prozapalnych zanik kosmków błony jelita cienkiego Procesowi temu towarzyszy także odpowiedź humoralna (lim. B) powstają przeciwciała przeciw gliadynie i transglutaminazie tkankowej W aktywnej chorobie stwierdza się większą ilość limfocytów śródnabłonkowych CD8 (zwiększają wytwarzanie IL-15 przez enterocyty). 71 Objawy - ze strony układu pokarmowego - przewlekła biegunka - ból brzucha - niedożywienie i masy ciała - nawrotowe afty jamy ustnej - wymioty - objawy jelita drażliwego - stłuszczeniowe zapalenie wątroby - ze strony skóry - zapalenie opryszczkowe skóry - ze strony układu moczowo-płciowego - opóźnienie dojrzewania płciowego - ze strony układu nerwowego - padaczka - migreny - depresja - ataksje - ze strony układu krwiotwórczego - objawy niedokrwistości - inne - osłabienie mięśni i tężyczka - niski wzrost - hipoplazja szkliwa Powikłania - u osób nieprzestrzegających diety bezglutenowej - ze strony układu pokarmowego - rak gardła, przełyku, jelita cienkiego - wrzodziejące zapalenie jelita cienkiego + przestrzeganie diety choroba oporna na leczenie - chłoniak jelita cienkiego - ze strony układu krwiotwórczego - chłoniak nieziarniczy - hiposplenizm - ze strony układu moczowo-płciowego - niepłodność - poronienia nawykowe - poród przedwczesny - przedwczesna menopauza - ze strony układu kostnego - osteomalacja - osteoporoza Kryteria rozpoznania - objawy kliniczne - obecność markerów serologicznych - zanik kosmków w badaniu endoskopowym - diagnostyka różnicowa - ustąpienie objawów po eliminacji glutenu Rozpoznanie - nie ma pojedynczego badania, na podstawie którego można potwierdzić/odrzucić celiakię - biopsja jelita cienkiego - oznaczenie przeciwciał - przeciw transglutaminazie - przeciwendomyzjalnych - ew. badania genetyczne Zespół jelita drażliwego - przewlekła choroba jelita cienkiego i jelita grubego, objawiająca się bólem brzucha i zaburzeniami rytmu wypróżnień, które nie są uwarunkowane zaburzeniami organicznymi lub biochemicznymi Epidemiologia - początek 30-40 r.ż. - 10-20% populacji - 2x częściej kobiety Patofizjologia - przyczyna nieznana - zaburzenia czucia trzewnego, czynności motorycznej i wydzielniczej jelit - podłoże psychogenne (70-90%) – zaburzenia regulacji osi mózg-jelita - zaburzenia osobowości, niepokój, objawy histerii lub depresji - zmiany aktywności kory mózgowej odpowiedzialnej za odczuwanie bólu - poinfekcyjny zespół (10%) - przebycie infekcji bakteryjnej - zmiana flory bakteryjnej 72 Przebieg przewlekły, nawracający Postacie - biegunkowa - z dominującym zaparciem (colon spasticum) Objawy - bóle brzucha – nasilenie po posiłku, ulga po wypróżnieniu - zaparcia - biegunka wodnista - wzdęcia - nudności, wymioty - zgaga - bóle głowy i zmęczenie - zaburzenia miesiączkowego - częstomocz - w badaniu – tkliwość w rzucie esicy - brak innych zmian w badaniu przedmiotowym - mieszana Rozpoznanie - objawy + wykluczenie zaburzeń organicznych i biochemicznych - rozpoznanie różnicowe - nieswoiste zapalenie jelit - choroba trzewna - choroba uchyłków okrężnicy - nadczynność tarczycy - cukrzyca - niedobór elastazy - guzy endokrynne - nowotwór Choroba Hirschprunga (Megacolon) - wrodzony defekt polegający na braku zwojów nerwowych śródściennych w dolnym odcinku jelita grubego; odcinek ten jest zwężony, a bliższy poszerzony Epidemiologia - 1:5000 dzieci - 4x częściej u mężczyzn - 18% przypadkom towarzyszy choroba genetyczna (gł. z. Downa) Pierwsze objawy zaraz po urodzeniu: brak smółki po 2-3 dniach, wymioty Dalszy przebieg jest różny a ) brak wypróżnień operacja b) następuje wypróżnienie Powikłania - ostre zapalenie jelita grubego i jelita cienkiego przedziurawienie porażenie ropień U dorosłych - ciężkie zaparcia od urodzenia - wzdęcia brzucha - w badaniu per rectum zwężona, pusta bańka odbytnicy Potwierdzenie - biopsja - manometria 73 Wrzodziejące zapalenie jelita grubego (Colitis ulcerosa) - rozlany, nieswoisty proces zapalny odbytnicy lub odbytnicy i okrężnicy prowadzący do owrzodzenia Epidemiologia - częściej biała rasa - 10:100 000/ rok - 20-40 r.ż. - kraje rozwinięte Etiologia - niewyjaśniona - czynniki genetyczne - czynniki środowiskowe (inna flora bakteryjna ilościowo i jakościowe: B. vulgatum i E.coli) - czynniki immunologiczne (↑ akt. CD4 ↑ cytokin prozapalnych) Objawy - bardzo częste (20x/dzień) biegunki z krwią - osłabienie - spadek masy ciała - krwawienia z dolnego odcinka przewodu pokarmowego - odwodnienie - tachykardia - obrzęki - gorączka - ból Choroba przewlekła, przebiega pod postacią ostrych rzutów (tygodnie miesiące). Ciężki przebieg, gdy pierwszy rzut pojawił się w wieku młodzieńczym. Trudno wychwycić przyczynę nawrotów Rozpoznanie - endoskopia - badanie histopatologiczne Powikłania - polipowatość zapalna - perforacja - ostre rozdęcie okrężnicy - krwawienia - rak jelita grubego - zwężenie - pozajelitowe - osteopenia, osteoporoza - ZZSK - zapalenie dużych stawów - zapalenie stawów krzyżowo-biodrowych - stłuszczenie wątroby - rak i stwardniejące zapalenie dróg żółciowych - zakrzepica żył - zatorowość - rumień guzowaty - zgorzelinowe zapalenie skóry - zapalenie spojówek i tęczówek - ropnie - przetoki - szczeliny 74 Choroba Leśniowskiego-Crohna - pełnościenne, ziarniniakowe zapalenie, które może dotyczyć każdego odcinka przewodu pokarmowego (od jamy ustnej do odbytu) Epidemiologia - kraje wysokorozwinięte - częściej kobiety (niewielka przewaga) - 15-25 r.ż. - 5:100 000/rok Patogeneza - czynniki genetyczne - mutacje białka NOD2 (chr.16) - obecność 2 alleli zmutowanego genu - ryzyka - TNF-alfa, cytokiny prozapalne Najczęściej dotyczy jelita cienkiego i grubego, chore fragmenty są poprzedzone zdrowymi odcinkami. Proces chorobowy rozpoczyna się w błonie śluzowej (zniszczenie, włóknienie przetoki, zwężenia, bliznowacenie) Objawy - gorączka - osłabienie - masy ciała - objawy zależą od lokalizacji - 40-50% dot. końcowego odcinka jelita krętego Przebieg - wieloletni, przewlekły, trwałe inwalidztwo - w ciągu 10 lat 60% jest poddawane co najmniej 1 operacji - 30-40% jelito cienkie i grube - 20% tylko jelito grube Rozpoznanie - endoskopia - badanie histopatologiczne WĄTROBA ZAPALENIE WĄTROBY - uszkodzenie miąższu wątroby o różnej etiologii z obecnością komórek zapalnych w wątrobie Podział - ostre – przebieg gwałtowny, ale krótki (ok 3 miesiące) - przewlekłe – ponad 6 miesięcy - przetrwałe ostre – 3-6 miesięcy Ostre zapalenie wątroby - etiologia ▪ wirusy (hepatotropowe: WZW-A, -B, -C, CMV) ▪ bakterie ▪ alkohol ▪ leki ▪ inne czynniki chemiczne np. toksyny grzybów - przebieg ▪ okres prodromalny – rzekomogrypowy (osłabienie, stany gorączkowe, niespecyficzny 2-14 dni) ▪ okres żółtaczkowy – ok. 4 tygodnie (zażółcenie skóry, błon śluzowych, ciemny mocz, odbarwiony stolec) ▪ okres zdrowienia lub przejścia zapalenia w stan przewlekły - badania laboratoryjne w WZW ▪ wzrost stężenia aminotransferaz AspAT, AlAT w surowicy (gdy rosną to jest to najczęściej zap. wirusowe i uszkodzenie miąższowe) ▪ podwyższone stężenie bilirubiny w surowicy krwi (bardziej wzrasta w żółtaczce mechanicznej) ▪ prawidłowe lub nieznacznie podwyższone stężenie fosfatazy alkalicznej i GGTP (znacznie podwyższone stężenie GGTP często występuje w alkoholowym uszkodzeniu lub chorobie autoimmunologicznej); wydalane do krwi, gdy jest blok wydalania żółci 75 WZW A Drogi zakażenia – „choroba brudnych rąk” - przenoszenie drogą pokarmową – inkubacja 20-50 dni Przebieg – objawy podobne do hepatitis B, ale łagodniejszy przebieg – przeciwciała IgM w okresie ostrym, później IgG – odporność pozostaje na całe życie – brak stanu przewlekłego – brak nosicielstwa Objawy pozawątrobowe: - zapalenie stawów - vasculitis Formy kliniczne – bezobjawowa – żołądkowo-jelitowa – żółtaczkowa – nawrotowa - oliguria pokrzywka WZW B Cechy HBV – wirus DNA – budowa – rdzeń - antygen rdzeniowy HBcAg (jądra hepatocytów) – płaszcz - antygen powierzchniowy HBsAg (w cytoplazmie) – antygen związany z cząsteczką Dane'a HBeAg Drogi zakażenia – krew, ślina, nasienie Okres inkubacji: 40-150 dni Fazy choroby – prodromalna – 14 dni – żółtaczkowa – 7-30 dni – okres zdrowienia lub przejścia w stan przewlekły Badania serologiczne antygen HBs – w ostrym okresie choroby przeciwciała przeciwko antygenowi HBs – pojawiają się 2-3 miesiące po zniknięciu HBsAg i mogą utrzymywać się przez całe życie przeciwciała przeciwrdzeniowe (anty HBc) – pojawiają się w fazie żółtaczki i utrzymują się przez kilka miesięcy przeciwciała anty HBe – pojawiają się w okresie remisji choroby i mogą utrzymywać się przez całe życie Formy kliniczne postać bezobjawowa postać bezżółtaczkowa ostre zapalenie wątroby z żółtaczką (najbardziej typowy) piorunujące zapalenie wątroby (z piorunująca niewydolnością) przedłużające się zapalenie wątroby (>4 miesiące) przewlekle zapalenie wątroby (>6 miesięcy) 76 WZW C Droga zakażenia – wirus RNA – zakażenie drogą pozajelitową, płciową – inkubacja 1-6 miesięcy Formy kliniczne - przebieg bezobjawowy z eliminacją wirusa 65% - ostre zapalenie z wyleczeniem i eliminacją wirusa – 25% - przetrwanie wirusa – nosicielstwo → 10-40% - piorunujące niewydolność wątroby – 1% (konieczność przeszczepu) - u 20% zakażonych – marskość wątroby - wzrasta ryzyko raka wątroby Przebieg - wyleczenie - przewlekłe przetrwałe zapalenie wyleczenie - przewlekłe aktywne (agresywne) zapalenie marskość rak śmierć marskość śmierć - śmierć Przewlekłe zapalenie wątroby przewlekłe przetrwałe zapalenie wątroby ◦ nacieki limfocytarne ◦ zachowana budowa zrazikowa przewlekłe aktywne zapalenie wątroby ◦ zniszczona budowa zrazikowa ◦ może prowadzić do marskości, raka wątroby i śmierci TRZUSTKA Trzustka – fizjologia - czynność zewnątrzwydzielnicza ▪ enzymy proteolityczne w formie proenzymów (trypsynogen, chymotrypsynogen A, B, proelastaza) ▪ enzymy lipolityczne (lipaza, fosfolipaza, esterazy) ▪ enzymy glikolityczne (amylaza, nukleaza) - czynność wewnątrzwydzielnicza ▪ insulina ▪ somatostatyna ▪ wazoaktywny peptyd ▪ glukagon ▪ polipeptyd trzsutkowy jelitowy VIP ▪ gastryna PP Symulacja wydzielania soku - pobudzająca ▪ pokarm ▪ cholecystokinina ▪ sekretyna ▪ GRP ▪ insulina ▪ hormon wzrostu - hamująca ▪ somatostatyna (podawana w zapaleniu trzustki) ▪ glukagon ▪ kalcytonina 77 Ostre zapalenie trzustki - samostrawienie tkanki gruczołkowej w wyniku aktywacji enzymów trzustki w obrębie gruczołu (np. w przypadku kamicy dróg żółciowych – kamień w pobliżu brodawki Vaterra – żółć zarzucana do przewodu Virsunga) Etiologia choroby dróg żołciowych (najczęściej): kamienie przewodu żółciowego wspólnego, zwężenie brodawki Vatera nadużywanie alkoholu idiopatyczna (przyczyna nieznana) leki: beta-adrenolityczne, moczopędne, enzymu konwertującego itd. rzadsze przyczyny: urazy brzucha, stan po operacjach brzusznych zakażenia wirusowa (świnka, AIDS, zapalenie wątroby) znaczna hipertriglicerydemia hiperkalcemia glisty w drogach żółciowych Patogeneza 1) czynnik wyzwalający 2) obrzęk 3) uszkodzenie komórek 4) uwalnianie enzymów trypsyna + chymotrypsyna → obrzęk, martwica elastaza → krwawienie lipaza → martwica tkanki tłuszczowej (martwica rozpływna) Objawy początek ostry: silne bóle brzucha! nudności, wymioty porażenie jelit brak biegunki! bladość, spocenie gorączka obniżenie RR (objawy wstrząsu) zmiany w EKG żółtaczka rzadko niebieskie plamy około pepla (objaw Cullena) lub na bokach tułowia (objaw Grey-Turnera) jest to objawy niepomyślny prognostycznie Przewlekłe zapalenie trzustki - stały proces uszkodzenia trzustki występujący nawet po usunięciu czynnika etiologicznego Etiologia – przewlekłe nadużywanie alkoholu (80%) – idiopatyczna – nadczynność przytarczyc – zmiany naczyniowe/zakrzepowe – hiperlipidemia, hiperkalcemia, nieprawidłowe odżywianie – mukowiscydoza, hemochromatoza − choroby dróg żółciowych są najczęstszą przyczyną ostrego zapalenia trzustki, ale jest wielce wątpliwe czy mogą stanowić przyczynę przewlekłego zapalenia trzustki 78 Obraz kliniczny – często skąpoobjawowy – objawem wiodącym jest nawracający ból, który nie ma charakteru kolki (tępy, przewlekły) – nietolerancja pożywienia – objawy dyspeptyczne, nudności, wymioty, wyniszczenie – zespół złego wchłaniania – biegunka, utrata masy ciała, stolce tłuszczowe, niestrawione włókna mięsne w kale – cukrzyca – możliwa nawracająca żółtaczka Powikłania torbiele rzekome (ew. z wylewami krwawymi i żółcią), ropień, zwężenie przewodu trzustkowego lub żółciowego, zakrzepy żył śledzionowych upośledzenie trawienia: utrata masy ciała, stolce tłuszczowe, bębnica (wzdęcia), biegunka objawy nieprawidłowego trawienia pojawiają się dopiero wtedy, gdy czynność zewnątrzwydzielnicza trzustki zmniejszy się do 10% normy Nowotwory przewodu pokarmowego - czynnika ryzyka Rak przełyku – płeć męska – palenie – alkohol – zwężenie, achalazja – zespół Plummera-Vinsona W nieoperacyjnym raku – stenty Rak żołądka – płeć męska – obciążenia rodzinne – zanikowe zapalenie żołądka – achlorhydria – niedokrwistość złośliwa Addisona-Biermera – wrzód żołądka – grupa krwi A – zakażenie Helicobacter pylori – przebyta operacja żołądka (10-15 lat wstecz) – polipy żołądka (stadium przednowotworowe) Typu A - zapalenie zanikowe żołądka Wczesny rak żołądka - może makroskopowo wyglądać jak owrzodzenie lub polip - do pewnego momentu jest operacyjny i niezłośliwy - jeśli sięga do błony mięśniowej (obecność naczyń włosowatych) rozsiew Rak jelita grubego – starzenie się organizmu – niewłaściwy tryb życia (w tym odżywianie) – obciążenie rodzinne – wrzodziejące zapalenie jelita grubego – polipy Pierwotny rak wątroby – niedobory żywieniowe – antygen HBsAg (HCV) – marskość wątroby – stosowanie androgenów Rak trzustki – płeć męska – starszy wiek – palenie tytoniu – cukrzyca 79 Blok z endokrynologii Tarczyca Fizjologia Struktura jednostka strukturalna – pęcherzyk o 1 warstwa komórek nabłonkowych – tyreocytów, w świetle – koloid o komórki endotelium, fibroblasty, komórki C o kształt zależy od stanu funkcjonalnego objętość tarczycy – 2 płaty tarczycy połączone cieśnią, mierzone w 3 wymiarach - szerokość x grubość x długość każdego z płatów x 0,5 o zależy od genetyki, ciąży, masy ciała, wieku (starzenie → atrofia narządu) o – przy obniżonym poziomie jodu – kompensacyjne powiększenie gruczołu tarczowego (aby lepiej wychwytywać jod) o kształt płata prawidłowego – wskazuje drogę zstępowania w rozwoju zarodkowym/płodowym o – „po drodze” mogą znajdować się ośrodki ektopowe tkanki tarczycowej (np. tarczyca językowa) badanie scyntygraficzne – izotop jodu 131 wychwytywany przez tkankę tarczycową obfity układ naczyniowy unerwienie o włókna współczulne ze zwojów szyjnych o przywspółczulne z nerwów błędnych o peptydergiczne o regulacja procesów wzrostowych, sekrecyjnych i przepływu krwi przez tarczycę Eutyreoza i stany nieprawidłowe Eutyreoza i stany nieprawidłowe – eutyreoza - stan prawidłowy – warunek do zabiegów chirurgicznych – płód – synteza hormonów od 12 tygodnia życia - ↑ zapotrzebowania na jod – ciąża – czynnik goitrogenny (wolotwórczy) Zawiązek tarczycy pojawia się się 8 tygodnia życia. Hormony produkowane są w 10-12 tygodniu do tego czasu dziecko czerpie hormony od matki, niezbędne do rozwoju narządów (głównie OUN) W ciąży należy suplementować jod (gdy występuje nadczynność to też, bo dziecko podkrada jod) ok 150 μg/dobę – przy nadczynności – nasilenie ukrwienia – Przełom tarczycowy – stan zagrożenia życia, niezdolność do wyrównania nadczynności (50% śmiertelność) Przed operacją należy wyrównać tyreostatykami – nadczynność = sympatykotonia – przewaga aktywności układu współczulnego → tachykardia, migotanie komór, skurcze dodatkowe (leczenie – beta-blokery – blokują receptory beta dla neuroprzekaźników układu współczulnego) – strumektomia/tyreoidektomia = usunięcie tarczycy – dysfagia = zaburzenia przełykania, które mogą być związane z powiększoną tarczycą uciskającą na przełyk − − Stridor = świszczenie przy wdechu i wydechu przy zwężeniu tchawicy spowodowane uciskiem tchawicy przez przyrośniętą tarczycę Chrypka = przez uciśnięcie nerwu krtaniowego wstecznego 80 Jod – niezbędny do syntezy hormonów tarczycy – zawartość w organizmie 10-15mg Hormony tarczycy warunkują rozwój i funkcjonowanie we wszystkich okresach życia – nadczynność pobudza, niedoczynność hamuje o wpływ na układ nerwowy, przemiany węglowodanów, metabolizm białek, tłuszczów, przemiany energetyczne, produkcja ciepła, bilans wodny, gospodarka wapniowo-fosforanowa, regulacja siły mięśniowej 1. 2. 3. 4. 5. 6. 7. 8. 9. tyreoglobulina (Tg) o glikoproteina syntetyzowana w rybosomach tyreocytów o podstawowy składnik koloidu o z nią wiążą się T3 i T4 tyreotropina (TSH) o glikoproteina o silny czynnik wzrostowy dla tarczycy o ↑czynność wydzielniczą tarczycy o działa na receptory białkowe w błonie tyreocytów – aktywuje cyklazę adenylową (↑ cAMP) o przeciwciała przeciwko receptorom dla TSH – TRAb – pobudają syntezę hormonó tarczycy → choroba Gravesa-Basedowa, oftalmopatia (wytrzeszcz związany z nadczynnością tarczycy) o podjednostki α – taka sama w gonadotropinach (FSH, LH, hCG – może pobudzić tyreocyty w ciąży) β – decyduje o specyficzności Etapy syntezy hormonów Jod przez przewód pokarmowy, skórę, płuca dostaje się do krwioobiegu w postaci zjonizowanej Transport anionów jodkowych zależy od pompy – białko/Na+/I- symporter (NIS, pułapka jodkowa) o jest to transport aktywny regulowany przez TSH – stężenie jodków w tyreocytach jest 20x większe niż we krwi Organifikacja jodu – tyreoperoksydaza (TPO) – aniony jodkowe ulegają utlenieniu do jodu elementarnego, który jest wbudowywany do mono- i dijodotyrozyny (MIT i DIT) = jodowanie tyreoglobuliny o gdy obecne są przeciwciała anty-TPO → choroba Hashimoto Sprzęganie jodotyrozyn w tyroksynę (T4) i trijodotyroninę (T3) o we krwi znajduje się 5x więcej T4 niż T3 T4, T3, MIT, DIT są magazynowane w koloidzie w postaci połączeń z tyreoglobuliną Pinocytoza - pobieranie kropel koloidu przez tyreocyty Proteoliza - uwolnienie T3, T4 i jodotyrozyny z tyreoglobuliny pod wpływem enzymów lizosomalnych obecnych w tyreocytach MIT i DIT zostają odjodowane pod wpływem dejodotyrozynazy, a aniony jodkowe są ponownie włączane w cykl wewnątrzkomórkowych przemian Dyfuzja - wydzielanie hormonów tarczycy do krwi (proces zależny od TSH) 81 Mechanizm działania Hormony we krwi są połączone z białkami nośnikowymi o w diagnostyce oznacza się wolne – fT3, fT4 T4 w tkankach obwodowych ulega konwersji do T3 (lub nieaktywnego metabolitu – rT3) o 20% w tarczycy o 80% w tkankach obwodowych – głównie w wątrobie o dejodynazy typu 1, 2, 3 T3 łączy się z receptorem jądrowym w komórce docelowej → synteza białek zależnych od T3 Hormony tarczycy są metabolizowane w wątrobie i nerkach (tzw. utrata jodu z moczem, w niewydolności wątroby/nerek występują zaburzenia metaboliczne hormonów tarczycy) Regulacja syntezy i wydzielania na obszarach niedoboru jodu – preferencyjna synteza MIT (szybciej przechodzi do T3) nadmiar jodków w tyreocycie hamuje: o proces organifikacji jodu – efekt Wolffa-Chaikoffa (nadmierna podaż jodu prowadzi do zahamowania TPO, mechanizm odwracalny) o pułapkę jodkową ujemne sprzężenie zwrotne w układzie podwzgórze-przysadka-tarczyca Diagnostyka krew o o o TSH, fT3, fT4, TPOAn, TRAb, morfologia, CRP, lipidogram, elektrolity Tg (+TgAb), kalcytonina, hCG, alfa-podjednostka rozmaz, OB, NT-proBNP, aminotransferazy, bilirubina, fosfataza alkaliczna, GGTP – TgAb, T3, T4 (proteinogram TBG), rT3 – SABG, IL-6 test z TRH, z pentagastryną techniki biologii molekularnej (w tym badania genetyczne) obrazowanie USG, RTG, TK, MR egzoftalmometria i inne metody scyntygrafia 131-I, Tc99m, MIBG diagnostyczne badanie cytologiczne i histopatologiczne Normy TSH fT4 fT3 TSH ↓ TSH ↑ TSH ↑ TSH ↓ 0,2-0,4 do 4,0-4,5μIU/ml 0,71-1,85 ng/dl 9,1-23,8 pmol/l 2,05-3,65 pg/ml 3,15-5,61 pmol/l Nadczynność pierwotna fT3↑ Nadczynność wtórna fT3↑ Niedoczynność pierwotna fT3↓ Niedoczynność wtórna fT3↓ fT4↑ fT4↑ fT4↓ fT4↓ TSH JEST BADANIEM PRZESIEWOWYM, bo tylko w eutyreozie jest w normie. Jedynie u ciężarnej z chorą tarczycą zaleca się cały panel. W postaci subklinicznej W niedoczynności o fT4 i fT3 są jeszcze w normie, a TSH już jest podwyższony W nadczynności fT4 i fT3 są jeszcze w normie, a TSH już jest obniżony TSH oceny po 6 tygodniach od zmiany dawki. 82 Wole nietoksyczne (Obojętne) - niezapalne i nienowotworowe powiększenie tarczycy w stanie eutyreozy (bez zaburzeń hormonalnych) - najczęstsza patologia tarczycy, której prawdopodobieństwo zwiększa się z wiekiem (w sytuacji niedoboru jodu = większa częstość) Etiopatogeneza niedobór jodu = tarczyca jest wtedy nadmiernie wrażliwa na TSH nawet w prawidłowym stężeniu przerost tyreocytów, zwiększenie ich ilości ciąża 1) hiperestrogenizm powoduje hiperglobulinemię 2) tym samym zwiększone zostaje wiązanie hormonów tarczycy z białkami osocza 3) obniżone stężenie wolnych hormonów i wzrost stężenia TSH ( działanie proproliferacyjne na tyreocyty) we krwi 4) pobudzenie tyreocytów 5) wole - zwiększony wychwyt jodu przez jednostkę łożyskowo-płodową - zwiększone wydalanie jodu okresy życia o zwiększonym zapotrzebowaniu na hormony tarczycy = pokwitanie, laktacja, przekwitanie niewłaściwe postępowanie z chorym po tyreoidektomii (w onkologii całkowita, w łagodnych zmianach częściowa ; „kikuty” tarczycy pozostają i produkują hormony tarczycy; lecz i tak dochodzi do pooperacyjnej niedoczynności) - niewłaściwa dawka tyroksyny podłoże genetyczne endogenne czynniki wolotwórcze = hormony, czynniki wzrostu, cytokiny substancje wolotwórcze naturalne i sztuczne Objawy – uciskowe – duszność (zwężenie tchawicy) – dysfagia (tarczyca obejmuje przełyk) – chrypka (ucisk nerwu krtaniowego wstecznego) – zespół żyły próżnej górnej = wyraz utrudnionego odpływu chłonki z klatki piersiowej – stridor (świszczący oddech przy wdechu i wydechu = bo zwężenie tchawicy) Ostrożność należy zachować w przypadku zmian guzkowych: - hipoechogeniczny = szarość taka sama jak tkanki tarczycy (hipo - ciemniejszy/ hiper - jaśniejszy) - z cechami wewnętrznego rozpadu = charakterystyczny dla zmian złośliwych - z przestrzeniami płynowymi i litymi wewnątrz w wyniku wewnętrznego rozpadu - z przerwaną otoczką - o nieregularnych - uciskających sąsiedni miąższ - współwystępujących z wyraźną asymetrią w wielkości płatków - z mikrozwapnieniami - o wyraźnej progresji wzrostu - których obraz USG zmienia się - będącymi obszarami „zimnymi” w scyntygrafii I-131 - powiększonych węzłów chłonnych szyi - widoczna asymetria płatów 83 Leczenie wola rozlanego obojętnego: powinno być prowadzone pod kontrolą USG stopień 0 - profilaktyka jodowa (jodowana sól, preparaty jodu w dawce 100 μg) stopień 1 - preparaty w dawce 100 μg (lub + preparaty L-tyroksyny w dawce 50 μg/dzień) stopień 2 - preparaty jodu w dawce 100 μg + L-T4 w dawce 50-150 μg/dzień w celu doprowadzenia do niepełnej supresji wydzielania TSH stopień 3 - rozważyć leczenie chirurgiczne kobiety ciężarne i w okresie laktacji mogą otrzymywać 200 μg jodu/dobę Postępowanie w przypadku wola guzkowego obojętnego (obowiązują kontrole między innymi USG, BACC, oznaczeń hormonalnych) rozważyć leczenie z użyciem L-T4 (ostrożne postępowanie u chorych w podeszłym wieku i obciążonych internistycznie) rozważyć tyreoidektomię (subtotalną, lobektomię jednostronną) obserwacja rozważyć podanie radiojodu chorym z objawami uciskowymi ze strony wola i przeciwwskazaniami do zabiegu operacyjnego Postępowanie w przypadku pojedynczego łagodnego guzka tarczycy (obowiązują kontrole między innymi USG, BACC, oznaczeń hormonalnych) pojedynczy guzek (niewielkich rozmiarów) można leczyć L-T4 w dawce 100 μg lub niższej przez okres 1 roku > jeśli wymiary guzka się zmniejszą, leczenie można przedłużyć. Ostrożne postępowanie u chorych w podeszłym wieku i obciążonych internistycznie) Obserwacja Rozważyć operacyjne usunięcie guzka (metodą klasyczną lub laparoskopową) Wole guzkowe nadczynne Postacie kliniczne: mnogie guzy autonomiczne pojedynczy guz autonomiczny rozproszona tkanka autonomiczna (nieautoimmunologiczna hiperplazja tarczycy) a) Wole rozlane (miąższowe) - proste b) Wole guzkowe (w części jest następstwem niepodjęcia postępowania profilaktycznego u osób z wolem rozlanym, obserwujemy nadczynność) - toksyczne/ nadczynne Zapalenie tarczycy Zapalenie Etiologia Objawy Leczenie Ostre bakteryjna – zakażenie krwiopochodne lub przez ciągłość - bolesny obrzęk - gorączka, dreszcze - ropień - antybiotyk - drenaż ropnia - okłady na szyje Podostre wirusowa (olbrzymiokomórkowe, choroba de Quervain) - bolesny, promieniujący obrzęk - stany podgorączkowe Przewlekłe Autoimmunologiczna, limfocytarna, ch. Hashimoto - podwyższone st TPO-Ab we krwi - salicylany - prednizolon + L-T4 przez 6 tyg Zapalenie przewlekłe poporodowe (rozwija się do 2 lat po porodzie) i bezbolesne zapalenie tarczycy Inne zapalenia – po leczeniu jodem radioaktywnym, polekowe, pourazowe – ból tarczycy choroba de Quervain, udar krwotoczny guza tarczycy, ostre bakteryjne zapalenie tarczycy 84 85 Niedoczynność tarczycy - zespół objawów klinicznych wywołanych niedoborem lub brakiem T4, zaburzeniami obowodowego metabolizmu T4, wewnątrzkomórkowej produkcji T3, opornością tkanek na hormony tarczycy, czego następstwem może być niedostateczne działanie T3 w komórkach ustroju Etiopatogeneza – pooperacyjna (tyreoidektomia częściowa lub całkowita, wystąpienie po operacji pr autoimmunizacyjnego) – choroba Hashimoto – przewlekłe autoimmunologiczne zapalenie tarczycy w połączeniu z chorobą Addisona tworzy tzw. zespół Schmidta - wiedzie do trwałej niedoczynności (dalsze spożywanie jodu > zespół Jod-Basedow) – przedawkowanie tyreostatyków – odwracalne w – przyjmowanie innych leków, np. soli litu, IFN-α krótkim czasie – aplazja, hipoplazja tarczycy – następstwo leczenia jodem radioaktywnym – efekt – ektopia tarczycy późny – po radioterapii z powodu raka sutka – znaczny niedobór jodu w środowisku – część przypadków zespołu niskiej T3 i T4 – nadmierne spożycie jodków → efekt Wolffa-Chaikoffa Objawy Przyrost masy ciała Zmęczona anemiczna twarz Obrzęki u dołu oczu Męczliwość, senność, skłonność do depresji Sucha pogrubiała skóra, łuszcząca się, chłodna, odcień sinożółty Wypadanie włosów, łamliwość Nadwrażliwość na zimno Zaparcia (obniżenie perystaltyki) Objawy układowe Układ krążenia o o o o o o o Układ oddechowy o o o Bradykardia (bo hiperkaliemia, hiponatremia) i tachyarytmia zmiany w EKG (niski woltaż QRS, wydłużenie QT) Obrzęki tkanek podskórnych - odkładanie mukopolisacharydów Spadek tolerancji wysiłku (o 30-50%, ↑ oporu obwodowego) Nadciśnienie tętnicze (↓ podatność tętnic, ↑ oporu obwodowego) Zwiększona przepuszczalność naczyń krwionośnych, przesięki Miażdżyca i ↓ filtracji kłębkowej o Zmniejszenie produkcji i metabolizmu kortyzolu Współistnienie niedoczynności przytarczyc, kory nadnerczy, gonad, cukrzycy typu I Układ krwiotwórczy o o o Niedokrwistość = 30-40% chorych Normocytarna - zmniejszone zużycie tlenu, spadek produkcji EPO Mikrocytoza - zaburzenie wchłaniania żelaza Makrocytoza - zaburzenia wchłaniania wit B12 Wzrost aktywności fibrynolitycznej osocza Zaburzenia funkcji płytek krwi (↑ t krzepnięcia) Układ rozrodczy o o o o o Upośledzenie drożności dróg oddechowych Osłabienie mięśni oddechowych i niewydolność oddechowa Przesięki w jamach opłucnowych Układ wewnętrznego wydzielania o Cykle bezowulacyjne Obfite miesiączki Zwiększona częstość poronień Hiperprolaktynemia Obniżone libido Śpiączka hipometaboliczna o o Bardzo duża śmiertelność - bezpośrednie zagrożenie życia Nasilenie wszystkich objawów niedoczynności tarczycy = hipowentylacja, hipoglikemia, hiponatremia 86 Zespół niskiej T3 kliniczne najczęściej eutyreoza; biochemicznie: TSH, fT4 N, fT3 N (dolna granica); ostre i przewlekłe ciężko przebiegające choroby pozatarczycowe (NTI) wywołują zaburzenia w obwodowym metabolizmie T4 i następcze ↓ekspresji T3 w narządach w stanach krytycznych występuje zespół niskiej T3 i T4 Leczenie Niedoczynność Nadczynność bezwzględna substytucja LT-4 w indywidualnej dawce Skuteczność dawki LT-4 ocenia się po 6-8 tygodniach oceniając stężenie TSH w pierwotnej niedoczynności oraz stężenia fT4 i fT3 we wtórnej niedoczynności celem jest uzyskanie trwałej eutyreozy odstawienie preparatów LT-4 i jodu podawanie: tyreostatyków, β-blokerów, leków hamujących konwersję T4 do T3, uspokajających leczenie jodem radioaktywnym Biochemiczne rozpoznanie pierwotnej niedoczynności: ↑ TSH, ↓ fT4 i fT3 Subklinicznej niedoczynności: ↑ TSH, fT4 i fT3 już podwyższone jeszcze w normie Subkliniczna niedoczynność Pierwotnej nadczynności: ↓ TSH, ↑ fT4 i fT3 Subklinicznej nadczynności: ↓ TSH, fT4 i fT3 już obniżone jeszcze w normie Subkliniczna nadczynność - bez wyraźnych objawów klinicznych, lecz ze względu na niekorzystny lipidogram i skłonność do stanów depresyjnych zalecane jest leczenie małymi dawkami LT-4. - rzadko zachodzi konieczność leczenia tyreostatykami, częściej stosuje się β-blokery, zwłaszcza, że objawy są głównie związane ze wzmożonym napięciem współczulnego Kryterium rozpoznania : TSH nie przekracza 2krotnej granicy górnej normy (już podwyższone), fT4 i/lub fT3 w dolnej granicy normy Kryterium rozpoznania : TSH we krwi jest już obniżone w różnym stopniu, fT4 i/lub fT3 nie przekracza górnej granicy normy 87 Nadczynność tarczycy - nadmierna komórkowa ekspresja T3 - choruje 2% populacji, częściej kobiety Etiopatogeneza Choroba Gravesa-Basedowa Wole guzkowe nadczynne Autonomiczny nadczynny guzek tarczycy Zapalenie tarczycy w fazie początkowej: choroba Hashimoto, podostre zapalenie tarczycy, poporodowe i bezbolesne zapalenie limfocytarne Zapalenie tarczycy po leczeniu radiojodem Wysoko zróżnicowane raki tarczycy Zespół Marine-Lencharta Wtórna nadczynność tarczycy Autonomia rozsiana Wole jajnikowe i inne postacie ektopowego wydzielania TSH Ciążowa nadczynność tarczycy (stymulowane przez hCG) Objawy Układ krążenia Inne o Uczucie kołatania serca o Częste wypróżnienia o Tachykardia o Objawy symaptykotonii o Zaburzenia rytmu o Rzadkie miesiączki o Wzrost ciśnienia skurczowego, amplitudy, tętna o Szmer naczyniowy nad tarczycą o Niewydolność krążenia zespół tarczycowosercowy Układ nerwowy o Nadpobudliwość o Chwiejność emocjonalna o Bezsenność Metabolizm Zwiększenie przemiany materii oraz Potliwość, uczucie gorąca Układ powłokowy o Skóra wilgotna, gładka, aksamitna o Wypadanie włosów o Kruchość paznokci Przełom tarczycowy Bardzo duża śmiertelność = bezpośrednie zagrożenie zycia Nasilenie wszystkich objawów nadczynności tarczycy oraz zaburzenia OUN, nerek, tachykardia, odwodnienie, utrata przytomności 88 Choroba Gravesa-Basedova Jedna z najczęstszych przyczyn nadczynności tarczycy Choroba o podłożu autoimmunologicznym Może ujawniać się w każdym wieku 10 krotnie (5-krotnie) częściej u kobiet (do 65 r.ż.) Charakterystyczne dla tej choroby jest występowanie - wola miąższowego - orbitopatii - dermopatii - akropachii tarczycowej Przyczyny wole guzkowe nadczynne (toksyczne) autonomiczny nadczynny guzek autoprzeciwciała 1. anty-TRAb (przeciwko receptorom TSH tarczycy) pobudzają rozrost gruczołu i wydzielanie hormonów tarczycy 2. anty-TG u 50% osób 3. Anty-TPO u 70% osób wole rozlane toksyczne Objawy 1. triada merseburska – wole rozlane, oftalmopatia, tachykardia 2. nadpobudliwość, chwiejność emocjonalna 3. skóra wilgotna, potliwość 4. zaburzenia miesiączkowania 5. przełom tarczycowy Lokalizacja pozatarczycowa choroby Gravesa-Basedowa – obrzęk przedgoleniowy – oftalmopatia – 10% ludzi Oftalmopatia Gravesa Patogeneza – autoimmunologiczna – przeciwciała przeciwko antygenowi wspólnemu dla tarczycy i oczodołów – występuje u 10% pacjentów z chorobą Gravesa-Basedowa – 90% przypadków towarzyszy chorobie Gravesa-Basedowa, mniej niż 5% - Hashimoto – 2-5% to postać izolowana Objawy – wytrzeszcz gałek ocznych – najczęściej symetryczny – niedomykalność powiek – uczucie wypychania gałek ocznych – pieczenie, łzawienie – objaw Moebiusa – brak akomodacji, diplopia, uszkodzenia nerwu wzrokowego Fazy kliniczne – faza naciekowo-obrzękowa – aktywna – faza zwłóknienia – nieaktywna Diagnostyka – ocena wytrzeszczu (NOSPECS, CAS) – RM oczodołu – ocena fazy Leczenie – w fazie aktywnej – glikokortykoidy – zmniejszają naciek – w fazie zwłóknienia – operacyjne powiększenie oczodołu o objętość zatok przynosowych – usunięcie ścian zatok 89 Rak tarczycy Wysoko zróżnicowany (brodawkowaty, pęcherzykowy) - zachowuje strukturę i funkcję ogniska, z którego się wywodzi Jest zdolny do syntezy tyreoglobuliny, stąd TSH będzie też stymulował komórki nowotworu - przerzutu Niskozróżnicowany (anaplastyczny) - odbiera bardzo od pierwotnej komórki, nie syntetyzuje hormonów; rokuje fatalnie Z komórek C (rdzeniasty) - produkuje kalcytoninę, złe rokowanie o Postać sporadyczna (gdy nie ma protoonkogenu RET) o Postać dziedziczna (gdy jest protoonkogen RET) Oznaczamy protoonkogen RET ; gdy występuje > badamy całą rodzinę, jeśli u kogoś zostanie wykryty wykonujemy profilaktyczną tyreidoektomię (strumektomię) <także u dzieci>, ponieważ dziedziczenie jest bardzo silne, a nowotwór bardzo szybko postępuje Leczenie Jeśli podejmiemy prawidłowe leczenie wyleczalność 98% 1. Całkowita tyreidoektomia (częściowa w przypadku guzów łagodnych) celem usunięcia mikroprzerzutów oraz jedynego narządu syntetyzującego Tg (spadek Tg do 0) 2. USG = jeśli objętość kikutów > 2 ml reoperacja 3. Scyntygrafia 131I , który zostanie wychwycony przez pozostałe tyreocyty 4. Jeżeli γ-kamera zarejestruje zmiany to podajemy olbrzymią dawkę I-131 (131I), dzięki czemu dojdzie do głosu promieniowanie β, niszcząc pozostałe tyreocyty (leczenie uzupełniające radiojodem) 5. Stężenie Tg we krwi obniża się do 0, powinno być sprawdzane na każdej kontroli co kwartał 6. Przerzuty zawsze zachowują właściwości nowotworu, z którego się wywodzą, więc jeśli podczas kontroli wykrywalne jest stężenie Tg, oznacza to, że doszło do rozsiewu 7. W celu usunięcia mikroprzerzutów na obwodzie stosujemy ablacyjne leczenie radiojodem (wykorzystując bardzo wysoką dawkę) ; trzeba jednak usunąć wszystkie miejsca jodochwytne, aby nie umniejszyć dawki docierającej na obwód 8. 6 miesięcy, 2 lata i 5 lat po zabiegu, a takie wyrywkowo w razie stwierdzenia Tg > 0 wykonujemy scyntygrafię całego ciała I-131, przesuwając γ-kamerę po całym ciele wykryjemy nawet mikroprzerzuty, ale będą one widoczne wyraźnie tylko jeśli tkanka tarczycowa została dokładnie usunięta Wskazania do leczenia radiojodem Choroba Gravesa-Basedowa z nadczynnością tarczycy, zwłaszcza z niewielkim wolem, wysokim mianem przeciwciał stymulujących tarczycę Guzki anatomiczne Obciążenie internistyczne Wole guzkowe nadczynne Podeszły wiek Oporność na tyreostatyki Przeciwwskazania do leczenia operacyjnego Skłonność do leukopenii, trombocytopenii Brak zgody na leczenie operacyjne Wznowa nadczynności tarczycy po tyreidoektomii Wstępne leczenie nadczynności tarczycy u chorych, u których zaplanowano przeprowadzenie tyreidoektomii z powodu wola dużych rozmiarów T3 toksykoza Rodzaj nadczynności tarczycy w której dochodzi do nadmiernej konwersji T4 do T3 Daje objawy nadczynności tarczycy, jednak T4 w badaniach ma prawidłowe/za niskie stężenie > T4 łatwiej oznaczyć w badaniu, ma dłuższy okres półtrwania i dłużej utrzymuje się we krwi obwodowej 90 Gospodarka Wapniowo-Fosforanowa Fizjologia Wapń Wapń ogólnoustrojowy – około 1500g (2,25-2,75 mmol/l ; 9-11 mg%) · 99% w kościach · 1% w przestrzeni pozakomórkowej i w tkankach miękkich Wapń we krwi: · 50% Ca2+ przy prawidłowym pH 7,35-7,45 (↓pH - ↑Ca2+) aktywny w postaci hydroksyapatytu · 45% Ca związany z białkami przy prawidłowym stężeniu albumin (↑pH - ↑Ca-białka) · 5% Ca związane z anionami nieaktywny Dobowa podaż wapnia w pożywieniu: 1000-1500 mg Wydalany z moczem (ok.200-250 mg/dobę) Równowaga zależy od pH krwi (7,35-7,45) - kwaśne przewaga formy zjonizowanej - alkaliczne przewaga formy niezjonizowanej hiperwentylacja! [alkaloza tężyczka czynna] Fosfor Fosfor całkowity 600-800g (0,9-1,6 mmol/l ; 2,8-6,0 mg%) · 85% w kościach · 6% w mięśniach · 9% w innych tkankach miękkich (zwłaszcza OUN) Parathormon PTH · 84 aminokwasy, aktywny biologicznie N-końcowy fragment 29 aminokwasów · produkowany przez przytarczyce (1-8szt. - zazwyczaj 4, najczęściej położone na tylnej powierzchni tarczycy, nietypowo: wewnątrz tarczycy, w grasicy, w śródpiersiu, w jamie brzusznej, w trzonie języka, masa 100-120mg) ; mają receptory wapniowe = określenie stężenia wapnia we krwi Wzrost wydzielania PTH –((( hipokalcemia - ↓ Ca = tylko gdy NIE MA NIEDOBORU Mg! – hipomagnezemia - ↓ Mg (w przypadku krótkotrwałego procesu) – hiperfosfatemia - ↑ fosforany (P) = niezależnie od hipokalcemii i hamowania wit D – ↓ wit. D3 [1,25 (OH)D3] – kalcytonina i kortyzol – układ adrenergiczny (receptory β i cAMP stres) Spadek wydzielania PTH – hiperkalcemia – hipermagnezemia – podwyższone stężenie witaminy D3 Rola biologiczna parathormonu jelita · wpływ pośredni – przez aktywację witaminy D3 = Brak receptorów PTH w jelitach! · ↑ wchłaniania Ca i fosforanów w jelitach nerki · aktywacja 1-α-hydroksylazy – powstaje aktywna wit. D3 · ↑ resorpcja zwrotna Ca · ↓ resorpcja zwrotna fosforanów, Na, HCO3-, glukozy, aminokwasy = Jedyna droga eliminacji P z org! kości · osteoliza osteoklastyczna i osteocytowa, związana z niedoborem wit. D3 · w niedoborze wit. D3 kość jest oporna na osteolityczne działanie PTH 91 Peptyd podobny do PTH – PTHrP · 135-173 aminokwasów, wykazuje homologię do N-końcowego fragmentu PTH · działa podobnie jak PTH = powoduje hiperkalcemię i hipofosfatemię · jest wydzielany przez komórki nowotworowe (rak sutka, płuc, nerki) Kalcytonina · 32 aminokwasy, wydzielana przez komórki okołopęcherzykowe C tarczycy · małe jest prawdopodobieństwo odgrywania istotnej roli biologicznej u ludzi – usunięcie tarczycy nie wpływa na stężenie Ca we krwi i metabolizm kości · jest markerem nowotworowym raka rdzeniastego tarczycy Podstawowy czynnik stymulujący działanie kalcytoniny ↑ wydzielania · ↑ Ca (hiper) · glukagon · gastryna · estrogeny · androgeny · etanol ↓ wydzielania · hipokalcemia Rola biologiczna kalcytoniny - lek przeciwbólowy w miejscu występowania nowotworu - działa na 24-α-hydroksylazę 24,25-dihydroksycholekalcyferol (nieaktywny biologicznie) jelita nerki kości · ↓ wchłaniania Ca · ↑ wydalania Ca i · Transformacja osteoklastów w i fosforanów (brak wit D) Fosforanów z moczem osteoblasty · ↓ syntezy wit. D3 [powstaje · odkładanie Ca w kościach nieaktywny 24,25] · ↓ osteolizy osteocytowej Małe prawdopodobieństwo odgrywania istotnej roli kalcytoniny u ludzi: 1. Usunięcie tarczycy (strumektomia) jedyne źródło kalcyoniny = nie wywiera wpływu na stężenie wapnia czy metabolizm kości 2. Wydzielanie jej w niezwykle wysokim stężeniu (rak rdzeniasty tarczycy) nie ma widocznego wpływu na homeostazę mineralną 3. Kalcytonina łososiowa = nie pomaga w osteoporozie, natomiast łagodzi objawy, np. przerzutów do kości Gospodarka wapniowo-fosforanowa W jej regulacji biorą udział 1. PTH (brak kalcytoniny) 2. Aktywne metabolity witaminy D3 3. ↑ Stężenie foforanów → ↓ Ca (zawsze), ↓ wit D3, ↑ wydz. PTH 4. Kotransporter Na-P cewek nerkowych – pod wpływem PTH i fosfatonin ulega internalizacji, ↓ resorpcję fosforanów w cewkach nerkowych Normy Ca 2,25-2,75 mmol/l 9-10 mg% iPTH 1,1-6,7 mmol/l 10-60 pg/ml 2+ Ca 1,0-1,3 mmol/l 4,0-5,2 mg% Ca w DZM <5 mmol/dobę fosforany 0,9-1,6 mmol/l 2,8-5,0 mg% 25(OH)D3 10-125 nmol/l 5-50ng/ml Nie oznacza się 1,25(OH)2D3, bo jest bardzo nietrwała! 92 Przyczyny hipokalcemii 1.niedobór PTH – prawdziwa niedoczynność przytarczyc − po operacjach − po radioterapii − zniszczenie przez nowotwór 2.rzekoma niedoczynność przytarczyc – oporność na PTH w prawidłowym stężeniu 3.↓ podaż Ca (norma 400-600 j., 1-1,5g) = najczęściej 4.↓ wchłanianie Ca − zespół upośledzonego wchłaniania lub trawienia − niedobory wit. D − celiakia 5.nadmierne odkładanie Ca w tkankach miękkich i w kościach − ostre zapalenie trzustki − stostownie bisfosforanów − zespół głodnych kości po usunięciu gruczolaków przytarczyc 6.nadmierna utrata Ca z moczem − diuretyki pętlowe np. furosemid − kwasice cewkowe 7.bezwzględny lub względny niedobór wit. D − choroby nerek – upośledzona 1-hydroksylacja − choroby wątroby – upośledzona 25hydroksylacja − żółtaczka zastoinowa – upośledzone wchłanianie witaminy D − inaktywacja witaminy D - leki przeciwpadaczkowe − zespół lizy nowotworów − ostra lub przewlekła niewydolność nerek − hiperfosfatemia Przyczyny hiperkalcemii Hiperkalcemia z dużym stężeniem PTH (PTH zależna) 1. pierwotna nadczynność przytarczyc 2. dziedziczna nadczynność przytarczyc (MEN) 3. paraendokrynopatie – wydzielanie PTH przez nowotwory 4. mutacje inaktywujące receptor Ca − rodzinna hiperkalcemia hipokalciuryczna Przyczyny hipofosfatemii 1.↓ podaż fosforanów z pokarmem – mało białek 2.upośledzone wchłanienie fosforanów w jelitach 3.przemieszczenie fosforanów z naczyń do tkanek − poparzenia, ciężkie urazy (faza anaboliczna) − zasadowica oddechowa − faza normalizacji glikemii po śpiączce ketonowej − zespół głodnych kości po usunięciu gruczolaka przytarczyc 4.nadmierna ucieczka z moczem − nadmiar PTH, fosfatonin − niedobór wit. D − kwasice cewkowe − glikokortykosteroidów Przyczyny hiperfosfatemii 1. ↑ podaż – mleko, żywienie pozajelitowe, leki przeczyszczające 2. nadmierne uwalnianie fosforanów z komórek − po urazach, zakażeniach (faza kataboliczna) − kwasica – mleczanowa, ketonowa, oddechowa − zespół lizy nowotworów, hemoliza − hipertermia złośliwa − intensywny wysiłek fizyczny 3. upośledzone wydalanie przez nerki − ostra, przewlekła mocznica − niewydolność nerek cukrzycowa, nadciśnieniowa − niedobór PTH, Mg, nadmiar GH 4. nadmierna mobilizacja fosforanów z kości 5. nadmierna podaż wit. D lub metabolitów → zwiększone wchłanianie fosforanów w jelitach Hiperkalcemia z małym stężeniem PTH 1. nowotwory (↑ wydzielania PTHrP, cytokin, chemokin, prostaglandyn o działaniu osteolitycznym) 2. zatrucie wit. D i jej metabolitami 3. zatrucie witaminą A – wzmożona osteoliza 4. nadczynność tarczycy (↑ osteoliza) 5. wytwarzanie 1,25(OH)D przez ziarniniaki (sarkoidoza) i chłoniaki 6. leki - tiazydy, teofilina - ↓ wydalania Ca z moczem 7. długotrwałe unieruchomienie (przy przyspieszonym obrocie kostnym – np. ludzie młodzi, mobilizacja wapnia z kości) 8. zespół mleczno-alkaliczny – zespół Burnetta - ↑ spożywanie produktów mlecznych lub nadużywanie leków zobojętniających sok Żołądkowy 9. faza wielomoczu u chorych z niewydolnością nerek 93 Witamina D3 : 1,25(OH)D3 · D3 cholekalcyferol – powstaje z cholesterolu w skórze (pod wpływem promieni UV) · D2 ergokalcyferol – występuje w pokarmach roślinnych · 25(OH)D2, 25(OH)D3 – wątroba · 1,25(OH)D2, 1,25(OH)D3 – nerki ↑ wydzielania ↓ Ca Hipokalcemia ↓ P Hipofosfatemia ↑ PTH ↓ kalcytoniny i wit D3 Androgeny i estrogeny PRL GH ↓ wydzielania ↑Ca Hiperkalcemia ↓ P Hipofosfatemia ↓ PTH ↑ kalcytoniny i wit D3 Rola witaminy D3: · ↑ wchłaniania Ca i fosforanów w jelitach i nerkach · ↓ wydzielania PTH (przy dostępie Mg) mechanizm sprzężenia zwrotnego · ↑ mineralizacji kosci (witamina antykrzywicza) · udział w procesach odpornościowych · udział w różnicowaniu komórek 94 Niedoczynność przytarczyc prawdziwa Zespół chorobowy spowodowany pierwotnym lub wtórnym niedoborem lub brakiem PTH, syntezą biologicznie nieczynnych cząstek PTH lub brakiem receptorów PTH. Zmiany biochemiczne · ↓ PTH · ↓ Ca hipokalcemia · hipokalciuria · ↑ P hiperfosfatemia Etiologia · po operacjach (strumektomia) · destrukcja autoimmunologiczna · przerzuty, nacieki nowotworowe · po radioterapii · po leczeniu izotopem 131I · · · hemosyderoza, skrobiawica, gruźlica wrodzony brak przytarczyc (zespół DiGeorge'a) stan po urazie, zapaleniu, wylewie krwawym Niedoczynność przytarczyc jest przyczyną hipokalcemii wskutek: - zmniejszonej mobilizacji wapnia z kości [bo niskie PTH] - zmniejszonej biosyntezy 1,25(OH)2D3 w nerkach [mniejsze wchłanianie w jelitach] - hiperfosfatemii spowodowanej zmniejszeniem klirensu nerkowego fosforanów Objawy kliniczne 1. Tężyczka jawna obniżenie progu pobudliwości nerwowo-mięśniowej drętwienie i kurcze toniczne mięśni rąk, przedramion, ramion, twarzy, klatki piersiowej, kończyn dolnych przy zachowanej świadomości, - „marsz tężyczkowy” > ↑ przepuszczalności dla Na+ > depolaryzacja błony kom.mięśniowych > mikropotencjały czynnościowe > skurcz 2. Tężyczka utajona z objawami Chvostka = uderzenie w nerw VII powoduje grymas z objawami Trousseau = zaciśnięcie mankietu sfingomanometru powoduje skurcz mięśni „ręka położnika” z objawem Ibrachima = zgięcie grzbietowe stopy z odwiedzeniem tężyczka hiperwentylacyjna 3. Równoważniki tężyczkowe − skurcz powiek, światłowstręt, podwójne widzenie, skurcz mięśni krtani, skurcz naczyń wieńcowych, brzusznych, mózgowych, napad astmy oskrzelowej Tężyczka u osób znerwicowanych tężyczka czynnościowa alkalizacja wskutek hiperwentylacji wiązanie Ca z białkami Następstwa przewlekłej hipokalcemii Zaburzenia neurologiczne o pląsawica o parkinsonizm o spastyczne porażenie poprzeczne Zaburzenia psychiczne o upośledzenie umysłowe o psychozy o nerwice o depresje Zmiany troficzne tkanek ektodermalnych o sucha skóra o łamliwość, rozwarstwienie paznokci o łamliwość włosów i rzęs o o o o skłonność do wyprysków i grzybicy bielactwo zaćma ubytki szkliwa 95 Niedoczynność przytarczyc rzekoma (Zespół Albrighta) Genetycznie uwarunkowany defekt - brak reakcji receptorów tkankowych na PTH – oporność tkanek docelowych na PTH. Przyczyna genetycznie uwarunkowany defekt receptora PTH-PTHrP Typy I. Defekt receptora – brak wzrostu cAMP i fosfaturii po podaniu egzogennego PTH II. Defekt pozareceptorowy – wzrost cAMP bez wzrostu fosfaturii po podaniu PTH Zmiany biochemiczne niedoczynności rzekomej przytarczyc · hipokalciuria · ↑ lub prawidłowe PTH · ↓ Ca hipokalcemia · ↓ P hipofosfatemia · hipofosfatura Objawy (szczególnie u dzieci) · nadpobudliwość nerwowo-mięśniowa, napady tężyczki · złogi hydroksyaptatytu pod skórą, pomimo, że jest hipokalcemia = zespół Fahra > liczne zwapnienia w OUN w niedoczynności przytarczyc · objawy przewlekłej hipokalcemii obniżony iloraz inteligencji objaw Albrighta – skrócenie IV i V kości śródręcza i śródstopia – deformacja dłoni i stóp otyłość, krępa budowa ciała, niski wzrost (<140 cm), okrągła twarz, płetwistość szyi zaburzenia kostne o typie „osteoitis fibrosa cystica” – cysty, odwapnienia, osady fosforanu wapnia w tkance podskórnej Niedoczynność przytarczyc jest przyczyną hipokalcemii wskutek: - zmniejszenia mobilizacji Ca z kości - zmniejszenia biosyntezy wit D3 Hiperfosfatemia = niewydolność nerek! Nadczynność przytarczyc pierwotna Pierwotna nadczynność przytarczyc jest schorzeniem, w przebiegu którego dochodzi do nadmiernego wydzielania PTH przez zmienione komórki przytarczyc. Pierwotna nadczynność przytarczyc może być utajona, nawet przez wiele lat. Jej obecność bywa wykrywana przypadkowo podczas wykonywania różnych badań laboratoryjnych. Zachorowalność − 4-6 przypadków / 100tyś /rok − 2-3 K : 1 M Etiologia · 75-80% pojedynczy gruczolak przytarczyc · 10-15% pierwotny przerost przytarczyc · <5% mnogie gruczolaki przytarczyc · <5% rak przytarczyc Zmiany biochemiczne · ↑ Ca hiperkalcemia · hiperkalciuria · ↓ P hipofosfatemia · hiperfosfaturia Składowa zespołów MEN Zespół MEN 1 1. nadczynność przytarczyc 2. guzki trzustki (gastrinoma, insulinoma, glukagonoma, VIPoma) 3. guzki przysadki (prolactinoma, somatotropinoma) Zespół MEN 2A 1. rak rdzeniasty tarczycy 2. nadczynność przytarczyc 3. guz chromochłonny rdzenia nadnerczy (pheochromocytoma) 96 Objawy kostne uogólniony lub miejscowy zanik kostny (osteopenia o typie osteoporozy) resorpcja podokostnowa (środkowe paliczki, barkowe końce obojczyków, blaszka zbita zębodołów) złamania patologiczne kręgosłupa, żeber, kości długich zniekształcenia kręgosłupa zespoły bólowe dolegliwości niespecyficzne (osłabienie mięśniowe) densytometria = diagnozowanie (złoty standard) -kręgosłup, szyjka kości udowej Zespół hiperkalcemiczny układ wydalniczy polidypsja, poliuria, hipostenuria, kamica moczowa wapniowa - nawrotowa, wapnica nerek układ pokarmowy brak apetytu, nudności, wymioty, zaparcia, układ krążenia tachykardia, niemiarowość, nadwrażliwość na glikozydy, przewlekła choroba Wrzodowa (↑ HCl i gastryny) hipertensja, ostre i przewlekłe w EKG skrócenie zapalenie trzustki odcinka QT układ nerwowy bóle głowy, apatia, stany depresyjne, senność, śpiączka hiperkalcemiczna, adynamia, dysfagia, wzmożenie odruchów ścięgnistych Nadczynność przytarczyc wtórna Stan nadmiernego wydzielania PTH spowodowanego hipokalcemią, który doprowadza do nadmiernego pobudzenia przytarczyc i ich przerostu. Czynność przerośniętych przytarczyc może z czasem ulec autonimizacji – powstaje wtedy tzw. wtórnie pierwotna nadczynność przytarczyc, najczęściej u chorych z przewlekłą mocznicą leczonych hemodializami lub dializami otrzewnowymi. Wtórna nadczynność przytarczyc występuje prawie u wszystkich chorych z przesączaniem kłębuszkowym 60 ml/min. Etiologia · niewydolność nerek · zespół złego wchłaniania Ca i fosforanów · choroby wątroby: marskość Badania laboratoryjne: · hipokalcemia · hiperfosfatemia · ↓ witaminy D · ↑ PTH W badaniu obrazowym rzadko powiększone przytarczyce. Nadczynność przytarczyc trzeciorzędowa Pojawienie się hiperkalcemii u chorych z wtórna nadczynnością przytarczyc po jej leczeniu. Etiologia: nieskuteczne leczenie wtórnej nadczynności przytarczyc Badania laboratoryjne: · ↑ Ca · ↑ (P) · ↑ PTH (często > 10x norma) · ↑ wskaźników obrotu kostnego 97 Oś podwzgórze-przysadka 98 Niedoczynność przedniego płata przysadki Zespół kliniczny spowodowany niedoborem jednego hormonu lub kilku hormonów przysadki Objawy niedoczynności zależą od - wieku, w jakim doszło do niedoczynności przysadki - czasu trwania choroby - zakresu niedoborów hormonalnych Przyczyny ucisk – guz, czaszkogardlak (guz niezłośliwy, ale po usunięciu szybko odrasta), przerzuty (rzadko np. z raka sutka) niedokrwienie – zespół Sheehana (zwiazany z krwotokiem w trakcie lub po porodzie niedokrwienie przysadki martwica), zawał krwotoczny uraz ziarniniak – sarkoidoza, hemochromatoza, histiocytoza autoagresja – limfocytarne zapalenie przysadki czynniki zakaźne jatrogenna – zabieg chirurgiczny, radioterapie Przyczyny: Postacie izolowane: GH – karłowatość* LH, FSH [najczęściej spotykana]– zespól Kallmana towarzyszy mu brak węchu, anemia sierpowata TSH – przewlekla niewydolnosc nerek, rzekoma niedoczynnosc przytarczyc ACTH – [najpoważniejsze uszkodzenie] limfocytarne zapalenie przysadki *Karłowatość - przysadkowa = brak GH, rozwój umysłowy prawidłowy - tarczycowa = brak TSH, hormonów tarczyc, często niedorozwój umysłowy (kretynizm) Objawy kliniczne: Objawy niedoboru GH, FSH, LH, TSH, ACTH, PRL: GH – łatwe meczenie, trudność z zapamiętywaniem, brak koncentracji, rozwój osteoporozy, zmniejszenie masy mięśniowej [na korzyść tkanki tłuszczowej] FSH, LH – brak miesiączki, impotencja, obniżenie libido ACTH* – osłabienie, nudności, brak apetytu, niedociśnienie ortostatyczne PRL – niewystępowanie laktacji po porodzie TSH – zwolniony metabolizm, uczucie zimna, senność, skłonność do depresji U chorych z wieloletnią niedoczynnością tendencja do hipoglikemii, osteoporoza oraz nasilona miażdżyca *Niedoczynność kory nadnerczy = zmęczenie, niskie ciśnienie Diagnostyka: wykazanie niedoboru GH, FSH, LH, TSH, ACTH, PRL hormonów obwodowych: IGF-1, estradiolu, testosteronu, kortyzolu wykonanie testów pobudzających (test insulinowy, z LH-RH, ACTH) test insulinowy daje wiele powikłań hipoglikemia wzrost wydzielania innych hormonów niedoczynność przysadki Leczenie: Substytucja: glikokortykosteroidow (hydrokortyzon) estrogenow+gestagenow, testosteronu hormonow tarczycy rekombinowany hormon wzrostu 99 Niedoczynność tylnego płata przysadki MOCZOWKA PROSTA Definicja: choroba charakteryzująca się występowaniem wielomoczy przekraczającego 4 litry na dobę. >40ml/kg/dobę u dorosłych >100ml/kg/dobę u dzieci Etiologia: 1. moczówka prosta centralna: podwzgórzowa – brak uwalniania wazopresyny przez tylny płat przysadki mózgowej 2. moczówka prosta nefrogenna – upośledzona reakcja nerek na wazopresyne Moczówka prosta centralna 1. Pierwotna: (uwarunkowana genetycznie) wrodzona autosomalna dominująca idiopatyczna 2. Wtórna: (uszkodzenie przysadki) uraz czaszki po operacjach neurochirurgicznych guzy wewnątrzczaszkowe – gruczolaki przysadki, czaszkogardlak, przerzuty do przysadki choroby ziarniakowate – sarkoidoza, gruźlica infekcje – zapalenie opon mózgowych, zapalenie mózgu naczyniowe – zawal, tętniak autoimmunologiczne Moczówka prosta nefrogenna - Pierwotna o wrodzona – defekt receptora dla wazopresyny V2 o wrodzona – defekt akwaporyny o idiopatyczna - Wtórna ◦ przewlekle choroby nerek – zwyrodnienie wielotorbielowate nerek, przewlekle odmiedniczkowe zapalenie nerek ◦ choroby metaboliczne – hyperkalcemia (↗Ca), hypokalemia (↘K) ◦ indukowane lekami (lit) ◦ choroby układowe – amyloidoza, szpiczak mnogi Objawy kliniczne 1. Wzmożone pragnienie 2. Wielomocz (>20 l/dobę) 3. Odwodnienie Leczenie - analog wazopresyny = desmopresyna (doustnie 0,10,2 mg/dobę) Polidypsja psychogenna: o idiopatyczna o związana z psychozami o pochodzenia podwzgórzowego (sarkoidoza) o autoimmunologiczna – stwardnienie rozsiane Diagnostyka: Objawy kliniczne o polidypsja, poliuria 8-10l/dobę o ciężar właściwy moczu 1001-1005g/l o osmolalność moczu 50-200 mosmol/kg < osmolalność surowicy (>300mosmol/kg) stężenie sodu w surowicy normalne lub podwyższone stężenie wazopresyny niskie bądź nieoznaczalne (moczówka centralna) próba odwodnieniowo-wazopresyniowa Próba odwodnieniowo-wazopresynowa: 1. przygotowanie nawodnienie pacjenta w dniu poprzedzającym test, zważenie pacjenta 2. faza odwodnieniowa pobieranie krwi na osmolalnosc lub stężenie sodu o godz 8rano, badanie moczu – osmolalość i objętość moczu, co dwie godziny; zakaz picia płynów, ważenie pacjenta 3. faza wazopresynowa podanie donosowo 2kropli desmopresyny, pobranie co najmniej 2 próbek moczu 2 godziny po podaniu desmopresyny 100 Faza odwodnieniowa Test przerywany, jeśli: nastąpi utrata masy ciała ok 3-5% ciężar właściwy moczu w kolejnych próbkach osiągnie plateau ok 1001/g/l wystąpią objawy nietolerancji ze ↘RR, ↗akcji serca w pozycji stojącej Leczenie: analog wazopresyny – desmopresyna doustnie 0.3-0.6mg/dobę w 3dawkach (minirin) donosowo w dawce 5-20ug (0.05-0.2ml) co 12h (Adiuretin) – analog Dawkę dobiera się indywidualnie pod kontrola bilansu płynów i stężenia sodu w surowicy Nadczynność tylnego płata przysadki Zespół nadmiernego wydzielania wazopresyny (Zespół Schwartza-Barttera, SIADH) Zespól nadmiernego w stosunku do osmolalnosci osocza (nieadekwatnego) wydzielania wazopresyny prowadzący do zatrzymywania wody w organizmie, obniżenia osmolalnosci, hiponatremii Etiologia: nowotwory choroby ośrodkowego układu nerwowego choroby klatki piersiowej leki Nowotwory: raki (drobnokomórkowy płuca, trzustki, prostaty, pęcherzyka żółciowego) grasiczak śródbłoniak chloniaki carcinoid = rakowiak Choroby klatki piersiowej: zapalenie płuc gruźlica ropniak opłucnej odma opłucnowa astma oskrzelowa aspergiloza (kropidlakowe zapalenie płuc) Choroby ośrodkowego układu nerwowego: uraz czaszki, operacje neurochirurgiczne ropień mózgu zapalenie opon mózgowych i mózgu zespól Guillain-Barre krwotok śródmózgowy wodogłowie padaczka Leki: wazopresyna i analogi (przedawkowanie) chloropropamin = przeciwcukrzycowe winkrystyna, winblastyna = cytostatyki tiazydy = moczopędne selektywne inhibitory wychwytu zwrotnego serotoniny = leki odchudzające Objawy kliniczne: hiponatremii, większość chorych bezobjawowa anoreksja, nudności, wymioty, zmęczenie, kurczę mięśni, mioklonie, niedrożności jelit, atrakcja, bole głowy, drgawki, śpiączka Leczenie: leczenie przyczynowe ograniczenie podaży płynów <500ml/dobę demeklocyklina sole litu antagoniści receptora V2 furosemid + suplementacja sodu Rozpoznanie: hiponatremia z niska osmolalnoscia osoczna osmolalnosc moczu > osmolalnosc osocza zwiększone wydalanie sodu z moczem brak objawów hipowolemii, obrzęków, hipotensji prawidłowa funkcja nerek i nadnerczy 101 Różnicowanie poliurii Osmolalność Osocza Moczu Moczu podczas próby odwodnieniowej Moczu po podaniu desmopresyny St wazopresyny w osoczu Moczówka prosta centralna ↑ ↓ Bez zmian Moczówka prosta nefrogenna ↑ ↓ Bez zmian Polidypsja psychogenna ↑ Bez zmian ↑ Niskie Prawidłowe lub wysokie Niskie Diagnostyka różnicowa hiponatremii Hipowolemia Euwolemia Pozakomórkowy Na Zawartość H2O w org Przyczyny ↓ ↓ ↑ Hiperwolemia ↓↓ Bez zmian ↑ ↓ ↑ ↑↑ Utrata przenerkowa Diuretyki Niedobór mineraloKS, salt-losing nephritis Utrata pozanerkowa Wymioty, biegunka, oparzenia SIADH Niedoczynność tarczycy Nied. Kory nadnerczy Niewydolność krążenia Marskość wątroby Niewydolność nerek > 20 < 10 > 20 < 10 > 20 [Na+] w moczu [mmol/l] Gruczolaki przysadki Guzy przysadki (gruczolaki) stanowią około 10% wszystkich guzów wewnątrzczaszkowych, są najczęstsza przyczyną zaburzeń czynności układu podwzgórzowo-przysadkowego (najczęściej nadczynności, rzadziej niedoczynności) Ze względu na wielkość dzielimy je na: mikrogruczolaki – średnica < 10mm makrogruczolaki – > 10mm Gruczolaki przysadki: prolactinoma – nadmiar PRL ok 40% akromegalia – nadmiar GH ok 20% choroba Crushinga nadmiar ACTH ok 10% incidentaloma – nadmiar FSH, LH podjednostek alfa i beta – ok 30% tyreotropinoma – nadmiar TSH <1% Około 25% to guzy mieszane wydzielające więcej niż jeden hormon Objawy miejscowe guza: - bóle głowy u > 60% - ubytki w polu widzenia (niedowidzenie połowicze, dwuskroniowe) ucisk guza na skrzyżowanie wzrokowe - zaburzenia czynności nerwów gałkoruchowych (III, IV, VI nerw) (podwójne widzenie, zez) duże guzy okolicy siodła tureckiego - obrzęk tarczy nerwów wzrokowych - płynotok z nosa 102 Prolaktinoma gruczolak przysadki wydzielający w nadmiarze PRL Najczęstszy gruczolak przysadki > Stanowi okolo 40% guzow przysadki Hiperprolaktynemia hamuje czynność gonad i prowadzi do hipogonadyzmu hipogonadotropowego Macroprolactinoma częściej u mężczyzn Fizjologia PRL prolaktyna PRL białko o masie cząsteczkowej 23 kDa zbudowane z 199 aminokwasów Wydzielane przez komórki laktotropowe części gruczołowej przysadki Ważna rola w regulacji układu reprodukcyjnego Poza typową cząsteczką PRL (23kDa) (85-95% krążącej) występują 2 inne jej postacie - „Big PRL” o masie cząsteczkowej 45-50 kDa - „Big-Big” PRL (makroprolaktyna) o masie 150-170 kDa Wydzielanie PRL = Norma - do 25 ng/ml Maksymalne stężenie PRL - 4h po zaśnięciu Minimalne stężenie PRL - 6h po obudzeniu Wzrasta ↑ w okresie dojrzewania, podczas stresu i w czasie ciąży 10-20krotnie Spada ↓ po menopauzie w połogu u niekarmiących matek powrót do normalizacji w czasie 3tygodni Czynniki hamujace: - PIF (prolactin inhibitor factor) dopamina hamuje syntezę i uwalnianie PRL, dzialajace poprzez podtyp D2 receptora dopaminowego - GABA (kwas γ-aminomasłowy) - GAP – prohormon GnRH - Somatostatyna (znaczenie drugorzędne) Czynniki pobudzajace: 1. TRH – bezpośrednio na komórki laktotropowe przysadki 2. TSH 3. VIP 4. GHRH - w przypadku akromegalii z guzem wydzielającym GHRH 5. oksytocyna 6. galanina 7. substancja P 8. CRH 9. ACTH 10. Peptydy opioidowe prawdopodobnie poprzez antagonizowanie hamującego wpływu dopaminy 11. Angiotensyna II (↑ PRL i proliferacji laktotropów) 12. Estrogeny - pobudzają syntezę i wydzielanie PRL, nasilają proliferację komórek laktotropowych 13. Β-endorfiny 14. Serotonina - receptory 5HT1A, 5HT2A, 5HT2C 15. Bombezyna 16. EGF - nabłonkowy czynnik wzrostu 17. Endogenna histamina rec H2, presynaptyczne H3 Mechanizm dzialania dopaminy: Typ DA1 – ↑cAMP TYP DA2 – ↓cAMP centralny receptor dopaminowy : - D1-like: D1A, D1B, D5 - D2-like: D2, D3, D4 103 Prolaktyna a układ rozrodczy: Działanie na gruczoł sutkowy : mammotropowe, laktogenne, galaktopoetyczne Działanie na jajniki – w przypadku hiperPRL niewydolność ciałka żółtego -> spadek progesteronu Działanie na przysadke – Hiperprolaktynemia = hamowanie pulsacyjnego wydzielania LH – obniżenie amplitudy i częstotliwości. Hiperprolaktynemia: Stan związany z nadmiarem PRL Stężenia w surowicy ponad 20ng/ml u kobiet > 15ng/ml u mężczyzn Jest to najczęściej występujące zaburzenie osio podwzgórzowo-przysadkowej Podział hiperprolaktynemii ze względu na przyczyny 1) Patologie przysadki 2) Uszkodzenie podwzgórza 3) PCOS - ↑ insulina ↑ PRL - W każdym przypadku hiperprolaktynemii powinno się wykluczyć zespół policystycznych jajników 4) Schorzenia okolicy brodawek sutkowych 5) Hiperandogenemia (nie PCOS) - zespół Forbesa-Albrighta 6) Guzy ektopowo wydzielające PRL 1) Patologie przysadki Guzy hormonalnie czynne o Prolactinoma 90% microprolactinoma - częściej u kobiet w wieku rozrodczym > poniżej 1 cm 10% makroprolactinoma średnica powyżej 1 cm; częściej u mężczyzn i kobiet po menopauzie, powiększa się z czasem o Gruczolaki wydzielające PRL/GK lub PRL/ACTH Zmiany, które nie wydzielają hormonów (Zmiany organiczne) o Nieczynne gruczolaki przysadki - incydentaloma o Czaszkogardlak o Guzy komórek rozrodczych = Rozrodczaki pozagonadalne o Oponiaki o Puste siodło o Zmiany naciekowo-zapalne Limfocytowe zapalenie przysadki o Torbiele kieszonki Rathkego o Sarkoidoza o Zmiany naczyniopochodne (udar przysadki, naczyniak, tętniak tętnicy szyjnej wewnętrznej) 2) Uszkodzenie podwzgórza i lejka (bo jest to droga hamowania PRL przez dopaminę) Glejaki Stany po zapaleniu opon mózgowych Uszkodzenie pourazowe, pooperacyjne i po leczeniu energią promienistą Uszkodzenia naczyniowe Odległe przerzuty nowotworowe Hiperstenoza czołowa *Ad 1) i 2) W powyższych stanach dochodzi do niedostatecznego hamowania wydzielania PRL przez dopaminę (bo brak dopaminy!) 104 Podział hiperprolaktynemii 1) Czynnościowa a) Fizjologiczne przyczyny zwiększenia wydzielania PRL b) Leki zwiększające PRL c) Niepełna regrecja poporodowa laktotropów przysadki (zespół Chiariego-Frommela) d) W pierwotnej niedoczynności tarczycy (↑ TSH) e) Psychogenna, związana ze wstrząsem f) Powstająca odruchowo po operacjach klatki piersiowej g) Wynikająca ze zwiększonej aktywności serotoniny, endorfin, VIP a) Fizjologiczne przyczyny zwiększenia wydzielania PRL Działanie estrogenów - ciąża, poród, połóg, okres płodowy i noworodkowy Stymulacja brodawki sutkowej - okres laktacji Stymulacja szyjki macicy - ↑ PRL po stosunku płciowym Sen - ↑ PRL po godzinach nocnych Stres Hipoglikemia ↓ Wysiłek fizyczny Podniecenie seksualne b) Leki zwiększające PRL - Neuroleptyki i leki przeciwdepresyjne Chlorpromazyna Pimozyd Haloperydol Sulfpiryd Butyrofenon Imipramina Meprobamat *Poprzez przyspieszenie „obrotu” (turn-over) dopaminy w podwzgórzu lub blokowanie mózgowych receptorów dopaminowych - Leki przeciwwymiotne i pobudzające perystaltykę Metoklopramid Tietylperazyna *Poprzez przyspieszenie „obrotu” (turn-over) dopaminy w podwzgórzu lub blokowanie mózgowych receptorów dopaminowych - Leki obniżające ciśnienie krwi *Poprzez wypłukanie dopaminy z zakończeń postsynaptycznych Rezerpina Metylodopa - Leki przeciwhistaminowe *Poprzez antagonizm z receptorami histaminowymi Cymetydyna Meklozyna - Estrogeny *poprzez wzmożenie syntezy - Opiaty *poprzez pobudzenie receptorów opiatowych Morfina 2) Hiperprolaktynemia spowodowana upośledzoną degradacją hormonu a) Przewlekła niewydolność nerek - 70-90% kobiet w końcowym stadium niewydolności nerek > zmniejszone nerkowe oczyszczanie prolaktyny oraz zwiększona produkcja związana z zaburzeniami neuroregulacji b) Marskość wątroby - 5-20% pacjentów z alkoholową lub inną marskością wątroby - 50% pacjentów z encefalopatią wątrobową - 50% pacjentek bez marskości wątroby po nagłym odstawieniu alkoholu 105 3) Hiperprolaktynemia idiopatyczna 30% samoistne wyleczenie 60% samoistne wyleczenie przy stężeniu <40ng/ml Patomechanizm hiperprolaktynemii Mechanizm złożony - nieprawidłowa reakcja w obrębie wszystkich narządów, na które działa ten hormon 50-60% przypadków - nadmierne pobudzenie gruczołu sutkowego mlekotok Hiperprolaktynemia bez mlekotoku Mlekotok bez hiperprolaktynemii Osłabienie działania gonadotropin na poziomie receptorów w jajniku Zmniejszenie syntezy estraddiolu w jajnikach zaburzenie funkcjonowania sprzężeń z podwzgórzem i przysadką Zaburzenie czynności jajników = niepłodność Na poziomie podwzgórzowo-przysadkowym Na poziomie jajnikowym Hiperprolaktynemia aktywacja układu dopaminergicznego podwzgórza - zahamowanie własnego wydzielania - zaburzenie pulsacyjnego rytmu uwalniania GnRH i dodatniego sprzężenia zwrotnego z estrogenami - brak jajeczkowania związany z zanikiem cyklicznego wydzielania LH i zaburzenia równowagi między gonadotropinami Objawy: mlekotok u obu płci! (w 30-50% przypadków) - obustronny/ jednostronny - ciągły/ przerywany - spontaniczny/ przy ucisku wzrost masy ciała hipogonadyzm (proporcjonalny do st PRL) połączony z osteopenią obnizenie libido bezpłodność objawy neurologiczne: bóle głowy, niedowidzenie dwuskroniowe (macroprolactinoma!) Kobiety cykle bezowulacyjne = obserwuje się korelację między stopniem nasilenia objawów a stężeniami PRL (ok 30%) zaburzenia miesiączkowania (15-20%) brak miesiączki (15-20%) niedobór estrogenów osteoporoza hirsutyzm – nadmierne owlosienie Mężczyźni ↓ testosteronu Zaburzenia erekcji Ginekomastia 106 Ciąża a gruczolaki wydzielające prolaktynę 1. Około 80% pacjentek z hiperprolaktynemią leczonych agonistą dopaminy może zajść w ciążę 2. Jeśli pacjentka chce karmić piersią, należy jej pozwolić bez obawy stymulacji guza 3. Nie obserwuje się częstszych poronień samoistnych, ciąż ektopowoych ani powikłań ciąży 4. U części pacjentek powrót regularnych miesiączek po ciąży 5. Pacjentka podczas ciąży - głównie ocena pola widzenia i poziomu PRL co miesiąc 6. Zaprzestanie leczenia agonistą dopaminy po zajściu w ciążę zwykle nie wiąże się ze wzrostem guza w czasie ciąży 7. Rozrost guza, jak również bóle głowy i zaburzenia widzenia szybko cofają się pod wpływem agonistów dopaminy 8. Leczenie agonistami dopaminy nie wpływa na poziom PRL w płynie owodniowym leczenie można utrzymać w czasie ciąży lub do niego powrócić, gdy pojawią się wykładniki ekspansji guza Hiperprolaktynemia a hiperinsulinemia 1. Istnieje związek podwyższonego poziomu prolaktyny z hiperinsulinemią spowodowaną wzrostem oporności tkankowej na insulinę 2. U pacjentek z hiperprolaktynemią, rodzinnie obciążonych chorobą wieńcową w młodym wieku albo nieprawidłowym lipidogramem należy rozważyć diagnostykę i leczenie hiperinsulinemii 3. Po leczeniu bromokryptyną opisano wzrost wrażliwości tkanek na insulinę wraz z normalizacją poziomów białka C-reaktywnego i homocysteiny Zespół pustego siodła: przyczyny: wada wrodzona (Niedorozwój przepony siodła), operacja, radioterapia, zawał guza przysadki stwierdza się go w blisko 5% sekcji posiada łagodny przebieg choroby główne niebezpieczeństwo = niepotrzebne leczenie guza przysadki pacjentki z ↑ PRL albo mlekotokiem i pustym siodłem - raz w roku przez kilka lat badania kontrolne PRL i obrazowanie przysadki leczenie bezpieczne = leczenie hormonalne lub indukcja jajeczkowania Zespół Sheehana: ostre niedokrwienie i martwica przysadki spowodowana krwotokiem poporodowym i wstrząsem objawy niedoczynności przysadki pojawiają się wkrótce po porodzie - brak laktacji - utrata owłosienia łonowego i pachowego - niedobory hormonu wzrostu i gonadotropin; rzadziej ACTH i TSH zespół Sheehana może zagrażać życiu Objawy hiperprolaktynemii 1. PRL dużego stopnia >100 ng/ml - brak miesiączki - mlekotok - hipogonadyzm 2. PRL średniego stopnia 50-75 ng/ml - rzadkie miesiączkowanie - możliwy mlekotok 3. PRL małego stopnia 20-50 ng/ml - zaburzenia miesiączkowania - niedomoga lutealna - niepłodność - zmniejszenie libido 107 Rozpoznanie: kilkakrotne oznaczeni stężenia PRL określenie dobowego profilu stężeń PRL diagnostyka obrazowa MRI test z metoklopramidem (MCP) = test stymulacji *gdy PRL >150, to NIE WYKAZUJE rytmu dobowego i NIE WZRASTA po stymulacji MCP! Wskazania do oznaczenia PRL Amenorrhoea secundaria (wtórny brak miesiączki) Zaburzenia podwzgórzowoprzysadkowe Galactorrhoea (mlekotok) Zaburzenia owulacji Niepłodność o niewyjaśnionej przyczynie Oligospermia u mężczyzn Wskazania do oceny siodla tureckiego: PRL >100 ng/ml objawy neurologiczne zaburzenia miesiączkowania – amenorrhoea/galactorrhea oporna na leczenie, niereagująca na test P Test z metoklopramidem MCP podaje się doustnie w dawce 10 mg a stężenie PRL oznacza się przed zażyciem leku, w 60 i 120 minucie po zażyciu leku Zwiększenie stężeń PRL u osób zdrowych nie powinno przekraczać 400-600% poziomu podstawowego, natomiast większy wzrost tych stężeń może przemawiać za utajoną hiperprolaktynemią Z kolei brak wzrostu PRL po MCP przy wysokim stężeniu wyjściowym, ma przemawiać za guzem prolaktynowym lub innymi zmianami organicznymi w okolicy podwzgórzowo-przysadkowej Leczenie: 1. Bromokryptyna – antagonista rec. D2, mozna podawac jak kobiety planują ciąże, częściowy antagonista D1 2. Kabergolina – antagonista receptorów D2 3. Pergolid 4. Quinagolid Z uwagi na wysoka efektywność leczenia farmakologicznego rzadko stosuje się leczenie operacyjne. Farmakoterapia bardziej opisana … ale nie chce mi się już przepisywać xD 108 AKROMEGALIA: Czynnosci osi GH-IGF-1 GH jest wytwarzany w przednim placie przysadki w odpowiedzi na stymulujący wpływ podwzgorzowego GHRH jednocześnie podwzgórzowa somatostatyna hamuje wytwarzanie GH w przysadce. Przedni płat przysadki wytwarza miejscowo pod wpływem GH niewielkie ilości IGF-1 IGF-1 zwrotnie hamuje uwalnianie GH z przysadki, wytwarzany jest głównie w wątrobie: zwrotnie działa bezpośrednio hamująco na wytwarzanie GH lub pośrednio przez stymulacje wytwarzania somatostatyny w podwzgórzu. Rola GH w ustoju działanie pobudzające wzrost – wpływa na chrząstkę wzrostowa kości nasilenie transportu aminokwasów do komórek: wzrost syntezy bialek, hamowanie katabolizmu bialek działanie lipolityczne – bezpośrednia stymulacja uwalniania wolnych kwasów tłuszczowych z tkanki tluszczowej, zmniejszenie rezerw tłuszczowych w surowicy – przesuniecie lipidów do wątroby działanie na metabolizm glukozy – podobnie do działania insuliny – natychmiast po dożylnym podaniu GH, jak i diabetogenne – w dłuższym okresie czasu nadmiar GH upośledza wykorzystanie glukozy poprzez postreceptorowe hamowanie działania insuliny, nasila glukogeneze działanie mitogenne na tymocyty, komórki ściany tętnic, linie erytrocytarna szpiku kostnego. IGF-1 moze dzialac: na drodze endokrynnej jak klasyczny hormon, po dotarciu droga układu krążenia do tkanek docelowych posiadających specyficzny receptor na drodze parakrynnej wydzielany do przestrzeni pozakomórkowej na sąsiednie komórki na drodze autokrynnej – na komórkę wytwarzającą ten czynnik Rola IFG w ustroju: 1. właściwy hormon wzrostu – powoduje akceleracje wzrostu działając na chrząstkę nasadowa kości 2. łącznie z IGF-2 decyduje o wzroście płodu – dzieci z uszkodzonym genem dla IGFs rodzą się ze znacznie obniżona masa ciała pomimo prawidłowego czasu trwania ciąży 3. obniżony poziom glikemi – aktywność IGF-1 jest 10 razy mniejsza niż insuliny 4. pobudza proliferacje komórek i różnicowanie morfologiczne i czynnościowe komórek 5. hamuje obumieranie komórek 6. pobudza aktywność limfocytów i makrofagów 7. zwiększa namnażanie i dojrzewanie komórek układu hemopoetycznego, przyspiesza dojrzewanie makrofagów, przyspiesza migracje limfocytów T do grasicy 8. odgrywa role jako neurotransmiter i neuromodulator w OUN – przewaga działania autokrynnego. zespól objawów w postaci powiększenia twarzoczaszki, dłoni, stop, rozrostu tkanek miękkich oraz narządów wewnętrznych w następstwie nadmiernego wydzielania hormonu wzrostu GH przez gruczolaka z komórek somatotropowych przysadki, Akromegalia: Rzadka choroba wynikająca z nadmiernego wydzielania hormonu wzrostu (GH) przez guz przysadki (komórki somatotropowe) Nadmiar GH powoduje ↑ syntezę insulinopodobnych czynników wzrostowych = somatomedyn (głównie IGF-1) Powoduje 3-5 krotnie większe ryzyko zgonu w porównaniu ze zdrową populacją Etiologia: gruczolak przedniego płata przysadki (akromegalia najczęściej makrogruczolak, prolactinoma - mikro) ektopowe wydzielanie GhRH <1% ektopowe wydzielanie GH 109 Wystepowanie: 4-5 nowych przypadkow na 1mln/ rocznie 70 przypadków na 1milion kobiety: mężczyźni 1:1 w 5 dekadzie życia opóźnienie rozpoznania około 5-10 lat (średnio 8 lat) z powodu powolnego rozwoju i dyskretnych objawów klinicznych *czesto gdy duży guz bardzo nasilone deformacje, obecne powikłania zmniejszona możliwość radykalnego leczenia Objawy charakterystyczne 1. Powiększenie dłoni, stóp, części twarzowej czaszki (m.in. żuchwy, kości czołowej) 2. Rozrost tkanek miękkich (języka, warg, nosa, podniebienia), kości oraz narządów wewnętrznych (serca, wątroby) 3. Nadmierna potliwość 4. Bóle głowy 5. Prognatyzm = Wysunięcie żuchwy 6. Powiększenie przestrzeni międzyżebrowych 7. U części kobiet zaburzenia miesiączkowania i mlekotok 8. U części mężczyzn obniżenie libido i impotencja 9. Wole miąższowe lub guzowate 10. Niekiedy objawami dominującymi są Zmiany zwyrodnieniowe stawów (biodrowych, kolanowych, kręgosłupa) Zespół cieśni nadgarstka najczestsze przyczyny zgonu w tej grupie chorych: 1. zgon z powodu powikłań naczyniowych – zawal serca, udar mózgu, zator tętnicy płucnej 50% 2. zgon z powodu nowotworu – jelita grubego, sutka, prostaty, nowotwory krwi) 21,6% 3. zgon z powodu powikłań oddechowych – zespół snu z bezdechem – 16,1% *normalizacja wydzielania GH (<2,5 ng/l) wydłuża oczekiwaną długość przeżycia Objawy kliniczne: zmiany wyglądu 98% zab miesiaczkowania 72% nadmierna potliwosc 64% glownie noca bol glowy 55% parastezje 40% zaburzenia wzwodu 36% nadcisnienie 28% wole 19% 110 Zaburzenia metaboliczne i powikłania Nieleczona akromegalia istotnie (2-3 krotnie) zwiększa ryzyko śmierci z powodu powikłań sercowonaczyniowych. 1. Ze strony układu krążenia stwierdza się nadciśnienie tętnicze przerost mięśnia sercowego LK = zwiększenie grubości ściany, przerost koncentryczny (nawet bez nadciśnienia) niewydolność serca upośledzenie funkcji rozkurczowej LK i PK, frakcja wyrzutowa upośledzona w czasie obciążenia, a nie w spoczynku 2. Upośledzona tolerancja węglowodanów – cukrzyca 3. ↑ ryzyka rozwoju polipów jelita grubego nowotworów raka jelita grubego, raka sutka, nerek, tarczycy i gruczołu krokowego 4. Powiększenie języka i przerost podniebienia miękkiego ▪ zespół bezdechu śródsennego ▪ zmiana barwy głosu 5. Inne wole miąższowe i guzowate deformacja szkieletu i artropatie Kryteria rozpoznania: brak hamowania wydzielania GH <1 ng/ml po doustnym obciążeniu glukoza wzrost wydzielania IGF-1 powyżej 700ng/ml u mlodszych, a 400ng/ml u starszych w MRI obecność guza przedniego płata przysadki *W chwili rozpoznania większość guzów ma >1 cm Nadciśnienie w akromegalii - GH = retencja Na - IGF-1 = dysfunkcja śródbłonka - czynniki wzrostowe - insulina - przyrost masy ciała Objawy towarzyszące - ARO = obniżona, nie wzrasta po pionizacji ani lekach moczopędnych - nadciśnienie „nisko …” - aldosteron = prawidłowy Leczenie: Przyczynowe i Objawowe Leczenie operacyjne = Terapia z wyboru wybiorcza adenomektomia z dojścia przez zatokę klinowa – przez nos możliwość reoperacji dojście przez kraniotomie (rzadko) 111 Cel postepowania neurochirurgicznego: całkowite wyleczenie odbarczenie skrzyżowania nerwów wzrokowych – ratowanie wzroku równowaga hormonalna pooperacyjna weryfikacja skuteczności zabiegu -> GH po tygodniu -> IGF-1 po 10 tygodnich od zabiegu Leczenie farmakologiczne: analogi somatostatyny Oktreotyd (i.m co 28 dni) i Lanreotyd (s.c co 14 dni/28 dni) a) Leczenie wspomagające w okresie przed- i pooperacyjnym, w oczekiwaniu na efekt radioterapii b) Leczenie pierwszoplanowe w przypadkach nieoperacyjnych c) Skuteczność leczenia zależy od - wielkości guza - gęstości receptorów somatostatynowych w guzie - wyjściowego poziomu GH d) Objawy niepożądane - bradykardia (25%) - kamica żółciowa (25%, objawowa u 1%) - czasem pogorszenie tolerancji glukozy (hamowanie wydzielania insuliny) Kontrola biochemiczna u 60% leczonych (90% mikro, 40-50% makro) Zmniejszenie guza u 30% agonisci receptorów dopaminergicznych D2 skuteczni przy współwydzielaniu PRL i GH (mixed adenoma) i gdy IGF-1 < 750 ng/ml - bromokryptyna = normalizuje GH u 10% leczonych - kabergolina normalizuje GH u 39% leczonych Można łączyć agonistów dopaminy i analogi somatostatyny. Bromkryptyna do 30 mg/dzień (Parlodel, Bromergon, Bromocorn) Kabergolina (Dostinex) Chinagolid (Norprolac) antagonisci receptora GH (działają obwodowo) Pevigsomant - hamuje dimeryzację, normalizacja metaboliczna - wskazany w oporności na analogi somatostatyny - Pegvisomant normalizuje wydzielanie IGF-1 u 90% leczonych, może być zwiększone wydzielanie GH (zaburzenie sprzężenia zwrotnego), wzrost guza - Konieczność codziennych iniekcji - wysoki koszt - Objawy niepożądane: zaburzenia czynności wątroby W szczególnie trudnych przypadkach Radioterapia = Leczenie energią promienista: konwencjonalna radio/kobaltoteriapia 40-50 Gy, funkcjonowane dawki 2.0-2,5 Gy na 4-5 sesji tygodniowo gamma tereotakrtyczna radiochirurgia „gamma knife” Kryteria wyleczenia: hamowanie GH <1.0 ng/ml w teście doustnego obciążenia glukoza normalizacja wydzielania IGF-1 112 Znaczenie wczesnego rozpoznania i skutecznego leczenia akromegalii - w akromegalii występują zmian fali centralnego ciśnienia tętniczego wskazujące na stwardnienie dużych naczyń - znaczenie dla morfologii i wydolności serca, oraz podatności na miażdżycę - kardiomiopatia w akromegalii jest odwracalna u większości młodych pacjentów, z krótkim czasem trwania choroby i osiągająca wyrównanie choroby w czasie leczenia SSA przez 12 miesięcy Zespół Cushinga Podział: 1. ACTH zależny zespól crushinga jest to postac przysadkowa – mikgogruczolak, gruczolak, rozrost komorek kortykotropowych – choroba crushinga, zespol ektopowego wydzielania ACTH 2. ACTH niezależny zespól crushinga – posta jatrogenna, gruczolak, rak nadnerczy, przerost guzkowy nadnercza: drobnoguzkowy przerost lub gruboguzkowy Diagnostyka: ACTH-IRMA <5 pg/ml >10pg/ml CT nadnerczy jednostronny guz MRI przysadki obustronny przerost CRH test ACTH<10pg/ml ACTH>20pg/ml -------- operacja nadnerczy prawidłowy -> IPSS nieprawidłowy IPS>2 zespół ektopowego ACTH operacja przysadki IPS<1 Badania obrazowe: MRI mikrogruczolaki przysadki CT mniej przyadatne w ACTH zaleznym zespole Crushinga, dobre do lokalizacji guza nadnerczy – gruczolaki wydzielajace kortyzol zwykle >2cm Leczenie: ACTH- zalezny zespol wybiorcza przezklinowa selektywna adenomektomia niekiedy przygotowanie farmakologiczne – inhibitory steroidogenezy ( w celu zmniejszenia skazy krwotocznej, wybroczyn, zakrzepow, zakazen bakteryjnych i grzybiczych, nadcisnienia tetniczego, cukrzycy i zaburzen psychicznych) Inhibitory steroidogenezy ketokonazol tabl 0,2g aminoglutetymin tabl 0,25g nie stosowac w ciazy blokuje synteze estrogenow metopiron tabl 0.25g lek z wyboru w ciazy 113 Nadnercza Fizjologia Budowa Kora 1. Warstwa kłębkowata - mineralokortykoidy (aldosteron i jego prekursory) 2. Warstwa pasmowata - glikokortykosteroidy (kortyzol - niezbędny, deoksykortykosteron, kortykosteron, 11-dehydrokortykosteron) 3. Warstwa siatkowata - steroidy płciowe (DHEAS, androstendion, estradiol, testosteron) Rdzeń - aminy katecholowe Regulacja Oś podwzgórze-przysadka-nadnercza (ACTH) Oś renina-angiotensyna-aldosteron Synteza hormonów cholesterol ⇒ prognenolon (wspólny prekursor) ⇒ aldosteron, kortyzol, steroidy płciowe Zaburzenia nadmierna produkcja kortyzolu → hamowanie ACTH uszkodzenie nadnerczy → brak produkcji hormonów uszkodzenie przysadki o brak produkcji kortyzolu o aldosteron zachowany dzięki układowi renina-angiotensyna-aldosteron o steroidy płciowe – produkowane nadal w gonadach Najczęstsze schorzenia 1. Hiperkortyzolemia (zespół Cushinga) 2. Hiperaldosteronizm (zespół Conna) 3. Guz chromochłonny rdzenia nadnerczy (pheochromocytoma) → aminy katecholowe 4. Niedoczynność kory nadnerczy – pierwotna (choroba Addisona) i wtórna 5. Guzy nadnerczy nieczynne hormonalnie 6. Rak nadnerczy Kortyzol Niezbędny do życia W niedoborze = substytucja hydrokortyzonem Rola kortyzolu Utrzymanie homeostazy w organizmie Adaptacja organizmu do sytuacji stresowych (stres zarówno psychiczny, jak i fizyczny) następuje wówczas większe wydzielanie kortyzolu Działanie Kataboliczne - na większość tkanek (łączna, mięśniowa, tłuszczowa, układ chłonny) Anaboliczne - w wątrobie zwiększona biosynteza białek, glukozy, glikogenu 114 Wpływ kortyzolu na gospodarkę 1. Węglowodanową - ↑ nasilenie glukoneogenezy i glikogenolizy w wątrobie - ↓ wychwytu glukozy w tkance tłuszczowej i mięśniowej ↑ st glukozy we krwi → hiperglikemia cukrzyca/ nieprawidłowa tolerancja glukozy 2. Białkową - katabolizm w mięśniach > aminokwasy substratem dla glukoneogenezy - anabolizm w wątrobie (w dużych ilościach) - hiperkatabolizm > rozpad białek zanik mięśni 3. Lipidową - nasila lipolizę na obwodzie - odkładanie kwasów tłuszczowych w obrębie głowy, szyi, tułowia (otyłość centralna) 4. Wodno-elektrolitową = Wykazuje słabe właściwości mineralokortykoidów - ↑ilość Na+ i H2O we krwi ⇢ podwyższa ciśnienie tętnicze, powstają obrzęki [hipernatremia, wzrost objętości płynów krążących] - ↑wydalanie K+⇢ hipokaliemia - ↓wchłanianie Ca w jelitach, ↑ wydalanie – hipokalcemia + hiperkalciuria Wpływ kortyzolu na układ 1. Kostny - stymuluje osteoklasty ⇢ osteoporoza - hamuje funkcje osteoblastów 2. Sercowo-naczyniowy - ↑ kurczliwość mięśnia sercowego - ↑ wrażliwość receptorów dla amin katecholowych - ↑ frakcję wyrzutową serca - ↑ napięcie mięśniówki naczyń → nadciśnienie 3. Współczulny = Zwiększa wrażliwość układu współczulnego – adaptacja do stresu Działanie przeciwzapalne i immunosupresyjne Hamowanie biosyntezy mediatorów reakcji zapalnej: bradykininy, serotoniny, histaminy, niektórych cytokin i enzymów niszczących tkanki ↓ liczby limfocytów, monocytów i eozynofilów ↓ migracja w/w komórek do ognisk zakażenia i miejsc urazu 1. 2. 3. 4. 5. 6. 7. Badania laboratoryjne funkcji nadnerczy Stężenie kortyzolu i ACTH w surowicy o godz 8 i 18 (rytm dobowy - najwyższe stężenie rano, najniższe w godzinach 23-24) Dobowe wydalanie wolnego kortyzolu z moczem Test hamowania DEX (deksametazonem) Test stymulacji syntetycznym ACTH (synakten) lub CRH Aldosteron we krwi i moczu ARO = aktywność reninowa osocza Metoksykatecholaminy w DZM 115 Test supresji z Deksametazonem (DEX) 1 (2) mg - krótki test hamowania DEX: 1(2) mg DEX o 23:00 > pomiar stężenia kortyzolu w surowicy o 8:00 Norma: prawidłowe stężenie kortyzolu ulega obniżeniu o >50% - długi test hamowania DEX Podawanie doustne przez 2 dni 2 mg/dobę Przez 2 kolejne dni 8 mg/dobę Oznaczanie stężenia kortyzolu w surowicy i w DZM na początku testu, po 2 dobie i po 4 dobie Interpretacja wyników - fizjologicznie: zahamowanie po 2 mg DEX - zespół Cushinga = postać przysadkowa - brak hamowania po 2 mg, zachodzi po 8 mg DEX - hiperkortyzolemia nadnerczowa i ektopowa = wydzielanie ACTH - brak hamowania po 8 mg DEX 116 Hiperkortyzolemia (Zespół Cushinga) Zespół objawów klinicznych uwarunkowany przewlekłą kortyzolemią Nadmierne stężenie endo- i egzogennych glikokortykosteroidów. (gruby pacjent z chudymi kończynami) * Choroba Cushinga jest zdefiniowana jako specyficzny typ zespołu Cushinga, spowodowany nadmiernym wydzielaniem przysadkowego ACTH z guza przysadki Przyczyny hiperkortyzolemii ACTH zależny (80%) (nadmierna produkcja ACTH → hiperkortyzolemia) o Przysadkowa choroba Cushinga (85%) = gruczolak przysadki lub inny guz - rozpoznawane przez MRI (wykazuje zmiany > 2-3 mm -mikrogruczolak (10 mm), gruczolak - rozrost komórek kortykotropowych o Zespół ektopowego wydzielania ACTH (15%) = nowotwór poza przysadką produkujący ACTH Rak drobnokomórkowy płuc rak rdzeniasty tarczycy guz chromochłonny = pheochromcytoma guzy wysp trzustkowych karcinoid płuc, grasicy, jelit, trzustki, jajnika obraz kliniczny: dominują objawy choroby nowotworowej w badaniach dodatkowych: hiperkaliemia, duży wzrost ACTH i wzrost RR ACTH niezależny (20%) (patogeneza związana z produkcją kortyzolu – przyczyna w nadnerczach = pierwotna hiperkortyzolemia obniżone stężenie ACTH) o pierwotna hiperkortyzolemia wtórna do gruczolaka nadnerczy o przerost guzkowy nadnerczy drobno- i gruboguzkowy o Gruczolak nadnerczy wydzielający kortyzol (10%) [zwykle w jednym nadnerczu] o Rak nadnerczy wydzielający kortyzol (8%) o postać jatrogenna = steroidoterapia - długotrwałe stosowanie kortyzolu lub ACTH - przewlekłe leczenie kortykosteroidami = działanie uboczne terapii niektórych chorób reumatologicznych, autoimmunologicznych czy hematologicznych Objawy kliniczne Zmiany somatyczne o otyłość centralna (głowa, szyja, tułów) twarz księżycowata, kark bawoli, poduszki tłuszczowe w dołach nadobojczykowych o zaniki mięśni ▪ obręczy barkowej i biodrowej ▪ proksymalnych części kończyn o osteopenia, osteoporoza bóle kostne, złamania patologiczne (kręgi, żebra) martwica aseptyczna kości o skóra o o naczynka krwionośne rozszerzone i pękające (plethora = zaczerwienie skóry twarzy) cienka, pergaminowata, prześwitują naczynia krwionośne sino-czerwone rozstępy na skórze tułowia i kończyn łatwe siniaczenie (dochodzi do wylewów podskórnych), wynaczynienia = rozległe siniaki na całym ciele u kobiet hirsutyzm, zarost, trądzik objawy neuropsychiczne dysfunkcje gonad 117 1) 2) 3) 4) Zmiany metaboliczne upośledzenie tolerancji glukozy cukrzyca zasadowica hipokaliemiczna W badaniach laboratoryjnych o Zasadowica o hipokaliemia o hiperlipidemia o nadpłytkowość o zwiększenie odsetka granulocytów o poliuria, kamica nerkowa Powikłania narządowe: przewód pokarmowy o owrzodzenia, nadżerki, krwotoki, zmiany zapalne, ostre zapalenie trzustki powikłanie okulistyczne o zaćma, jaskra sercowo-naczyniowe o nadciśnienie tętnicze - retencja Na i wody > wynika z mineralokortykokoidowego działania kortyzolu - ↑ napięcia mięśniówki naczyń - ↑ wrażliwość receptorów adrenergicznych na działanie katecholamin o kardiomiopatia przerostowa o niewydolność serca (w zespole Cushinga długość życia jest zmniejszona, głównymi przyczynami śmierci są niewydolność serca lub cukrzyca) o udar mózgu o powikłania zatorowo-zakrzepowe układ immunologiczny o upośledzone reakcje zapalne o zmniejszona odpowiedź humoralna i komórkowa - upośledzone gojenie ran, - uogólnione zakażenia swoiste i nieswoiste - grzybice, skóry i błon śluzowych - zapalenia płuc układ dokrewny = hamowanie czynności przysadki o komórek tyreotropowych (↓ sekrecji TSH) - wtórna niedoczynność tarczycy spadek wagi pacjentów o gonadotropowych (LH) - ↓ sekrecji LH i FSH Objawy hipogonadyzmu = hipogonadyzm hipogonadotropowy zmiany psychiczne o niepokój, nadmierna pobudliwość, bezsenność, depresja, obniżony nastrój o psychozy = mogą nawet zdarzać się próby samobójcze (także przewlekła steroidoterapia może doprowadzić do zaburzeń psychicznych) układ płciowy o u mężczyzn o u kobiet - zmniejszenie libido - nieregularne krwawienia - impotencja miesiączkowe - cykle bezowulacyjne - brak miesiączki - bezpłodność/ problemy z zajściem w ciąże 118 Kryteria rozpoznania 1. Wyniki badań hormonalnych 2. Charakterystyczne jest ZNIESIENIE rytmu dobowego = wysokie stężenia rano, jak i w nocy 3. Nieprawidłowe wyniki testów, np. - brak hamowania wydzielania kortyzolu w godzinach rannych po podaniu małej dawki DEX (deksametazonu) wieczorem [kortyzolemia po 1 mg DEX > 1,8 mg/l] 4. Ocena stężenia ACTH ~ różnicowanie - ↑ ACTH = gruczolak przysadki lub ektopowe wydzielanie ACTH - ↓ ACTH = guz nadnerczy Badania laboratoryjne funkcji nadnerczy: 1. Stężenie kortyzolu i ACTH (prawidłowo ACTH rano jest najwyższe, a w nocy najniższe – rytm dobowy) a. ACTH niskie – guz w nadnerczach b. ACTH podwyższone – guz w przysadce c. ACTH bardzo wysokie - nowotwór 2. Wydalanie dobowe kortyzolu z moczem 3. Test hamowania deksametazonem: o 23:00 podaje się 1-2mg Dexa, o 8:00 mierzy się poziom stężenia kortyzolu we krwi (norma <1,8μg% - wyklucza zespół Cushinga) 4. Test stymulacji syntezy ACTH 5. Test stymulacji syntezy CRH Badania podstawowe: Laboratoryjne o morfologia: leukocytoza, limfopenia o gospodarka lipidowa o gospodarka węglowodanowa: upośledzenie tolerancji glukozy ⇢ cukrzyca typu 2 o elektrolity: ↓K, ↑Na Obrazowe o TK nadnerczy (kiedy ACTH niskie) o MR przysadki (kiedy ACTH wysokie) Różnicowanie z innymi przyczynami hiperkortyzolemii Stany fizjologiczne o stres o intensywne ćwiczenia fizyczne Stany patologiczne o depresja, stany lekowe o anorexia nervosa, otyłość o alkoholizm Leczenie [dokończyć później!] zespół Cushinga ACTH zależny (gruczolak przysadki) – przezklinowe usunięcie guza zespół Cushinga ACTH zależny (zespoły ektopowego wydzielania ACTH) – usunięcie nowotworu, leki hamujące steroidogenezę zespół Cushinga ACTH niezależny (gruczolak nadnerczy) – usunięcie gruczolaka nadnerczy lub adrenalektomia (*przed i po leczeniu stosujemy lek Mitotan 3-12g/d Pierwotna niedoczynność kory nadnerczy (Choroba Addisona) (pacjenci słabną, chudną i ciemnieją) - niedoczynność wszystkich warstw kory = nieprawidłowa funkcja lub destrukcja nadnerczy 119 120 Przełom nadnerczowy nagły niedobór kortyzolu np. po nagłym odstawieniu sterydów etiologia o stres o brak leczenia niedoczynności kory nadnerczy o urazy, operacje jamy brzusznej objawy o osłabienie, spadek ciśnienia o nudności, wymioty o utrata przytomności, śpiączka o zgon leczenie – hydrokortyzon + nawadnianie Pierwotna niedoczynnośc kory nadnerczy Etiologia pierwotnej niedoczynności kory nadnerczy – autoimmunologia (90%) = choroba Addisona - przeciwciała przeciwko 21-hydroksylazie ▪ postać izolowana ▪ wielogruczołowa nadczynność typu I ▪ wielogruczołowa nadczynność typu II – infekcje ▪ HIV i AIDS ▪ CMV ▪ Gruźlica ▪ grzybica – krwawienia do nadnerczy, zakrzepica – naciekanie do nadnerczy = przerzuty, chłoniak, sarkoidoza, hemochromatoza – jatrogenna = usunięcie nadnerczy, polekowa: aminoglutetymid, ketokonazol, mitotan – wrodzona = WPN (wrodzony przerost nadnerczy), oporność nadnerczy na ACTH Objawy przewlekłej niedoczynności zasłabnięcia, osłabienie, znużenie, brak łaknienia = chudnięcie objawy z przewodu pokarmowego = nudności, wymioty, bóle brzucha bóle stawowo-mięśniowe > spadek sprawności wysiłkowej hipotonia ortostatyczna = ↓ RR po pionizacji Objawy ciemnienie skóry – hiperpigmentacja o wzrost ACTH i MSH – 92% o odsłonięte powierzchnie ciała o przebarwienia na łokciach, zgięciach dłoni, kolanach, brodawkach sutkowych o plamiste przebarwienia brunatne o przebarwienia linii papilarnych na brązowo, ciemnieją blizny, śluzówki, wargi, spojówki Diagnostyka – obniżony kortyzol – ACTH – wysoki – wolny kortyzol w DZM – obniżony – testy stymulacji nadnerczy syntetycznym ACTH – niski kortyzol – przyrasta w teście 121 Badania – niedokrwistość, leukopenia – hipoglikemia – niskie ciśnienie, hipotonia – hiperkaliemia, hiponatremia Leczenie hydrokortyzon – 20mg rano, 10mg po południu – zawsze! Cortineff 0,1mg rano – analog aldosteronu (w niedoczynności pierwotnej) parenteralnie o przy wymiotach, biegunce o przed operacjami o przed ekstrakcją zęba w narkozie Wtórna niedoczynność kory nadnerczy Etiologia – po kortykoterapii (najczęściej – wygasanie funkcji komórek produkujących ACTH) – zapalenia i guzy przysadki – urazy czaszki – jatrogenna niedoczynność przysadki po operacji, napromienieniu – hipoplazja przysadki (uwarunkowana genetycznie) – autoimmunizacja Objawy – wolniej narastają, są słabiej wyrażone – brak hiperpigmentacji – bladość Diagnostyka – ACTH – niski Pierwotny hiperaldosteronizm (Zespół Conna) 1% populacji osób chorujących na NT Kobiety > Mężczyźni Aldosteron – ↑ resorpcji sodu w dystalnych cewkach nerkowych – ↑ wydalania potasu i jonów wodorowych – Efekt: hipernatremia, hipokaliemia – ↓stężenia reniny = aktywności reninowej osocza (ARO) > nadciśnienie tętnicze Przyczyny – pojedynczy gruczolak (60%) – przerost kory nadnerczy – rak – ektopowe wydzielanie aldosteronu = najczęściej nowotwory nerek i jajników Objawy kliniczne – nadciśnienie tętnicze (oporne na leczenie) = w zespole Conna wtórne > po wyleczeniu ulegnie wyrównaniu – hipokaliemia → zasadowica metaboliczna – osłabienie mięśni, mrowienia, parestezje – objawy tężyczkowe, kurcze mięśniowe – bóle głowy – cukrzyca Objawy nieswoiste – wielomocz – ↑ wydalania potasu – ↑ pragnienie 122 Badania sugerujące rozpoznanie – hipokaliemia <3,5mmol/l – wydalanie potasu z moczem >50mmol/dobę Badania potwierdzające rozpoznanie – ↑ aldosteronu we krwi (nie można rozpoznać zespołu Conna tylko w oparciu o ten wskaźnik, bo stężenie aldosteronu rośnie też we wtórnej hiperaldosteronemii - np. w niewydolności mięśnia sercowego) – ↑ wydalania aldosteronu z moczem – niska aktywność reninowa osocza – ↑ wskaźnika aldosteron [ng/dl] : ARO [ng/ml/h] > 50 Leczenie gruczolaka kory nadnerczy leczenie operacyjne (w niektórych przypadkach usunięcie samego guza, w większości > całkowita adrenalektomia przygotowanie przedoperacyjne = uzupełnienie niedoboru potasu oraz dieta niskosodowa i bogatopotasowa - diuretyki oszczędzające potas, np. spironolakton 100-400 mg/d przez kilka tygodni przed zabiegiem Wtórny hiperaldosteronizm stenoza tętnicy nerkowej niewydolność serca diuretyki ↑ ARO Guzy rdzenia nadnerczy = Pheochromocytoma Rodzaje 1) Guz chromochłonny = pheochromcytoma 2) Zwojak zarodkowy = neuroblastoma 3) Nerwiak zwojowy = ganglioneuroma 4) Postać mieszana = ganglioneuroblastoma Dokończyć!!! Stary skrypt charakterystyka o wytwarzanie noradrenaliny, adrenaliny, dopaminy, somatostatyny, substancji P, ACTH o 10% złośliwych, 10% w obu nadnerczach, 10% pozanadnerczowo o występuje w genetycznych zespołach rodzinnych o MEN 2A rak rdzeniasty tarczycy, gruczolak przytarczyc o MEN 2B wysokie czoło, gotyckie podniebienie, cechy marfanoidalne, gruczolakowłókniaki o stwierdzenie zespołu MEN – obciążenie całej rodziny → tyreoidektomia profilaktyczna o współistnieje z chorobą Recklinghansena i zespołem von Hippel-Lindau Objawy nadciśnienie tętnicze o napadowe i utrwalone potliwość tachykardia bladość niepokój bóle głowy arytmia hipotonia ortostatyczna 123 Diagnostyka – metoksykatecholaminy w moczu – katecholaminy w moczu – kwas wanilinomigdałowy w moczu – katecholaminy we krwi Badania obrazowe – TK, MR, scyntygrafia 131 I, oktreoskan Powikłania naczyniowe – zaburzenia rytmu serca – zawał – udar – kardiomiopatia – obrzęk płuc –encefalopatia nadciśnieniowa 124 Incidentaloma nadnerczy Charakterystyka Przypadkowo wykryty guz nadnerczy Nieczynny hormonalnie Gruczolak Rak, przerzut Torbiel Mielolipoma Diagnostyka Badania przesiewowe Badania obrazowe o Gruczolak - okrągły, owalny, obrysy gładkie - przed kontrastem współczynnik osłabienia promieniowania <10 j.H - po kontraście < 30 j.H Czynny hormonalnie Zespół Cushinga Pheochromcytoma Aldosteronizm pierwotny o Rak - nieregularny kształt - densyjność > 10j.H - po podaniu kontrastu > 40 j.H Rak nadnerczy Cechy sugerujące raka nadnerczy >4 cm ; ogniska martwicy, nierówne zarysy, naciekanie otoczenia Objawy Chudnięcie Wirylizacja grupa objawów związanych z podwyższonym poziomem męskich hormonów płciowych u kobiet, np. owłosienie typu męskiego, wzrost masy tkanki mięśniowej, zmniejszenie piersi, trądzik, powiększenie łechtaczki Stany podgorączkowe Charakterystyka - rzadki ~~ 1:1,5 mln ; złe rokowanie - 80% wydziela hormony najczęściej kortyzol (prowadzi do zespołu Cushinga z wirylizacją) aldosteron, estrogeny, testosteron - rzadko - leczenie operacyjne, mitotan, ketokonazol Zespół Nelsona - jatrogenna niedoczynność kory nadnerczy po usunięciu obu nadnerczy (przy istnieniu gruczolaka przysadki) niszczymy pętlę sprzężenia zwrotnego z przysadką, co powoduje znaczny wzrost ACTH z czasem doprowadza to do autonomii i rozwoju gruczolaka przysadki (przyczyną zbyt niska substytucja kortyzolu) 125 Cukrzyca Fizjologia Definicja: zespół zaburzeń polegających na nieprawidłowej regulacji metabolizmu węglowodanów, białek i lipidów najbardziej typową biochemiczną cechą cukrzycy jest przewlekła hiperglikemia, wynikająca z bezwzględnego lub względnego niedoboru insuliny rozpoznanie przewlekłej hiperglikemii jest warunkiem sine qua non rozpoznania cukrzycy Patogeneza: niedobór insuliny może być całkowity lub względny (w stanach zwiększonego zapotrzebowania na ten hormon). Tak, więc patogeneza rozumiana, jako ciąg zaburzeń metabolicznych i strukturalnych, będących konsekwencją niedoboru lub całkowitego braku insuliny jest jednolita i wspólna dla wszystkich typów cukrzycy. Czynniki ryzyka wystąpienia cukrzycy, czemu jest więcej przypadków? ∙ cz. środowiskowe (dieta, ruch nadwaga) ∙ predyspozycje genetyczne ∙ płeć ∙ wiek ∙ diagnostyka (spada próg poziomu glukozy uznawany za prawidłowy) Insulina ∙ Główny hormon anaboliczny organizmu (najsilniejszy) ∙ Polipeptyd o masie cząsteczkowej 6000 ∙ Łańcuchy: A - zawierający 21 aminokwasów i B - zawierający 30 aminokwasów, połączone 2 mostkami siarczkowymi między 7 i 20 AM łańcucha a oraz 7 i 19 AM łańcucha b. Łańcuch A zawiera wewnętrzny mostek siarczkowy pomiędzy AM 6 i 11 ∙ Preproinsulina (peptyd sygnałowy) proinsulina (minimalna aktywność) insulina + peptyd C ∙ Peptyd C – wydaje się nie mieć biologicznej aktywności. Oznaczenia st. peptydu C we krwi wykorzystuje się do badania endogennego wydzielania insuliny – diagnostyka cukrzycy typu I ∙ ∙ ∙ ∙ ∙ ∙ Stężenie insuliny we krwi (RIA) na czczo wynosi 10-25 mj/l Wydzielanie podstawowe 40% (w sposób ciągły) Wydzielanie stymulowane przez bodziec (po posiłku) 60% ◦ Insulina jest wydzielana dwufazowo: ◦ faza szybka (insulina zmagazynowana) – przekazuje inf. kom. mięśniowym, tłuszczowym, tk. łącznej, wątroby, że dopłynie do nich duża ilość glukozy – aktywacja receptorów ◦ faza wolna (synteza de novo) – dokończenie procesu obniżania glikemii Trzustka zdrowego człowieka wydziela 24 - 48 jednostek insuliny na dobę Ulega ona szybkiemu rozkładowi w tkankach, głównie w wątrobie i nerkach Znikanie jej z krwi nie jest równomierne i okres półtrwania wynosi u człowieka dla 80% tego hormonu 5 minut, a dla reszty około 2 - 3 godziny Czynniki wpływające na wydzielanie insuliny ∙ stężenie glukozy we krwi dopływającej do wysp trzustkowych ∙ wydzielanie insuliny zwiększają wyraźne aminokwasy, związki ketonowe, kwasy tłuszczowe ∙ glukagon, żołądkowy peptyd hamujący - GIP, cholecystokinina - CCK, wazoaktywny peptyd jelitowy - VIP i glukagonopodobne peptydy jelitowe 126 ∙ ∙ ∙ somatostatyna SRIF ◦ hamuje wydzielanie insuliny ◦ hamuje trawienie i perystaltykę ◦ wytwarzana przez komórki D bł. śl. przewodu pokarmowego i komórki delta trzustki ◦ amylina APP (hormon anorektyczny) ◦ hamuje wydzielania insuliny i glukagonu ◦ hamuje uczucie głodu, wchłanianie pokarmu i opróżnianie żołądka insulina może działać autokrynnie hamując swoje własne wydzielanie na poziomie tkanek przeciwstawnie do insuliny działają również tzw. hormony przeciwregulacyjne: glukagon, katecholaminy, hormon wzrostu ◦ Hormony te wywierają działanie diabetogenne poprzez bezpośredni wpływ na tkanki lub - w przypadku katecholamin - przez hamowanie wydzielania insuliny Działanie insuliny zmniejszające stężenie glukozy wynika przed wszystkim z : ∙ zahamowania wytwarzania glukozy w wątrobie (co zmniejsza szybkość jej uwalniania do krwi) ∙ stężenie glukozy we krwi na czczo jest determinowane głównie przez wytwarzanie glukozy w wątrobie (glukoza ta pochodzi z rozpadu spichrzanego glikogenu oraz syntezy cząstki glukozy de novo glukoneogeneza) ∙ pobudzenia wykorzystania glukozy (głównie przez mięśnie szkieletowe, a w mniejszym stopniu przez tkankę tłuszczową oznacza to wychwyt glukozy z krwi) Biologiczne działanie insuliny przemiana węglowodanów o nasila transport glukozy z przestrzeni zewnątrzkomórkowej do komórki mięśniowej, adipocytów, fibroblastów oraz nasila wewnątrzkomórkowe zużytkowanie glukozy (glikoliza, cykl kwasów trikarboksylowych, cykl pentozofosforanowy) o przyspiesza syntezę glikogenu w wątrobie i mięśniach o z jednej strony zmniejsza oddawanie glukozy przez wątrobę do krwi, z drugiej zwiększa jej zużytkowanie w tkankach przemiana tłuszczowa o zwiększa lipogenezę w adipocytach o hamuje lipazę triglicerydową nie powstają wolne kw. tł. i ciała ketonowe - hamuje rozpad zgromadzonych w tkance tłuszczowej triglicerydów do niezestryfikowanych kwasów tłuszczowych (i prekursora glukoneogenezy - glicerolu) - kwasy tłuszczowe są zasadniczo substratem dla ketogenezy w wątrobie (insulina hamuje powstawanie ciał ketonowych) cukrzyca typu I – powstają ciała ketonowe (zapach acetonu z ust, ciała ketonowe w moczu i krwi, kwasica) chudnięcie cukrzyca typu II – nie powstają ciała ketonowe przybieranie na wadze przemiana białek o zwiększa transport aminokwasów do wnętrza komórek o zwiększa syntezę białek o hamuje proces glukoneogenezy (przekształcanie aminokwasów do glukozy) o w stanach niedoboru insuliny następuje ograniczenie lub zahamowanie wyżej wymienionych reakcji jeżeli glikemia przekroczy tzw. próg nerkowy dla glukozy - 10 mmol/l - przechodzi ona do moczu powodując jednocześnie nasilenie diurezy osmotycznej głównym źródłem energii stają się kwasy tłuszczowe Część tych kwasów jest bezpośrednio utleniana w tkankach, część jest pobierana przez wątrobę, w której zostają one wykorzystane do syntezy lipoprotein o bardzo małej gęstości VLDL lub przekształcone do związków ketonowych (acetooctanu i -hydroksymaślanu), oddawanych następnie do krwi. Zwiększona zawartość VLDL doprowadza do gromadzenia się we krwi lipoprotein o małej gęstości LDL, będących produktem katabolizmu VLDL i stanowiących czynnik ryzyka chorób naczyniowych. 127 Metaboliczne efekty działania insuliny: ∙ hamowanie wytwarzania glukozy w wątrobie ∙ pobudzanie wychwytu glukozy poprzez mięśnie i tkankę tłuszczową ∙ ułatwianie gromadzenia glukozy w postaci glikogenu ∙ hamowanie lipolizy w komórkach tłuszczowych i ketogenezy w wątrobie ∙ regulacja obrotu białek ∙ wpływ na równowagę elektrolitową Receptor insulinowy ∙ za klasyczne tkanki docelowe dla insuliny uznaje się: ◦ komórki wątrobowe ◦ komórki mięśni szkieletowych ◦ komórki tłuszczowe ∙ budowa: ◦ podjednostki alfa są zewnątrzkomórkowe ◦ podjednostki beta są transbłonowe, plus fragment wewnątrzkomórkowy, który posiada aktywność kinazy tyrozynowej i ulega autofosforylacji ∙ zaburzenia mogą dotyczyć wiązania insuliny lub przekazywania sygnału Upośledzone działanie insuliny może wynikać z następujących mechanizmów 1. Defekty receptorowe: - zmniejszona liczba receptorów insulinowych lub zmniejszone powinowactwo do insuliny; może występować w reakcji na przewlekłą hiperinsulinemię (tzw. sprzężenie zwrotne ujemne) 2. Defekty postreceptorowe: - najczęściej - gł. niedobór białka GLUT-4 - zaburzenia procesów wewnątrzkomórkowych poza miejscami wiązania insuliny odpowiadają za insulinooporność u większości chorych na cukrzycę typu 2 3. Oporność przedreceptorowa Insulinooporność ∙ zmniejszona biologiczna reakcja na fizjologiczną ilość insuliny ∙ normo- lub hiperglikemia z jednoczesną hiperinsulinemią ∙ jest bezobjawowa do chwili pojawienia się niewyrównania metabolicznego prowadzącego do cukrzycy ∙ jest ona istotną cechą metaboliczną cukrzycy typu 2 ◦ najpierw insulina i prawidłowa lub podwyższona glikemia ◦ wyczerpanie (zniszczenie) kom. β – insulina nie może już bardziej wzrosnąć - glikemii ◦ w pewnym momencie następuje zniszczenie większości kom. β – konieczność podawania insuliny Patogeneza powikłań cukrzycy ∙ szlak poliolowy (szlak sorbitolowy) ◦ alternatywny szlak glukozy przy braku insuliny ◦ gromadzenienie sorbitolu m.in. w kom. tk. nerwowej ◦ sorbitol to produkt pośredni przemiany glukozy we fruktozę: glukoza ulega redukcji w obecności NADPH, który to proces jest katalizowany przez reduktazę aldozową; potem następuje utlenianie sorbitolu do fruktozy ◦ im więcej enzymu (reduktazy) jest w tkance, tym więcej sorbitolu powstanie ◦ sorbitol nie przechodzi przez błony zaburzenia elektrolitowe (hiperosmotyczność komórki) uszkodzenie błony ◦ zużycie NADPH podczas tworzenia sorbitolu nie działa katalaza śmierć komórek w mechanizmie wolnorodnikowym 128 ∙ ∙ ∙ ∙ nieenzymatyczna glikacja białek (późna glikacja białek) zaawansowane produkty glikacji AGE (białka glikowane) ◦ ogniskowe zakrzepy ◦ zwężenie naczyń ◦ zjawisko pamięci hiperglikemicznej aktywacja kinazy białkowej C – powstawanie DAG ◦ zwężenie naczyń ◦ zaburzenia mikrokrążenia – spadek przepływu ◦ zapalenie naczyń ◦ zwiększona przepuszczalność ◦ RFT Aktywacja szlaku heksozaminaz Dysfunkcja śródbłonka naczyniowego Wyspy Langerhansa ∙ 1% trzustki, 1-2 miliony ∙ komórki A (alfa) – glukagon ∙ komórki B (beta) – insulina, amylina ∙ komórki D (delta) – somatostatyna ∙ komórki F – polipeptyd trzustkowy Glukagon: ∙ jest hormonem polipeptydowym wytwarzanym przez komórki wysp trzustkowych ∙ wydzielanie jest pobudzane przez hipoglikemię, a hamowane przez hiperglikemię i wysoki poziom kwasów tłuszczowych ∙ szybko i silnie podnosi stężenie glukozy we krwi - stosowany w leczeniu stanów hipoglikemicznych oraz jako lek działający inotropowo dodatnio w leczeniu niewydolności krążenia ∙ fiolka 1mg; w leczeniu hipoglikemii 1mg i.v. lub s.c., i.m. (u pacjentów nieprzytomnych) ∙ hipoglikemia: glukagon, 40% glukoza, cukry złożone ∙ także u pacjentów ze stanem drgawkowym Cukrzyca - przewlekła hiperglikemia - składowa zespołu metabolicznego Normy poziomu glukozy (na czczo) - st. glukozy na czczo 3,9-5,5 mmol/l (70-99 mg/dl) - nieprawidłowa glikemia na czczo 5,6-7,0 mmol/l (100-126 mg/dl) - cukrzyca ≥ 7 mmol/l (≥ 126 mg/dl) Jak dochodzi do rozpoznania? - objawy - zaburzenia gospodarki wodnej (pragnienie, wielomocz) - trudno gojące się zmiany skórne (np. trądzik), świąd - / masy ciała, zab. koncentracji, zmęczenie - zaburzenia widzenia - infekcje – obniżona odporność 129 Etiologiczna klasyfikacja cukrzycy: I. cukrzyca typu 1 (dawniej cukrzyca insulinozależna, dziecięca) ◦ zniszczenie komórek beta wysp Langerhansa, prowadzące zwykle do bezwzględnego niedoboru insuliny ▪ na tle immunologicznym (90%) - przeciwwyspowe, przeciwko dekarboksylazie kwasu glutaminowego, przeciwko receptorowi insulinowemu i przeciwinsulinowe ▪ idiopatyczne ◦ ◦ ◦ II. ujawnia się gwałtownie: gdy pacjent nie otrzyma insuliny to dojdzie do ketozy i śpiączki szczyt zachorowania 12-16 lat brak peptydu C cukrzyca typu 2 (dawniej cukrzyca insulinoniezależna, starcza) ◦ jest przyczyną > 85% przypadków na całym świecie ◦ heterogenna (od przewagi insulinooporności do przewagi niedoboru insuliny) ▪ skojarzona z otyłością trzewną (najczęściej) ▪ bez otyłości ∙ obie podgrupy (typu 1 i 2) dzielą się ponadto na nieleczone insuliną i leczone insuliną (100% c.1 i 20-30% c.2) III. cukrzyca wtórna i skojarzona z innymi chorobami i zespołami (typu 3) ◦ uwarunkowane genetycznie zaburzenia czynności komórek beta, np. zespoły MODY ◦ uwarunkowane genetycznie zaburzenia działania insuliny, np. krasnoludkowość ◦ choroby wewnątrzwydzielniczej części trzustki, np. zapalenie trzustki – związane np. z alkoholem (najczęstsza przyczyna) ◦ wtórna do endokrynopatii, np. akromegalia (GH), nadczynność tarczycy, hormony rdzenia nadnerczy (guz chromochłonny), zespół Cushinga ◦ wywołana przez przyjmowane leki lub inne związki chemiczne, np. glikokortykosterydy (jatrogenny zespół Cushinga) ◦ zakażenia, np. wrodzona różyczka ◦ rzadko występujące postacie cukrzycy autoimmunologicznej, np. zespół uogólnionej sztywności ◦ inne zespoły genetyczne związane z cukrzycą, np. zespół Downa (trisomia lub translokacja chromosomu 21), zespół Turnera (kariotyp 45X0 lub mozaicyzm), zespół Klinefeltera (kariotyp 47XXY lub mozaicyzm), zespół Pradera-Williego (delecja lub translokacja chromosomu 15) IV. cukrzyca ciężarnych (cukrzyca ciążowa i cukrzyca w ciąży) ◦ cukrzyca rozpoznana w okresie ciąży – obejmuje wcześniej istniejącą cukrzycę i cukrzycę rozwijającą się w czasie ciąży V. Kategorie podwyższonego ryzyka cukrzycy (kiedyś tzw. stany przedcukrzycowe) ◦ nieprawidłowa tolerancja glukozy ◦ nieprawidłowa glikemia na czczo ◦ HbA1c 5,7-6,4% (poziom hemoglobiny glikowanej) 130 Cukrzyca typu 1 Epidemiologia Występowanie cukrzycy typu 1 cechuje się wyraźną zmiennością geograficzną; z największą częstością występuje w Finlandii, Norwegii i Szwecji, najrzadziej w Danii i Japonii Różnorodna zachorowalność zarówno w obrębie określonej populacji, jak i w poszczególnych populacjach uznawana jest za dowód na rolę środowiskowych czynników patogenetycznych (np. wirusów, toksyn) Szczyt występowania choroby obejmuje okres między 11 a 13 r.ż. (rzadko przed 6 r.ż.), aczkolwiek cukrzyca typu 1 może dotyczyć każdej grupy wiekowej Etiologia Wykazano znamiennie częstsze kojarzenie się tego typu cukrzycy z antygenami zgodności tkankowej HLA-DR3/B8 i DR4/B15 i znamiennie rzadsze z antygenami szeregu DR2/B7 (indukcja przez czynniki zewnętrzne) Określona konstelacja antygenów HLA nie jest swoista dla cukrzycy, ale dla bardziej ogólnego procesu autoimmunizacji Zakażenia wirusowe - mniejsze znaczenie mają te wirusy, które bezpośrednio niszczą i uszkadzają komórki wysp trzustkowych (wirus świnki, różyczki). W większości przypadków diabetogenny wpływ zakażenia wirusowego jest pośredni i sprowadza się do indukcji autoimmunizacji, skierowanej przeciwko komórkom wysp trzustki. Szczególną rolę zdaje się odgrywać mało zjadliwy i wykazujący tropizm do komórek wirus Coxsackie B4 U około 90% chorych na cukrzycę typu 1 można wykryć obecność serologicznych markerów procesu autoimmunologicznego, np. przeciwciała przeciwwyspowe, przeciwciała skierowane przeciwko dekarboksylazie kwasu glutaminowego (GAD) lub insulinie Uważa się, że gdy zniszczona zostanie większość komórek (ok. 90%), to u chorego występują typowe objawy cukrzycy W cukrzycy typu 1 występuje długi bezobjawowy okres początkowy, podczas którego komórki podlegają stopniowemu niszczeniu Szybko się rozwija Brak prewencji Przeciętne ryzyko rozwinięcia się choroby u krewnych chorych na cukrzycę typu 1 jest następujące: rodzeństwo - ogólne ryzyko 10% chora matka - 2-3% chory ojciec - 5-10% chorzy oboje rodzice - 30% u około 30-50% bliźniąt jednojajowych i do 20% dwujajowych rozwinie się cukrzyca, jeśli jedno z nich jest chore ◦ ◦ Objawy cukrzycy typu 1 w chwili rozpoznania objawy zaburzeń osmotycznych pragnienie wielomocz oddawanie moczu w nocy zmniejszenie masy ciała zmęczenie i osłabienie objawy dodatkowe kurcze mięśnie (związane z zaburzeniami elektolitowymi) zaburzenia widzenia - krótkowzroczność (związane z obrzękiem osmotycznym soczewki, a nie uszkodzeniem nerwu – po wyrównaniu ciśnień osmotycznych obrzęk ustępuje i wada mija) zakażenia grzybicze (jama ustna, narządy płciowe) lub bakteryjne (skóry) 131 Obraz kliniczny ◦ kliniczny obraz cukrzycy jest różnorodny ◦ nasilenie objawów jest bardzo zróżnicowane: od sporadycznie występującego, zagrażającego życiu głębokiego niewyrównania metabolicznego (tj. śpiączki ketonowej lub hiperosmolarnej), do bezobjawowych przypadków wykrytych podczas przypadkowego badania ◦ u około 5-10% chorych na cukrzyce typu 1 podczas rozpoznania stwierdza się cukrzycową kwasicę ketonową, objawy kliniczne: pH < 7,3 zaburzenia świadomości nasilona poliuria i polidypsja oddech kwasiczy Kussmaula osłabienie z nudnościami i (oddech gonionego psa) wymiotami deskowaty brzuch odwodnienie zapach acetonu z ust Leczenie Chorzy na cukrzycę typu 1 bezwzględnie wymagają leczenia insuliną Nowo rozpoznana cukrzyca – pobyt w szpitalu i edukacja Badania wykrywające powikłania późne, co 5 lat. Cukrzyca typu 2 - zespół zaburzeń charakteryzujących się współistniejącą, o różnym nasileniu, zmniejszoną wrażliwością tkanek obwodowych na działanie insuliny z dysfunkcją komórek trzustki, prowadzącą w rezultacie do niedostatecznego wydzielania insuliny w stosunku do zapotrzebowania na ten hormon Epidemiologia ◦ pojawia się w późniejszym okresie życia, po 40, najczęściej po 50 roku życia ◦ z reguły stwierdza się otyłość, która spośród mężczyzn dotyczy 80%, a spośród kobiet 90% pacjentów ◦ przebieg jest powolny i często mijają lata do postawienia rozpoznania ◦ przyjmuje się, że około 50% przypadków pozostaje nierozpoznane ◦ ◦ ◦ ◦ ◦ ◦ ◦ ◦ ◦ Etiologia Podłoże dziedziczne teoria dziedziczenia recesywnego: przyjmuje, że cukrzyca jest przekazywana przez pojedynczy gen recesywny o niepełnej penetracji; oznacza to, że genotyp dd determinuje istnienie predyspozycji do cukrzycy, a nie samej choroby, do której ujawnienia przyczyniają się czynniki środowiskowe teoria dziedziczenia wielogenowego: zakłada, że cukrzyca jest uwarunkowana zespołem zmutowanych genów, umiejscowionych w różnych loci tego samego lub kilku chromosomów; także w tej teorii przyjmuje się ograniczoną penetrację genotypu „cukrzycowego” i przypisuje się dużą rolę wpływom środowiskowym czynniki środowiskowe starzenie się: naturalna inwolucja wysp trzustkowych, polegająca na zmniejszeniu liczby komórek , rozroście tkanki łącznej i występowaniu zmian szklistych w wyspach oraz rozwoju miażdżycy tętnic i tętniczek trzustki otyłość: zapadalność na cukrzycę typu 2 jest 15 razy większa u osób z nadwagą przekraczającą o ponad 45% należną masę ciała aniżeli u osób o prawidłowej masie; u ludzi otyłych stwierdza się jeszcze przed wystąpieniem nieprawidłowej tolerancji glukozy i cukrzycy zwiększenie stężenia insuliny we krwi i insulinooporność wpływy hormonalne: glukagon, hormon wzrostu, glikokortykosterydy, katecholaminy, hormony tarczycy choroby trzustki choroby wątroby: przewlekłe miąższowe schorzenia wątroby, a zwłaszcza jej marskość, co może być wynikiem zwiększonej oporności na insulinę, co z kolei tłumaczy się zwiększoną przemianą kwasów tłuszczowych i zwiększonym stężeniem we krwi hormonu wzrostu i glukagonu niektóre leki: glikokortykosterydy, tabletki antykoncepcyjne, leki przeciwnadciśnieniowe z grupy -blokerów 132 Patofizjologia - cukrzyca typu 2 jest zespołem heterogennym ◦ nieprawidłowe wydzielanie insuliny: u chorych na cukrzycę typu 2 wydzielana jest wystarczająca ilość insuliny, by nie doszło do ketozy, nie wystarcza jej jednak do utrzymania prawidłowego metabolizmu glukozy; zmniejszenie zależnego od insuliny wykorzystania glukozy o 30-40% prowadzi do nasilenia wyrównawczej hiperinsulinemii na czczo; potem wydzielanie endogennej insuliny stopniowo się zmniejsza ◦ insulinooporność ◦ otyłość, która występuje często ◦ odkładanie tkanki tłuszczowej w obrębie brzucha wiąże się z cechami zespołu insulinooporności Obraz kliniczny ◦ w chwili rozpoznania chorzy mają zwykle ponad 40 lat ◦ na obraz kliniczny składają się zwykle typowe objawy, chociaż zmniejszenie masy ciała stwierdza się rzadko ◦ w wielu przypadkach przebiegających bezobjawowo rozpoznanie ustala się w toku badań przesiewowych ◦ cukrzyca typu 2 stanowi późne stadium patologicznego procesu o złożonym i postępującym charakterze Kliniczne i metaboliczne cechy: ◦ objawy występują zwykle w średnim wieku lub później ◦ często otyłość (w > 75%) ◦ objawy łagodne nierozpoznawalne lub brak objawów ◦ raczej względny niż całkowity niedobór insuliny ◦ często insulinooporność ◦ niewystępowanie ketozy ◦ nasilanie się zaburzeń - nawet przy leczeniu przeciwcukrzycowym ◦ insulinoterapia często wymagana do utrzymania długotrwałego wyrównania metabolicznego ◦ często występują inne cechy „zespołu insulinooporności”, np. nadciśnienie, dyslipidemia ◦ duże ryzyko makroangiopatii - główna przyczyna przedwczesnej umieralności ◦ w chwili rozpoznania często występują powikłania narządowe Objawy: ◦ brak objawów → chorzy bez objawów z rozpoznaniem ustalonym po przypadkowym badaniu ◦ objawy osmotyczne (jak w cukrzycy typu 1) pragnienie zaburzenia widzenia wielomocz i oddawanie moczu w nocy zmęczenie, osłabienie ◦ zakażenia nawracające zakażenia grzybicze nawracające zakażenia bakteryjne (np. infekcje dróg moczowych) ◦ ◦ ◦ ◦ makroangiopatia choroba niedokrwienna serca choroby naczyń mózgowych (epizody przejściowego niedokrwienia mózgu, udar mózgu) choroby naczyń obwodowych (chromanie przestankowe, ból w spoczynku, owrzodzenie niedokrwienne) neuropatia objawowa polineuropatia czuciowa owrzodzenie stopy zanik mięśni tachykardia, hipotonia ortostatyczna choroby dodatkowe jaskra ◦ ▪ ▪ ▪ mikroangiopatia retinopatia nefropatia (proteinuria, nadciśnienie, zespół nerczycowy) dot. wszystkich innych naczyń włosowatych (te są wyróżnione, bo są proste w diagnostyce) porażenia nerwów czaszkowych mononeuropatie obwodowe zaćma 133 Leczenie chorzy nie wymagają insuliny, aby przeżyć, ale około 20% pacjentów wymaga leczenia insuliną dla uzyskania lepszej kontroli metabolicznej o w leczeniu istotne znaczenie ma dieta, a gdy ona nie wystarcza stosuje się doustne leki przeciwcukrzycowe - pochodne sulfonylomocznika i biguanidu o w badaniu wstępnym przy rozpoznaniu choroby często stwierdza się zmiany naczyniowe, głównie typu makroangiopatii dominuje insulinooporność, która przez wiele lat jest bezobjawowa (rośnie poziom insuliny, glikemia się wyrównuje) cele leczenia o glikemia na czczo - 6,0 mmol/l (110 mg/dl) o glikemia po jedzeniu < 9,0 mmol/l (160 mg/dl) o HbA1c < 6,5% Gdy bardzo duża hiperglikemia – szpital, a w innych przypadkach poradnie Wieloletnia cukrzyca – rzadsze wizyty w poradniach w por. z cukrzycą typu I Badania wykrywające powikłania – jak najszybciej po rozpoznaniu. Porównanie objawów klinicznych cukrzycy typu 1 i typu 2: Objaw Cukrzyca typu 1 Cukrzyca typu 2 Przeważnie < 20 lat Przeważnie > 40lat Nagłe Powolne Wywiady rodzinne Rzadziej (10%) Częściej (20%) Stan odżywienia Niedostateczny Nadmierny Wiek w chwili rozpoznania Pojawienie się objawów Objawy kliniczne: - wielomocz i pragnienie - nadmierne łaknienie - ketonuria, kwasica - stłuszczenie wątroby - zmiany skórne bakteryjne - grzybica skóry i śluzówek Przebieg - bardzo często często często dość często rzadko rzadko - u 40% chorych często rzadko często często często Niestabilny Stabilny Bardzo niskie Wysokie, prawidłowe lub obniżone Obecna Bardzo nasilona Wszyscy chorzy 20-30% chorych Stężenie peptydu C Niskie Wysokie Doustne leczenie hipoglikemizujące Zawsze nieskuteczne Często skuteczne Leczenie wyłącznie dietą Zawsze nieskuteczne Często skuteczne Obecność angiopatii cukrzycowej 70% chorych Mniejsza, najczęściej makroangiopatia Obecność neuropatii cukrzycowej 70% chorych Mniejsza Stężenie insuliny w surowicy Insulinooporność tkanek Leczenie insuliną Jedyną skuteczna terapia jest stosowanie terapii skojarzonej – samo obniżenie glikemii do poziomu prawidłowego u osób długo chorujących nie jest do końca korzystne, ponieważ organizm się zaadaptował w pewnym stopniu, i może dojść do zgonu w wyniku ostrych incydentów niedocukrzenia. 134 Badanie stężenia peptydu C - pomiar na czczo - 1 mg glukagonu i.v. - po 6 min pomiar st. peptydu C - 2-krotny wzrost świadczy o rezerwie kom. beta Cukrzyca typu 3 ∙ do tej grupy zalicza się wszystkie przypadki cukrzycy jawnej oraz nieprawidłowej tolerancji glukozy, w których owe zaburzenia są skutkiem innej choroby podstawowej (cukrzyca wtórna) lub w których kojarzą się one w nie zawsze wyjaśniony sposób z inną chorobą, której objawy dominują w obrazie klinicznym (cukrzyca skojarzona) ∙ choroby trzustki ◦ ostre i przewlekłe zapalenie ◦ kamica trzustkowa ◦ rak ◦ stany po całkowitej pankreatektomii ◦ mukowiscydoza ∙ endokrynopatie ◦ glukagonoma ◦ somatostatinoma ◦ akromegalia: u około 30% występuje nieprawidłowa tolerancja glukozy, a u kolejnych 30% cukrzyca ◦ choroba Cushinga: zwłaszcza przy dużych stężeniach kortyzolu wtórnych do ektopowego wydzielania kortykotropiny (ACTH) ◦ pogorszenie wyrównania metabolicznego może być objawem endokrynopatii rozwijającej się u chorego na cukrzycę, najczęstszą z nich jest choroba Gravesa i Basedowa ◦ zespół Conna: hiperaldosteronizm pierwotny, nieprawidłowa tolerancja glukozy około 50% ◦ guz chromochłonny: insulinooporność i -adrenergiczne hamowanie wydzielania insuliny przez adrenalinę zakażenia np. wrodzona różyczka cukrzyca jatrogenna – wywołana przyjmowaniem sterydów (schorzenia zapalne, autoimm.) ∙ ∙ Cukrzyca typu MODY i LADA Cukrzyca typu MODY - cukrzyca dorosłych występująca u osób młodych (MODY - maturity-onset diabetes of young) ∙ rzadko występująca postać cukrzycy dziedziczona autosomalnie dominująco charakteryzująca się hiperglikemią i względną insulinopenią, która pojawia się przed 25 rokiem życia ∙ ryzyko zachorowania na cukrzycę u potomstwa chorego na MODY wynosi 50% ∙ brak przeciwciał ∙ cukrzyca monogenowa (inne: mitochondrialna, noworodkowa) ∙ większość form związanych jest z defektem wydz. insuliny ∙ brak zależności od insuliny, brak tendencji do kwasicy ketonowej, oznaczalny peptyd C ∙ rozpoznanie: badania genetyczne, dodatni wywiad rodzinny 135 Porównanie cukrzycy typu 2 i zespołów MODY początek choroby patofizjologia rola środowiska otyłość dziedziczenie cukrzyca typu 2 średni do starszego MODY dzieciństwo do młodego dorosłego zaburzenia czynności komórek , insulinooporność znaczna częsta wielogenowe/heterogenne zaburzenia czynności komórek minimalna rzadka jednogenowe autosomalne dominujące Cukrzyca typu LADA późno występująca cukrzyca autoimmunologiczna po 35 r.ż. (jak typu 1) HbA1C > 10% niskie st. peptydu C obecne Ig anty-GAD/ICA brak powikłań Cukrzyca Ciężarnych (GDM) dowolnego stopnia nietolerancja glukozy pojawiająca się lub po raz pierwszy rozpoznana w okresie ciąży GDM rozpoznaje się niezależnie od tego, czy konieczne jest stosowanie insuliny, czy wystarczy tylko modyfikacja diety oraz czy stan ten utrzymuje się po ciąży po upływie 6 lub więcej tygodni od zakończenia ciąży kobietę należy zakwalifikować do jednej z następujących kategorii: o cukrzyca o upośledzenie tolerancji glukozy o normoglikemia rozpoznanie GDM jest ważne, ponieważ odpowiednie postępowanie może zmniejszyć związaną z GDM zachorowalność i umieralność okołoporodową Algorytm diagnostyczny cukrzycy ciążowej: wstępne oznaczenie stężenia glukozy we krwi należy wykonać na początku ciąży, przy pierwszej wizycie u ginekologa w celu wykrycia bezobjawowej cukrzycy przedciążowej ◦ stężenie glukozy na czczo od 100 mg/dl (5,6 mmol/l) do 125 mg/dl (6,9 mmol/l) – wynik nieprawidłowy – należy wykonać w możliwie najkrótszym czasie doustny test tolerancji glukozy (75g) ◦ stężenie glukozy na czczo > 125 mg/dl (6,9 mmol/l) – należy powtórzyć badanie na czczo i w razie ponownego wyniku powyżej tych wartości pacjentkę skierować w trybie pilnym do ośrodka referencyjnego; jeśli w kolejnym pomiarze uzyskano wynik < 125, należy przeprowadzić doustny test tolerancji glukozy (75g) Przesiewowy doustny test tolerancji glukozy (50g) → GCT – obecnie już niestosowany rutynowo badanie wykonuje się między 24 a 28 tygodniem ciąży, pacjentka nie musi być na czczo jednorazowy pomiar glukozy we krwi po 1 godzinie od momentu podanie 50g glukozy interpretacja wyników ◦ < 140 mg/dl (7,8 mmol/l) - wartość prawidłowa, nie wymaga dalszej diagnostyki ◦ 140-200 mg/dl (7,8-11,1 mmol/l) – wartość nieprawidłowa, należy ją zweryfikować za pomocą doustnego testy tolerancji glukozy (OGTT-75g) w możliwie najkrótszym czasie, z zachowaniem reguł dotyczących testu diagnostycznego ◦ > 200 mg/dl (11,1 mmol/l) - nie należy już wykonywać OGTT, pacjentkę należy skierować do ośrodka referencyjnego 136 Doustny test tolerancji 75g glukozy (OGTT-oral glucose tolerance test) o wykonywany na czczo o 8 - 14 godzin od ostatniego posiłku o przez 3 dni przed testem nie należy ograniczać spożycia węglowodanów ( ≥ 150 g/d węglowodanów przy zwykłej aktywności fizycznej) o 75g glukozy należy rozpuścić w 250 - 300 ml i wypić w ciągu 5 minut o w trakcie badania pacjentka powinna siedzieć, nie powinna przyjmować pożywienia, palić tytoniu o krew do badania pobiera się na czczo i 2 godziny po wypiciu roztworu glukozy (test może być także 3 punktowy: 0, 60, 120 minuta) o interpretacja wyników jeśli u badanej ciężarnej uzyska się wynik na czczo > 100 mg/dl (5,6 mmol/l) a < 126 mg/dl (7,0 mmol/dl), po 2 godzinach < 140 mg/dl (7,8 mmol/l), to mimo, że nie odpowiada ona kryteriom cukrzycy, należy skierować pacjentkę do ośrodka referencyjnego Schemat badania przesiewowego i rozpoznania cukrzycy ciężarnych stężenie glukozy w osoczu na czczo po 1 godzinie po 2 godzinach obciążenie 50g glukozy (badanie przesiewowe) 140 mg/dl (7,8 mmol/l) - obciążenie 75g glukozy (pełne badanie diagnostyczne) 100 mg/dl (5,6 mmol/l) 140 mg/dl (7,8 mmol/l) Docelowe wartości glikemii u kobiet w ciąży (żeby nie było hipoglikemii): [nowe normy 2017 - sprawdzić!] na czczo 70-99 mg/dl (3,9-5,5 mmol/l) przed posiłkiem 60-105 mg/dl (3,3-5,8 mmol/l) 1h po posiłku < 140 mg/dl (7,8 mmol/l) między 2 a 4 > 60 mg/dl (3,3 mmol/l) U chorej kobiety 6-12 tydz. Po porodzie OGTT, a potem oznaczanie glikemii na czczo, co 2-3 lata. Przed kolejną planowaną ciążą - OGTT Powikłania i zagrożenia dla matki i płodu wynikające z obecności cukrzycy: matka o wielowodzie o uraz porodowy, poród instrumentalny lub o nadciśnienie tętnicze cięcie cesarskie o zakażenie dróg moczowo-płciowych o rozwój cukrzycy w przyszłości płód/dziecko o wady wrodzone (większa częstość występowania) o makrosomia (urodzeniowa masa ciała > 4000g, LGa) o kardiomiopatia o wewnątrzmaciczna śmierć płodu o uraz okołoporodowy o o powikłania poporodowe: niedojrzałość płuc, gwałtowna hipoglikemia, hipokalcemia, hiperbilirubinemia, infekcje, niewydolność serca wpływ na okres dzieciństwa i wiek dojrzały Nazewnictwo hiperglikemii w ciąży (2014) „Cukrzyca w ciąży” - glikemia na czczo ≥ 7 mmol/l - lub glikemia ≥11,1 mmol/l w 2.godz. po 75g glukozy (OGTT) - lub glikemia przygodnia ≥ 11,1 mmol/l z towarzyszącymi objawami „Cukrzyca ciążowa” - jeden z wyników OGTT jest nieprawidłowy - 0 min. 5,1-6,9 mmol/l (92-125 mg/dl) - po 1h ≥ 10,0 mmol/l (180 mg/dl) - po 2h ≥ 8,5-11,0 mmol/l (153-199 mg/dl) 137 Inne patologie Upośledzona tolerancja glukozy (IGT) i upośledzenie glikemii na czczo (IFG) stan metaboliczny pośredni między prawidłową homeostazą glukozy i cukrzycą IFG oraz IGT nie są samodzielnymi jednostkami klinicznymi, lecz raczej czynnikami ryzyka rozwoju cukrzycy i chorób sercowo-naczyniowych są związane z zespołem oporności na insulinę IGT można rozpoznać wyłącznie na podstawie wyniku OGTT 75g glukozy (2h - OGTT > 140 mg/dl (7,8 mmol/l) i < 200 mg/dl (11,1 mmol/l)) IFG rozpoznaje się, gdy FPG (stężenie glukozy na czczo) > 100 mg/dl (5,6 mmol/l), ale < 126 mg/dl (7,0 mmol/l) Zespół metaboliczny (Zespół X/ oporności na insulinę) - insulinooporność - wyrównawcza hiperinsulinemia dla utrzymania homeostazy glukozowej - glikemia > 100 mg% lub leczenie cukrzycy typu 2 - ciśnienie tętnicze >130/85 mmHg lub leczenie nadciśnienia tętniczego - dyslipidemia z wysokim stężeniem triglicerydów lub niskim stężeniem cholesterolu frakcji HDL - HDL ♂ < 40 mg% ♀ < 50 mg% - TG > 150 mg% - otyłość - obwód talii ♂ > 94 cm ♀> 80 cm Diagnostyka Kryteria rozpoznania cukrzycy: możliwe są trzy sposoby rozpoznania cukrzycy i każdy z nich musi być potwierdzony następnego dnia dowolną z tych metod: 1. Obecne kliniczne objawy cukrzycy i wynik przygodnego oznaczenia stężenia glukozy w osoczu > 200 mg/dl (11,1 mmol/l).”Przygodne” oznacza o dowolnej porze dnia bez względu na czas jaki upłynął od ostatniego posiłku. Klasyczne objawy cukrzycy to: wielomocz, wzmożone pragnienie i niewyjaśniona utrata masy ciała. Nie wymaga potwierdzania 2. FPG (stężenie glukozy w osoczu na czczo) > 126 mg/dl (7,0 mmol/l). „Na czczo” oznacza niespożywanie kalorii co najmniej przez 8 godzin. 3. 2hPG (glikemia 2 godziny po obciążeniu glukozą) > 200 mg/dl (11,1 mmol/l) w OGTT 4. Poziom HbA1C > 6,5% – w Polsce nie obowiązuje (nie ma badań populacyjnych, nie ma wystarczającej liczby laboratoriów, badania są drogie) Kategorie wartości FPG < 100 mg/dl (5,6 mmol/l) - prawidłowa glikemia na czczo (70-99 mg/dl, 3,9-5,6 mmol/l) ≥ 100 mg/dl (5,6 mmol/l) i < 126 mg/dl (7,0 mmol/l) - IFG (upośledzenie regulacji glikemii na czczo, stan zwiększonego ryzyka cukrzycy, należy wykonać OGTT) ≥ 126 mg/dl (7,0 mmol/l) - wstępne rozpoznanie cukrzycy (musi być potwierdzone jak opisano powyżej) Prawidłowe stężenie glukozy we krwi żylnej na czczo wynosi 3,6 - 5,5 mmol/l, zaś we krwi włośniczkowej o 0,55 - 0,83 mmol/l więcej W cukrzycy glikemia na czczo (ostatni posiłek 12h przed badaniem) jest najczęściej zwiększona, jednak w łagodniejszych postaciach cukrzycy typu 2 i 3 może być na czczo prawidłowa i zwiększa się powyżej normy dopiero po posiłku 138 Doustny test tolerancji glukozy - OGTT Jest najlepszą metodą ustalenia rozpoznania cukrzycy Glukozę bezwodną (75g) rozpuszcza się w 250 ml wody Krew pobiera się na czczo (czas 0) i 120 minut po wypiciu w ciągu 5 minut wody z glukozą Można dodać cytrynę – nie ma wtedy odruchu wymiotnego Interpretacja wyników OGTT: 2hPG < 140 mg/dl (7,8 mmol/l) → prawidłowa tolerancja 2hPG ≥140 mg/dl (7,8 mmol/l) i < 200 mg/dl (11,1 mmol/l) = IGT 2hPG ≥200 mg/dl (11,1 mmol/l) → wstępne rozpoznanie cukrzycy (rozpoznanie musi być potwierdzone j.w.) Próby doustnego testu glukozą nie należy wykonywać, jeżeli rozpoznanie cukrzycy wynika z pojedynczych oznaczeń glikemii ( > 126 mg/dl [7,0 mmol/l] na czczo i 200 mg% 2 godziny po posiłku), w cukrzycy typu 1 ze znaczną hiperglikemią, cukromoczem i ketonurią, w ostrych chorobach przewodu pokarmowego, w stanach znacznego niedożywienia oraz ciężkim stanie ogólnym Oznaczanie glikemii u chorych na cukrzycę 1. 2. 3. Oznaczanie powinno się wykonywać w osoczu krwi żylnej, w akredytowanym laboratorium, za pomocą analizatora biochemicznego. Oznaczenia stężenia glukozy należy poddać wewnątrz- i zewnątrzlaboratoryjnej kontroli jakości. Próbkę krwi należy w możliwie krótkim czasie dostarczyć do laboratorium. Krwinki należy oddzielić od osocza do 60 minut po pobraniu materiału. Jeśli nie jest to możliwe do pobieranej krwi należy dodać substancje hamujące glikolizę, takie jak fluorek sodu (25 mg/ml), jodooctan sodu (0,5 mg/ml) lub maleinoimid (0,1 mg/ml), zwykle stosowane razem z antykoagulantami takimi jak szczawian lub EDTA W celach diagnostycznych (takich jak rozpoznawanie cukrzycy, upośledzonej tolerancji glukozy i nieprawidłowej glikemii na czczo) nie można stosować oznaczeń stężenia glukozy w pełnej krwi żylnej lub włośniczkowej wykonywanych metodami laboratoryjnymi lub glukometrem. Oznaczanie glikemii w celu monitorowania leczenia cukrzycy 1. Oznaczenia glikemii w celu monitorowania leczenia i oceny wyrównania metabolicznego cukrzycy wykonuje się w pełnej krwi włośniczkowej. Badanie przeprowadzają pacjenci (samokontrola) lub pracownicy służby zdrowia. 2. Oznaczenia w próbkach krwi włośniczkowej w ramach samokontroli pacjenci wykonują samodzielnie metodami tzw. suchej chemii za pomocą glukometrów. 3. Pacjent powinien być przeszkolony w zakresie obsługi glukometrów w placówce służby zdrowia, w której się leczy. 4. Oznaczenia stężenia glukozy w pełnej krwi włośniczkowej w placówkach służby zdrowia wykonuje się za pomocą glukometrów lub innych analizatorów glukozy. Wyniki uzyskiwane przy ich użyciu powinny być systematycznie porównywane z wynikami uzyskiwanymi metodą laboratoryjną. 5. Oznaczenia wykonuje się w porach dnia zależnych od aktywności chorego i przyjmowanych posiłków, kiedy oczekuje się skrajnych wartości glikemii w ciągu doby (dobowy profil glikemii). Oznaczanie hemoglobiny glikowanej W diagnostyce wykorzystuje się zjawisko nieenzymatycznej glikozylacji hemoglobiny i białek surowicy. W krwince czerwonej zdrowego, dorosłego człowieka hemoglobina glikowana (HbA 1c) stanowi około 5% całkowitej hemoglobiny, zaś w cukrzycy jej stężenie wzrasta proporcjonalnie do podwyższenia glikemia 2-3 razy Jest najlepszym parametrem oceniającym długotrwały poziom kontroli cukrzycy wartość HbA 1c w cukrzycy wyrównanej wynosi do 7%, wartością pożądaną jest 6,1 - 6,5%, poniżej 6,1% wskazują na zagrożenie hipoglikemią HbA1c ≤ 8,0% u starszych > 20 lat chorowania HbA1c ≤ 6,1% u kobiet planujących ciążę i będących w ciąży Zmiany jej stężenia następują wolniej niż zmiany glikemii Wartość jej informuje nie tylko o stanie metabolicznym, ale do pewnego stopnia o długości tego stanu (do 3 m-cy przed wykonaniem oznaczenia, poziom glukozy przez ostatnie 3-4 miesiące (czas życia erytrocytów ~120 dni)). 139 Oznaczanie ciał ketonowych Oznaczanie ciał ketonowych odgrywa istotną role w monitorowaniu leczenia cukrzycy typu 1, w cukrzycy ciężarnych oraz w przypadku wystąpienia dodatkowych ostrych schorzeń wikłających cukrzycę U chorych na cukrzycę typu 1 ciała ketonowe powinno się oznaczać przy utrzymującej się hiperglikemii > 300mg/dl (16,7 mmol/l) oraz przy wystąpieniu objawów kwasicy ketonowej (nudności, wymioty, ból brzucha) Ciała ketonowe w moczu oznacza się przy użyciu suchych testów paskowych metodą opartą na reakcji acetonu i kwasu acetooctowego z nitroprusydkiem sodu i glicyną w środowisku alkalicznym, w wyniku, której powstaje barwne kompleksowe połączenie. Ma ona charakter półilościowy, ze wzrokową lub reflektometryczną (czytniki pasków) oceną zmiany barwy pola reakcyjnego. Metoda ta nie pozwala na wykrycie kwasu beta-hydroksymasłowego, stanowiącego największa frakcję ciał ketonowych Badanie powinno się wykonywać w niedawno oddanej próbce moczu Wyniki fałszywie dodatnie mogą wystąpić u chorych zażywających leki zawierające grupy sulfhydrylowe, takie jak kaptopryl lub penicylamina. Na wyniki fałszywie ujemnie może wpływać obecność w dużych stężeniach kwasu askorbinowego w moczu Zasady prowadzenia badań przesiewowych w kierunku cukrzycy - jest konieczne, ponieważ u ponad połowy chorych nie występują objawy: I. Objawy wskazujące na możliwość rozwoju cukrzycy: zmniejszenie masy ciała wzmożone pragnienie wielomocz osłabienie pojawienie się zmian ropnych na skórze oraz stanów zapalnych narządów moczowo-płciowych II. Jeśli nie występują objawy hiperglikemii, badanie w kierunku cukrzycy należy przeprowadzić raz w ciągu 3 lat u każdej osoby po 45 roku życia. Ponadto niezależnie od wieku, badanie to należy wykonywać, co roku u osób z następujących grup ryzyka: z nadwagą (BMI ≥>= 25 kg/m2) z cukrzycą występującą rodzinnie (rodzice bądź rodzeństwo) mało aktywnych fizycznie z grupy środowiskowej lub etnicznej częściej narażonej na cukrzycę u których w poprzednim badaniu stwierdzono nieprawidłową glikemię na czczo ( > 100 mg/dl [5,6 mmol/l]) lub nieprawidłowa tolerancję glukozy z przebytą cukrzycą ciężarnych, u kobiet które urodziły dziecko o masie ciała > 4kg z nadciśnieniem tętniczym ( ≥140/90 Hg) z hiperlipidemią (stężenie cholesterolu frakcji HDL < 40 mg/dl [1,0 mmol/l] lub stężenie triglicerydów > 250 mg/dl [28,5 mmol/l]) z zespołem policystycznych jajników z chorobą układu sercowo-naczyniowego Określenie wartości docelowych w leczeniu cukrzycy kryteria wyrównania gospodarki węglowodanowej ◦ HbA1c (%) od ≥ 6,1% do < 6,5% ◦ glikemia na czczo w osoczu żylnym < 110mg/dl (6,1 mmol/l) ◦ glikemia na czczo – podczas samokontroli: 70-90 mg/dl (3,9 - 5,0 mmol/l) ◦ glikemia po posiłku – podczas samokontroli: 70-135 mg/dl (3,9 - 7,5 mmol/l) 140 kryteria wyrównania gospodarki lipidowej ◦ stężenie cholesterolu całkowitego < 175 mg/dl (4,5 mmol/l) ◦ stężenie cholesterolu frakcji LDL < 100mg/dl (2,6 mmol/l) ◦ stężenie cholesterolu frakcji LDL u chorych na cukrzycę i chorobę niedokrwienną serca < 70 mg/dl (1,9 mmol/l) ◦ stężenie cholersterolu frakcji HDL > 40 mg/dl (1 mmol/l), dla kobiet większe o 10 (0,275) ◦ stężenie cholesterolu „nie-HDL” < 130 mg/dl (3,4 mmol/l) ◦ stężenie trójglicerydów < 150 mg/dl (1,5 mmol/l) Statyny – obniżają st. ch całkowitego oraz frakcji LDL, nie wpływają na retinopatię, dotyczą dużych naczyń Fibraty – obniżają st. trójglicerydów, zmniejszają ryzyko retinopatii, dotyczą małych naczyń kryteria wyrównania ciśnienia tętniczego ◦ ciśnienie skurczowe < 130 mmHg (ciśnienie > 115/75mmHg łączy się ze zwiększonym ryzykiem sercowo-naczyniowym; jego wartości można obniżać do granic dobrej tolerancji) ◦ ciśnienie rozkurczowe < 80 mmHg (p. uwaga w nawiasie powyżej) ◦ przy wartościach > 130/80 mmHg należy rozpocząć leczenie farmakologiczne w celu osiągnięcia wartości < 130/80 mmHg Powikłania cukrzycy ostre (stany nagłe w cukrzycy) ◦ śpiączka hipoglikemiczna ◦ śpiączka cukrzycowa (ketonowa) ◦ śpiączka hiperosmolarna (typ 2) ◦ śpiączka mleczanowa przewlekłe ◦ makroangiopatia ◦ mikroangiopatie cukrzycowe ▪ retinopatia cukrzycowa ▪ nefropatia cukrzycowa ◦ neuropatia Makroangiopatia: zawał i udar to 70% zgonów chorych na cukrzycę typu 2 choroba niedokrwienna serca: ◦ występuje wśród osób z cukrzycą 2-3 razy częściej aniżeli w populacji ogólnej ◦ jest główną przyczyną zgonów w cukrzycy typu 2 ◦ obraz kliniczny choroby niedokrwiennej serca, zwłaszcza zawału, w cukrzycy nie różni sie od typowego obrazu tej choroby ◦ zawał przebiega bezbólowo lub z bólem o małym nasileniu choroba naczyniowa mózgu ◦ udar mózgu stwierdza się u 2-3% chorych na cukrzycę w wieku średnim, a jeszcze częściej u ludzi starszych ◦ najczęściej dochodzi do zmian zatorowo-zakrzepowych, natomiast wylewy krwi są znacznie rzadsze ◦ jest to 2-ga co do częstości przyczyna zgonów chorych na cukrzycę typu 2 choroba naczyniowa kończyn dolnych + neuropatia ◦ stanowi swoiste powikłanie cukrzycy, zwłaszcza typu 2, najczęściej u osób starszych ◦ subiektywnym wyrazem choroby jest chromanie przestankowe ◦ badaniem przedmiotowym stwierdza się brak tętna na tętnicach stopy, zmiany troficzne skóry, paznokci, zaniki mięśniowe i obniżenie temperatury skóry ▪ trudno gojące się owrzodzenia w wyniku niedokrwienia ▪ sprzyja rozwojowi wtórnych zakażeń bakteryjnych i grzybiczych ▪ początkowo dotyczy dystalnych części paliczków, potem obejmuje także części proksymalne; ostatecznie dochodzi do rozwoju pełnej stopy cukrzycowej, która jest stanem zagrożenia życia 141 Mikroangiopatie cukrzycowe: zgrubienie błony podstawnej włośniczek (wiązanie przez kolagen większej ilości związków cukrowych oraz gromadzenie się glikozaminoglikanów) stopniowa utrata komórek ściennych (pericitów) co prowadzi do tworzenia się bezkomórkowych odcinków tych naczyń, zwiotczenia ich ściany i uwypuklenia się w postaci mikrotętniaków Prawidłowo 1:1 pericyt:kom.śródbłonka W cukrzycy 1:4 rozplem komórek śródbłonka, który przy pogrubieniu błony podstawnej powoduje niedrożność i obliterację (zarastanie) kapilarów powstawanie dużej ilości sorbitolu (alkohol), który przy braku insuliny dostaje się wewnątrzkomórkowo prowadząc do wzrostu ciśnienia osmotycznego i dużych zaburzeń elektrolitowych wzrost stężenia hormonu wzrostu co prowadzi do wzrostu stężenia fibrynogenu obniżenie aktywności fibrynolitycznej osocza wzrost stężenia czynnika Von Willebranda (VIII) co prowadzi do wzrostu agregacji płytek, wytwarzania tromboksanu A2 i obkurczania ściany naczyniowej I. Retinopatia cukrzycowa – główna przyczyna ślepoty u osób w wieku produkcyjnym retinopatia nieproliferacyjna (NPDR) – poszerzenie naczyń żylnych, krwotoki punktowate, płomykowate i drobne przedsiatkówkowe, mikrotętniaki, wysięki twarde (lipoproteiny, które wydostały się poza naczynia), wysięki miękkie (wynik wzrostu przepuszczalności naczyń i obrzęków siatkówki) retinopatia przedproliferacyjna – pojawiają się krwotoki przedsiatkówkowe, szanty tętniczo-żylne i liczne wysięki miękkie retinopatia proliferacyjne (PDR) – ogniska nowotworzenia naczyń siatkówki, krwotoki do ciała szklistego, proliferacje w ciele szklistym typ 1 – wizyta u okulisty nie później niż po 2 latach typ 2 – jak najszybciej II. Nefropatia cukrzycowa ◦ jest powikłaniem polegającym na uszkodzeniu kłębuszków nerkowych, odpowiedzialnych za filtrowanie krwi i usuwanie z organizmu zbędnych i szkodliwych produktów przemiany materii ◦ prowadzi do niewydolności nerek, do uszkodzenia których dochodzi stopniowo: początkowo zwiększa się wydalanie albumin w moczu (mikroalbuminuria), następnie wydalane są większe ilości białka w moczu (tzw. jawny białkomocz) - zwykle w tym stadium pojawia sie nadciśnienie tętnicze; w kolejnym etapie następuje stopniowy wzrost stężeń mocznika i kreatyniny we krwi; w najbardziej zaawansowanych stadiach nefropatii konieczne jest leczenie dializą a potem możliwe jest przeszczepienie nerki ◦ szacuje się że rozwinie się u około 25-30% chorych na cukrzycę ◦ cukrzyca jest obecnie najważniejszą pojedynczą przyczyną schyłkowej niewydolności nerek ◦ zasadniczą cechą kliniczną nefropatii cukrzycowej jest białkomocz najczęstsze dolegliwości i objawy: obrzęki, początkowo dyskretne, mogą dotyczyć tylko okolicy kostek, pojawiają się w ciągu dnia i ustępują po nocy; w ciężkim zespole nerczycowym mogą obejmować całe ciało; obrzęki są miękkie, podatne na ucisk, skóra nad nimi jest napięta wodobrzusze (płyn zbiera się w jamie otrzewnej) płyn w jamach opłucnowych powoduje duszność osłabienie, uczucie zmęczenia brak łaknienia, rzadziej dołączają się nudności i wymioty bóle głowy (często) pieniący się mocz ◦ ◦ sposoby zapobiegania ścisła kontrola stężenia glukozy we krwi systematyczne leczenie nadciśnienia tętniczego dieta niskobiałkowa zaprzestanie palenia tytoni badanie w kierunku mikroalbuminurii wykonać można na trzy sposoby: ▪ w przypadkowej porcji moczu, oznaczając stosunek stężenia albuminy do kreatyniny ▪ w 24-godzinnej zbiórce moczu ▪ w okresowej zbiórce moczu (4-godzinnej lub nocnej) 142 Mikroalbuminurię można rozpoznać, jeśli w 3-krotnym badaniu w ciągu 6 miesięcy przynajmniej 2 razy wynik był nieprawidłowy Przebieg: stadium 1 – zmiany czynnościowe (polegające na zwiększonym nerkowym przepływie krwi) oraz przerost nerek stadium 2 – zmiany w nerkach; wczesne zmiany strukturalne mogą pojawić się po 2-3 latach; przebieg subkliniczny stadium 3 – mikroalbuminuria (stężenie albumin poniżej 20 mg/l moczu uważa się za prawidłowe); ciśnienie krwi zaczyna się zwiększać, chociaż nadal utrzymuje się w zakresie wartości prawidłowych; stadium bezobjawowe stadium 4 - jawna kliniczna nefropatia; dodanie wyniki oznaczeń białka za pomocą standardowych testów paskowych; może wystąpić zespół nerczycowy (wydalanie białka z moczem > 5 g/dobę, hipoalbuminemia, obrzęki obwodowe); nadciśnienie tętnicze jest już utrwalone, zaczyna zwiększać się stężenie kreatyniny w osoczu; gdy wydalanie albumin przekroczy 300 mg/dobę wyniki testu paskowego Albustix stają się dodatnie - oznacza to pojawienie się klinicznie jawnej nefropatii stadium 5 – podstęp do schyłkowej niewydolności nerek; stężenie kreatyniny w osoczu zwiększa się powyżej 500 mol/l, zazwyczaj z szybkością stosunkowo stałą dla danej osoby, osiągając tą wartość w ciągu 7 - 10 lat od wystąpienia klinicznie jawnej nefropatii Nieprawidłowe wydalanie albumin Kategoria Przygodna porcja moczu (g/mg kreatyniny) 24-godzinna porcja moczu (mg/24h) Okresowa zbiórka (g/min) Norma < 30 < 30 < 20 Mikroalbuminuria 30 - 299 30 - 299 20 - 199 > 300 > 200 Istotna mikroalbuminuria > 300 143 Neuropatia cukrzycowa ◦ ◦ ◦ ◦ najczęściej spotykanym obrazem jest odcinkowa demielinizacja włókien osiowych, powiększenie i zwyrodnienie lemocytów (kom. Schwanna) oraz obrzęk ruchowej płytki końcowej złącz nerwowo-mięśniowych rzadziej występuje zmniejszenie liczby komórek zwojowych w rogach tylnych i w mniejszym stopniu w rogach przednich rdzenia, jak również w zwojach korzeni tylnych badaniem klinicznym zmiany stwierdza się u około 40% chorych na cukrzycę neuropatia utajona – rozpoznawana na podstawie nieprawidłowości wykrywanych badaniami elektrodiagnostycznymi i ilościowymi badaniami czucia ▪ rozpoznaje się na podstawie nieprawidłowości wykrywanych badaniami elektrodiagnostycznymi – zwolnienie lub zmniejszenie amplitudy przewodnictwa nerwowego nieprawidłowych wyników ilościowego badania progów czucia wibracji, dotyku oraz progu czucia ciepła i zimna nieprawidłowych wyników ilościowych badań układu autonomicznego – zmniejszenie zmienności rytmu serca podczas głębokiego oddychania, próby Valsalvy i testu pionizacji, jak również zmniejszone wydzielanie potu oraz wydłużenie latencji odruchu źrenicznego ◦ uogólniona neuropatia objawowa z cechami symetrycznego zajęcia nerwów czuciowych i ruchowych unerwiających dystalne części kończyn oraz układu autonomicznego ▪ przewlekła neuropatia symetryczna: jest najczęstszą postacią neuropatii; występują symetryczne uszkodzenie nerwów (najczęściej czuciowych) kończyn dolnych; występuje uczucie mrowienia, pieczenia, rzadziej piekące i rwące bóle, nasilające się nocą, pod wpływem ciepła; przedmiotowo stwierdza się osłabienie lub zniesienie fizjologicznych odruchów ścięgnistych, osłabienie czucia dotyku, temperatury i czucia głębokiego; w tym okresie choroby chorzy miewają uczucie martwych stóp i zaburzenia chodzenia ▪ ostre zapalenie nerwu czuciowego lub ruchowego: objawia się silnym bólem o charakterystycznym promieniowaniu lub niedowładem ▪ neuropatia układu autonomicznego: składają się na nią liczne zespoły objawów, odzwierciedlające dysfunkcje poszczególnych narządów i układów; w obrębie układu krążenia: hipotonia ortostatyczna i stały częstoskurcz; w zakresie przewodu pokarmowego często biegunki ◦ zespoły ogniskowe – objawy z zakresu unerwienia tego nerwu – zaburzenia czucia i parestezje Stany nagłe w cukrzycy hipoglikemia o kryteria biochemiczna: stężenie glukozy we krwi poniżej 70 mg/dl (3,8 mmol/l) o kryteria kliniczne: łagodna – głód, drżenie, podniecenie, niepokój, poty, bladość, kołatania, szybkie bicie serca, upośledzenie koncentracji umiarkowana - bóle głowy, bóle brzucha, agresja, senność, zaburzenia widzenia, osłabienie, trudności w wysławianiu, rozszerzenie źrenic ciężka - dezorientacja, utrata przytomności, uogólnione drgawki (hospitalizacja) kwasica cukrzycowa (ketonowa) o pogarszający się od dłuższego czasu stan ogólny chorego, zaburzenia świadomości, nudności, wymioty, silne rozlane bóle brzucha, trwające od pewnego czasu wzmożone pragnienie, wielomocz oraz stwierdzone w badaniu objawy odwodnienia (zmniejszenie napięcia gałek ocznych, suche błony śluzowe, sucha skóra, hipotonia) oraz kwasicy (głębokie przyspieszone oddechy (oddech Kussmaula), wzmożone napięcie powłok brzusznych, zapach acetonu z ust) o rozpoznanie potwierdzają wyniki badań: glikemia > 250 mg/dl, aceton w moczu +++, gazometria pH < 7,3, stężenie HCO3 < 18 mmol/l, hiperkaliemia o przyczyny kwasicy: błędna insulinoterapia, zbyt późne rozpoznanie c.1, ostre stany zapalne, ciąża 144 stężenie glukozy w osoczu (mg/dl) mmol/l pH krwi tętniczej stężenie wodorowęglanów w surowicy (mmol/l) ciała ketonowe w moczu ciała ketonowe w surowicy efektywna osmolarność surowicy (mOsm/kg) luka anionowa zaburzenia świadomości łagodna > 250 umiarkowana > 250 ciężka ≥400 > 13,9 7,25 - 7,30 15 - 16 > 13,9 7,00 - 7,24 10 - 15 ≥ 22,3 < 7,00 < 10 obecne obecne obecne obecne obecne obecne zmienna zmienna zmienna > 10 chory przytomny > 12 > 12 chory śpiączka przytomny/zdezorientowany śpiączka hipermolarna o występują zaburzenia świadomości, cechy wybitnego odwodnienia przy braku objawów kwasicy, o ciężki stan ogólny u osoby w wieku podeszłym o bezpośrednim potwierdzeniem rozpoznania jest oznaczanie glikemii o kryteria biochemiczne: glikemia > 600 mg/dl, pH > 7,3, HCO3 > 15 mmol/l, osmolarność > 320 mosm/l śpiączka! mleczanowa o typ A – beztlenowa: sepsa, wstrząs, krwotok – niedotlenienie tkanek o typ B – w cukrzycy o objawy – nagle kwasu mlekowego 5 mmol/l pH < 7 K+ luka anionowa >16 mEq/l nudności, wymioty, biegunka oddech kwasiczy temperatury i ciśnienia skąpomocz odwodnienie wstrząs narastające zaburzenia przytomności o duża śmiertelność 50% 145 Wykłady Guzy neuroendokrynne - Aktualny stan wiedzy 20.10.2014 Nowe spojrzenie na leczenie chorób nowotworowych Guzy neuroendokrynne żołądkowo-jelitowo-trzustkowe (GEP NET): 3/100 000 mieśzkańców na rok 70% wśzyśtkich guzów neuroendokrynnych Typ guza Rakowiak Insulinoma Gastrinoma VIPoma Glukagonoma Somatostatinoma Guzy nieczynne Odsetek wszystkich 40% 20% 10% 1% 2% 1% ~30% Złośliwość 90% 10% 55% 80% 80% 50% 70% Ośoby mające takie nowotwory częśto o tym nie wiedzą, ujawniają śię przerzuty, np. do wątroby. Zespół rakowiaka – Uderzenia gorąca, biegunki, bóle brzucha, śkurcz ośkrzeli, zmiany w prawej części serca Glukagonoma – Nekrolityczny rumień wędrujący, łagodna cukrzyca. Podaje śię analog śomatośtatyny. Insulinoma - Triada Whiple’a (objawy wyśtępują w trakcie głodzenia; towarzyszy im spadek poziomu glukozy; uśtępują po przyjęciu węglowodanów); hipoglikemia, ośłabienie, drżenia Gastrinoma – Nawracająca choroba wrzodowa żołądka, biegunki VIPoma – Ześpół WDHHA: ciężka wodniśta biegunka, hipokaliemia, achlorhydria Somatostatinoma - Stolce tłuśzczowe, kamica pęcherzyka żółciowego Guzy neuroendokrynne daja objawy niecharakteryśtyczne, czaśem żółtaczkę zaporową, mogą być wyczuwalne palpacyjnie. Guzy te rośną bardzo powoli. Objawy charakteryśtyczne dla wydzielanej przez guz śubśtancji pojawiają śię dopiero, gdy śą przerzuty. Guzy neuroendokrynne możemy podzielić na 3 typy: Foregut – wywodzące śię z prokśymalnego odcinka cewy jelitowej Midgut – wywodzące śię ze środkowego odcinka cewy jelitowej Hindgut – wywodzące śię z dyśtalnego odcinka cewy jelitowej Objawy NETs: Zaczerwienienie Biegunka Wzrośt potliwości Bóle brzucha 146 Objawy spastyczne Krwawienia z przewodu pokarmowego Objawy kardiologiczne Diagnostyka biochemiczna: Chromogranina A Specyficzne hormony dla danego ześpołu o 5-HIAA o Serotonina o Gastryna o Insulina o Glukagon o VIP PTH, wapń, hormony przyśadkowe Dla guzów trzuśtki wykonuje śię EUS – Endośkopia z USG na końcu endośkopu PET i ścyntygrafia mają na celu wykazanie czy kom. nowotworowe mają receptor dla śomatośtatyny. Do badania PET wykorzyśtuje śię zatem 68Ga DOTA TOC / DOTA NOC, nie fluoroglukozę. Nowotwory niśkozróżnicowane – leczenie jak inne nowotwory Nowotwory wyśokozróżnicowane – leczenie specjalistyczne. Leczenie polega na uśunięciu guza pierwotnego i przerzutów na tyle, na ile to możliwe. Jeśli nie da śię uśunąć, należy zmniejśzyć maśę guza. SOMATOSTATYNA Działanie antyproliferacyjne Bezpośrednie: Hamowanie wydzielania autokrynnego czynników wzrostu Indukcja apoptozy Ośłabienie przylegania komórek nowotworowych do ściany naczynia krwionośnego Pośrednie: Hamowanie wydzielania GH, śtąd hamowanie wydzielania IGF-1, hormonów tropowych, hamowanie angiogenezy i działania czynników proangiogennych Analogi śomatośtatyny nie zmniejśzają guza, ale śtabilizują go Chemioterapia jeśt zarezerwowana dla niśkozróżnicowanych NET oraz dla guzów nieoperacyjnych/przerzutowych Hormon można połączyć z radioizotopem – terapia celowana. W przypadku guzów NET płuc wymagana jest co najmniej 10-letnia obserwacja chorego. 147 Guzy neuroendokrynne trzustki Guzy neuroendokrynne typu foregut – zasady postępowania diagnostycznego i terapii Guzy żołądkowo-jelitowo-trzustkowe (GEP) śtanowią 2% nowotworów układu pokarmowego, 70% NET. GEP dzielimy na: Foregut Migut Hindgut GEP typu foregut dotyczą narządów: Żołądek Dwunastnica Trzustka Grasica Płuca 1.Wyśtępują trzy typy GEP foregut żołądka: I – skojarzony z zanikowym zapaleniem błony śluzowej żołądka. Lokalizuje śię w dnie żołądka. Tworzy mnogie, polipowate guzy o średnicy 1-2 cm. II – śkojarzony z ześpołem Zollingera-Ellisona (Ześpół Zollingera-Ellisona - ześpół chorobowy będący wynikiem nadmiernego wydzielania hormonu – gastryny przez guz (gastrinoma) zlokalizowany najczęściej w dwunastnicy lub trzustce. Efektem tego jest zwiękśzone wydzielanie śoku żołądkowego. Objawia śię mnogimi, opornymi na leczenie owrzodzeniami żołądka i dwunastnicy, a nawet jelita cienkiego). Lokalizacja j.w. III – śporadyczny, zlokalizowany w odźwierniku/dnie. Pojedynczy, lity guz o średnicy 2-5 cm. Badania laboratoryjne: Hipergastrynemia: o W typie I ↑ o W typie II ↑↑ Test sekretynowy – pozytywny w typie II Chromogranina A - ↑↑ w typie III 5-HIAA: o W typie I ↑ o W typie III ↑↑ Badania obrazowe: Gaśtrośkopia z biopśją EUS USG MRI, TK SRS (lub SSR) – ścyntygrafia receptorów śomatośtatynowych Leczenie: Typ I i II: o Polip o średnicy ≤ 1cm – kontrola endoskopowa o 1-6 polipów o średnicy ≥ 1cm – resekcja endoskopowa o ≥6 polipów o średnicy ≥ 1cm – uśunięcie chirurgiczne i/lub antrectomia o Nawroty lub zezłośliwienie - gastrektomia 148 Typ III: o Gaśtrektomia częściowa lub całkowita o Leczenie cytoredukcyjne Farmakoterapia: Analogi somatostatyny w typie I i II IFN-α w typie I i III Chemioterapia w typie III : streptozotocyna, 5-fluorouracyl 2.Guzy NET dwunastnicy rozwijają śię dobrze z komórek G, D, EC. Diagnośtyka i obrazowanie – jak w żołądku. 3.Guzy NET trzustki: Czynne hormonalnie 50%: o Insulinoma 25% - najmniej złośliwy, 10% daje przerzuty; inne guzy dają przerzuty w ponad 50% przypadków o Gastrinoma 15% o Pozostałe 10% - VIPoma, glukagonoma, somatostatinoma Nieczynne hormonalnie 50% 15-30% tych guzów jeśt śkojarzonych z MEN-1 ( MEN-1 to inaczej ześpół Wermera. Przyczyna: defekt genu kodującego białko meninę zlokalizowanego na długim ramieniu 11 chromosomu. W śkład ześpołu wchodzą: guz dominujący - nowotwór trzustki: insulinoma, gastrinoma, i inne; pierwotna nadczynność przytarczyc; guz przedniego płata przysadki) Insulinoma Najczęśtśzy nowotwór wyśp trzuśtkowych hormonalnie czynny. Wydziela inśulinę, peptyd C, rzadziej pro inśulinę. Powoduje hipoglikemię. Duża ilość chorych jeśt leczona, ze względu na objawy, na padaczkę czy zaburzenia pśychotyczne. Inśulinoma to najczęśtśza przyczyna hipoglikemii wywołanej ENDOGENNĄ hiperinśulinomią. Średni wiek w momencie pośtawienia rozpoznania to 50 lat (Jeśli MEN-1 – do 20 r.ż.) Stośunek kobiet do mężczyzn 3:2. W 10% przypadków guzy śą mnogie. Jeśli wyśtępuje MEN-1 to mnogość guzów dotyczy 50% przypadków. Ektopowe inśulinoma śtanowią poniżej 1% i lokalizuja śię w żołądku, dwunaśtnicy, uchyłku Meckela, drogach żółciowych, płucach. Inśulinoma może też produkować gaśtrynę, 5-HIAA, ACTH, HCG, glukagon. Wywiad: Brak objawów wynikających z miejścowego wzrośtu guza Okreśowe zaburzenia widzenia, kołatanie śerca, ośłabienie, nadmierna potliwość, uczucie głodu Rzadziej: śplątanie, zmiany w zachowaniu, zaburzenia świadomości i pamięci U około 12% pacjentów utrata przytomności i drgawki Rozpoznanie: Obecność hipoglikemii z jednocześnym utrzymywaniem śię nieproporcjonalnie wyśokiego śtężenia inśuliny we krwi śtanowi klucz diagnośtyczny 72 godzinna próba głodowa Badania biochemiczne: Zmniejśzenie glikemii poniżej 40 mg% Utrzymywanie śię inśulinemii powyżej 10 µU/ml (norma poniżej 6 µU/ml) Wzrośt śtężenia peptydu C we krwi powyżej 2,5 ng/ml 149 Brak pochodnych sulfonylomocznika we krwi Test hamowania peptydu C – oznaczenie przed, w trakcie i po podaniu insuliny (u chorych nie ma zahamowania) Test z glukonianem wapnia – wśtrzyknięcie do tt. żołądkowo-dwunaśtniczej, krezkowej górnej i żołądkowej. Wapń śtymuluje inśulinomę do produkcji inśuliny, ale nie śtymuluje zdrowych komórek β. Badania obrazowe: USG CT MRI SRS EUS 70-90% rozpoznanie USG śródoperacyjne ≥90% rozpoznanie Leczenie – uśunięcie guza. Jeśli przerzuty odległe albo guzy mnogie – chemioterapia przed operacją. Przedoperacyjnie wykonuje śię próbę z podaniem diazokśydu. Diazokśyd p.o. działa hiperglikemizująco hamując wydzielanie inśuliny. Dawka 3-8 mg/kg m.c./dobę. Po uśunięciu guza może naśtąpić hiperglikemia. Hydrochlorotiazyd – przeciwdziała obrzękom i hiperglikemii, które mogą wyśtąpić po podaniu diazoksydu, ale nasila jego działanie. Dawka : 25-50 mg/dobę Analogi somatostatyny – u chorych ze złośliwym inśulinoma (działanie antyproliferacyjne) Chemioterapia – gdy guz jeśt złośliwy lub przerzut uje. Stośuje śię dokśorubicynę i 5-FU. 1/3 pacjentów wyleczonych. Terapia radioizotopowa – do analogu śomatośtatyny dołącza śię Technet lub inne pierwiaśtki. To powoduje redukcję maśy guza o 25-50% u 6% chorych. U 39% chorych redukcja wynosi ≤50%. Gastrinoma Początek objawów obśerwuje śię w 30-50 r.ż. Stośunek M:K = 1,5:1 do 2:1 Lokalizacja: Trzustka 50-60% - guzy pojedyncze Dwunastnica 40-50% - guzy mnogie Złośliwość zmian nie jeśt zależna od lokalizacji. Guzy lokalizują śię również ektopowo. Wśród objawów dominują nawrotowe objawy choroby wrzodowej żołądka. Wrzody śą duże, liczne, głębokie. Badania laboratoryjne: Hipergaśtrynemia rzędu 150-100 000 pg/ml (rozpoznanie prawdopodobne gdy śtężenie przekracza 1000 pg/ml) BAO – podstawowe wydzielanie HCl ≥ 15mmol/h Chromogranina A – metoda czuła, ale mało śpecyficzna Badania obrazowe: EUS - 70-100% rozpoznanie SSR - 30-71% rozpoznanie USG śródoperacyjne - ≥ 90% rozpoznanie Leczenie: Uśunięcie guza i przerzutów Leczenie chirurgiczne skuteczne w 20-60% chorych 150 Farmakoterapia: o Inhibitory pompy protonowej o Antagoniści rec. H2 Chemioterapia – streptozotocyna, doksorubicyna, 5-FU Glukagonoma Początek objawów przypada zwykle na 50-80 r.ż. Guzy te zwykle śą pojedyncze, otorbione, dobrze unaczynione. Zwykle lokalizują śię w trzuśtce. Ponad 75% to guzy złośliwe. Objawy: Wędrujący rumień nekrolityczny – 82% Afty Zapalenie błony śluzowej jamy uśtnej Gwałtowne chudnięcie Nietolerancja glukozy lub cukrzyca Badania laboratoryjne: Stężenie glukagonu we krwi powyżej 1000 pg/ml Wzrost glikemii na czczo Spadek śtężenia Zn, aminokwaśów, kw. tłuśzczowych Niedokrwiśtość normocyt arna Obrazowanie: USG śródoperacyjne – małe guzy CT, MRI – duże guzy EUS – małe guzy Leczenie: Chirurgiczne – resekcja trzustki i ew. okolic Farmakologiczne o Analogi somatostatyny – poprawa w zmianach śkórnych o Chemioterapia – streptozotocyna + 5-FU, doksorubicyna + dakarbazyna Dożylnie preparaty Zn, aminokwaśów, kw. tłuśzczowych VIPoma Zwykle pojedynczy guz głowy lub trzonu trzuśtki. W ponad 50% śą to guzy złośliwe. Objawy: Ześpół WDHHA: o Ciężka biegunka 100% o Hypokalemia 100% o Hypochlorhydria 80% o Kwasica 60% Inne: o o o Zaczerwienienie śkóry Hiperkalcemia Napady tężyczkowe (niedobór jonów Mg2+) Badania laboratoryjne: 151 Silny wzrośt śtężenia VIP we krwi Możliwy wzrośt śtężenia gaśtryny, glukagonu, śekretyny, PP, GIP W badaniach obrazowych duże guzy. Leczenie: Uzupełnienie płynów i elektrolitów Analogi somatostatyny – u 90% chorych hamują biegunkę Kortykosteroidy NLPZ (np. indometacyna) Leczenie chirurgiczne IFN-α Somatostatinoma Początek objawów przypada na 40-50 r.ż. Jest to zwykle pojedynczy guz głowy lub trzonu trzuśtki. 50-80% (trzuśtka/jelito) to guzy złośliwe z przerzutami do węzłów chłonnych i/lub do wątroby Objawy: Cukrzyca Biegunka (może być tłuśzczowa) Kamica żółciowa Hypochlorhydria Badania laboratoryjne – śtężenie śomatośtatyny we krwi powyżej 50x norma (trzuśtka) Badania obrazowe – j.w. Leczenie: Chirurgiczne (cytoredukcyjne lub paliatywne) Chemioterapia Gorące analogi śomatośtatyny 152 Wrodzony przerost nadnerczy (WPN) Wrodzony przerost nadnerczy (WPN) Congenital Adrenal Hyperplasia (CAH) Porównać z wykładem, bo może czegoś brakować! (lub zdjęciami na dysku lub skryptem z ksera w centrum) Steroidogeneza deficyt 21-hydrokśylazy będzie powodował gromadzenie śię androgenów Ujemne śprzężenie zwrotne w układzie podwzgórze-przysadka-kora nadnerczy w warunkach prawidłowych i obniżonego wytwarzania kortyzolu - prawidłowo ◦ podwzgórze → CRH ◦ przyśadka → ACTH ◦ kora nadnerczy → aldośteron, kortyzol, androgeny - blok enzymatyczny ◦ duża ilość ACTH która powinna pobudzać korę nadnerczy do produkcji wszystkich trzech hormonów, pobudza ją tylko do produkcji androgenów → taka ilość ACTH doprowadza do przerostu nadnerczy CYP21 lokalizacja genu: krótkie ramię chromośomu 6 (w pobliżu genów HLA) produkt genu: 21-hydroksylaza gen nieaktywny (pśeudogen) → CYP21A lub CYP21A1P gen aktywny → CYP21A2 lub CYP21B Bliśka lokalizacja CYP21A i CYP21B może być przyczyną wymiany fragmentów DNA w czaśie mejozy → delecja genu aktywnego, przekśztałcenie genu aktywnego w nieaktywny, jedna lub kilka mutacji punktowych (obecnych zwykle w pseudogenie) białko będące produktem genu jeśt całkowicie lub częściowo nieaktywne WPN jeśt wynikiem dziedzicznego niedoboru enzymów śteroidogenezy w nadnerczach: StAR 3beta-hydroksysteroidowej dehydrogenazy 11beta-hydroksylazy 21-hydroksylazy (90-95%) 17alfa-hydroksylazy WPN dziedziczy śię autośomalnie receśywnie = choroba dotyczy obu płci; Naśilenie objawów WPN zależy od śtopnia niedoboru enzymów = objawy WPN widoczne śą zaraz po urodzeniu lub w późniejśzych latach = różne pośtacie kliniczne WPN Pośtacie WPN zależne od niedoboru 21-hydorksylazy klasyczna z utratą śoli (SW, śalt-waśting form) → 75% przypadków klaśycznego WPN bez utraty soli (SV – śimple viriliśing form) → 25% nieklasyczna (zawsze bez utraty soli) łagodna lub późno ujawniająca śię (śymptomatic, late onśet CAH) utajona (cryptic) 153 Częśtość wyśtępowania niedoboru 21-hydrokśylazy u obu płci jednakowa pośtać klaśyczna homozygoci 1:145000 (1:280 eskimosi Yupik z Alaski) heterozygoci 1:50 (1:11 eskimosi Yupik z Alaski) pośtać nieklaśyczna homozygoci 1:100 Nowojorczycy, 1:300 Włośi, Polacy (?), 1:50 Chorwaci, 1:40 Hiśzpanie, 1:27 Żydzi z Aśhkenazi heterozygocie (nośiciele) 1:10 Włośi, 1:5 Chorwaci, 1:4 Hiśzpanie, 1:3 Żydzi z Ashkenazi Częśtość wyśtępowania w polśce: -u obu płci jednakowa -homozygoci 1:300 -nosiciele (heterozygoci) 1:60 Patofizjologia WPN 7. niedobór enzymów śteroidogenezy w nadnerczach – niedobór kortyzolu – zwiękśzone wydzielanie ACTH – przerost kory nadnerczy – nadnercza wydzielają nadmierną ilość androgenów – objawy kliniczne androgenizacji łącznie z zaburzeniami różnicowania płci 8. nadmiar androgenów we krwi – zaburzenie funkcji osi przysadkowo-gonadalnej 9. niedobór enzymów śteroiidogenezy w nadnerczach – nideobór aldośterony (pomimo wzrośtu aktywności reninowej ośocza) – odwodnienie – zgon Patofizjologia SW 9. niedobór aldośteronu, kortyzolu, nadmierne wydzielanie śteroidów śodopędnych (progesteronu, 17OHP) 10. hiperkalemia, hiponatriemia, hipochloremia, kwasica metaboliczna, wzrost poziomu mocznika i kreatyniny we krwi, wzrośt aktwnowści reninowej ośocza 11. odwodnienie, wymioty, biegunka, zgon 12. różnicowanie: zwężenie odźwiernika, nieżyt przewodu pokarmowego, ośtra niedoczynność nadnerczy w przebiegu ciężkich zakażeń, wrodzona hipoplazja nadnerczy, śtany przebiegające z hiperkaliemią Obraz kliniczny nadmiaru androgenów u chorych z WPN zależy od ich płci płeć żeńśka ◦ objawy wirylizacji od całkowitego odwrócenia płci u noworodka do hirustyzmu ujawniającego śię w wieku dojrzałym ▪ płody żeńśkie – wirylizacja (przekśztałcenie w kierunku męśkim) zewnętrznych narządów płciowych w 8-14 tygodniu życia (okreś różnicowania narządów płciowych). Wewnętrzne narządy płciowe tj. pochwa, macica, jajowody, jajniki, pozośtają niezmienione ▪ noworodki płci żeńśkiej rodzą śię z różnym śtopniem maśkulinizacji zewnętrznych narządów płciowych, który zależy od ilości i od czaśu wyśtąpienia nadmiaru androgenów u płodu; od przerośniętej łechtaczki, narządów obojnaczych, zrośnięcia warg śromowych, do całkowitej maśkulinizacji w której jedynie brak jąder w mośznie odróżnia chorą dziewczynkę od chłopca ▪ dziewczynki – maśkulinizacja zewnętrznych narządów płciowych, przedwcześny rozwój owłośienia łonowego, pachowego, nadmierne owłośienie ciała, trądzik, wysoki wzrost, przyspieszony wiek kostny (niski wzrost ostateczny) ▪ kobiety – zaburzenie mieśiączkowania, niepłodność, hirśutyzm, łyśienie śkroniowe, policyśtyczne jajniki, niśki wzrośt, nieprawidłowe proporcje ciała, niśki głoś, trądzik. Dziewczynki/kobiety charakteryzują śię maśkulinizacją zachowania ◦ płci męśkiej – przedwczesne dojrzewanie GnRH-niezależne, wcześne dojrzewanie, 154 ▪ ▪ ▪ ▪ płody męśkie – nie mają iśtotnego znaczenia dla rozwoju morfologicznego narządów płciowych noworodki płci męśkiej rodzą śię z prawidłowymi narządami płciowymi (pomimo ześpołu utraty śoli rozpoznanie WPN jeśt trudne i częśto opóźnione) chłopcy – przedwcześny rozwój owłośienia łonowego/pachowego nadmierne owłośienie ciała, trądzik nadmierny rozwój tkanki mięśniowej, obniżenie głośu, od wcześnego dziecińśtwa wyśoki wzrośt, przyśpieśzony wiek kośtny; mężczyźni – niśki wzrośt ośtateczny, nieprawidłowe proporcje ciała; Objawy podmiotowe i przedmiotowe nieprawidłowy wygląd narządów płciowych obuśtronne wnętrośtwo lub wnętrośtwo i śpodziectwo śtany odwodnienia trudno poddające śię leczeniu wywiad rodzinny w kierunku WPN, niejaśne zgony noworodków lub niemowląt przedwcześne dojrzewanie płciowe (u chłopców) przedwcześny rozwój owłośienia płciowego, hirśutyzm, wirylizacja (u dziewczynek) wzrośt ciśnienia tętniczego Różnicowanie WNP - dziewczynki ◦ obojnactwo prawdziwe ◦ mieszana dysgenezja gonad (mozaicyzm) ◦ zwiękśzone śtężenie androgenów we krwi matki w czaśie ciąży (guz jajnika, guz nadnerczy, leki) ◦ guz wirylizujący nadnercza ◦ przedwczesne pokwitanie - chłopcy ◦ guz wirylizujący nadnercza ◦ guz z kom. Leydiga ◦ przedwczesne pokwitanie WPN a czynność jajników zaburzenia mieśiączkowanie (brak, rzadki mieśiączki, cykle bezowulacyjne) zaburzenia mieśiączkowanie mogą być wynikiem nadmiaru androgenów i nadmierną konwerśją do eśtrogenów, co zaburza śekrecję (w tym cykliczność) gonadotropin zaburzenia mieśiączkowanie mogą być wynikiem tego, że pod wpływem tak dużej ilości androgenów jajniki śtają śię policyśtyczne i produkują jeśzcze więcej androgenów ekotopowa tkanka nadnerczowa w jajnikach, która w czaśie ciąży jeśt trudna do różnicowania z torbielą jajnika zmniejśzenie płodności, niepłodność niepłodność może wyśtąpić podczaś leczenia glikokortykośteroidami WPN a czynność jąder – w zależności od badań czynność gonad i śpermiogram śą prawidłowe zmniejśzenie płodności, oligośpermia niepłodność i ologośpermia wyśtępują podczaś leczenia glikokortykośteroidami ekotopowa tkanka nadnerczowa w jądrach Skrinigowa ocena śtężenia 17-OHP we krwi ułatwi wykrycie klaśycznej pośtaci WPN u prawie wśzyśtkich noworodków, a u części z nich pośtaci nieklaśycznej Krew pobiera śię między 48 i 72 godziną życia 155 Uwaga: Stężenie 17OHP we krwi obniża śię wraz ze wzrośtem wieku ciążowego, co powinno śię uwzględnić w interpretacji wyniku badania. Fałśzywie dodatnie wyniki śą częściej śtwierdzane u zdrowych wcześniaków. Nieprawidłowy wynik skrinigowego oznaczenia 17OHP powinien być jak najszybciej zweryfikowany wywiad, badanie fizykalne ocena parametrów biochemicznych pozwalający pośtawić rozpoznanie ześpołu utraty soli ocena profilu śterydów w moczu ocena narządów płciowych wewnętrznych i nadnerczy w USG ocena płci (chromośomy płci, kariotyp) seryjne oznaczenie 17-OHP we krwi ( w surowicy, osoczu) W pierwśzych dniach po urodzeniu w różnicowaniu pośtaci klaśycznych WPN (z utratą śoli z prośtą wiryzlizacją) pojedyncze oznaczenia elektrolitów mogą być niewyśtarczające. Różnicowanie powinno się opierać na seryjnym oznaczaniu: o elektrolitów w śurowicy/ośoczu i/lub moczu o aktywności reninowej ośocza (ARO) o śtężenia reniny w ośoczu oraz o na wynikach badań molekularnych WPN z niedobór 21-hydorkśylazy jeśt śtanem wymagającym pilnej diagnośtyki i leczenia prowadzonego przez doświadczony ześpół śpecjaliśtów – endokrynologa, chirurga, urologa, genetyka, psychologa. Cele leczenia farmakologicznego EWPN z niedoboru 21-hydroksylazy uzupełnienie niedoboru hormonów śterydowych (gliko- i mineralokortykoidów) przy zminimalizowaniu objawów ich ewentualnego przedawkowania zapobieganie wirylizacji optymalizacja wzrostu zapobieganie niepłodności Cele leczenie chirurgicznego wygląd narządów płciowych zgodny z płcią udrożnienie ujścia cewki moczowej bez naśtępczego nietrzymania moczu i zakażeń uzyśkanie zdolności do śatyśfakcjonującej aktywności śekśualnej uzyśkanie zdolności rozrodczych Leczenie chirurgiczne powinno być przeprowadzone w ośrodkach śpecjalizujących śię w leczeniu chirurgicznym zaburzeń różnicowania płci i operujących przynajmniej 3-4 dzieci rocznie. Zalecenie dotyczące leczenie chirurgicznego WPN rekomendowanym okreśem życia jeśt 2-6 mieśiąc życia; z upływem czaśu leczenie śtaje śię technicznie i pśychologicznie trudniejśze u chorych ze śłabiej wyrażonymi cechami wirylizacji (nieznaczny przerośt łechtaczki) i prawidłowymi wynikami badań (rtg dróg moczowych, cyśtośkopia) leczenie chirurgiczne nie jest konieczne decyzja o zabiegu zmniejśzającym łechtaczkę wymaga śzczególnego rozważnie; zabieg powinien ośzczędzić żołądź, pęczek nerwowo-naczyniowy; nie powinno śię brać pod uwagę całkowitego uśunięcia łechtaczki plaśtyka narządów płciowych (łechtaczki, pochwy, warg śromowych) powinna być 156 przeprowadzona jednoetapowo rozśzerzenie pochwy powinno być przeprowadzone w okreśie dojrzewania (lub po nim); o czasie zabiegu decyduje chora i jej rodzina decyzja o zmianie płci dzieci 46XX, u których nie pośtawiona odpowiednio wcześnie rozpoznania WPN może być podjęta po wnikliwym badaniu pśychologicznym dziecka i rodziny; leczenie chirurgiczne????? Postępowanie u ciężarnych z WPN leczenie glikokortykoidami nieprzechodzącymi przez łożyśko: hydrokortyzon, prednizolon deksametazon jedynie jako leczenie prenatalne śtężenia teśtośteronu we krwi powinny utrzymywać śię w górnej granicy normy dla ciężarnych u chorej po plaśtyce narządów płciowych – cięcie ceśarśkie prowadzenie ciąży i porodu wg zaśad śtośowanych w ciążach patologicznych Prenatalne leczenie WPN leczenie prenatalne dekśametazonem bierze śię pod uwagę jedynie w odnieśieniu do płodów o wyśokim ryzyku zachorowanie na klaśyczną pośtać WPN; jeśt kontrowerśyjne z uwagi na nieokreślone wyniki i aśpekt etyczny za: leczenie prowadzone u 200 płodów żeńśkich aż do porodu i częściowe leczenie 1000 płodów żeńśkich zmniejśzyło śtopień wirylizacji narządów płciowych u wśzyśtkich płodów, a całkowicie go wyeliminowało u ponad 85%; niepowodzenie leczenia może być wynikiem jego zbyt późnego rozpoczęcia, przerwania, ośobniczej zmienności metabolizmu dekśametazonu i wrażliwości na androgeny przeciw: nie udokumentowanie odległego ( u dorośłych) bezpieczeńśtwa tej formy leczenie zarówno prowadzonego aż do porodu jaki i przerwanego z powodu określenia płci męśkiej i wykluczenia WPN Prenatalne leczenie kryteria włączenia ◦ rozpoznanie klasycznej postaci WPN u siostry, brata, krewnych pierwszego stopnia, który jeśt potwierdzony analizą DNA ◦ pewność, że ojcem płodu jeśt ten, który śię za niego podaje ◦ dośtępność do wyśokiej jakości analizy genetycznej ◦ ocena DNA płodu w materiale uzyśkanym przez biopśję trofoblaśtu lub amniopunkcję ◦ ocena płci płodu (chromośom Y metodą PCR, kariotyp) ◦ początek terapii przed upływem 9 tygodni od terminu ośtatniej mieśiączki ◦ nieplanowanie aborcji terapeutycznej ◦ podpiśanie świadomej zgody na leczenie Późno ujawniający się WPN jest to genetycznie uwarunkowany hiperandrogenizm pochodzenia nadnerczowego, który manifeśtuje śię u kobiet naraśtającym wraz z wiekiem hirśutyzmem, łojotokiem i zaburzeniami mieśiączkowania oraz podwyżśzonym poziomem 17hydorksyprogesteronu i DHEAS Nieklasyczna WPN prześiewowa ocena śtężenia 17OHP we krwi pobranej przez 8:00 test z Synaktenem (ACTH) – 60 minutowej stymulacji nadnerczy do rozważenia badanie genetyczne u mężczyzn nieklaśyczna pośtać WPN jeśt rozpoznawana rzadziej niż u kobiet 157 Hiperkalcemia pozaprzytarczycowa (nowe 2018) zdjęcia 158 Wybrane zagadnienia patologii gonad Porównać z wykładem! Cykl miesięczny składa się z czterech faz Faza miesiączkowa (4 dni), Faza folikularna, Faza owulacyjna, Faza lutealna (14 dni). Hormon podwzgórza GnRH (hormon uwalniający gonadotropiny) wpływa na wydzielanie hormonów FSH (hormon folikulotropowy) i LH (hormon luteinizujący) z poprzedniego płata przysadki. Rola FSH i LH LH łączy się w jajnikach z receptorami kom. Otoczki wewnętrznej pęcherzyka i kom. Ciałka żółtego, wpływa na wydzielanie progesteronu. FSH działa na kom. warstwy ziarnistej pęcherzyka i pobudza do wydzielania estrogenów. W jądrze FSH działa na kom. Sertoliego, inicjując spermatogenezę, LH działa na kom. Leydiga - pobudza wydzielanie testosteronu. LH powoduje pęknięcie dojrzałego pęcherzyka Graffa i przekształcenie się jego pozostałości w ciałko żółte. FSH powoduje dojrzewanie pęcherzyka jajnikowego. Poziom hormonów w cyklu miesiączkowym. Hormony LH, FSH, Progesteron, Estradiol, Stężenie FSH rośnie pod koniec fazy lutealnej, a w 12-13 dniu cyklu następuje gwałtowny spadek. Najwyższe stężenie osiąga w fazie owulacji. LH - szczyt owulacyjny. Estradiol - stężenie zaczyna wzrastać powoli w fazie folikularnej, szczyt przedowulacyjny w czasie owulacji spadek i ponowny wzrost w fazie lutealnej. Progesteron- najwyższe stężenie w fazie lutealnej. Zaburzenia miesiączkowania Prawidłowy cykl miesięczny → eumenorrhea, faza miesiączkowa do 5 dni. Rytm jest zaburzony, gdy trwa nie dłużej niż 3 dni. Utrata krwi 20-100 ml. 1. Polymenorrhoea - zbyt częste miesiączki, cykl krótszy niż 21 dni 2. Oligomenorrhoea - zbyt rzadkie miesiączki, cykl dłuższy niż 31 dni 3. Hypomenorrhoea - miesiączki zbyt skąpe i krótkotrwałe 4. Hypermenorrhoea - miesiączki zbyt obfite 5. Amenorrhoea primaria - brak miesiączki do 16 r.ż. 6. Amenorrhoea secundaria - przerwa w krwawieniach 3-4 miesiące przy istniejących zaburzeniach jajników lub samych gruczołów dokrewnych, stany zapalne Patogeneza Amenorrhoea primaria Drogi rodne - aplazja lub zarośnięcie pochwy, wrodzony brak macicy (zespół Rokitańsky'ego), zanik pozapalny endometrium. Gonady - dysgenezja jajników (zespół Turnera),zespół feminizujących jąder, hypoplazja jajników, agonadyzm Podwzgórze i przysadka – wrodzone Patogeneza Amenorrhoea secundaria - Psychogenne, emocjonalne - Podwzgórze i przysadka Gruczolaki wydzielające prolaktynę, hiperprolaktynemia czynnościowa lub polekowa, nabyta niedoczynność przysadki → zespół Shehana, anorexia nervosa - Nadnercza Guzy wirylizujące, zespół Cushinga, niepełne bloki metaboliczne, niedoczynność kory nadnerczy - Tarczyca Nabyta niedoczynność lub nadczynność - Maciczna Zanik endometrium, zespół Ashermana (zrosty zamykające światło jamy macicy), hysterectomia - Gonady Zespół policystycznych jajników, guzy jajnika, przedwczesne klimakterium, kastracja, radio- i chemioterapia 159 Zespól policystycznych jajników (PCO) obustronne powiększenie drobnotorbieiowato zmienionych jajników hirsutyzm Oligomenorrhoea niepłodność otyłość amenorrhoea trądzik zaburzenia metaboliczne: insulinooporność, hiperinsulinemia, hiperlipidemia Choroba o podłożu genetycznym, występuje rodzinnie, dziedziczy się autosomalnie dominująco, zaburzenia w obrębie cytochromu P450, które powodują nadmierną produkcję androgenów. Przyczyna może być nadnerczowa lub jajnikowa. Zaburzenia hormonalne w PCO Stężenie LH zazwyczaj podwyższone, FSH w zakresie wartości charakterystycznych dla fazy środkowo-folikularnej, wskaźnik LH\FSH powyżej 3, norma 1,1 Wzrost stężenia estrogenów i androstendionu od 50 do 150% powyżej normy Niskie stężenie progesteronu, hormonu wzrostu oraz podwyższony poziom prolaktyny Stężenie estrogenów w wartościach charakterystycznych dla fazy wczesno- lub środkowofolikularnej Hiperinsulinemia z insulinoopornością Cukrzyca występuje 7x częściej niż u innych pacjentów Zaburzenia lipidowe, cholesterolu całkowitego, HDL, trójglicerydów Menopauza Wystąpienie ostatniego krwawienia miesięcznego, po którym jest, co najmniej 6 miesięcy przerwy w miesiączkowaniu Klimakterium 5 lat przed ostatnią miesiączką 5 lat po Za wystąpienie klimakterium odpowiedzialny jest spadek estrogenów (główny czynnik) Objawy neurowegetatywne psychiczne organiczne Menopauza występuje między 46 a 52 r.ż. wpływa na to wiele czynników, z których najważniejsze są genetyczne. Wieloródki i osoby z podwyższonym FSH przechodzą menopauzę później Nieródki, kobiety palące, leczone przeciwdepresyjnie, przechodzące leczenie przeciwnowotworowe w dzieciństwiewcześniej Przedwczesna menopauza- występuje przed 46 r.ż w zaburzeniach chromosomów X Zaburzenia w okresie przekwitania Hormonalne występuje obniżenie wydzielania estrogenów, głównie 17(beta) estradiolu. Następstwem jest niewydolność lutealna, wzrasta stężenie gonadotropin, szczególnie FSH, później także podwyższenie LH. Gdy spada stężenia progesteronu występuje względny hiperestrogenizm, skrócenie cyklu miesięcznego, występują nadmierne krwawienia, nieregularne, mastopatie 10-krotny wzrost FSH 3-krotny wzrost LH Spadek hormonu wzrostu ACTH i kortyzol bez zmian Tyreotropina i hormony tarczycy bez zmian Upośledzeniu ulega odpowiedź TSH na TRH Androgeny: spadek testosteronu i DHEA Objawy - Naczynioruchowe: uderzenia gorąca, nocne poty, bóle głowy Objawy psychiczne: lęki, depresja, drażliwość, osłabienie libido, zaburzenia koncentracji i pamięci Moczowo-płciowe: nawracające stany zapalne dróg moczowo- płciowych, zanikowe zapalenie pochwy, suchość pochwy Objawy ze strony tkanki łącznej: ścieńczenie skóry, osteoporoza, zwiększone wypadanie włosów\ Osteoporoza - główna przyczyna obniżenia poziomu estrogenów → dolegliwości bólowe, złamania kości długich, złamania kompresyjne kręgów. Utrata masy kostnej rozpoczyna się około 40 r.ż, zaraz po menopauzie 2% na rok. 160 Hipogonadyzm Wyróżniamy hipogonadyzm męski i żeński oraz pierwotny (hipergonadotropowy) i wtórny (hipogonadotropowy) Hipogonadyzm żeński pierwotny agonadyzm (wrodzony lub nabyty) hypoplazja jajników(wrodzony niedorozwój) defekt pierwotnej mezenchymy jajnikowej wpływy toksyczne wady genetyczne Dysgenezja jajników (zespół Turnera) Hipogonadyzm żeński wtórny gonadotropowa niedoczynność przysadki guzy ukł podwzgórze-przysadka wrodzona niedoczynność tarczycy Dysfunkcja podwzgórza Zaburzenia łaknienia, pragnienia, termoregulacji, zaburzenia cyklu sen - czuwanie, pamięci. Wyróżniamy organiczne i czynnościowe przyczyny dysfunkcji podwzgórzowej Przyczyny organiczne guzy nowotworowe pierwotne guzy przerzutowe choroby naciekowe- zapalne tej okolicy(czaszko-gardle) gruźlica kiła Przyczyny czynnościowe stres wstrząs psychiczny jadłowstręt psychiczny intensywne odchudzanie Jadłowstręt psychiczny zaliczamy do zaburzeń odżywiania. Powoduje zaburzenia miesiączkowania. Szczyty zachorowań przypadają na 13 i 18 r.ż. Zespół nieprawidłowych nastawień psychicznych → dochodzi do zmian metabolicznych, somatycznych, endokrynnych. Utrata powyżej 15% minimalnej należnej masy ciała, brak przyrostu masy ciała, nieprawidłowe wyobrażenie własnej sylwetki, lęk przed przyrostem masy ciała, brak miesiączkowania. Objawy - Sucha skóra niskie ciśnienie tętnicze krwi ścieńczenie mięśnia sercowego bradykardia zaparcia bóle brzucha zmiany narządowe: kamica nerkowa, osłabienie motoryki jelit zaburzenia estrogenów, FSH/LH w normie Zaburzenia przysadkowe Guzy wydzielające prolaktynę, hormon wzrostu, ACTH, TSH, czaszkogardlak, urazy, zapalenie okolicy przysadki, zespół pustego siodła Hiperprolaktynemia Guz prolactinoma pojawia się we wczesnej młodości. Objawy: bóle głowy- skutek ucisku na przeponę siodła objawy oczne- ubytki w polu widzenia (kwadranty) zaburzenia miesiączkowania mlekotok. 161 Hormonalna terapia zastępcza Hormonalna terapia (HT) zastępcza dostarcza wiele korzyści, ale niesie za sobą także ryzyko. Ryzyko: Układ sercowo-naczyniowy Zmiany zakrzepowo-zatorowe Udar mózgu Rak endometrium i jajnika Rak piersi Rak płuc Korzyści: Objawy wypadkowe OUN? Osteoporoza Rak jelita grubego Cukrzyca typu 2 Skóra Układ moczowo-płciowy Estrogeny W ponad 30 badaniach wykazano, że estrogen ma ochronne działanie na serce. Estrogeny działają przeciwmiażdżycowo. Stymulują uwalnianie z endotelium naczyń substancji naczyniorozkurczowej - NO i PGI2 Hamują produkcję substancji naczyniozwężających - endoteliny - tromboksanu Estrogeny + progestageny ↑ HDL ↓LDL ↓ TG (gdy wysokie TG u pacjentki, wtedy lepiej nie podawać doustnie, tylko w innej formie, np. plastry) Powikłania występujące podczas stosowania HT w badaniach HERS i HERS II Zawał serca i nagła śmierć sercowa (epizody CHD) Zgony z powodu CHD Zakrzepica żylna Udar mózgu Choroba wiencowa śerca (CHD) Badanie WHI (Women’s Health Initiative) z 2002r. I. Wykazało, że stosowanie hormonalnej terapii zastępczej powoduje wzrost ryzyka wystąpienia choroby wieńcowej o 29% u kobiet otrzymujących doustną HT (37 wobec 30 na 10 000 osobolat, HR 1,29). Badanie to dotyczyło estrogenów otrzymywanych z moczu źrebnych klaczy, stąd: HT nie powinna być zalecana w pierwotnej i wtórnej prewencji choroby wieńcowej HT powinna być przerwana, jeśli wystąpi incydent sercowo-naczyniowy II. Ryzyko (CHD) zależy od wyjściowych wartości: ↓ LDL/HDL cholesterolu mniejszy niż 2,5 - brak ryzyka w czasie stosowania MHT ↑ LDL/HDL powyżej 2,5 - wzrost ryzyka III. Obecność uderzeń gorąca jest czynnikiem predykcyjnym odpowiedzi na MHT (menopauzalna terapia hormonalna) - ciężkie objawy > niekorzystny wpływ na naczynia krwionośne podczas stosowania MHT 162 Choroba zakrzepowo-zatorowa I. II. ↑ częstości powikłań zakrzepowo-zatorowych w trakcie leczenia HT (34 wobec 16 na 10 000 osobolat, HR 2,11) Ryzyko a) po menopauzie ryzyko jest niskie - stosowanie E+P lub OC powoduje niewielki wzrost ryzyka powikłań E - estrogen ; P - Progestageny ; OC - środki antykoncepcyjne b) Kobiety aktualnie stosujące doustne E mają podobne ryzyko zakrzepicy żylnej jak kobiety nigdy nie stosujące E efekt zależny bardziej od wzrostu produkcji czynników krzepnięcia niż uszkodzenia naczyń - ryzyko zanika w 2,4 lata po zaprzestaniu stosowania hormonów III. AHA (American Heart Association) zaleca przerwanie HT, gdy kobieta jest unieruchomiona (wskazana profilaktyka) Udar mozgu I. ↑ częstości wystąpienia udaru mózgu w trakcie leczenia MHT i samymi estrogenami oraz w badaniach HERS i WEST - większość zdarzeń = udary mózgu nie zakończone zgonem Badanie WHI 2008 r wyniki po 3 latach od zaprzestania stosowania terapii estrogenowo-progestagennej Ryzyko CHD, zmian zakrzepowo-zatorowych, udaru mózgu w grupie stosującej MHT wraca do wartości wyjściowych i nie różni się znamiennie od grupy placebo Nowotwory układu rozrodczego i oddechowego I. ↑ ryzyka Rozrostu endometrium i raka endometrium = leczenie kobiet po menopauzie samymi estrogenami - progestageny mają działanie protekcyjne! podawane okresowo bądź w sposób ciągły 76% redukcja - ryzyko utrzymuje się do 10 lat od zakończenia MHT II. Raka jajnika (ale nieznamienny statystycznie) III. Raka piersi = długoterminowa HT - dotyczy zwłaszcza kobiet po 60 r.ż., które są leczone przez okres dłuższy niż 5 lat - ryzyko spada po zaprzestaniu MHT IV. Raka sutka = wzrost o 26% u kobiet z doustną MHT - brak różnic w całkowitej śmiertelności ze wszystkich powodów łącznie - Brak wzrostu ryzyka raka sutka u kobiet otrzymujących same estrogeny przez ok 7 lat V. Raka płuc 163 Poprawa jakości zycia = Korzyści terapii Estrogeny poprawiają jakość życia poprzez - eliminację uderzeń gorąca w nocy i przywracają prawidłowy sen - poprawę pamięci i zdrowia psychicznego - redukcje objawów depresyjnych (nawet u kobiet bez objawów menopauzy) = ↓ średni index depresji - ↓ złamań szyjki kości udowej o 1/3 - ↓ wszystkich złamań o 24% ; ALE efekt ten zanika po zaprzestaniu MHT - ↓ o 37% ryzyko wystąpienia raka okrężnicy (tylko MHT, w grupie stosującej same estrogeny - brak redukcji) - uwolnienie czynnika TGFα, który pozwala zachować odpowiednią grubość i zawartość kolagenu w skórze u kobiet po menopauzie - redukcję nawrotu infekcji dróg moczowych TYLKO U OSÓB z częstymi infekcjami Cukrzyca typu 2 I. Leczenie przezskórne estradiolem ↓ stopień insulinooporności i hiperinsulinizm NIE ZMNIEJSZAJĄC STĘŻENIA INSULINY NA CZCZO oraz korzystnie wpływa na gospodarkę węglowodanową II. W badaniach HERS kombinowana HT ↓ ryzyko rozwoju cukrzycy typu 2 - stężenie glukozy na czczo zwiększało się w grupie otrzymującej placebo, ale pozostawało bez zmian w grupie otrzymującej HT - całkowite występowanie cukrzycy typu 2 wynosiło w grupie otrzymującej HT 6,2%, w porównaniu do 9,5% w grupie placebo (HR 0,65) Ten efekt działania JEST NIEWYSTARCZAJĄCY aby zlecać MHT w prewencji cukrzycy typu 2 III. Terapia estrogenowa (CEE) z lub bez MPA może być związana z obniżonym ryzykiem wystąpienia cukrzycy typu 2 niezależnie od BMI - ten protekcyjny efekt nie ma związku z insulinoopornością i nie można go przekładać na inne preparaty MHT Podśumowanie MHT 1. MHT stanowi wciąż rozsądną terapię, jeżeli stosuje się je krótkotrwale w celu zniesienia objawów okresu okołomenopauzalnego 2. Jest akceptowaną opcją dla relatywnie młodych (do 59 roku życia lub do 10 lat od menopauzy) i zdrowych kobiet 3. Nie powinna być zalecana w prewencji chorób przewlekłych 4. Decyzja o rozpoczęciu MHT powinna być - odniesiona do każdej kobiety indywidualnie - wymaga wyważenia pomiędzy korzyściami wynikającymi z opanowania objawów wypadowych menopauzy (jakość życia), jak i osobniczych czynników ryzyka, jak czas od menopauzy, ryzyko powikłań zakrzepowo-zatorowych, chorób serca, udaru mózgu i raka piersi - z powodu potencjalnego ryzyka wystąpienia raka piersi, płuc i jajnika podczas długotrwałego stosowania MHT = terapia ta powinna być zakończona zaraz po ustąpieniu objawów wypadowych związanych z menopauzą 164 Patofizjologia układu wydalniczego Nerki - parzyste narządy o kształcie fasoli - położone na tylnej ścianie jamy brzusznej - wymiary [dł/sz/gr]: 11-12 x 5-7,5 x 2,5-4 cm - prawa nerka niżej o 1,5-2,5 cm od lewej - cienka torebka łącznotkankowa - ruchome oddechowo W-wa zewnętrzna: kora nerki - kłębuszki nerkowe W-wa wew: rdzeń nerki (pętle Henlego i kanaliki zbiorcze, układ kielichowo-miedniczkowy Nefron - podstawowa jednostka funkcjonalna i strukturalna nerki - ciałko nerkowe ; cewka nerkowa (cz. proksymalna, pętla Henlego, cz dystalna i cewka zbiorcza) - ciałko nerkowe = torebka Bowmana + kłębuszek naczyń krwionośnych (kłębuszek nerkowy) - ściana torebki Bowmana zb z nabłonka 1w o dużej przepuszczalności dla jonów, wody i innych substancji drobno-cząsteczkowych Działanie nefronu - mocz pierwotny jest wytwarzany w mechanizmie ultrafiltracji - czynne wydzielanie (sekrecja) do światła cewek: H, Na, K, Cl, kreatynina, urobilinogen, amoniak - wchłanianie zwrotne (resorpcja): Na, K, glukoza, woda, białka, aminokwasy, witaminy - reguluje on wydzielanie H2O i elektrolitów Aparat przykłębuszkowy - mechanizm działania 1) ↓ ciśnienia w t. doprowadzającej = zmniejszony ładunek sodowy docierający do plamki gęstej/ kanalika dystalnego 2) pobudzenie receptorów β-adrenergicznych w kom. aparatu przykłębuszkowego 3) ↑ sekrecji reniny ↑ angiotensynogenu angiotensyna I angiotensyna II aldosteron 4) Aldosteron oddziałuje na cewkę dalszą ↑ resorpcji sodu 5) Zwiększa się wydzielanie do światła cewki jonów potasowych i wodorowych 6) ↑ ciśnienia krwi Układ RAA - regulacja wolemii, gospodarki wodno-elektrolitowej, ciśnienia tętniczego - patogeneza nadciśnienia tętniczego - przebudowa naczyń, mięśnia sercowego (włóknienie) - miażdżyca Rola nerek - prawidłowa praca nerek jest niezbędna do zachowania zdrowia - znaczna rezerwa funkcjonalna = można żyć z jedną nerką - stopień wydolności = stężenie kreatyniny i współczynnik przesączania kłębkowego (GFR) Czynność regulacyjna nerek słaba widoczność na zdjęciu :c (cztery punkty) 165 Funkcje nerek: · wydalnicza – upośledzenie powoduje: - zmniejszenie wytwarzania moczu pierwotnego, woda zatrzymywana jest w organizmie - zwiększenie przepuszczalności błony filtracyjnej ⇨ białkomocz, krwinkomocz - zatrzymanie Na+ i H2O w organizmie ⇨ obrzęki i zwiększone ciśnienie tętnicze · endokrynna - erytropoetyna: niedobór powoduje niedokrwistość - witamina D3 – 1,25-dihydroksycholekalcyferol: zwiększa wchłanianie Ca w przewodzie pokarmowym · regulacyjna - ciśnienie tętnicze - gospodarka wodno-elektrolitowa - gospodarka kwasowo-zasadowa Upośledzenie czynności wydzielniczej nerek Zmniejszenie wytwarzania moczu pierwotnego → zatrzymanie wody w organizmie → obrzęki i ↑ RR. Regulacje gośpodarki wodno-elektrolitowej Regulacja objętości wydalanego moczu 1) Mała ilość spożywanych płynów ↓objętości krwi 2) ↑ ciśnienia osmotycznego 3) Pobudzenie receptorów osmotycznych w podwzgórzu uwalnianie ADH 4) ↑ przepuszczalności ścian kanalików zbiorczych 5) ↑ wchłanianie wody mniejsza objętość moczu Regulacja poziomu sodu Zbyt duża ilość sodu → ↑ RR → ↓wydzielania reniny w komórkach aparatu przykłębuszkowego → ↓angiotensyny → ↓aldosteronu → ↓resorpcji (reabsorbcji) sodu w cewkach → ↑ wydalania sodu Przewlekła choroba nerek - ↓ ilości czynnego miąższu → upośledzenie wydalania sodu → obrzęki, ↑RR. Regulacja poziomu potasu Zbyt duża ilość potasu → ↑sekrecji w cewkach → ↑wydalania z moczem. Zbyt mała ilość potasu → ↓sekrecji w cewkach → ↓wydalania z moczem → ↑K w organizmie Upośledzenie wydalania potasu → hiperkaliemia → objawy kliniczne: parestezje, mrowienia, zwolnienie czynności serca. Rola nerek w gospodarce kwasowo-zasadowej – resorpcja wodorowęglanów w cewce bliższej – wydalanie jonów wodorowych pod postacią kwaśności miareczkowej w świetle cewki Na2HPO4 Kwaśność miareczkowa (w świetle cewki Na2HPO4 NaH2PO4 a zwrotnie wchłania się NaHCO3) Amoniak (NH3 NH4+) 166 Regulacja ciśnienia Regulacja przez układ renina – angiotensyna - aldosteron. 1) Renina jest wytwarzana przez aparat przykłębuszkowy w nerkach. 2) Angiotensyna II zwęża naczynia i aktywuje ukł. współczulny powodując ↑ wydzielania wazopresyny i ↑RR. 3) Aldosteron działa na cewkę powodując ↑ wchłaniania sodu, ↑ resorpcji wody, ↑RR, powoduje wydzielanie do światła cewki potasu. Czynnośc wewnątrzwydzielnicza nerek Nerki wytwarzają - reninę, prostaglandyny (PG), EPO, aktywną wit D3 i kalikreinę - pobudzają inne narządy do wydzielania: aldosteronu, ADH, ANP (przedsionkowego czynnika natriuretycznego) i PTH Erytropoetyna - hormon glikoproteinowy wytwarzany w 90% w komórkach śródmiąższowych naczyń włosowatych kory nerek - Główny bodziec = niedobór tlenu w tkance nerkowej pobudza erytropoezę w szpiku/ nasila syntezę hemoglobiny/ przyspiesza uwalnianie retikulocytów ze szpiku Niedobór EPO = niedokrwistość Nerki jako źródło aktywnych metabolitów wit.D3 W nerkach 1,25-dihydroksycholekalcyferol → ↑ wchłaniania wapnia w jelitach → ↑ mineralizacji kości. Przewlekła choroba nerek ↓ ilości czynnego miąższu → ↓produkcji 1,25(OH)2D3 → ↓wchłaniania wapnia w jelitach → hipokalcemia i hiperfosfatemia → wtórna nadczynność przytarczyc → zmiany w kościach (osteodystrofia nerkowa). 167 Ocena funkcji nerek - śtęzenie kreatyniny 1. 2. 3. 4. Kreatynina powstaje w mięśniach podczas przemian metabolicznych Przefiltrowana przez kłębki nerkowe ulega całkowitemu wydaleniu z moczem Nie podlega wchłanianiu zwrotnemu Zwiększone st kreatyniny w surowicy krwi świadczy o pogorszeniu czynności nerek - może ono mieć charakter ostry i przejściowy = mówi się wówczas o ostrej niewydolności nerek lub - może być trwałe, postępujące - przewlekła niewydolność nerek 5. Na podstawie stężenia kreatyniny oblicza się wskaźnik sprawności nerek = GFR Kreatynina Do oceny prawidłowej funkcji mierzy się stężenie kreatyniny (norma = 0,4-1,1 mg%) lub mniej czuły test oznaczania stężenia mocznika. Do oceny ilościowej funkcji – klirens kreatyniny (objętość osocza zawierająca kreatyninę w ilości wydalanej z moczem w ciągu minuty = wielkość przesączania kłębkowego [ml/min] - wartość przelicza się na powierzchnię ciała (norma = 60 ml/min/m2) C = U x V/ P U - st kreatyniny w moczu w mg% ; V - ilość moczu w ml/min ; P - st kreatyniny w osoczu w mg% Mocznik - końcowy metabolit przemiany białkowej - jego stężenie zależy od: Czynności wydalniczej nerek Podaży białek w pokarmach Rozpadu endogennych białek w organizmie Norma: 15-40 mg% eGFR - szacunkowy współczynnik filtracji kłębuszkowej GFR = ( ) x Ws W - wiek w latach ; M - masa ciała ; Sk - st kreatyniny (ml/min) ; Ws - wskaźnik płcu (M = 1; K = 0,85) Norma GFR M = 130 ml/min/1,73 m2 ; K = 115 ml/min/1,73 m2 168 Symptomatologia objawow klinicznych związanych z chorobami nerek - często przebieg bezobjawowy - bóle = okolica lędźwiowa, wzdłuż przebiegu moczowodu - zaburzenia w oddawaniu moczu = zmiana ilości, zmiana zabarwienia/ przejrzystości moczu - stany gorączkowe - objawy ze strony innych układów = nadciśnienie tętnicze, obrzęki, niedokrwistość, zmęczenie, apatia Zaburzenia ilości wydalanego moczu Poliuria > 2l / dobę Oliguria < 500 ml/ dobę Anuria < 200 ml/ dobę Ból w chorobach układu moczowego - kolka nerkowa - zapalenie odmiedniczkowe nerek = ostre/ przewlekłe - zapalenia pęcherza - zapalenia cewki moczowej - przewlekłe kłębuszkowe zapalenie nerek Ostra niewydolność nerek Nagłe zaburzenie czynności wydalniczej narządu moczowego → spada filtracja w nefronach, ale nie zmniejsza się liczba nefronów zatrzymanie produktów metabolizmu, które w normalnych warunkach są wydalane z moczem (woda, związki azotowe, H+, K+). Patogeneza Utrata zdolności wytwarzania moczu zaburzenia gospodarki wodnej (obrzęki) i kwasowo-zasadowej (kwasica) Brak czynności wewnątrzwydzielniczej nerek Przyczyny: przednerkowe - stany prowadzące do nagłego zmniejszenia ilości krwi krążącej → ↓przesączania kłębuszkowego → zatrzymanie toksycznych produktów przemiany materii - krwotoki - zmniejszony dowóz płynów np. przed - rozległe rany, urazy operacjami - wymioty, biegunka - wewnątrzustrojowe przemieszczanie płynów = niedrożność jelit, zapalenie otrzewnej, wodobrzusze - wstrząs, posocznica - ostra niewydolność lewej komory nerkowe - ostre stany zapalne nerek o ostre odmiedniczkowe zapalenie nerek o ostre kłębuszkowe zapalenie nerek o martwica brodawek nerkowych o przedłużająca się ostra przednerkowa niewydolność nerek - czynniki alergiczne i toksyczne ⇨ uszkodzenie, martwica cewek nerkowych o środki kontrastowe o antybiotyki, pestycydy, grzyby o rozpuszczalniki organiczne, sole ciężkie o hiperkalcemia o choroby nowotworow 169 czynniki pozanerkowe (mechaniczne, zaporowe) ⇨ zamknięcie światła moczowodów lub cewki moczowej - mechanicznie zatykające światło moczowodów lub cewki moczowej JEDYNEJ czynnej nerki - zaburzenia odpływu moczu = upośledzone wydalanie moczu. - Skrzepy krwi, kamica nerkowa, podwiązanie moczowodów, - guzy uciskające z zewnątrz na moczowód = rak macicy, rak gruczołu krokowego; - zamknięcie cewki przez guzy pęcherza moczowego, zwężenie wrodzone Objawy ONN o o o o o o o o o o skąpomocz (<500ml/dobę) lub bezmocz (<200 ml/d) przewodnienie organizmu lub u 15% chorych normalna objętość moczu / poliuria ↑ kreatyniny, mocznika, azotu pozabiałkowego, hiperkaliemia kwasica metaboliczna, kwasiczy oddech Kussmaula rozdrażnienie lub senność brak łaknienia, nudności senność, dezorientacja bóle głowy, brzucha zaburzenia snu wzmożone pragnienie kwasiczy oddech Kussmaula Cechy odwodnienia = sucha skóra, śluzówki; zapadnięte gałki oczne, ostre rysy twarzy, spadek ciśnienia, tachykardia nadciśnienie tętnicze ; niewydolność lewokomorowa; obrzęki Badania laboratoryjne i obrazowe w ostrej niewydolności nerek o o o ↑ kreatynina, mocznik Kwasica metaboliczna Hiperkaliemia o o o USG nerek - obrzęknięte nerki w niewydolności nerkowej Złogi w drogach moczowych Powiększenie prostaty o Badania ogólne moczu - krew, białko = pierwotna choroba nerek - komórki nabłonkowe, wałeczki nabłonkowe = ostra martwica cewek nerkowych - leukocyty, wałeczki białokrwinkowe = ostre śródmiąższowe zapalenie nerek - wałeczki czerwonokrwinkowe = ostre kłębuszkowe zapalenie nerek Przewlekła niewydolność (choroba) nerek Zespół chorobowy, następstwo postępującego niszczenia wszystkich struktur nerek przez przewlekły proces chorobowy (utrata czynnych nefronów) lub upośledzona funkcja nerek - zaburzenia czynności nerek > 3 m-ce - istotny wpływ na zdrowie - GFR < 60 ml/min/1,73 m2 pow ciała przez > 3 m-ce z uszkodzeniem nerek lub bez uszkodzenia nerek - wielkość filtracji nerkowej w krańcowym okresie niewydolności nerek wynosi około 1-2 ml/min - w Polsce choruje ok. 2,4 mln osób 170 Przyczyny PNN Najczęstsze 1. Cukrzycowa choroba nerek (nefropatia cukrzycowa) 2. Pierwotne kłębuszkowe zapalenie nerek 3. Uszkodzenie nerek w wyniku nadciśnienia tętniczego (nefropatia nadciśnieniowa) i miażdżycy (nefropatia niedokrwienna) 4. U dzieci: wrodzone lub nabyte wady układu moczowego powodujące niedomogę czynności nerek Rzadsze 5. Choroby śródmiąższowe nerek (Przewlekłe odmiedniczkowe zapalenie nerek) 6. Nefropatie: cukrzycowa , toczniowa, skrobiawicza 7. Kamica i uszkodzenie nerek wywołane innymi przeszkodami w odpływie moczu 8. Wielotorbielowate zwyrodnienie nerek 9. Jatrogenne: stosowanie przewlekle leków przeciwbólowych i przeciwzapalnych Nadciśnienie tętnicze Mniejsza ilość nefronów Zaburzenia natriurezy ↑ aktywności układu RA ↑ wrażliwości cewek na działanie mineralokortykoidów = zwiększona reabsorbcja cewkowa sodu ↑ opór naczyń doprowadzających do kłębuszka nerkowego Zaburzenia równowagi cewkowo-kłębuszkowej Skutki PNN 1. Upośledzenie czynności wydzielniczej nerek - zmniejszenie wytwarzania moczu pierwotnego zatrzymanie wody w organizmie obrzęki/↑ RR 2. ↓ ilości czynnego miąższu - upośledzone wydalanie K+ przez nerki hiperkaliemia Objawy kliniczne: parestezje, mrowienia, zwolnienie czynności serca - upośledzone wydalanie jonów H+ zatrzymanie ich w org kwasica metaboliczna Objawy kliniczne: kwasiczy oddech Kussmaula (szybki i głęboki) - ↓ produkcji 1,25 (OH)2D ↓ wchłaniania Ca w jelitach hipokalcemia wtórna nadczynność tarczycy zmiany w kościach (osteodystrofia) - ↓ EPO przewlekła niedokrwistość ↓ siły fizycznej, apetytu, zmniejszenie jakości życia 3. ↓ przesączania kłębkowego - niedostateczne wydalanie produktów przemiany materii ↑ stężenie kreatyniny, mocznika, fosforanów zatrzymany w ustroju mocznik rozkłada się pod wpływem ureazy na amoniak, który drażni błonę śluzową żołądka - niedostateczne wydalanie jonów H+ kwasica metaboliczna - ↓ EPO 171 Stadia niewydolności nerek Stadium nefrolog 1 GFR > 90 2 60-89 3 4 5 30-59 15-29 < 15 Opis Uszkodzenie nerek z prawidłowym GFR Uszkodzenie nerek z niewielkim upośledzeniem GFR Umiarkowane upośledzenie GFR Umiarkowane upośledzenie GFR Niewydolność nerek Polski odpowiednik Uszkodzenie nerek (albuminuria, krwinkomocz) Utajona niewydolność nerek Wyrównana niewydolność nerek Niewyrównana niewydolność Schyłkowa niewydolność (mocznica) Przebieg Stadium 2 - czynność narządu jest nieznacznie upośledzona pomimo redukcji miąższu o ponad 50% - nerki zachowują wszystkie funkcje, które są niezbędne do utrzymania stałości środowiska wewnętrznego ustroju - główne objawy: chwiejne lub utrwalone nadciśnienie tętnicze - N kreatynina w normie Stadium 3 - czynne jest 25-50% miąższu - objawy: wzmożone pragnienie, wielomocz i nocne oddawanie moczu, nadciśnienie tętnicze, niedokrwistość - ↑ kreatynina, mocznik, kwas moczowy w surowicy krwi podwyższone Stadium 4 - czynne jest około 20-25% miąższu - objawy: nasilone, anemia, zaburzenia gospodarki Ca-P, kwasica metaboliczna - ↑↑ kreatynina, mocznik w surowicy krwi kilkakrotnie podwyższone Stadium 5 = Mocznica - czynne kilka % miąższu - chory umiera w ciągu kilku tygodni lub miesięcy - objawy: Ogólne osłabienie, uczucie stałego zmęczenia i zaburzenia snu Trudności z koncentracją, apatia Skóra szarożółta, sucha i złuszczona Uogólnione obrzęki Objawy z przewodu pokarmowego = brak łaknienia, nudności, wymioty, biegunki i krwawienia, niekiedy ciężkie krwotoki Niewydolność krążenia = nadciśnienie tętnicze i uszkodzenie mięśnia serca przez toksyny mocznicowe Zaburzenia rytmu serca bezpośrednio zagrażające życiu Zaburzenia krzepnięcia krwi Zaburzenia równowagi wodno-elektrolitowej i kwasowo-zasadowej Zaburzenia przemiany białkowej, węglowodanowej i tłuszczowej Upośledzeniu ulega czynność gruczołów dokrewnych = nieprawidłowe miesiączkowanie, osłabiony popęd płciowy, impotencja 172 Objawy laboratoryjne ↑ stężenia kreatyniny, mocznika, potasu Kwasica metaboliczna Albuminuria = wczesny objaw PChM < 30 mg < 300 mg Białkomocz, ryzyko powikłań > 300 mg U pacjentów z cukrzycą, nadciśnieniem tętniczym (NT) wskaźnik albumina/ kreatynina (ACR) Stany pogarszające czynność nerek u chorych z PNN Zakażenia Ostre odmiedniczkowe zapalenie nerek Hipowolemia (odwodnienie, hiponatremia) Złośliwa faza NT Gwałtowne obniżenie RR Niewydolność krążenia Czynniki nefrotoksyczne Hiperkalcemia Hipokaliemia Kwasica metaboliczna Hiperurykemia Zakażenia układu moczowego – częściej chorują kobiety – dotyczy wszystkich struktur układu moczowego od cewki moczowej do miedniczek nerkowych – aby stwierdzić zakażenie - dwie próbki z bakteriurią znamienną - 10.000/ml w drodze nakłucia nadłonowego Postacie kliniczne Bezobjawowy bakteriomocz zapalenie pęcherza moczowego zapalenie cewki moczowej odmiedniczkowe zapalenie nerek ropień nerki i posocznica Etiologia · E. coli (75-80%) · bakterie Gram(-): Proteus, Klebsiella, Enterobacter, Pseudomonas · bakterie Gram (+): paciorkowiec kałowy, gronkowiec biały · zakażenia grzybicze Czynniki sprzyjające zakażeniom · zabiegi instrumentalne (cewnikowanie) · zastój moczu · przerost gruczołu krokowego · nietrzymanie moczu Przebieg zależy od czynników takich jak: – odporność pacjenta – prawidłowa budowa ukł. moczowego – właściwości drobnoustrojów. · · · · cukrzyca kamica nerkowa wielotorbielowate zwyrodnienie nerek stosowanie leków immunosupresyjnych Badania laboratoryjne – badanie ogólne moczu (bakteriomocz z posiewem) – badanie morfologii z liczbą białych krwinek, OB – USG jamy brzusznej, urografia, badanie izotopowe (DMSA) 173 Zapalenie cewki moczowej Objawy – pieczenie, ból, częstomocz, wydzielina ropna z cewki Powikłania – zakażenie drogą wstępującą, odmiedniczkowe zapalenie nerek Zapalenie pęcherza moczowego - częstomocz - bolesne parcie na mocz - ból w okolicy nadłonowej - krwinkomocz - ropomocz - bakteriomocz - leukocyturia - ↑OB. Odmiedniczkowe zapalenie nerek • stan zapalny miąższu nerki i miedniczki nerkowej wywołany stanem bakteryjnym - gorączka • zapalenie ostre lub przewlekłe • obrzmienie zapalne nerek - ból w okolicy lędźwiowej • ↓przesączania kłębuszkowego, obrzęki, nadciśnienie, bóle głowy • krwinkomocz, białkomocz • ↑kreatyniny i mocznika • kwasica metaboliczna, hiperkaliemia Powikłania • wodonercze • roponercze • ropień przynerkowy • niewydolność nerek Rak jasnokomórkowy nerki • szerzy się w kierunku miedniczki nerkowej, nacieka otaczające tkanki, węzły chłonne. Może wrastać do żyły nerkowej i do żyły głównej dolnej • objawem jest krwiomocz lub krwinkomocz, w miejscu nerki wyczuwalny guz, bóle, okresowe gorączki. Zwyrodnienie wielotorbielowate nerek • uwarunkowane genetycznie • w 70% przypadków ↑RR, bo ↑ reniny • ból przewlekły w nadbrzuszu • krwiomocz • rozpoznanie - badanie USG 174 Stany zagrożenia życia w endokrynologii Porównać z nowym skryptem! Przełom tarczycowy - hipermetaboliczny Przełom hipometaboliczny Przełom nadnerczowy Przełom hiperkalcemiczny Przełom hipokalcemiczny Endokrynologiczne stany zagrożenia życia występują rzadko, gdy jednak do nich dochodzi najważniejsze jest szybkie postawienie diagnozy. Ze względu na banalność objawów: nudności, wymioty biegunka, często myśl o rozpoznaniu zaburzenia endokrynologicznego przychodzi dopiero wtedy, gdy chory jest w stanie krytycznym. Przełom tarczycowy Hipo i hipermetaboliczny. Są stanami diametralnie różnymi. Objawy Zaburzenia psychiczne Zaburzenia termoregulacji Czynniki wywołujące - elementy wspólne. Przełom hipermetaboliczny Definicja Zagrażające życiu powikłanie nadczynności tarczycy Jest to nasilenie objawów nadczynności tarczycy, które rozwija się w trakcie lub po: operacji, porodzie, radioterapii, objawia się ↑ciepłoty ciała, częstoskurcz, niewydolność krążenia, odwodnienie, zaburzenia w OUN Zagrażający życiu stan nadczynności tarczycy, w którym dochodzi do niewydolności szeregu narządów i układów głównie krążenia, pokarmowego i OUN. Czynniki inicjujące Zabieg chirurgiczny (jakikolwiek) Podawanie dużej dawki jodu aktywnego w ciężkiej nadczynności Nagłe przerwanie leczenia tyreostatykami Podanie kontrastu jodowego Intensywne badania pooperacyjne tarczycy Zakażenia bakteryjne lub wirusowe Duży uraz fizyczny Ostry stan emocjonalny Poród - zawał serca Zatorowość płucna Niewyrównana cukrzyca Hipoglikemia Udar mózgu. Występuje zarówno u chorych na chorobę Basedowa, jak i w przypadkach wola guzowatego. Rozwija się nagle w ciągu godzin lub kilku dni. Dotyczy 1-2% chorych hospitalizowanych. Śmiertelność z powodu przełomu tarczycowego to 10-75%. Patogeneza Nieznana. Należy brać pod uwagę Gwałtowne uwolnienie hormonów z tarczycy w wyniku Operacji tarczycy Intensywnego badania palpacyjnego Przerwania leczenia tyreostatykami Duża dawka preparatów jodowych Zmniejszenie wiązania się hormonów tarczycy z białkami nośnikowymi (głównie TBG) U chorych po strumektomii U chorych z infekcją bakteryjną U chorych z niewyrównana cukrzycą (z kwasicą ketonową) Udział ukł. Współczulnego Zwiększenie ilości i wrażliwości receptorów dla katecholamin Upośledzenie procesów utlenowania komórek ↑ lipolizy i stężenia wolnych kwasów tłuszczowych we krwi ↑ zużycia tlenu i produkcji ciepła w organizmie. Objawy ↑ ciepłoty ciała 38-41 °C 175 - Zaczerwienienie tułowia i twarzy Częstoskurcz nadkomorowy, nadkomorowy, najczęściej > 150/min Nadkomorowe zaburzenia rytmu serca, migotanie przedsionków Niewydolność krążenia Nudności, wymioty, biegunka, odwodnienie, żółtaczka Niepokój, pobudzenie psychoruchowe, objawy psychotyczne, senność, śpiączka. Jeżeli stan chorego (psychiczny) jest prawidłowy nie można rozpatrywać przełomu tyreotoksycznego ani śpiączki w obrzęku śluzowatym. Jeżeli temperatura ciała jest prawidłowa przełom lub śpiączka są wykluczone. WYJĄTEK: Chory z zaawansowaną niedoczynnością tarczycy i jednoczesnym zakażeniem temperaturę ciała może mieć prawidłową. Badania dodatkowe ↑całkowitych i wolnych hormonów tarczycy oraz spadek TSH. WYJĄTEK: U chorych z ciężkimi chorobami współistniejącymi np. cukrzyca, stężenie T3 może być obniżone Hiperglikemia Leukocytoza ↑Ca w surowicy ↑aminotrasferaz i bilirubiny ↑fosfatazy alkalicznej ↑kortyzolu w surowicy Inne badania: Rtg płuc, posiew moczu, krwi, plwociny w celu poszukiwania innych źródeł zakażenia. Przełom hipometaboliczny Rzadki, ale bardzo poważne powikłania, najczęściej długotrwałej, nierozpoznanej i nieleczonej lub leczonej w sposób niewystarczający niedoczynności tarczycy. Do stanu tego dochodzi podczas trwania niezwiązanej z tarczycą choroby lub powodowaniem środków działających depresyjnie na OUN. Czynniki inicjujące Infekcje np. zapalenie płuc Zastoinowa niewydolność krążenia Znieczulenie ogólne i zabieg operacyjny Leki - uspakajające, narkotyki, antydepresyjne Ekspozycja na zimno. Objawy Objawy niedoczynności Ogólne spowolnienie Senność Zaparcia Suchość skóry i nadmierne jej rogowacenie w okolicy kolan i łokci Obrzęk śluzowaty wypadanie włosów Bradykardia Powiększenie sylwetki serca ↑RR Osłabienie odruchów ścięgnistych Śpiączka Hipotermia Hipowentylacja z hiperkapnią i hipoksemią → kwasica oddechowa Objawy laboratoryjne Brak korelacji stężenia hormonów i objawów klinicznych ↓stężenia obwodowych hormonów tarczycy ↑TSH Rzadko ↓ kortyzolu Hipoglikemia Hiponatremia Kwasica oddechowa ↑cholesterolu całkowitego, LDL, TG Niedokrwistość W EKG niski woltaż zespołu komorowego QRS, bradykardia. Przełom nadnerczowy Ostra niewydolność kory nadnerczy to zagrażający życiu stan dysproporcji pomiędzy zapotrzebowaniem organizmu na hormony kory nadnerczy a możliwością sekrecyjną w tym zakresie. Przyczyny Nagły ↑ zapotrzebowania na glikokortykosteroidy u chorych z przewlekłą niedoczynnością kory nadnerczy Zabieg operacyjny Ciężkie zakażenia 176 Urazy, oparzenia Zatrucie pokarmowe Długotrwałe głodzenie Duży wysiłek fizyczny Ekspozycja na ciepło Uraz okołoporodowy u noworodków Posocznica meningokokowa u dzieci Obustronna zakrzepica żył nadnerczowych np. po porodzie Długotrwałe leczenie lekami przeciwzakrzepowymi. Objawy; Osłabienie Brak apetytu, niedobór masy ciała Przebarwienia skóry Bóle brzucha, nudności i wymioty Biegunka, gorączka ↓RR W ciężkim stanie: drgawki, hipotermia, wstrząs, śpiączka. Objawy laboratoryjne Hiponatremia Hipochloremia Hiperkaliemia Kwasica metaboliczna Hipoglikemia Hiperkalcemia Eozynofilia, limfocytoza Na ogół niskie stężenie kortyzolu we krwi. Przełom hiperkalcemiczny Stan zagrożenia życia, gdy zwiększonemu stężeniu wapnia we krwi (powyżej 3,5 mmol/l) towarzyszy ↑ objętości płynów krążących, zaburzenia świadomości oraz zaburzenia rytmu serca. Najczęstszą przyczyną hipokalcemii jest nowotwór, rzadziej choroby przytarczyc Przyczyny Nowotwory 70% Pierwotna nadczynność przytarczyc 20% Inne np. niekontrolowane podawanie wit. D3 i wit. A Objawy Polidypsja - wzmożone pragnienie Poliuria Nudności, wymioty, zaparcia, bóle brzucha ↑temp. ciała Zaburzenia rytmu serca Niedrożność porażenna jelit Odwodnienie hipertoniczne Wstrząs Zaburzenia świadomości, śpiączka. Objawy laboratoryjne Hiperkalcemia >3,5mmol/l 14mg% Hipofosfatemia Hipokaliemia Kwasica metaboliczna Cechy odwodnienie ↑Ht, hipernatremia. Przełom hipokalcemiczny Przyczyny Idiopatyczne: wrodzone i autoimmunologiczne Pooperacyjne → po strumektomii, po operacyjnym leczeniu nadczynności przytarczyc, leczeniu jodem radioaktywnym lub Rtg Po wielokrotnym przetaczaniu krwi (łączenie się cytrynianów z Ca) Ostre zapalenie trzustki Krzywica Znaczna hipomagnezemia np. u alkoholików Objawy Napad tężyczkowy(skurcz mm. palców, nadgarstka, stopy, mm. krtani) Zaburzenia zachowania Drętwienie i parestezje, okresowe bolesne kurcze mięśni Zespół subtężyczkowy Objawy Chwostka i Trousseau'a 177 Zaćma patologiczna Zwapnienie w tkankach miękkich Objawy laboratoryjne Ca w surowicy znacznie obniżone Fosforan w surowicy podwyższony lub w normie ↓PTH w surowicy ↓1,25(OH)D Fosfataza alkaliczna w normie ↓Ca w moczu ↓lub norma Mg w surowicy W EKG wydłużony odstęp QT spowodowany wydłużeniem odcinka ST. 178 AIDS Porównać z wykładem! Rys historyczny 1981 - pierwsze przypadki zapalenia płuc wywołane przez Pneumocystis carini 1982 - wprowadzenie nazwy AIDS 1983 - izolacja wirusa LAV (lymphadenopathy asociated virus) 1984 - izolacja wirusa Epidemiologia do1997r zarejestrowano 1,5 min chorych zakłada się, że do tego czasu zachorowało 8 min, a zmarło 6 min osób ocenia się, że jest 28 min osób zakażonych 1981 - pierwsze zachorowania w Polsce Grupy zwiększonego ryzyka Homoseksualiści i biseksualiści 70% Narkomani Prostytutki i promiseksualiści - osoby często zmieniające partnerów Osoby chore na choroby weneryczne Chorzy na hemofilię Osoby, którym często przetacza się krew Dzieci matek zakażonych. Przekazanie zakażenia Przez błonę śluzową Uszkodzoną skórę Przetaczanie zakażonej krwi i jej pochodnych z chorej matki na płód-30% Sztuczna inseminacja zakażonym nasieniem. Wirus obecny jest w Krew Narządy np. do przeszczepów Nasienie Wydzielina pochwy i szyjki macicy Mleko kobiety- mało Ślina - mało Łzy - mało Mocz i stolec hipotetycznie. Okres inkubacji Czas do wystąpienia wiremii - 1-3 tyg. Od zakażenia do objawów-1-8 tyg. Od zakażenia do serokonwersji- 6-8 tyg. Czas do wystąpienia jakichkolwiek objawów klinicznych-1 tydz. do co Czas do rozwinięcia się AIDS- od 6 m.-cy do wielu lat, u dzieci od urodzenia. Wirus HIV1 i HIV2 Human immunodeficiency virus HIV 1 i 2 wykazują podobieństwo strukturalne 40% Posiadają enzym REWERTAZĘ oraz INTEGRAZĘ przy pomocy tych enzymów replikują materiał genetyczny z RNA na DNA. Integraza umożliwia wbudowanie DNA w genom gospodarza Wykazują tropizm do limfocytów Głównym receptorem dla HIV jest CD4 - fenotypowo cecha dojrzałego limf. CD4 – Th Wykazują potencjał onkogenny. Mechanizm zakażenia wirusem Utworzenie kompleksu z powierzchnią komórki permisywnej (cząsteczka CD4) Przechodzenie HIV do cytoplazmy (aktywna endocytoza) „rozebranie" wirusa z otoczki 179 - Odwrotna transkrypcja (RNA→ DNA) Integracja- włączenie DNA w genom gospodarza - prowirus Replikacja - wytworzenie na matrycy prowirusa mRNA i synteza białek HIV Wbudowanie wirionu w błonę komórkową na drodze egzocytozy. Komórki wrażliwe na zakażenie HIV Limfocyty CD4 (Th) Monocyty / makrofagi Nabłonkowe komórki Langerhansa Dendrytyczne kom. folikularne Mikroglej, astroglej, oligodendroglej Komórki siatkówki, szyjki macicy, jelita grubego. Immunopatogeneza Limfocyty T ↓ odpowiedź proliferacyjna na mitogeny, antygeny rozpuszczalne i kom. allogeniczne ↓ wytwarzania limfokin (Il-2, INF-γ) w odpowiedzi na antygen ↓ aktywności cytotoksycznych limf.T Limfocyty B Samoistna proliferacja (namnażanie) limf.B Poliklonalna hipergammaglobulinemia Zaburzona odpowiedź na wzbudzoną mitogenami, antygenami zdolności do wydzielania immunoglobulin Monocyty i makrofagi Upośledzenie chemotaksji Upośledzenie zależnej od monocytów proliferacji kom.T ↓ aktywność przeciw drobnoustrojom ↓ proliferacji kom.T Komórki pamięci; Utrata zdolności do rozpoznania antygenów, z którymi organizm zetknął się w przeszłości Komórki NK Zaburzenie aktywności cytotoksycznej (mediatora cytotoksyczności) Funkcje limf. CD4- pomocniczych Rozpoznanie obcego antygenu przedstawionego przez makrofagi Pobudzenie proliferacji limf.B i ich różnicowania w kom. plazmatyczne Indukcja kom. CD8 - cytotoksyczno-supresorowych do rozpoznania antygenów na Powierzchni błon komórkowych Pobudzenie aktywności komórek supresorowych Pobudzenie proliferacji kom. pamięci immunologicznej Pobudzenie fagocytozy Aktywacja cytotoksycznych kom. NK. Definicja i klasyfikacja AIDS nie jest osobną jednostką chorobową. Stanowi zespół objawów lub jednoczesne występowanie objawów wielu chorób pojawiających się w wyniku zaburzenia odporności. Jest końcowym stadium zakażenia HIV, występującym z reguły po wielu latach do zakażenia. Kryteria laboratoryjne Kryteria kliniczne Limfocyty Th (CD4) A B C >500μl >29% A1 B1 C1 200-499μl 14-28% A2 B2 C2 <200μl <14% A3 B3 C3 A Bezobjawowa, ostra (pierwotna) infekcja HIV (ostra choroba retrowirusowa) lub PGL- persistent generalised lymphadenopathy. B Choroba objawowa i stany nienależące do A lub C Kandydoza Leukoplakia włochata Dysplazji i rak szyjki macicy in situ 180 - Nawracający półpasiec Plamica małopłytkowa. C Choroby wskaźnikowe AIDS. Kryterium rozpoznania AIDS w Europie są wyłączne stadia C1-C3. W USA również A3 i B3 (niezależnie od stadium klinicznego). Choroby wskaźnikowe AIDS (2001 r) Kandydoza przełyku, oskrzeli lub płuc Inwazyjny rak szyjki macicy Kokcidiomykoza pozapłucna Kryptokokoza pozapłucna Kryptosporydioza z biegunką trawiącą >1 m.-ca Cytomegalia narządowa (z wyjątkiem wątroby, śledziony i węzłów chłonnych) Opryszczka HSV skórna lub na błonach śluzowych trwająca > 1m.-c, Zapalenie oskrzeli, płuc lub przełyku HIV- demencja Histoplazmoza pozapłucna Zespół wyniszczenia Biegunka w przebiegu izosporozy >1 m.-ca Mięsak Kaposiego Chłoniak nieziarniczy z limf. B Gruźlica płuc prosówkowa oraz pozapłucna Nokardioza Mykobakterioza Rozsiana pneumocystowe zapalenie płuc Nawracające bakteryjne zapalenia płuc, co najmniej 2x w roku Postępujące wieloogniskowe leukoencefalopatie Nawracająca, uogólniona salmonelloza Toksoplazmoza narządowa Ostra choroba retrowirusowa ARD Objawy u 20% zainfekowanych - związane są z wystąpieniem wiremii. Można wykryć antygen w surowicy Objawy występują po 1-6 tyg. po zainfekowaniu Utrzymują się przez 1-2 tyg., mogą być nawroty po 3 tyg. do 3 m-cy Objawy przypominają mononukleozę: gorączka, potliwość, senność, złe samopoczucie, Bóle stawów i mięśni, bóle gardła poprzedzające powiększenie węzłów chłonnych, ↑ limf. CD8, ↓ wskaźnika CD4/CD8. PGL - Powiększenie węzłów chłonnych o średnicy >1 cm, w co najmniej dwóch okolicach ciała Utrzymujące się >3 m.-cy (bez węzłów pachwinowych) Najczęściej węzły karkowe 85%, przyuszne, w dołkach łokciowych 50% Niebolesne o wzmożonej spoistości, twarde, powiększone symetrycznie U 30% w wywiadzie ARD U 30% splenomegalia U 10-30% zakażonych HIV z objawami PGL w ciągu 5 lat rozwija się AIDS. Zakażenie bezobjawowe Trwa z reguły kilka lat - ok. 10 Jest to okres zakaźny Objawy laboratoryjne Nieswoiste: ↓ limf. CD4-pomocniczych, ↑ limf. CD8, niedokrwistość, leukopenia, neutropenia, trombocytopenia, ↑ OB, hipergammaglobulinemia, hiper IgA, ↓ INF-γ, ↓ aktywności limfocytów na czynniki mitogenne, ↑ stężenia neopteryny Swoiste ↓ miana przeciwciał przeciw HIV, ↑ antygenu HIV Wyniki dodatnie i ujemne uznaje się za ostateczne, wątpliwe - po kilku tygodniach lub miesiącach kolejna próba W 10% przypadków dodatnich badań przesiewowych (ELISA), wynik pozostaje nierozstrzygnięty po testach potwierdzenia Antygen p24- główne białko wirusa wykrywa się metodą immunoenzymatyczną monoklonalne przeciwciała w fazie stałej wykrywa się w płynach ustrojowych. Hodowla wirusa Pozwala na wykrycie zakażenia u dzieci urodzonych przez matki zakażone HIV i wczesną diagnostykę osób po potencjalnej ekspozycji 181 - do hodowli używane są jądrzaste komórki krwi obwodowej, prowadzi się przez 14-28 dni w płynie znad hodowli oznacza się antygen p24, wirusowy mRNA oraz prowirusowy HIV- DNA. Wykrywanie materiału genetycznego wirusa HIV-RNA w surowicy, płynach ustrojowych, płynach znad hodowli komórek jądrzastych Ilościowe oznaczenie HIV-RNA. Odrębności w diagnostyce klinicznej u dzieci wczesne objawy zakażenia stany gorączkowe uogólnione powiększenie węzłów chłonnych powiększenie śledziony i wątroby nawracające zakażenia bakteryjne dróg oddechowych małopłytkowość niedokrwistość niedobarwliwa klasyfikacja N- zakażenie bezobjawowe lub objawy z grupy A A Zakażenie łagodne (min. 2 objawy) limfadenopatia powiększenie wątroby powiększenie śledziony zapalenie atopowe skóry zapalenie ślinianek nawracające lub przewlekle zapalenie zatok, ukł.oddechowego B Zakażenie umiarkowane niedokrwistość, neutropenia, małopłytkowość pojedyncze epizody zapalenia opon mózgowo-rdzeniowych, posocznicy zapalenia płuc grzybica jamy ustnej i gardła >2 m.-ce kardiomiopatie zakażenie CMV w okresie noworodkowym nawracające lub przewlekłe biegunki zapalenie wątroby C Pełnoobjawowy AIDS encefalopatia cytomegalia narządowa pneumocystowe zapalenie płuc kryptokokoza ciężkie zakażenia bakteryjne (rnin.2X w roku). 182 Osteoporoza - Aspekty patofizjologiczne i kliniczne Porównać z wykładem! Choroby metaboliczne, zmniejszona masa kostna, uszkodzona mikroarchitektonika kostna. Zwiększona kruchość kości i podatność na złamania. Budowa tkanki kostnej Kość zbita (lita) Kość gąbczasta- trzony kręgów, kość piętowa, nasada dalsza kości promieniowej. Kość gąbczasta jest najbardziej narażona na złamania. Składniki kości elementy nieorganiczne 70% elementy organiczne 30% osteoblasty, osteoklasty, osteocyty macierz kostna (włókna kolagenu l, białka niekolagenowe, proteoglikany) Czynniki wpływające na metabolizm kości Miejscowe Prostaglandyny E2, cytokiny- IL-1, IL-6, IGF 1 Systemowe Wysiłek fizyczny, zawartość wapnia w diecie, hormony: PTH, kalcytonina, estrogeny, T3, T4, GH, androgeny, wit.D3 Do 30 r.ż przeważają procesy tworzenia kości, w równowadze osteoklasty i osteoblasty. W 3-4 dekadzie życia, po menopauzie przeważają osteoklasty. Zachowanie masy kostnej zależy od równowagi między kościotworzeniem a resorpcją. Zaburzenia mikroarchitektoniki tkanki kostnej Proces resorpcji prowadzi do przerwania ciągłości beleczek kostnych. Dochodzi do tego u kobiet w czasie menopauzy i u mężczyzn w czasie andropauzy. Powoduje wzrost wrażliwości na złamania. Jest to proces nieodwracalny, przerwana ciągłość beleczek nie może być przywrócona. Przewaga resorpcji utrzymująca się dłużej prowadzi do osteopenii, w dalszej fazie do klinicznej manifestacji osteoporozy. Czynniki ryzyka osteoporozy płeć żeńska rasa biała lub żółta obciążający wywiad rodzinny dotyczący złamań w przeszłości (osteoporoza u matki!!!) wiek po 65 r.ż niski wzrost (wysoki wzrost to czynnik ryzyka złamań szyjki kości udowej) niski wskaźnik masy ciała BMl (proces kościotworzenia pobudzony jest max. przez obciążenia) Późna menarche i wczesna menopauza lub długotrwały brak miesiączki (> 6-ciu m-cy)!!! Uprzednio przebyte złamanie po niskim upadku czy urazie (upadek z wysokości własnego ciała) po 40 r.ż!!! Niska masa kostna odpowiadająca kryteriom osteopenii i osteoporozy - BMD!!! Dieta: niska podaż wapnia, wit. D3, nadmierna podaż białka, sodu, niedożywienie Używki: nikotyna, kofeina!!!, alkohol!!! (negatywny wpływ na osteoblasty i zaburzenia gospodarki wapniowej) Długotrwały brak aktywności fizycznej Zaburzenia równowagi ze skłonnością do częstych upadków (choroba Parkinsona, zaburzenia krążenia, podciśnienie ortostatyczne) Zaburzenia widzenia (upadki) Stany chorobowe i lęki o znanym negatywnym działaniu na tkankę kostną (osteoporoza wtórna), głównie długotrwała terapia glikokortykoidami >6-ciu m-cy i >6-ciu mg prednizonu dziennie (nie ma bezpiecznej dawki) Podział osteoporozy 1) Uogólniona Pierwotna Pomenopauzalna typ l Starcza typ II Idiopatyczna - rzadko spotykana Wtórna 10-20% zaburzenia endokrynologiczne, choroby przewlekłe, leki 2) Miejscowa 183 Wg. Nordina w przedziale wieku 55-75 lat do osteoporozy przyczynia się w 38% menopauza i w 68% starzenie się organizmu. Patogeneza osteoporozy okresu menopauzy Wypadnięcie funkcji jajników i hipoestrogenizm powodują ↑↑ resorpcji kości Brak hamulca w wydzielaniu bodźców stymulujących resorpcję IL-1 i IL-6 osteoblastów stymulujących osteoklasty Podnosi się stężenie wapnia we krwi, spada sekrecja PTH, obniża się synteza wit. D3 Następuje zmniejszenie jelitowej resorpcji wapnia i ujemny bilans wapniowy Patogeneza osteoporozy po menopauzie - ↓ stężenia IGF1, t syntezy kolagenu i matrix w kościach, pobudza aktywność osteoblastów, przeciwdziała degradacji kolagenu w kościach ↓ stężenia kalcytoniny posiadającej właściwości antyosteolityczne, co powoduje Przyspieszenie utraty masy kostnej (elementów mineralnych i matrix) Zmniejszenie aktywności fizycznej. Wypadnięcie czynności jajników natychmiast zwiększa resorpcję kości. Proces ten zależy od 60-80% od kodu genetycznego (polimorfizm wit. D3) Poziomu osiągnięcia szczytowej masy kostnej Oddziaływania innych czynników ryzyka. Estrogeny - ↑ wchłaniania wapnia Redukują nerkową utratę wapnia Zwalniają proces resorpcji kości Modyfikują wpływ PTH Progestageny Zwalniają szybkość procesu resorpcji kości przez ↓ wydalania wapnia z moczem. Patogeneza osteoporozy starczej Utrata tkanki kostnej wiąże się z procesem starzenia Niski poziom kalcytoniny (wit. D3) wynikający z niedoborów pokarmowych, niskiej Ekspozycji na światło, obniżonego wskaźnika filtracji kłębuszkowej i zmniejszenia Aktywności enzymu 1-α-hydroksylazy w nerkach Z wiekiem zaczynają narastać niedobory wapnia: - niedobory pokarmowe (dieta ubogo wapniowa, niskobiałkowa, zbyt bogata w sól kuchenną i fosforany) upośledzone wchłanianie jelitowe wapnia spowodowane niewystarczającą ekspozycją na światło nerkowe niedobory aktywnych postaci wit. D3 Prowadzi to do Spadku wchłaniania wapnia w jelitach, ↑fosforanów, hiperkalcemia, stymulacja wydzielania PTH → wtórna nadczynność przytarczyc Zmniejszenie mineralizacji i nadmiernej resorpcji kości, osteomalacji i osteoporozy. Końcowym efektem tych zjawisk jest utrata tkanki kostnej. U kobiet utrata masy kości beleczkowatej 30-50% i litej 15-30%. U mężczyzn 15-40% i 5-15%. Wskaźnik utraty masy kostnej u kobiet jest najwyższy we wczesnym okresie po menopauzie i może wynosić nawet 4-8% rocznie i 2-3% w kości korowej. Cechy różnicujące osteoporozę pomenopauzalną i starczą Cecha Osteoporoza pomenopauzalna Osteoporoza starcza Wiek Stosunek K:M Typ kości Lokalizacje złamań >65 Lat 2:1 Beleczkowata i korowa Kręgi i nasada bliższa kości udowej 50-65 Lat 6:1 Beleczkowata Kręgi i dystalne części kości promieniowej Przyczyny osteoporozy wtórnej Choroby endokrynologiczne: nadczynność przytarczyc, tarczycy, kory nadnerczy, cukrzyca typu l, akromegalia, hipogonadyzm, anorexia Choroby przewlekłe: schorzenia jelit utrudniające proces wchłaniania jelitowego (głównie wapnia), choroby wątroby i dróg żółciowych, kamica nerkowa z hiperkalciurią, mocznica, szpiczak, homocystynuria, zespoły dziedzicznych zaburzeń tkanki łącznej - zespół Marfana, R.Z.S Leki: kortykosteroidy, heparyna, doustne antykoagulanty, cytostatyki, tetracyklina, Hormony tarczycy, leki przeciw drgawkowe, diuretyki pętlowe. Brak charakterystycznego objawu klinicznego zwłaszcza we wczesnych stadiach. 184 Złamania osteoporotyczne Złamania dalszej nasady kości promieniowej ok. 60 r.ż złamania trzonów kręgów ok.70-80 r.ż złamania szyjki kości udowej w osteoporozie pomenopoauzalnej najczęściej złamania kompresyjne kręgów, szczególnie w części piersiowej przewlekły i uporczywy ból (przy siedzeniu i staniu) zmiana sylwetki utrata wzrostu ograniczenie ruchomości Osteoporoza - odcinek piersiowy kręgosłupa, zmiany zwyrodnieniowe odcinka szyjnego i lędźwiowego. Zasady diagnostyki osteoporozy ocena czynników ryzyka badanie fizykalne badanie Rtg badanie densytometryczne badanie laboratoryjne Badanie fizykalne Ocena postawy ciała Ocena krzywizn kręgosłupa Ocena utraty wzrostu Występowanie cech mogących przemawiać za osteoporoza wtórną Ocena stanu odżywienia Badanie Rtg Zdjęcie boczne kręgosłupa Osteoporoza widoczna przy utracie >30% masy kostnej Badanie densytometryczne Podstawowa rola w diagnostyce Ocena masy kostnej - BMD Metoda DEXA- precyzyjna, dokładna, czuła, nieobciążająca Uzyskaną wartość masy kostnej porównuje się ze szczytową masą kostną i średnią masą kostną dla danego wieku T-score → dla młodych Z-score → dla starych Dla oceny ryzyka złamań Kręgosłup >65r.ż Szyjka kości udowej >60 r.ż Kość promieniowa Kość piętowa Wystarczy pomiar w jednym punkcie pomiarowym, ważne są dwa pierwsze. BMD metodą DEXA - Norma+1-0-1 Osteopenia -1<→ -2,5 Osteoporoza < -2,5 Osteoporoza zaawansowana <2,5 z obciążeniem złamań. Badania laboratoryjne oznaczenie markerów biochemicznych metabolizmu kostnego markery kościotworzenia: osteokalcyna, fosfataza kwaśna, karboksyterminalny propeptyd prokolagenu l markery resorpcji kości: pirydynolina, deoksypirydynolina, C-końcowy telopeptyd kolagenu l badania gospodarki wapniowo-fosforanowej. W surowicy stężenie wapnia i fosforanów, w moczu wydalanie ich w zbiórce dobowej. Leczenia wymagają Wszystkie osoby ze złamaniami po niskich urazach Osoby bez złamań z BMD poniżej -2,5 T-score Osoby z niską masą kostną lub wysokimi wskaźnikami przebudowy Chorzy z osteoporoza młodych, dorosłych Chorzy podczas długotrwałej sterydoterapii 185 Stosowanie HTZ → estrogeny chronią przed złamaniami 50-90%, ale osteoporoza nie może być główną przyczyną wprowadzenia HTZ. Raloksyfen - receptor estrogenowy SERM Kość- 49%redukcja ryzyka pierwszego złamania 34% kolejnych złamań 68% redukcja ryzyka nowych złamań Korzystny wpływ na ukł. sercowo-naczyniowy Redukcja ryzyka raka sutka Nie powoduje przerostu endometrium Nie zwiększa ryzyka raka endometrium Bifosfoniany; Hamują resorpcję kostną Uniemożliwiają resorpcję osteoklastyczną Wykazują bezpośrednie działanie na osteoklasty Kalcytonina należy do substancji o najsilniejszym wpływie na gospodarkę wapniowo-fosforanową. Hamuje resorpcję kostną i wywiera silny efekt przeciwbólowy Wapń 1-1.5 g/dobę np. w postaci węglanu. Wit. D3 600-1000 j/dobę jednorazowo Przeciwwskazania: hiperkalcemia, hiperkalciuria, kamica nerkowa Równolegle z podaniem dawki wapnia 186