Próba syntezy multimerycznej formy aktywnego analogu lamininy YIGSR
Marta Sowińska
Praca magisterska wykonana w Pracowni Peptydów pod kierunkiem dr Ewy Witkowskiej
CEL PRACY
WPROWADZENIE
Niepowodzenia w leczeniu nowotworów są spowodowane
nadzwyczajną liczbą i złożonością mechanizmów prowadzących do
wystąpienia tych chorób. Poznanie i zrozumienie procesów komórkowych
jest niezbędne dla opracowania leków skierowanych wybiórczo w stosunku
do czynników odpowiedzialnych za inwazyjność nowotworów. Jednym z
etapów powstawania przerzutu nowotworu jest migracja komórek
nowotworowych przez błony podstawne. Wiązanie komórek nowotworowych
przez białka adhezyjne, m. in. lamininę, powoduje ich zakotwiczenie w
błonie.
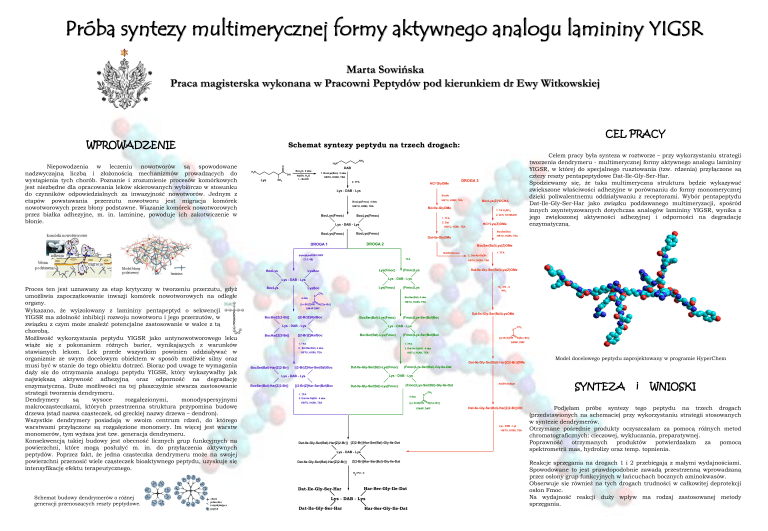
Schemat syntezy peptydu na trzech drogach:
NH2
H2N
O
DAB
Boc2O, 2 ekw.
H2N
OH
Lys
NH2
1. BocLys(Boc) 2 ekw.
NaOH, H 2O
t - BuOH
HBTU, HOBt, TEA
2. TFA
HCl*GlyOMe
DROGA 3
Lys - DAB - Lys
BocIle
HBTU, HOBt, TEA
BocLys(Fmoc) 4 ekw.
HBTU, HOBt, TEA
BocLys(Fmoc)
BocIle-GlyOMe
1. 1N H2SO 4
2. 20% HCl/MeOH
BocLys(Fmoc)
1. TFA
2. Dat
Lys - DAB - Lys
BocLys(Fmoc)
BocLys(Z)*DCHA
HCl*Lys(Z)OMe
HBTU, HOBt, TEA
BocSer(Bzl)
BocLys(Fmoc)
HBTU, HOBt, TEA
Dat-Ile-GlyOMe
DROGA 2
DROGA 1
BocSer(Bzl)Lys(Z)OMe
2. Dat-Ile-GlyOH
TFA
(1:1:48)
Lys(Fmoc)
LysBoc
Dat-Ile-Gly-Ser(Bzl)Lys(Z)OMe
(Fmoc)Lys
BocLys
Lys(Fmoc)
LysBoc
4 ekw
S
H2 / Pd - C
NH3
(Fmoc)Lys
CH3
BocSer(Bzl) 4 ekw.
HBTU, HOBt, TEA
[(o-Br)Z]HN
N[Z(o-Br)]
DMAP DMF
Dat-Ile-Gly-Ser(Bzl)LysOMe
BocHar[Z(2-Br)]
[(2-Br)Z]HarBoc
BocSer(Bzl)-Lys(Fmoc)
Lys - DAB - Lys
(Fmoc)Lys-Ser(Bzl)Boc
Lys - DAB - Lys
S
BocHar[Z(2-Br)]
BocSer(Bzl)-Lys(Fmoc)
[(2-Br)Z]HarBoc
CH3
(Fmoc)Lys-Ser(Bzl)Boc
[(o-Br)Z]HN
N[Z(o-Br)]
DMAP, DMF
1. TFA
1. TFA
2. BocSer(Bzl) 4 ekw.
2. Dat-Ile-GlyOH 4 ekw.
HBTU, HOBt, TEA
HBTU, HOBt, TEA
Dat-Ile-Gly-Ser(Bzl)-Har[Z(2-Br)]OMe
BocSer(Bzl)-Har[Z(2-Br)]
Dat-Ile-Gly-Ser(Bzl)-Lys(Fmoc)
[(2-Br)Z]Har-Ser(Bzl)Boc
Lys - DAB - Lys
Lys - DAB - Lys
BocSer(Bzl)-Har[Z(2-Br)]
Model docelowego peptydu zaprojektowany w programie HyperChem
(Fmoc)Lys-Ser(Bzl)-Gly-Ile-Dat
[(2-Br)Z]Har-Ser(Bzl)Boc
Dat-Ile-Gly-Ser(Bzl)-Lys(Fmoc)
(Fmoc)Lys-Ser(Bzl)-Gly-Ile-Dat
1. TFA
4 ekw.
2. Dat-Ile-GlyOH 4 ekw.
HBTU, HOBt, TEA
S
[(o-Br)Z]HN
NaOH/dioksan
CH3
Dat-Ile-Gly-Ser(Bzl)-Har[Z(2-Br)]OH
Lys - DAB - Lys
HBTU, HOBt, TEA
Dat-Ile-Gly-Ser(Bzl)-Har[Z(2-Br)] [Z(2-Br)]Har-Ser(Bzl)-Gly-Ile-Dat
Lys - DAB - Lys
Dat-Ile-Gly-Ser(Bzl)-Har[Z(2-Br)]
Z(2-Br)]Har-Ser(Bzl)-Gly-Ile-Dat
Dat-Ile-Gly-Ser-Har
Har-Ser-Gly-Ile-Dat
Lys - DAB - Lys
Dat-Ile-Gly-Ser-Har
Har-Ser-Gly-Ile-Dat
SYNTEZA
i
WNIOSKI
N[Z(o-Br)]
DMAP, DMF
H / Pd - C
2
Schemat budowy dendrymerów o różnej
generacji przenoszących reszty peptydowe.
HBTU, HOBt, TEA
Lys - DAB - Lys
Lys - DAB - Lys
Proces ten jest uznawany za etap krytyczny w tworzeniu przerzutu, gdyż
umożliwia zapoczątkowanie inwazji komórek nowotworowych na odległe
organy.
Wykazano, że wyizolowany z lamininy pentapeptyd o sekwencji
YIGSR ma zdolność inhibicji rozwoju nowotworu i jego przerzutów, w
związku z czym może znaleźć potencjalne zastosowanie w walce z tą
chorobą.
Możliwość wykorzystania peptydu YIGSR jako antynowotworowego leku
wiąże się z pokonaniem różnych barier, wynikających z warunków
stawianych lekom. Lek przede wszystkim powinien oddziaływać w
organizmie ze swym docelowym obiektem w sposób możliwie silny oraz
musi być w stanie do tego obiektu dotrzeć. Biorąc pod uwagę te wymagania
dąży się do otrzymania analogu peptydu YIGSR, który wykazywałby jak
największą aktywność adhezyjną oraz odporność na degradację
enzymatyczną. Duże możliwości na tej płaszczyźnie stwarza zastosowanie
strategii tworzenia dendrymeru.
Dendrymery
są
wysoce
rozgałęzionymi,
monodyspersyjnymi
makrocząsteczkami, których przestrzenna struktura przypomina budowę
drzewa (stąd nazwa cząsteczek, od greckiej nazwy drzewa – dendron).
Wszystkie dendrymery posiadają w swoim centrum rdzeń, do którego
warstwami przyłączone są rozgałęzione monomery. Im więcej jest warstw
monomerów, tym wyższa jest tzw. generacja dendrymeru.
Konsekwencją takiej budowy jest obecność licznych grup funkcyjnych na
powierzchni, które mogą posłużyć m. in. do przyłączenia aktywnych
peptydów. Poprzez fakt, że jedna cząsteczka dendrymeru może na swojej
powierzchni przenosić wiele cząsteczek bioaktywnego peptydu, uzyskuje się
intensyfikację efektu terapeutycznego.
1. TFA
NaOH/dioksan
piperydyna/DBU/DMF
BocLys
Celem pracy była synteza w roztworze – przy wykorzystaniu strategii
tworzenia dendrymeru - multimerycznej formy aktywnego analogu lamininy
YIGSR, w której do specjalnego rusztowania (tzw. rdzenia) przyłączone są
cztery reszty pentapeptydowe Dat-Ile-Gly-Ser-Har.
Spodziewamy się, że taka multimeryczna struktura będzie wykazywać
zwiększone właściwości adhezyjne w porównaniu do formy monomerycznej
dzięki poliwalentnemu oddziaływaniu z receptorami. Wybór pentapeptydu
Dat-Ile-Gly-Ser-Har jako związku poddawanego multimeryzacji, spośród
innych zsyntetyzowanych dotychczas analogów lamininy YIGSR, wynika z
jego zwiększonej aktywności adhezyjnej i odporności na degradację
enzymatyczną.
Podjęłam próbę syntezy tego peptydu na trzech drogach
(przedstawionych na schemacie) przy wykorzystaniu strategii stosowanych
w syntezie dendrymerów.
Otrzymane pośrednie produkty oczyszczałam za pomocą różnych metod
chromatograficznych: cieczowej, wykluczania, preparatywnej.
Poprawność
otrzymanych
produktów
potwierdzałam
za
pomocą
spektrometrii mas, hydrolizy oraz temp. topnienia.
Reakcje sprzęgania na drogach 1 i 2 przebiegają z małymi wydajnościami.
Spowodowane to jest prawdopodobnie zawadą przestrzenną wprowadzaną
przez osłony grup funkcyjnych w łańcuchach bocznych aminokwasów.
Obserwuje się również na tych drogach trudności w całkowitej deprotekcji
osłon Fmoc.
Na wydajność reakcji duży wpływ ma rodzaj zastosowanej metody
sprzęgania.









