LABORATORIUM
PRZEMIAN ENERGII
BADANIE OGNIWA PALIWOWEGO TYPU PEM”
I. Wstęp
Ćwiczenie polega na badaniu ogniwa paliwowego typu PEM. Urządzenia tego typy są
obecnie rozwijane i przystosowywane do takich aplikacji jak: zasilanie gwarantowane,
hybrydowe układy wytwarzania energii, energetyka rozproszona, transport.
II. Opis teoretyczny
Energie produkowana przez badane w ćwiczeniu ogniwo paliwowe wytworzona zostaje w
procesie elektrochemicznej konwersji. Elektryczność wyprodukowana jest z paliwa podanego
na anodę i utleniacza wprowadzanego na stronę katody. Reakcja między nimi zachodzi w
obecności elektrolitu.
Podstawowym rodzajem ogniw są te wodorowo-tlenowe z membraną do wymiany protonów
(elektrolit polimerowy), takie teŜ wykorzystane zostały w ćwiczeniu. Cienka warstwa
polimeru przewodzącego protony rozdziela anodę i katodę. Zwykle elektrody mają postać
nawęglonego papieru pokrytego platyną w charakterze katalizatora reakcji.
Gazowy wodór wprowadzany jest w obszar porowatej anody, gdzie w wyniku oddziaływania
wodoru z materiałem katody zachodzi dysocjacja w wyniku czego powstają jony protonowe
H+ oraz elektrony e. Elektrony przyciągane przez anodę pozostają w niej jony wodorowe
dyfundują:
Półprzepuszczalna membrana jest przewodnikiem tylko dla protonów, nie przepuszcza innych
jonów szczególnie jonów tlenu od katody do anody. Elektrony muszą dotrzeć do katody
poprzez obwód elektryczny, wytwarzając prąd pozwalający na zasilanie urządzeń.
Na katodzie tlen reaguje z elektronami tworząc jony O2-:
jony wodorowe H+ są zobojętniane zjonizowanym tlenem:
Końcowy produktu to H2O czyli woda w postaci pary lub ciekłej.
Schemat pojedynczego ogniwa jest pokazany na rysunku nr 1:
Rys. 1. Schemat ogniwa paliwowego typu PEM
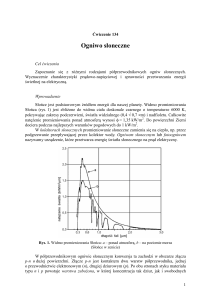
Rysunek nr 2 przedstawia przykładową charakterystykę u=f(Iobc) dla ogniwa paliwowego.
Rys. 2. Przykładowa charakterystyka ogniwa paliwowego typu PEM
Typowe parametry pojedynczego ogniwa typu PEM:
Elektrolit: spolimeryzowany fluorkowany kwas sulfonowy w postaci membrany pokrytej
porowatą platyną
Temperatura pracy: 50° – 100° C
Sprawność: od 25% do ponad 50%
Napięcie pojedynczego ogniwa 0,6 V
W celu uzyskania wymaganego napięcia wyjściowego ogniwa łączy się szeregowo.
Zalety ogniwa PEM:
- Elektrolit w postaci stałej membrany redukuje korozję i problemy związane z obsługą
elektrolitu
- niska temperatura pracy
- szybki start
- brak emisji zanieczyszczeń i hałasu
- jakość wyprodukowanej energii
Wady to:
- moŜliwość uszkodzenia poprzez przeciąŜenie lub zwarcie
- duŜy koszt w porównaniu do innych technologii
- konieczność zachowania środków bezpieczeństwa ze względu na łatwopalność wodoru
Istnieją odmiany ogniw paliwowych, w których źródłem energii nie jest wodór w postaci
gazowej. Gaz ten jest produkowany w ogniwie na skutek spalania związków chemicznych
bogatych w wodór, jak metan czy metanol. Wodór zgromadzony w postaci związanej jest
łatwiejszy do transportu – zajmuje mniejszą objętość i nie musi być skraplany w tak niskiej
temperaturze. Jednak sprawność takich ogniw jest mniejsza i często oprócz pary wodnej
produkują one dwutlenek węgla. Niemniej są i tak czystsze oraz bardziej wydajne od
tradycyjnych silników spalinowych.
W odróŜnieniu od baterii i akumulatorów, ogniwa paliwowe nie gromadzą wewnątrz energii.
Bez dostarczania paliwa proces produkcji prądu się zatrzymuje. Są jednak urządzenia, w
których łączy się baterie słoneczne produkujące wodór przez elektrolizę z ogniwem
paliwowym. W takim układzie wodór jest produkowany w ciągu dnia z energii słonecznej, a
w nocy ulega spaleniu w ogniwie. Sprawność takiego procesu (prąd → wodór → prąd) jest
rzędu od 30 do 40%.
NaleŜy wyznaczyć charakterystyki ogniwa paliwowego i je zinterpretować
Na zajęciach wykreślamy
a) charakterystyki napięciowo prądowe U = f (I) w zaleŜności od:
- ciśnienia wodoru
- ciśnienia tlenu
b) charakterystykę mocy P = f (I)
Środki:
1. Ogniwo NP 50
2. Butla z wodorem
3. Ciśnieniomierz,
4. Termometr
5. Miliamperomierz
6. Woltomierz
7. Przetwornica podwyŜszająca napięcie
8. Rezystor 0,5 Ω
Opis ćwiczenia:
Uwaga!
Ćwiczenie rozpoczynamy od włączenia wiatraczka i dopuszczenia wodoru na
ogniwo na 10 min. przed rozpoczęciem właściwym ćwiczenia. Dopiero po 10
min. załączamy obciąŜenie.
Odwrotnie z kolei postępujemy przy wyłączaniu układu. Najpierw wyłączamy
obciąŜenie, następnie zamykamy dopływ wodoru i wyłączamy wiatraczek.
Przed przystąpieniem do badań naleŜy połączyć układ wg schematu:
DC
NP
50
V
mA
DC
Ro
Zajęcia będą polegały na zdjęciu charakterystyk napięciowo prądowych U = f(I)
w zaleŜności od:
a) ciśnienia P wodoru H2
b) ciśnienia P tlenu O2
oraz wykreśleniu charakterystyki mocy P = f (I)
Pomiary rozpoczynamy od maksymalnej rezystancji i zmniejszamy ją stopniowo
tak by napięcie ogniwa paliwowego na woltomierzu nie spadło poniŜej 4V, a
temperatura ogniwa nie przekroczyła 30 oC Regulując tak rezystancję obciąŜenia
notujemy 30 punktów charakterystyki. Wszystkie charakterystyki dla trzech
ciśnień wykreślamy na wspólnym wykresie U = f (I).
Tabela 1
Lp.
P (O2) = const
P H2 = 1,2 (bar)
U [V]
I [mA]
P [W]
P H2 = 1,5 (bar)
U [V] I[mA] P [W]
P H2 = 1,8 (bar)
U [V] I[mA] P [W]
U2 (O2 )=
U (V) I
(mA)
U3 (O2 )=
U (V) I (ma)
1…30
Tabela 2
Lp.
P (H2) = const
U1 (O2 )=
U (V)
I (mA)
P (W)
P
(W)
P
(W)
1…30
Z wartości „U” i „I” otrzymanych w czasie badania układu obliczamy moc P =
U . I i wykreślamy charakterystykę P = f (I) dla uzyskania, której wykonujemy
pomiary dla trzech wartości napięć na wiatraczku podającego tlen O2 na ogniwo
przy stałym ciśnieniu wodoru.