574
Probl Hig Epidemiol 2014, 95(3): 574-579
Campylobacter spp. – niedoceniany w Polsce czynnik
etiologiczny zakażeń przewodu pokarmowego
Campylobacter spp. – etiologic factor of the gastrointestinal tract infections underestimated
in Poland
Bernadeta Szczepańska, Małgorzata Andrzejewska, Dorota Śpica, Jacek Klawe
Katedra i Zakład Higieny i Epidemiologii, Collegium Medicum im. Ludwika Rydygiera w Bydgoszczy, Uniwersytet Mikołaja
Kopernika w Toruniu
Campylobacter należą do najczęściej izolowanych czynników etiologicznych
bakteryjnych chorób biegunkowych przenoszonych przez żywność
na całym świecie. Od 2005 roku kampylobakterioza jest najczęściej
zgłaszaną chorobą odzwierzęcą u ludzi w Unii Europejskiej. W Polsce
kampylobakterioza jest chorobą rzadko diagnozowaną, rozpoznawaną
i rejestrowaną. Campylobacter spp. są szeroko rozpowszechnione
w przyrodzie, a ich podstawowym rezerwuarem jest przewód pokarmowy
ptaków i ssaków, zarówno dziko żyjących, jak i hodowlanych. Źródłem
zakażenia człowieka jest żywność pochodzenia zwierzęcego (zwłaszcza mięso
drobiowe i mleko), woda lub bezpośredni kontakt ze zwierzętami, głównie
domowymi będącymi nosicielami tych bakterii. Do czynników ryzyka
kampylobakteriozy u ludzi zakwalifikowano także zagraniczne podróże
i kąpiele w naturalnych zbiornikach wodnych. Wtórnie zanieczyszczona
Campylobacter spp. woda do picia lub woda spożywana z nieznanych źródeł
są najczęstszymi przyczynami ogniskowych zakażeń tymi bakteriami u ludzi.
Możliwa jest także transmisja tych patogenów z młodego psa lub kota na
człowieka. Dotyczy to szczególnie małych dzieci. Grupami zawodowymi,
które narażone są na infekcje Campylobacter są: pracownicy ubojni,
weterynarze, czy też hodowcy drobiu, bydła i trzody chlewnej.
Campylobacter is one of the mostly isolated etiologic factors of foodborne diarrheal illness worldwide. Campylobacteriosis has continued
to be the most commonly reported zoonosis in humans in the EU since
2005. In Poland, campylobacteriosis is rarely diagnosed and recorded.
Campylobacter spp. are widely distributed in nature, and their primary
reservoir is the gastrointestinal tract of birds and mammals, both wild and
farmed. The source of human infection is food of animal origin (especially
poultry meat and milk), water or direct contact with the animals, primarily
pets which are carriers of the bacteria. Foreign travel and swimming in
natural water are also qualified as the risk factors for campylobacteriosis
in humans. Secondarily contaminated with Campylobacter spp., drinking
water or water ingested from unknown sources are the most common causes
of focal infections in humans. These pathogens can also be transferred
from puppies or kittens to humans, especially small children. Professional
groups that are exposed to Campylobacter infections are: slaughterhouse
workers, veterinarians or keepers of poultry, cattle and pigs.
Key words: Campylobacter spp., campylobacteriosis, poultry meat, water
Słowa kluczowe: Campylobacter spp., kampylobakterioza, mięso drobiowe,
woda
© Probl Hig Epidemiol 2014, 95(3): 574-579
www.phie.pl
Nadesłano: 20.02.2014
Zakwalifikowano do druku: 08.07.2014
Zatrucia i zakażenia pokarmowe są nadal poważnym problemem zdrowia publicznego w wielu krajach
i generują duże koszty dla publicznych systemów
opieki zdrowotnej oraz straty dla gospodarki.
Bakterie z rodzaju Campylobacter należą do
najczęściej izolowanych czynników etiologicznych
zatruć i zakażeń pokarmowych u ludzi na całym świecie. Drobnoustroje te są szeroko rozpowszechnione
w przyrodzie, a ich podstawowym rezerwuarem jest
przewód pokarmowy ptaków i ssaków, zarówno dziko
żyjących, jak i hodowlanych. Źródłem zakażenia człowieka jest żywność pochodzenia zwierzęcego (zwłaszcza mięso drobiowe i mleko), woda lub bezpośredni
Adres do korespondencji / Address for correspondence
dr n. med. Bernadeta Szczepańska
Katedra i Zakład Higieny i Epidemiologii
ul. Curie-Skłodowskiej 9, 85-094 Bydgoszcz
tel. 52 585 36 16 (61), fax 52 585 35 89
e-mail: [email protected]
kontakt ze zwierzętami, głównie domowymi będącymi
nosicielami tych bakterii. Przeprowadzone badania
kliniczno-kontrolne zakwalifikowały także zagraniczne podróże i kąpiele w naturalnych zbiornikach
wodnych do czynników ryzyka kampylobakteriozy
u ludzi. Grupami zawodowymi, które narażone są na
infekcje Campylobacter są: pracownicy ubojni (głównie
drobiu) weterynarze, czy też hodowcy drobiu, bydła
i trzody chlewnej [1, 2, 3].
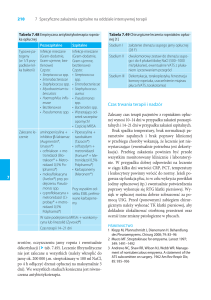
Kampylobakterioza w krajach Unii Europejskiej
Jak wynika z raportów zoonotycznych Europejskiego Urzędu ds. Bezpieczeństwa Żywności (EFSA)
Szczepańska B i wsp. Campylobacter spp. – niedoceniany w Polsce czynnik etiologiczny zakażeń ...
oraz Europejskiego Centrum Zapobiegania i Kontroli
Chorób (ECDC) od 2005 r. w krajach członkowskich
Unii Europejskiej, liczba zachorowań na kampylobakteriozę przewyższa liczbę przypadków salmonelloz
(ryc. 1). W 2011 r. zarejestrowano w Europie 224 744
potwierdzonych przypadków zakażeń spowodowanych przez bakterie z rodzaju Campylobacter u ludzi,
przy czym salmonelloz było ponad 2 razy mniej, tj.
95 548 potwierdzonych zachorowań. Najwyższą
liczbę przypadków kampylobakteriozy odnotowano
w Wielkiej Brytanii – 72 150 przypadków (zapadalność – 115,44 na 100 000), co stanowiło prawie
1/3 wszystkich zgłoszonych zachorowań w UE oraz
w Niemczech – odpowiednio 71 307 i 86,62/100 000
(tab. I). Jednak krajem o najwyższej zapadalności
były Czechy – 177,95 na 100 tys., gdzie wartość tego
wskaźnika była trzykrotnie wyższa niż średnia dla
całej Europy – 50,25 na 100 tys. [4-6].
W Polsce istnieje obowiązek rejestracji zachorowań na kampylobakteriozę, określony w Ustawie
o zapobieganiu oraz zwalczaniu zakażeń i chorób
zakaźnych u ludzi z dnia 5 grudnia 2008 r. Jednak
zgłaszalność zachorowań jest bardzo niska – zapadalność utrzymuje się na poziomie 0,9-1,0 na 100 000
i należy do jednej z najniższych w Europie. Niższe
wartości zanotowano tylko w: Łotwie – 0,31, Rumunii
– 0,70, Włoszech – 0,77. Są jednak kraje, takie jak
Portugalia i Grecja, gdzie nie wdrożono jeszcze systemu monitoringu i kontroli nad kampylobakteriozą
u ludzi [4-6]. W przypadku Polski oficjalne dane
dostarczone do EFSA wskazywały na 270 przypadków kampylobakteriozy w 2008 r. Pomimo faktu, że
w kolejnych latach obserwujemy wzrost liczby zgłoszonych przypadków do 367 w 2010 roku, to jesteśmy
bardzo dalecy od oszacowania rzeczywistej liczby
przypadków i częstości kampylobakteriozy w naszym
kraju. W Polsce jest to nadal choroba, która jest nie
250 000
wystarczająco często diagnozowana, rozpoznawana
i rejestrowana. Potwierdzają to dane publikowane
przez Zakład Epidemiologii Narodowego Instytutu
Zdrowia Publicznego – Państwowego Zakładu Higieny
w formie corocznych biuletynów „Choroby zakaźne
i zatrucia w Polsce” (w oparciu o informacje z formularzy o indywidualnych zachorowaniach i z formularzy dochodzeń epidemiologicznych w ogniskach
kampylobakteriozy nadsyłanych przez wojewódzkie
stacje sanitarno-epidemiologiczne). W Polsce w latach
2004-2012 zgłoszono 2 210 zachorowań na kampylobakteriozę (tab. II). Województwo śląskie jest
jedynym województwem, w którym można śledzić od
2005 r. tendencje czasowe tych zachorowań. Dotyczy
to zwłaszcza powiatu bielskiego i bielsko-bialskiego,
gdzie podczas diagnostyki chorób przebiegających
z biegunką, rutynowo prowadzi się badania w kierunku zakażenia pałeczkami Campylobacter. Łącznie
w tym okresie w województwie śląskim zarejestrowano 1 014 przypadków, co stanowiło 46% wszystkich
zachorowań zgłoszonych w Polsce. Jednak najwyższą
zapadalność pod koniec analizowanego okresu odnotowano w województwie warmińsko-mazurskim
7,16 na 100 tys. w 2011 roku oraz 6,47 na 100 tys.
w 2012 r. W województwie tym łącznie zgłoszono 331
przypadków kampylobakteriozy, tj. 15% wszystkich
zgłoszonych zachorowań w kraju. Małopolskie i mazowieckie to województwa, w których w 2004 r. zgłoszono pierwsze zakażenia Campylobacter, natomiast
do chwili obecnej nie odnotowano tych zachorowań
w województwie łódzkim i opolskim, a kilka infekcji
(mniej niż 10) zgłoszono w województwach: podlaskim (1), zachodnio-pomorskim (2), lubelskim (3)
oraz w świętokrzyskim (7). Ze względu na trudną
hodowlę, diagnostyki bakterii z rodzaju Campylobacter
w Polsce podejmują się tylko nieliczne, wyspecjalizowane laboratoria i stąd, najczęściej pozostają one
nierozpoznane [7, 8].
Charakterystyka bakterii z rodzaju
Campylobacter
200 000
Confirmed cases
575
150 000
campylobacteriosis
salmonellosis
yersiniosis
100 000
50 000
0
2004
2005
2006
2007
2008
2009
2010
2011
Ryc. 1. Choroby odzwierzęce u ludzi w krajach Unii Europejskiej
w latach 2004-2011 wg Europejskiego Urzędu ds. Bezpieczeństwa
Żywności (EFSA) oraz Europejskiego Centrum Zapobiegania i Kontroli
Chorób (ECDC) [4-6]
Fig. 1. Zoonoses in humans in countries of European Union in
2004‑2011 by European Food Safety Authority (EFSA) and European
Centre for Disease Prevention and Control (ECDC) [4-6]
Bakterie z rodzaju Campylobacter to mikroaerofilne, Gram-ujemne pałeczki, zdolne do ruchu dzięki
obecności rzęski na jednym lub na obu biegunach.
Cechą charakterystyczną jest zgięty kształt komórki,
przypominający spiralę, przecinek lub literę S. Muszą
być zdolne do reagowania na zmiany temperatury,
ponieważ bytują zarówno w jelicie ptaków, gdzie
temperatura wynosi 42°C, jak i w przewodzie pokarmowym człowieka w 37°C. Temperaturą optymalną
dla ich wzrostu jest 42°C. W niesprzyjających warunkach przekształcają się z formy cylindrycznej w nie
dającą wzrostu na podłożach hodowlanych formę
ziarniaka (VBNC). Ponieważ dawka infekcyjna jest
niska – 500‑800 jednostek tworzących kolonię, do
zakażeń ludzi dochodzi stosunkowo łatwo i często
[1, 3, 9].
576
Probl Hig Epidemiol 2014, 95(3): 574-579
Tabela I. Liczba zgłoszonych przypadków kampylobakteriozy w wybranych krajach UE w latach 2008-2011 (w nawiasach podano współczynnik zapadalności
na 100 000 mieszkańców) [4-6]
Table I. Number of reported cases of campylobacteriosis in selected EU countries in 2008-2011 (in parentheses incidence rate per 100 000 population) [4-6]
2008
2009
2010
2011
Niemcy /Germany
Kraj /Country
64,731 (78,7)
62,787 (76,01)
65,110 (79,59)
71,307 (86,62)
Wielka Brytania /United Kingdom
Czechy /Czech Republic
Słowacja /Slovakia
Litwa /Lithuania
Polska /Poland
Ogółem UE /EU Total
55,609 (90,9)
20,067 (193,3)
3,064 (56,7)
762 (21,6)
270 (0,7)
190,566 (40,7)
65,043 (106,32)
20,259 (193,54)
3,813 (70,45)
812 (24,24)
359 (0,94)
198,725 (45,57)
70,298 (113,37)
21,075 (200,58)
4,476 (82,51)
1,095 (32,89)
367 (0,96)
215,397 (48,56)
72,150 (115,44)
18,811 (177,95)
4,736 (83,99)
1,124 (34,64)
354 (0,93)
224,744 (50,25)
Tabela II. Kampylobakterioza w Polsce w latach 2004–2012. Liczba zachorowań (1) i zapadalność na 100 000 mieszkańców (2) wg województw [7, 8]
Table II. Campylobacteriosis in Poland between 2004–2012. Number of cases (1) and incidence rate per 100 000 population (2) by province [7, 8]
Lp.
Województwo
/Province
1 Dolnośląskie
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2004
2005
2006
2007
2008
2009
2010
1
2
1
2
1
2
1
2
1
2
1
2
1
–
–
–
–
3
0,1
–
–
5
0,17
–
–
–
Kujawsko-Pomorskie
–
Lubelskie
–
Lubuskie
–
Łódzkie
–
Małopolskie
22
Mazowieckie
2
Opolskie
–
Podkarpackie
–
Podlaskie
–
Pomorskie
–
Śląskie
–
Świętokrzyskie
–
Warmińsko-Mazurskie –
Wielkopolskie
–
Zachodnio-Pomorskie –
Razem /Total
24
–
–
–
–
–
3
–
–
0,676 4
0,039 1
–
–
–
–
–
–
–
–
–
39
–
–
–
–
–
–
–
–
0,063 47
–
–
–
–
0,3 26
–
–
0,12 22
0,02 7
–
–
–
6
–
–
–
–
0,83 86
–
–
–
7
–
–
–
–
0,12 157
–
–
–
1
–
–
–
–
2,58 28 2,78 21
–
–
–
–
0,67 18 0,55 15
0,14 6
0,12 10
–
–
–
–
0,29 1
0,05 –
–
–
–
–
–
3
0,14 4
1,84 116 2,49 169
–
2
0,16 3
0,49
–
–
19
–
18 0,53 23
–
–
–
–
0,41 192 0,5 270
Wysokie wymagania niezbędne do wzrostu powodują, że bakterie te są znacznie bardziej wrażliwe na
wpływ czynników środowiska niż np. Salmonella czy
też Escherichia coli.
Ciepłolubne Campylobacter nie namnażają się
w produktach żywnościowych pochodzenia zwierzęcego, ale mogą w nich przeżyć, zwłaszcza w niskich
temperaturach. Na skórze schłodzonych tuszek kurcząt i wieprzowiny C. jejuni i C. coli mogą przeżywać
nawet przez kilka tygodni [3, 10].
Chorobotwórczość i wrażliwość
na chemioterapeutyki
Spośród ponad 20 gatunków i podgatunków
najczęściej izolowane od ludzi z przypadków kampylobakteriozy są: C. jejuni subsp. jejuni – 90-95%
przypadków oraz C. coli – 5 % zakażeń. Bardzo rzadko izolowane są szczepy należące do: C. upsaliensis,
C. lari, C. fetus subsp. fetus [1, 3, 11].
Kampylobakterioza u ludzi przebiega najczęściej
pod postacią zapalenia żołądka i jelit lub zapalenia
jelit. Pierwsze objawy pojawiają się między 2 a 5 dniem
od zakażenia. Najczęściej występującym objawem jest
0,05 2
0,1
13
–
1 0,05
–
2,08 47 4,66 34
–
–
–
–
0,46 36 1,09 41
0,19 17 0,33 22
–
–
–
–
–
–
–
4
–
–
–
–
0,18 2 0,09
3
3,64 171 3,68 171
0,24 –
–
2
1,33 39 3,73 68
0,68 45 1,32 17
–
–
–
–
0,71 360 0,94 375
2011
2012
2
1
2
1
2
20042012
–
–
–
5
0,17
13
0,57
0,05
2,54
–
1,76
1,15
–
0,23
–
0,17
3,25
–
6,47
0,38
0,06
1,12
40
3
212
0
254
159
0
20
1
17
1014
7
331
137
2
2210
0,63 12 0,57 12
–
1 0,05 1
3,36 27 2,64 26
–
–
–
–
1,24 37 1,11 59
0,42 33 0,63 61
–
–
–
–
0,19 4 0,19 5
–
1 0,08 –
0,13 1 0,04 4
3,69 112 2,42 150
0,16 –
–
–
4,76 104 7,16 94
0,5 21 0,61 13
–
1 0,06 1
0,98 354 0,92 431
biegunka, często krwawa połączona z bólami brzucha
i gorączką, która zwykle sama ustępuje po 3-6 dniach.
Opisywane są przypadki, kiedy u zainfekowanych osób
dochodzi do infekcji systemowych, przeniesienia zakażenia na inne organy lub posocznicy. Sporadycznie pałeczki Campylobacter mogą wywołać powikłania, takie
jak: reaktywne zapalenie stawów, okresowe porażenia
ze strony układu nerwowego: zespół Guillaina-Barrego
(GBS) (1% ludzi zakażonych), czy też zespół MilleraFischera (MFS). Ich konsekwencją mogą być zejścia
śmiertelne [3, 12].
W przypadkach objawiających się ostrą, krwawą
biegunką z towarzyszącą wysoką temperaturą, utrzymującą się ponad tydzień (zwłaszcza u dzieci i osób
z obniżoną odpornością) wskazane jest włączenie
antybiotykoterapii. Lekiem z wyboru w leczeniu
kampylobakteriozy jest erytromycyna, ze względu na
łatwość użycia, niski poziom toksyczności oraz wysoką
skuteczność. U dorosłych, w przypadku stwierdzonych stanów zapalnych jelit bez identyfikacji czynnika
etiologicznego, stosuje się fluorochinolony będące antybiotykami o szerokim spektrum działania [11, 13].
Niepokojącym zjawiskiem w ostatnich latach jest
narastanie oporności na antybiotyki i chemioterapeu-
Szczepańska B i wsp. Campylobacter spp. – niedoceniany w Polsce czynnik etiologiczny zakażeń ...
tyki szczepów Campylobacter izolowanych od ludzi,
zwierząt oraz z żywności. Wynika to z niewłaściwego
stosowania antybiotyków w medycynie i weterynarii.
W krajach uprzemysłowionych poziom oporności na antybiotyki stosowane w leczeniu zakażenia
pałeczkami Campylobacter wzrasta o ok. 1-2% w skali
roku, w krajach rozwijających się sytuacja jest jeszcze
gorsza. W Nigerii, tylko w latach 1984-1994 oporność na erytromycynę szczepów Campylobacter spp.,
wyizolowanych od osób chorych, wzrosła prawie
o 60%. Natomiast w Tajlandii oporność na ciprofloksacynę w okresie od 1991 do 1995 roku, wzrosła od
0 do 84%. W krajach uprzemysłowionych narastanie oporności na antybiotyki przebiega wolniej, np.
w Norwegii w latach 1988-2000 oporność wzrosła od
6,1 do 36%, w Niemczech w latach 1992-2000 o 10%,
a w USA w latach 1995-2000 wzrosła z 10 do 36%
[3, 11, 13].
Badania prowadzone w Polsce wskazują, że wśród
szczepów C. jejuni izolowanych od ludzi (najczęściej od dzieci do 2 roku życia) największy odsetek
szczepów opornych obserwowano w odniesieniu do
cirpofloksacyny do 49,5%, tetracykliny do 17,5%,
ampicyliny do 13,2%.
W pracach, gdzie oznaczano wrażliwość szczepów
C. jejuni pochodzących od ludzi na erytromycynę,
cirpofloksacynę, ampicylinę, tetracyklinę oraz gentamycynę stwierdzono, że aż 35% szczepów wykazywało oporność na jeden antybiotyk, 23% na dwa,
a 6% na trzy antybiotyki bądź na chemioterapeutyki.
Cirpofloksacyna nie jest lekiem stosowanym u dzieci
poniżej 16 roku życia, dlatego należy przypuszczać,
że tak wysoki odsetek szczepów opornych ma swoje
przyczyny w nadużywaniu fluorochinolonów w medycynie weterynaryjnej, szczególnie na fermach drobiu
będącego głównym rezerwuarem bakterii z rodzaju
Campylobacter. Może to prowadzić do selekcji szczepów opornych, a następnie do ich transmisji na ludzi
poprzez skażoną żywność [11-14].
Zjawisko narastania oporności szczepów Campylobacter spp. na antybiotyki występuje na całym świecie
i została uznana przez WHO za istotny problem zdrowia publicznego. Na mocy obowiązujących obecnie w
Polsce uregulowań prawnych (Dyrektywa 2003/99/
WE Parlamentu Europejskiego i Rady) kraje członkowskie Unii Europejskiej są zobowiązane do wykrywania
zakażeń i monitorowania lekooporności wybranych
czynników zoonotycznych, do których zaliczono
również pałeczki z rodzaju Campylobacter [3, 15].
Kampylobakterioza – rezerwuar i czynniki
ryzyka
Ważnym rezerwuarem bakterii z rodzaju Campylobacter jest przewód pokarmowy ptaków, których temperatura ciała (42°C) stwarza doskonałe warunki do
ich rozwoju. Stwierdzono te bakterie u: 20-70% mew
577
(C. lari), 45% gawronów oraz 50% gołębi (C. jejuni).
Od 0 do 100% próbek kału pobieranego od dzikich gęsi
zawierało szczepy Campylobacter spp. Wolno żyjące
ptaki, a zwłaszcza gatunki wędrowne, mogą stać się
długodystansowymi wektorami dla szczepów Campylobacter spp. (również odpornych na antybiotyki),
które dalej mogą być przenoszone na ludzi i zwierzęta
gospodarskie. Ze względu na dużą ruchliwość ptaki
swoim kałem mogą zanieczyszczać pastwiska, pola
uprawne i wody powierzchniowe [1, 16, 17].
Do źródeł termofilnych Campylobacter spp.
w środowisku zaliczane są także zwierzęta hodowlane, takie jak: bydło, kozy, owce, czy świnie. Z danych
publikowanych przez EFSA wynika, że w 2010 r. wyizolowano Campylobacter spp. od 1,8% do 66,7% przebadanych świń i bydła. Bakterie te występują zarówno
w przewodzie pokarmowym zdrowych zwierząt, jak
i w ich zewnętrznej okrywie, tj. szczecinie, sierści, na
skórze, na kopytach oraz w węzłach limfatycznych.
Do zanieczyszczenia surowców rzeźnych dochodzi
zwykle podczas uboju i rozbioru tusz [3, 6].
W wielu pracach udowodniono transmisję pałeczek Campylobacter spp. pomiędzy człowiekiem
a zwierzętami domowymi. Uznano, że posiadanie
w swoim otoczeniu szczególnie psów i kotów, jest
czynnikiem ryzyka kampylobakteriozy. Na zakażenie
podatne są małe dzieci, które mają bliski kontakt ze
swoimi ulubieńcami, przy jednocześnie obniżonej
odporności. Z przeglądu literatury wynika, że odsetek
izolacji Campylobacter spp. od psów waha się od 17%
(Brazylia, Argentyna) do 76% (Dania). Nieco niższy
odsetek izolacji tych bakterii stwierdzono od młodych
kotów (Niemcy – 47%, Irlandia – 42%, Brazylia – 8%).
W badaniach przeprowadzonych przez Andrzejewską
i wsp. bakterie z rodzaju Campylobacter wyizolowano
od 4,81% psów i 9,86% kotów (próbki pochodziły od
zdrowych zwierząt z okolic Bydgoszczy w wieku od
2 tygodni do 24 miesiąca życia) [18-21].
Jednak za najważniejszy czynnik ryzyka kampylobakteriozy u ludzi uważa się mięso drobiowe – nieodpowiednio przygotowane lub grillowane (mocno
spieczone na powierzchni, a często w głębszych warstwach nie poddane właściwej obróbce termicznej)
[1, 2, 22-24]. Zdaniem ekspertów EFSA 20-30% tych
zachorowań u ludzi w UE spowodowanych jest spożyciem mięsa drobiowego, podczas gdy 50-80% może być
spowodowane przenoszeniem szczepów Campylobacter
pochodzących z drobiu na człowieka innymi drogami
niż żywność, np. za pośrednictwem środowiska lub
przez bezpośredni kontakt. Według tego samego
źródła, w 2009 roku do krajów o najwyższym odsetku
tuszek kurcząt „Campylobacter-pozytywnych” należały: Luksemburg, Irlandia i Malta (więcej niż 95%).
Najniższy odsetek stwierdzono w: Finlandii, Norwegii
i Estonii (5%). W Polsce odsetek zanieczyszczonych
tuszek kurcząt wynosił 75-85% i był nieco wyższy niż
578
średnia dla całej Unii Europejskiej – ok. 75% [4, 5,
10, 25].
Jednym z nośników pałeczek Campylobacter odpowiedzialnym za ich rozpowszechnianie w środowisku
są wody powierzchniowe, do których bakterie te trafiają wraz ze ściekami, kałem dzikiego ptactwa oraz odpadami z ferm hodowlanych. Przeprowadzone badania
kliniczno-kontrolne zakwalifikowały także kąpiele
w naturalnych zbiornikach wodnych do czynników
ryzyka kampylobakteriozy u ludzi. Bakterie z rodzaju
Campylobacter stwierdzono także w fontannach miejskich (40%), które mogą stanowić źródło wody pitnej
dla ptaków oraz psów pozostawionych bez opieki,
a w upalne letnie dni miejsce do zabaw dzieci. [26]
Wtórnie zanieczyszczona Campylobacter spp. woda do
picia lub nieuzdatniona woda spożywana z nieznanych
źródeł są najczęstszymi przyczynami ogniskowych
zakażeń tymi bakteriami u ludzi [9, 22, 27-29].
Kuchnia – miejsce wtórnego zanieczyszczenia
żywności Campylobacter spp.
Surowce pochodzenia zwierzęcego, a zwłaszcza surowy drób, który trafia do kuchni domowych
i komercyjnych może być źródłem bakterii z rodzaju
Campylobacter. W warunkach domowych przyczyną
około 30% zakażeń Campylobacter spp. są tzw. zakażenia krzyżowe, kiedy to (przy braku zachowania
podstawowych zasad higieny) może dojść do przeniesienia tych patogenów znajdującej się w posoce
pochodzącej z surowego mięsa (zwłaszcza drobiowego), z rąk osoby przygotowującej potrawę i sprzętu
kuchennego na inne osoby i potrawy. Bakterie te
stwierdzono po 24 godzinach od „obróbki” mięsa
drobiowego na powierzchni roboczej w obrębie 1,5 m.
Z badań przeprowadzonych w Kanadzie wynika, że
48% desek do krojenia niewłaściwie mytych po kontakcie z mięsem drobiowym stanowiło główny czynnik
ryzyka zakażeń spowodowanych przez Campylobacter
spp. [3, 30, 31].
W przenoszeniu tych patogenów w środowisku
kuchennym pewną rolę mogą odgrywać także udomowione zwierzęta – nosiciele mający swobodny dostęp
do kuchni (pies, kot, kanarek) oraz owady, takie jak:
karaluchy, karaczany i muchy, których rola w przenoszeniu tych patogenów może być dużo większa niż się
powszechni ocenia [1, 30, 32].
W grupie ryzyka związanego z możliwą infekcją
Campylobacter spp. znalazły się również warzywa,
które mimo na ogół niskiego poziomu zanieczyszczenia pierwotnego na etapie uprawy (nawożenie
gnojowicą), mogą znacznie częściej ulegać zakażeniu
wtórnemu, zarówno w kuchni, jak i na zapleczu kuchennym. Dlatego warunkiem zapewnienia bezpieczeństwa zdrowotnego konsumentów jest staranne
mycie warzyw przed obraniem, zwłaszcza jeżeli mają
być spożywane na surowo [32, 33].
Probl Hig Epidemiol 2014, 95(3): 574-579
Kampylobakterioza u ludzi: występowanie
i koszty
W 2011 r. w 27 krajach członkowskich Unii
Europejskiej odnotowano ponad 220 tys. potwierdzonych zachorowań na kampylobakteriozę Jednak,
według EFSA liczba klinicznych przypadków kampylobakteriozy w tych krajach w dużej mierze jest
niedoszacowana, a jej rzeczywista wartość może sięgać
nawet od 2 do 20 mln przypadków rocznie. Zdaniem
ekspertów Europejskiego Urzędu ds. Bezpieczeństwa
Żywności koszt, jaki generuje kampylobakterioza
dla publicznych systemów opieki zdrowotnej oraz
poprzez straty w produkcji, szacowany jest od 500
mln do 5 mld euro rocznie. Te same źródła podają, że
w Holandii (szacunkowo około 80 tys. przypadków
rocznie), koszty te mogą wynosić ok. 21 mln euro
rocznie. Obejmują one: koszty leczenia, opiekę nad
chorym, utracone zarobki, straty w produkcji, koszty
sądowe i inne koszty pośrednie. W Belgii (prawdopodobnie około 55 tys. przypadków rocznie) koszty te
są jeszcze wyższe i mogą osiągać wartość ok. 27 mln
euro rocznie [3, 34].
Z analizy raportów z Centrum Kontroli i Prewencji
Chorób (CDC) i działającej przy nim sieci nadzoru
FoodNet wynika, że w 2011 r. w USA zarejestrowano
6 785 potwierdzonych przypadków kampylobakteriozy u ludzi, zapadalność wynosiła 13,02 na 100 tys.,
a 1 042 (15%) tych chorych było hospitalizowanych
[35]. Jednak wiele więcej przypadków pozostaje nierozpoznanych lub nieudokumentowanych. Szacuje
się, że Campylobacter spp. powoduje w tym kraju ponad
2 mln zachorowań, 13 tys. hospitalizacji i ponad 100
zgonów rocznie [3, 34, 36]. Zdaniem ekspertów amerykańskich, roczne koszty generowane przez kampylobakteriozę dla opieki zdrowotnej i gospodarki, mogą
sięgać nawet 1 miliarda 560 milionów dolarów [37].
Podsumowanie
Mimo powszechnego występowania kampylobakteriozy na świecie, w Polsce jest ona chorobą rzadko
diagnozowaną, rozpoznawaną i rejestrowaną. Wynika
to głównie z faktu, że rutynowo diagnostyka w kierunku
zakażenia pałeczkami Campylobacter wykonywana jest
jedynie w pojedynczych powiatach. Dlatego ważne jest,
aby na terenie całego kraju wszystkie próbki kału (a szczególnie od dzieci), w przypadku chorób przebiegających
z biegunką, badano również w kierunku tych patogenów.
W działaniach ukierunkowanych na poprawę
zdrowia naszego społeczeństwa, kluczowe znaczenie mogą mieć programy profilaktyczne związane
z ograniczeniem czynników ryzyka wystąpienia kampylobakteriozy, a przede wszystkim promowanie podstawowych zasad higieny w trakcie przygotowywania
bezpiecznej żywności (odpowiednia jakość produktów
i wody, właściwa obróbka termiczna, warunki przechowywania surowców i gotowej do spożycia żywności).
Szczepańska B i wsp. Campylobacter spp. – niedoceniany w Polsce czynnik etiologiczny zakażeń ...
579
Piśmiennictwo / References
1. Humphrey T, O’Brien S, Madsen M. Campylobacters as
zoonotic pathogens: a food production perspective. Int J Food
Microbiol 2007, 117: 237-57.
2. The global view of Campylobacteriosis Report of an expert
consultation. WHO, Utrecht 2013.
3. Silva J, Leite D, Fernandes M, et al. Campylobacter spp. as
a Foodborne Pathogen: A Review. Front Microbiol 2011, 2: 200.
4. The European Union Summary Report on Trends and
Sources of Zoonoses, Zoonotic Agents and Food-borne
Outbreaks in 2009. EFSA J 2011, 9(3): 2090.
5. The European Union Summary Report on Trends and
Sources of Zoonoses, Zoonotic Agents and Food-borne
Outbreaks in 2010. EFSA J 2012, 10(3): 2597.
6. The European Union Summary Report on Trends and
Sources of Zoonoses, Zoonotic Agents and Food-borne
Outbreaks in 2011. EFSA J 2013, 11(4): 3129.
7. Meldunki o zachorowaniach na choroby zakaźne, zakażeniach
i zatruciach w Polsce. NIZP-PZH. http://www.pzh.gov. pl/
oldpage/epimeld/index_p.html
8. Czarkowski MP, Cielebąk E, Kondej B i wsp. Choroby zakaźne
i zatrucia w Polsce. NIZP-PZH, Warszawa. Roczniki 20042012. http://www.pzh.gov.pl/oldpage/epimeld/2012/
index_mp.html
9. Jones K. Campylobacters in water, sewage and the
environment. J Appl Microbiol 2001, 90: 68-79.
10. Risk assessment of Campylobacter spp. in broiler chickens:
Technical Report. Microbiological Risk Assessment Series.
FAO/WHO, Geneva 2009. No 12: 132.
11. Rzewuska K, Korsak D, Maćkiw E. Oporność bakterii
Campylobacter sp. na antybiotyki i chemioterapeutyki. Prz
Epidemiol 2010, 64: 63-68.
12. Krutkiewicz A. Kampylobakteriozy u ludzi i zwierząt. Życie
Weter 2008, 83(40): 285-288.
13. Rożynek E, Dzierżanowska-Fangrat K, Szczepańska B, et
al. Trends in antimicrobial susceptibility of Campylobacter
isolates in Poland (2000-2007). Pol J Microbiol 2009, 58(2):
111-5.
14. Krutkiewicz A, Klimuszko D. Mechanizmy oporności
pałeczek Campylobacter sp. na chemioterapeutyki. Post
Mikrobiol 2008, 47(4): 489-95.
15. Dyrektywa 2003/99/WE Parlamentu Europejskiego i Rady
z dnia 17 listopada 2003 r. w sprawie monitorowania
chorób odzwierzęcych i odzwierzęcych czynników
chorobotwórczych, zmieniająca decyzję Rady 90/424/EWG
i uchylająca dyrektywę Rady 92/117/EWG (Dz.U. L 325
z 12.12.2003: 31).
16. Waldenström J, Mevius D, et al. Antimicrobial resistance
profiles of Campylobacter jejuni isolates from wild birds in
Sweden. Appl Environ Microbiol 2005, 71(5): 2438‑2441.
17. Waldenstrom J, Broman T, Carlsson I, et al. Prevalence of
Campylobacter jejuni, Campylobacter lari and Campylobacter
coli in different ecological guilds and taxa of migrating bird.
Appl Environ Microbiol 2002, 8: 5911-5917.
18. Andrzejewska M, Szczepańska B, Klawe JJ, et al. Prevalence
of Campylobacter jejuni and Campylobacter coli species in
cats and dogs from Bydgoszcz (Poland) region. Pol J Vet Sci
2013, 16(1): 115-20.
19. Hald B, Pedersen K, Wainø M, et al. Longitudinal study of
the excretion patterns of thermophilic Campylobacter spp.
in young pet dogs in Denmark. J Clin Microbiol 2004, 42:
2003-2012.
20. Lopez CM, Giacoboni G, Agostini A, et al. Thermotolerant
Campylobacters in domestic animals in a defined population in
Buenos Aires, Argentina. Prev Vet Med 2002, 55: 193‑200.
21. Moser I, Rieksneuwohner B, Lentzsch P, et al. Genomic
heterogeneity and O-antigenic diversity of Campylobacter
upsaliensis and Campylobacter helveticus strains isolated from
dogs and cats in Germany. J Clin Microbiol 2001, 39: 2548-2557.
22. Tam CC, Higgins CD, Neal KR, et al. Chicken consumption
and use of acid-suppressing medications as risk factors for
Campylobacter Enteritis, England. Emerg Infect Dis 2009,
15(9): 1402-1408.
23. Doorduyn Y, van den Brandhof WE, van Duynhoven YT,
et al. Risk factors for indigenous Campylobacter jejuni and
Campylobacter coli infections in The Netherlands: a casecontrol study. Epidemiol Infect 2010, 138: 1391-1404.
24. Risk assessment of Campylobacter spp. In broiler chickens.
Technical report. WHO/FAO 2009.
25. Scientific opinion on quantification of the risk posed by
broiler meat to human campylobacteriosis in the EU. EFSA
J 2010, 8: 1437-1526.
26. Andrzejewska M, Szczepańska B, Śpica D. Occurrence
of Campylobacter species in surface waters in Bydgoszcz
Region. Med Biol Sci 2009, 23(3): 27‑31.
27. Close M, Dann R, Ball A, Pirie R, et al. Microbial groundwater
quality and its health implications for a border-strip irrigated
dairy farm catchment, South Island, New Zealand. J Water
Health 2008, 6: 83-98.
28. Schonberg-Norio D, Takkinen J, Hanninen ML, et al.
Swimming and Campylobacter infections. Emerg Infect Dis
2004, 10(8): 1474-7.
29. Mughini Gras L, Smid JH, Wagenaar JA. Risk factors for
Campylobacteriosis of chicken, ruminant, and environmental
origin: A combined case-control and source attribution
analysis. PLoS One 2012: 7.
30. Burgess F, Little CL, Allen G, et al. Prevalence of Campylobacter,
Salmonella and Escherichia coli on the external packaging of
raw meat. J Food Prot 2005, 68: 469-475.
31. Michaud S, Menard S, Arbeit RD. Risk factors for
Campylobacter infections in Estrie, Quebec: A case-control
study. (in Proceedings CACMID 2001 meeting) Victoria,
Canada 4-8 November 2001: T4.
32. Daczkowska-Kozon E. Kuchnia – miejsce wtórnego
zanieczyszczenia żywności Campylobacter. Przem Spoż
2006, 1: 34-35.
33. Brandl MT, Haxo AF, Bates AH, et al. Comparison of survival
of Campylobacter jejuni in the phyllosphere with that in the
rhizosphere of spinach and radish plants. Appl Env Microbiol
2004, 70: 1182-1189.
34. Anonymous. Emerging infections program. FoodNet News
Vol 2007. 1(1). http://cdc.gov/foodnet/news/2007/
October2007_foodnet_news.pdf
35. Foodborne Diseases Active Surveillance Network (FoodNet):
FoodNet Surveillance Report for 2011 (Final Report). CDC,
Atlanta 2012.
36. Preliminary FoodNet Data on the incidence of infection
with pathogens transmitted commonly through food – 10
states, 2009. Weekly MMWR 2010, 16, 2010/59(14).
418‑422. http://www.foodconsumer.org/newsite/Nutrition/
foodborne_illnesses_on_the_decline_1504100853.html
37. Scharff RL. Economic burden from health losses due to foodborne
illness in the United States. J Food Prot 2011, 75(1): 123-131.