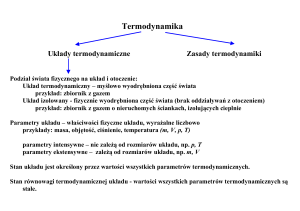
Układy dysypatywne - układy, w których występuje dysypacja (strata) energii.
Energia wewnętrzna – suma energii oddziaływań międzycząsteczkowych i wewnątrz cząsteczkowych
układu oraz energii ruchu cieplnego cząsteczek. Energię wewnętrzną układu można zmienić,
wykonując nad tym układem pracę lub dostarczając do układu ciepła.
∆𝑈 = ∆𝑊 + ∆𝑄
Jeżeli chcemy zmienić energię wewnętrzną układu jakim jest gaz to należy zmienić średnią energię
kinetyczną cząsteczek lub energię potencjalną cząsteczek. Energia potencjalna cząsteczek jest
znikoma, więc jej zmianę możemy zaniedbać. Stąd wynika, że:
∆𝐸𝑚 = ∆𝐸𝐾 ś𝑟 = 𝑊
Ciepło – forma przekazywania energii.
Ciepło właściwe – względna zdolność substancji do pochłaniania różnych ilości ciepła przy zmianie
temperatury o tę samą wartość.
Przemiany fazowe I-ego rodzaju – procesy, podczas których przy dostarczaniu ciepła nie zmieniamy
temperatury układu (np. wrzenie, topnienie, skraplanie, krzepnięcie)
Temperatura – miara średniej energii kinetycznej cząsteczek.
Ciśnienie – iloraz wartości siły działającej prostopadle do powierzchni i powierzchni na którą działa
ta siła.
𝑝=
𝐹
𝐴
Praca objętościowa – praca wykonana nad gazem (lub przez gaz) podczas zmiany jego objętości
∆𝑊 = 𝑝 ∙ 𝐴 ∙ ∆𝑥
∆𝑊 = 𝑝 ∙ ∆𝑉
Jeżeli do układu dostarczymy ciepła, to nastąpi wzrost temperatury, a zatem nastąpi wzrost średniej
energii kinetycznej cząsteczek, czyli wzrost średniej prędkości cząsteczek, co spowoduje pojawienie
się pędu. Zatem pojawi się pewna niezerowa zmiana pędu, a co za tym idzie wystąpi niezerowa
⃗⃗⃗𝑛 (siła parcia).
siła 𝐹
∆𝑊 = ⃗⃗⃗
𝐹𝑛 ∙ ∆𝑥 = 𝐹𝑛 ∙ ∆𝑥
𝐹𝑛 = 𝑝 ∙ 𝐴
0 zasada termodynamiki - dwa ciała będące w równowadze termodynamicznej z pewnym układem
są w równowadze termodynamicznej ze sobą.
I zasada termodynamiki - zmiana energii wewnętrznej układu jest równa sumie pracy wykonanej
przez układ bądź nad układem i ciepła dostarczonego lub oddanego przez układ.
II zasada termodynamiki – niemożliwy jest proces, którego jedynym rezultatem jest zamiana ciepła
pobranego ze źródła ciepła na równoważną temu ciepłu pracę; nie możliwy jest też proces, którego
jedynym rezultatem jest przekazanie ciepła z układy chłodniejszego do układu cieplejszego (dotyczy
to procesów spontanicznych)
Równanie stanu gazu:
𝑝∙𝑉 =𝑛∙𝑅∙𝑇
𝑝𝑉
= 𝑐𝑜𝑛𝑠𝑡
𝑇
𝑝1 𝑉1 𝑝2 𝑉2
=
𝑇1
𝑇2
Gęstość
𝜌=
𝑚
𝑉
Wartość ciśnienia na pewnej głębokości
𝑝 = 𝑝0 + 𝜌𝑔ℎ
Gradient ciśnienia
∆𝑝
= 𝜌𝑔
∆𝑦
Prawo Pascala – ciśnienie wywierane na zamknięty płyn przekazywane jest na każdą część płynu oraz
na ścianki naczynia i na wszystkie powierzchnie zanurzone w tym płynie i ma tę samą wartość w tej
samej objętości.
Prawo Archimedesa – Na każde ciało zanurzone w płynie (całkowicie lub częściowo) działa siła
wyporu równa ciężarowi wypartego przez to ciało płynu. Siła ta działa wzdłuż prostej przechodzącej
przez środek ciężkości tego ciała.
𝐹𝑤𝑦𝑝 = 𝑄𝑤𝑦𝑝.𝑝ł
𝐹𝑤𝑦𝑝 = 𝑚𝑝ł ∙ 𝑔 = 𝜌𝑝ł ∙ 𝑉𝑐𝑖𝑎ł𝑎 ∙ 𝑔