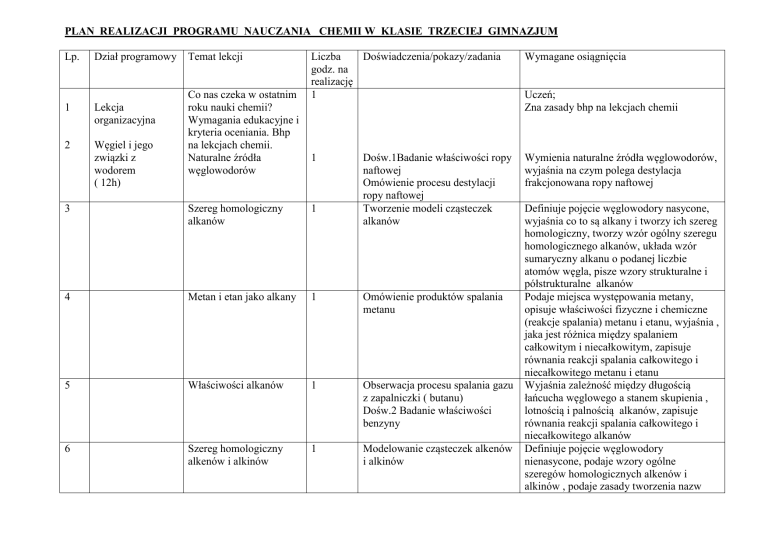
PLAN REALIZACJI PROGRAMU NAUCZANIA CHEMII W KLASIE TRZECIEJ GIMNAZJUM
Lp.
Dział programowy
1
Lekcja
organizacyjna
2
Węgiel i jego
związki z
wodorem
( 12h)
Temat lekcji
Co nas czeka w ostatnim
roku nauki chemii?
Wymagania edukacyjne i
kryteria oceniania. Bhp
na lekcjach chemii.
Naturalne źródła
węglowodorów
Liczba
Doświadczenia/pokazy/zadania
godz. na
realizację
1
1
Dośw.1Badanie właściwości ropy
naftowej
Omówienie procesu destylacji
ropy naftowej
Tworzenie modeli cząsteczek
alkanów
3
Szereg homologiczny
alkanów
1
4
Metan i etan jako alkany
1
Omówienie produktów spalania
metanu
5
Właściwości alkanów
1
Obserwacja procesu spalania gazu
z zapalniczki ( butanu)
Dośw.2 Badanie właściwości
benzyny
6
Szereg homologiczny
alkenów i alkinów
1
Modelowanie cząsteczek alkenów
i alkinów
Wymagane osiągnięcia
Uczeń;
Zna zasady bhp na lekcjach chemii
Wymienia naturalne źródła węglowodorów,
wyjaśnia na czym polega destylacja
frakcjonowana ropy naftowej
Definiuje pojęcie węglowodory nasycone,
wyjaśnia co to są alkany i tworzy ich szereg
homologiczny, tworzy wzór ogólny szeregu
homologicznego alkanów, układa wzór
sumaryczny alkanu o podanej liczbie
atomów węgla, pisze wzory strukturalne i
półstrukturalne alkanów
Podaje miejsca występowania metany,
opisuje właściwości fizyczne i chemiczne
(reakcje spalania) metanu i etanu, wyjaśnia ,
jaka jest różnica między spalaniem
całkowitym i niecałkowitym, zapisuje
równania reakcji spalania całkowitego i
niecałkowitego metanu i etanu
Wyjaśnia zależność między długością
łańcucha węglowego a stanem skupienia ,
lotnością i palnością alkanów, zapisuje
równania reakcji spalania całkowitego i
niecałkowitego alkanów
Definiuje pojęcie węglowodory
nienasycone, podaje wzory ogólne
szeregów homologicznych alkenów i
alkinów , podaje zasady tworzenia nazw
7
Eten i etyn jako
przykłady
węglowodorów
nienasyconych
8
Podsumowanie
1
wiadomości o
węglowodorach
Sprawdzian wiadomości i 2
umiejętności dotyczący
węglowodorów, jego
omówienie i poprawa.
Szereg homologiczny
1
alkoholi
9
10
Pochodne
węglowodorów
(13h)
3
Dośw. 3. Otrzymywanie etanu i
badanie jego właściwości
Modelowanie cząsteczek alkoholi
1
11
Metanol i etanol jako
przykłady alkoholi
Dośw. 4. Badanie właściwości
etanolu i jego wykrywanie
( reakcja charakterystyczna)
12
Glicerol jako przykład
1
Dośw.5. Badanie właściwości
alkenów i alkinów na podstawie nazw
alkanów
Opisuje właściwości (spalanie ,
przyłączanie bromu i wodoru) etenu i etynu,
projektuje doświadczenie umożliwiające
odróżnienie węglowodorów nasyconych od
nienasyconych ,opisuje zastosowanie etenu
i etynu, zapisuje równania reakcji
polimeryzacji etenu, opisuje właściwości i
zastosowanie polietylenu, wyjaśnia na czym
polega reakcja polimeryzacji, zapisuje
równania reakcji spalania całkowitego i
niecałkowitego, przyłączania bromu i
wodoru do węglowodorów nienasyconych
Opisuje budowę cząsteczki alkoholi,
wskazuje grupę funkcyjną, i podaje jej
nazwę, wyjaśnia ,co to znaczy że alkohole
są pochodnymi węglowodorów, tworzy
nazwy prostych alkoholi, zapisuje wzory
sumaryczne i strukturalne prostych alkoholi,
tworzy szereg homologiczny alkoholi na
podstawie szeregu homologicznego
alkanów
Opisuje właściwości i zastosowanie
metanolu i etanolu, bada właściwości
etanolu, zapisuje równanie reakcji spalania
metanolu i etanolu ,opisuje negatywne
skutki działania etanolu na organizm ludzki
Zapisuje wzór sumaryczny i strukturalny
alkoholu
polihydroksylowego
13
14
glicerolu
Szereg homologiczny
kwasów karboksylowych
1
Modelowanie cząsteczek kwasów
Kwas metanowy i
etanowy jako przykłady
kwasów karboksylowych
2
Wyższe kwasy
karboksylowe
1
Dośw.6. Badanie właściwości
kwasu octowego
Dośw. 7.Badanie odczynu kwasu
Dośw. 8. Reakcja kwasu
octowego z magnezem
Dośw.9. Reakcja kwasu octowego
z zasadą sodową i tlenkiem
miedzi (II)
Dośw. 10. reakcja kwasu
stearynowego z zasadą sodową
Dośw. 11. badanie właściwości
wyższych kwasów
karboksylowych
Estry
2
15
16
Dośw. 12. reakcja alkoholu
etylowego z kwasem octowym
glicerolu, bada i opisuje właściwości
glicerolu, wymienia zastosowania glicerolu,
zapisuje równania reakcji spalania glicerolu
Podaje przykłady kwasów organicznych
występujących w przyrodzie, tworzy nazwy
prostych kwasów karboksylowych i
zapisuje ich wzory sumaryczne i
strukturalne, podaje nazwy zwyczajowe i
systematyczne kwasów karboksylowych,
opisuje budowę kwasów- wskazuje grupę
karboksylową, wyjaśnia co to znaczy ,że
kwasy karboksylowe są pochodnymi
węglowodorów
Bada i opisuje właściwości i zastosowania
kwasów metanowego i etanowego, zapisuje
równania reakcji spalania, dysocjacji
jonowej(elektrolitycznej) reakcji z zasadami
metalami i tlenkami metali kwasów
metanowego i etanowego
Podaje nazwy3 kwasów karboksylowych,
zapisuje wzory kwasów karboksylowych,
opisuje właściwości długołańcuchowych
kwasów karboksylowych, projektuje
doświadczenie umożliwiające odróżnienie
kwas od palmitynowego lub stearynowego
Wyjasnia na czym polega reakcja
estryfikacji, zapisuje równania reakcji
estryfikacji między prostym kwasem
karboksylowym a alkoholem
monohydroksylowym, tworzy nazwy
estrów pochodzących od podanych nazw
kwasów i alkoholi, projektuje
doświadczenie umożliwiające otrzymanie
estru o danej nazwie, opisuje właściwości
estrów w aspekcie ich zastosowań
Aminy i aminokwasy –
pochodne
węglowodorów
zawierające azot
17
18
19
20
21
Substancje o
znaczeniu
biologicznym(10h)
1
Modelowanie cząsteczek amin
czy aminokwasów
Podsumowanie i
1
utrwalenie wiadomości o
pochodnych
węglowodorów
Sprawdzian wiadomości i 2
jego poprawa
Składniki chemiczne
1
żywności
Tłuszcze
2
Dośw. 13. Badanie
rozpuszczalności tłuszczów
Odróżnianie tłuszczu od
substancji tłustej
22
Białka
2
Dośw.14. Wykrywanie białek,
badanie właściwości białek
23
Monosacharydy
1
Dośw. 15 Badanie składu
pierwiastkowego sacharydów,
badanie właściwości glukozy
Opisuje budowę amin na przykładzie
metyloaminy, opisuje właściwości fizyczne
i chemiczne na przykładzie metyloaminy,
opisuje budowę aminokwasów na
przykładzie glicyny (wiązanie peptydowe)
Wymienia składniki chemiczne żywności i
wyjaśnia ich rolę w prawidłowym
funkcjonowaniu organizmu
Klasyfikuje tłuszcze pod względem
pochodzenia, stanu skupienia i charakteru
chemicznego, opisuje właściwości fizyczne
tłuszczów , projektuje doświadczenie
umożliwiające odróżnienie tłuszczu
nienasyconego od nasyconego
Definiuje biała jako związki chemiczne
powstające z aminokwasów, wymienia
pierwiastki chemiczne, których atomy
wchodzą w skład cząsteczek białek, bada
zachowanie się białka pod wpływem
ogrzewania, stężonego alkoholu etylowego,
kwasów , zasad, soli metali ciężkich( np.
CuSO4 ) i soli kuchennej, wykrywa białka
w różnych produktach
Wymienia pierwiastki chemiczne, których
atomy wchodzą w skład cukrów, dokonuje
podziału sacharydów na proste i złożone,
podaje wzór sumaryczny glukozy i
fruktozy, bada i opisuje właściwości
fizyczne , występowanie i zastosowanie
glukozy
24
Disacharydy
1
Dośw. 16. Badanie właściwości
sacharozy
25
Polisacharydy
1
Dośw. 17. Badanie właściwości
skrobi, wykrywanie skrobi w
produktach spożywczych
26
Podsumowanie
wiadomości o
substancjach o znaczeniu
biologicznym.
1
Razem 35h + 1h do dyspozycji
nauczyciela
Podaje wzór sumaryczny sacharozy, bada i
opisuje właściwości fizyczne sacharozy,
zapisuje równanie reakcji sacharozy z wodą
za pomocą wzorów sumarycznych
Opisuje występowanie skrobi i celulozy w
przyrodzie, podaje wzór sumaryczny skrobi
i celulozy, opisuje właściwości fizyczne
skrobi i celulozy, wymienia różnice,
wykrywa obecność skrobi w różnych
produktach spożywczych, opisuje znaczenie
i zastosowanie skrobi i celulozy