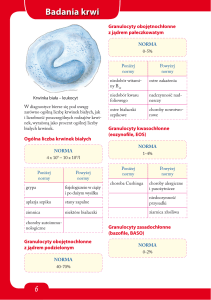
Zaburzenia ilościowe płytek krwi
Płytki krwi powstają na skutek fragmentacji cytoplazmy megakariocytów,
do której dochodzi w przestrzeniach zatokowych szpiku kostnego i
częściowo w płucach. Proces trombopoezy trwa średnio 8-10 dni i jest
regulowany wieloczynnikowo. Głównym hormonem regulującym tworzenie
płytek jest trombopoetyna (TPO), produkowana w wątrobie, a także w
nabłonku cewek proksymalnych nerek, jądrach, płucach, szpiku,
śledzionie i mózgu. Około 30 % trombocytów jest magazynowana w
śledzionie. Śledziona jest również miejscem niszczenia płytek krwi, a po
splenektomii jej funkcję przejmuje wątroba [1,5,6].
Średni czas życia trombocytów wynosi 7-10 dni. Fizjologicznie liczba płytek krwi
w ciągu doby waha się o ok. 10%, a u kobiet w trakcie krwawienia miesięcznego
może zmniejszyć się nawet o 25-50% [1,3].
Zakres referencyjny: 150-400 tys/µl.
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą pierwotny
czop hemostatyczny w miejscu uszkodzenia śródbłonka naczyniowego oraz
uczestniczą w reakcjach krzepnięcia krwi. Przyczyną płytkowych skaz
krwotocznych mogą być zmiany ilościowe liczby trombocytów [6].
I) Małopłytkowość (trombocytopenia) jest to obniżenie liczby płytek krwi
poniżej 150 tys/µl. Przy wartościach poniżej 50 tys/µl mogą występować skłonność
do powstawania sińców i wybroczyn. W skrajnych przypadkach małopłytkowości
mogą wystąpić zagrażające życiu krwotoki śródczaszkowe [1,2,4,6].
Poniżej przedstawiono podział małopłytkowości ze względu na przyczynę.
1. Małopłytkowości centralne – uwarunkowana zmniejszonym
wytwarzaniem płytek w szpiku kostnym:
Wrodzone:
– wrodzona hipoplazja megakariocytwa;
– dziedziczna małopłytkowość związana z zaburzeniem dojrzewania
megakariocytów;
– anomalia Maya-Hegglina;
– zespół Alporta;
– anemia Fanconiego – wrodzona aplazja szpiku.
Nabyte:
– niedokrwistość aplastyczna;
– selektywna aplazja megakariocytowi;
– nacieczenie szpiku kostnego (białaczki, chłoniaki i inne nowotwory,
gruźlica);
– zwłóknienie szpiku;
– uszkodzenie szpiku przez środki chemiczne, leki mielosupresyjne i
promieniowanie jonizujące;
– zakażenia wirusowe;
– nocna napadowa hemoglobinuria;
– niewydolność nerek;
– niedokrwistość z niedoboru żelaza i niedokrwistość megaloblastyczna
(zaburzenie dojrzewania megakariocytów w skutek niedoboru witaminy B12
i kwasu foliowego) [1,2,4,6].
2. Małopłytkowości obwodowe – uwarunkowana zwiększonym usuwaniem
płytek krwi z krążenia:
Immunologiczne:
– samoistna autoimmunologiczna plamica małopłytkowa (AIPM);
– małopłytkowość poprzetoczeniowa;
– małopłytkowość polekowa na tle immunologicznym (heparyna, chinina,
chinidyna, sulfonamidy, niesteroidowe leki przeciwzapalne, sole złota);
– w przebiegu autoimmunologicznej niedokrwistości hemolitycznej;
– w toczniu rumieniowatym układowym;
– w przebiegu zakażeń – infekcje wirusowe odpowiadają za większość
małopłytkowości u dzieci, pojawiają się 1-2 tygodnia po zakażeniu i
ustępują samoistnie;
– w chłoniakach złośliwych;
– po przeszczepieniu szpiku kostnego;
– alloimmunologiczna trombocytopenia noworodka: niezgodność
antygenowa między matką, a dzieckiem, matka w wyniku immunizacji
wytwarza przeciwciała skierowane przeciwko własnym płytkom i płytkom
dziecka [1,3,4, FAB].
Ze względu na niską wykrywalność oznaczanie przeciwciał przeciwpłytkowych w
diagnostyce laboratoryjnej nie ma dużego znaczenia klinicznego. W
małopłytkowościach obwodowych czas przeżycia trombocytów jest skrócony, a w
rozmazie krwi stwierdza się obecność płytek olbrzymich. Czas krwawienia ulega
przedłużeniu [1,2,4,6].
Nieimmunologiczne:
– posocznica;
– rozsiane krzepnięcie śródnaczyniowe (DIC);
– martwicze zapalenie jelit;
– zespół hemolityczno-mocznicowy;
– infekcja HIV;
– zakrzepowa plamica małopłytkowa (zespół Moschcowitza);
– u kobiet ciężarnych zespół HELLP, stan przedrzucawkowy i rzucawka.
3. Małopłytkowości związane z nieprawidłowym rozdziałem płytek krwi w
ustroju:
– małopłytkowość w stanach hipotermii;
– hipersplenizm – nadmierne niszczenie płytek w śledzionie, liczba płytek
krwi na ogół nie obniża się poniżej 50 tys/µl.
W przypadku jednoczesnego występowania neutropenii i trombocytopenii należy
spodziewać się niewydolności wątroby i powiększenia śledziony (splenomegalii).
W tym przypadku małopłytkowość jest objawem niewydolności wątroby,
najczęściej w wyniku uszkodzenia poalkoholowego, a powiększona śledziona
odpowiada za nieprawidłową redystrybucję i niszczenie trombocytów [2,3,4].
4. Małopłytkowości wynikające z utraty płytek krwi lub z rozcieńczenia
krwi:
– krwotoki;
– krążenie pozaustrojowe;
– przetoczenie ponad 5 l krwi konserwowanej [5,6].
5. Małopłytkowość noworodków:
Wczesna: występuje w pierwszych 72 godzinach od porodu i jest najczęściej
wynikiem przejściowych zaburzeń trombopoezy. Małopłytkowość wczesna u
noworodków może wynikać także z wrodzonej infekcji wirusem różyczki,
cytomegalii, opryszczki, czy wirusem HIV.
Późna: ujawnia się po 72 godzinach od porodu i najczęściej wynika z nabytej
infekcji bakteryjnej lub martwiczego zapalenia jelit. U noworodków
urodzonych przedwcześnie o małopłytkowości mówimy, gdy liczba płytek krwi
spadnie poniżej 100tys/µl [2,4].
6. Małopłytkowość rzekoma: w warunkach in vitro spotkać można
psedudotrombocytopenie EDTA-zależną. Więcej o pseudotrombocytopenii EDTAzależnej można znaleźć tutaj.
II) Nadpłytkowość (trombocytoza) – nadmierna liczba płytek we krwi, powyżej
400 tys/µl.
Nadpłytkowość wynika z nadmiernej produkcji płytek, a nie wydłużenia ich czasu
przeżycia. W zależności od przyczyn trombocytozy dzielimy na pierwotne i wtórne.
1.Nadpłytkowość pierwotna:
Zwiększenie liczby płytek krwi jest wynikiem autonomicznego procesu
rozrostowego. Wśród nadpłytkowści pierwotnych wyróżniamy:
– nadpłytkowość samoistną (ET), będącą przewlekłym zespołem
mieloproliferacyjnym, związanym ze wzmożoną proliferacją
megakariocytów, poziom płytek krwi utrzymuje się najczęściej na poziomie
1000 tys/µl i więcej;
– nadpłytkowość rodzinna (FT) jest wrodzoną chorobą, związaną z mutacją
w genie TPO, prowadzącą do nadprodukcji trombopoetyny;
– inne zespoły mieloproliferacyjne: takie jak czerwienica prawdziwa,
zwłóknienie szpiku, przewlekła białaczka szpikowa [6].
Samoistna nadpłytkowość objawia się nawracającymi krwawieniami do przewodu
pokarmowego, dróg moczowych i z błon śluzowych nosa. Natomiast na skutek
nadmiernej gęstości krwi, następuje zaburzenie jej przepływu w naczyniach, co
może być przyczyną powikłań zatorowo-zakrzepowych (głownie w naczyniach
śledzionowych, krezkowych i mózgowych). Zakrzepy występują rzadziej, niż
krwawienia, a u połowy chorych obserwuje się powiększenie śledziony [5,6].
2. Nadpłytkowość wtórna:
Jest objawem innych chorób lub wynika z działania innych czynników
przyczynowych. Zwykle przebiega bezobjawowo, a ustalenie rozpoznania
następuje w oparciu o całość obrazu klinicznego i badanie szpiku [6].
Najczęstsza przyczyną trombocytozy jest ostry stan zapalny, który ustępuje po
wyleczeniu zapalenia. Innymi przyczynami trombocytozy reaktywnej są choroby
nowotworowe, leki (np. winkrystyna), splenektomia i inne zabiegi chirurgiczne,
przewlekły stan zapalny (reumatoidalne zapalenie stawów, zapalenie jelita
grubego) oraz niedokrwistość pokrwotoczna i z niedoboru żelaza [2,3].
W przypadku nadpłytkowości wtórnej nie obserwuje się objawów skazy
krwotocznej, natomiast czas krwawienia może być przedłużony [5].
Liczbę trombocytów we krwi obwodowej określa się metodami automatycznymi
(impedancja, metoda optyczna i fluorescencyjna z użyciem przeciwciał
monoklonalnych) lub manualnymi (rozmaz krwi i metody komorowe). W praktyce
manualne metody są stosowane bardzo rzadko, w celu weryfikacji ich niskiej
liczby lub obecności płytek nietypowych.
W przypadku oznaczenia płytek krwi poniżej 100 tys/µl zaleca się ponowne
oznaczenie oraz ocenę rozmazu krwi obwodowej w celu wykluczenia obecności
agregatów i płytek olbrzymich.
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą
pierwotny czop hemostatyczny w miejscu uszkodzenia śródbłonka
naczyniowego oraz uczestniczą w reakcjach krzepnięcia krwi.
Źródło: Flickr, licencja: CC BY 2.0
Oznaczenie płytek krwi jest czułym na błędy przedlaboratoryjne parametrem
morfologii krwi, dlatego w przypadku wątpliwości, należy rozpatrzyć możliwość
wystąpienia wyniku fałszywie zaniżonego lub zawyżonego.
Piśmiennictwo:
1. Dembińska-Kieć A., Naskalski W. J. Diagnostyka laboratoryjna z elementami
biochemii klinicznej. Wrocław, 2005; Elsevier Urban & Partner
2. Niemirowicz K., Car H., Wysocka J. et al. Zaburzenie liczby płytek krwi. Diagn
Lab, 2012; 48, 4:455-460
3. Wasiluk A., Jasińska E.A. Parametry morfologiczne i czynnościowe płytek krwi
noworodków i osób dorosłych. Diagn Lab, 2010; 46, 3:325-329
4. Wasiluk A. Trombocytopenia – istotny problem kliniczny w neonatologii.
Perinatologia, Neonatologia i Ginekologia, 2010; 3, 1:5-9
5. Raszeja-Spechł A. Badania układu hemostazy w praktyce laboratoryjnej.
Grudziądz, 2008; Bio-Ksel sp. z.o.o.
6. Mariańska B., Fabijańska-Mitek J., Windyga J. Badania w laboratoryjne w
hematologii. Podręcznik dla słuchaczy studiów medycznych. Warszawa, 2006;
Wydawnictwo Lekarskie PZWL.
Nie w pośpiechu lecz na czas –
wpływ stazy i pozycji ciała na
wybrane parametry
Zmienność poziomu składników we krwi i moczu zależy od wielu
czynników egzogennych. Wśród nich można wymienić pozycję ciała i
stosowanie opaski uciskowej podczas pobierania krwi.
Zmiana pozycji ciała przed pobraniem materiału biologicznego do badania nie jest
odległym zagadnieniem. Zdarza się, że pacjenci muszą oczekiwać na pobranie
materiału do badań bez możliwości pozostania w pozycji siedzącej, ze przychodzą
do laboratorium „w biegu”. Część pacjentów ze względu na podatność na
omdlenia prosi o pobranie krwi w pozycji leżącej, niektórzy w wyniku sytuacji
zdrowotnej przez dłuższy czas pozostają w omawianej pozycji. Przyjmuje się, że
standardowo pacjent pozostaje w pozycji siedzącej podczas pobierania krwi i 15
minut przed tą czynnością.
Udowodniono, że większość składników komórkowych i wielkocząsteczkowych
zmienia się we krwi o od 5 do 15% w pozycji wyprostowanej w stosunku do
pozycji leżącej. Po zmianie pozycji ciała z leżącej na wyprostowaną (stojącą)
obserwowano wzrost następujących parametrów:
– wzrost o mniej niż 10% – hemoglobina, leukocyty, wapń całkowity,
aminotransferaza asparaginianowa, fosfataza alkaliczna, IgM, IgG, IgA, tyroksyna,
albumina, białko całkowite, apolipoproteina B-100, cholesterol całkowity, LDL,
trójglicerydy
– wzrost o od 10% do 20% – hematokryt, erytrocyty, HDL, apolipoproteina A-I,
aldosteron
– wzrost o od 40 do 80% – adrenalina, renina, noradrenalina [4].
W przypadku długotrwałego unieruchomienia pacjenta w łóżku obserwuje się
wzrost wydalania wapnia z moczem (nawet do 240% po 6 tygodniach
unieruchomienia) [1]. Zmiany dotyczą także parametrów gazowych. Prężność
tlenu we krwi tętniczej w pozycji siedzącej jest wyższa niż w pozycji leżącej
średnio o 5 mmHg [2].
Wymienia się wiele mechanizmów odpowiedzialnych za zmienność zawartości
niektórych składników we krwi. W momencie zmiany pozycji ciała z leżącej na
wyprostowaną w niżej położonych częściach ciała wzrasta efektywne ciśnienie
filtracyjne, w następstwie czego dochodzi do przesunięcia wody z przestrzeni
wewnątrznaczyniowej do płynu śródmiąższowego i zmniejszenie objętości osocza
o około 12%. Składniki krwi o średnicy większej od 4 nm nie ulegają
przemieszczeniu razem z płynami. Poziom większości składników
drobnocząsteczkowych nie zmienia się przy zmianie pozycji ciała ze stojącej na
leżącą. Skład płynów ustrojowych w zależności od przyjmowanej pozycji ciała
zmienia się również ze względu na działanie mechanizmów regulatorowych takich
jak wydzielanie związków wazoaktywnych [4].
Rola opaski uciskowej
Opaska uciskowa stosowana jest podczas nakłucia aby ułatwić dostęp do żyły. Ze
względu na wpływ na pewne parametry krwi zaleca się, aby czas jej stosowania
nie przekraczał 1 minuty. Jednominutowy ucisk nie ma znaczącego wpływu na
oznaczenia parametrów w surowicy lub osoczu i nie zmienia otrzymywanych
wartości parametrów układu krzepnięcia.
Przedłużający się ucisk wywołany stosowaniem stazy wywiera wpływ na
parametry hematologiczne. Podczas badania 30 zdrowych ochotników
stwierdzono, że po zastosowaniu ucisku 60 mmHg przez czas do 3 minut doszło
do znaczącego obniżenia się całkowitej liczby leukocytów oraz subpopulacji
leukocytów oraz wzrostu poziomu erytrocytów, hemoglobiny i hematokrytu [3].
Podobne zmiany obserwuje się w przypadku innych parametrów. Po 6 minutach
od zaciśnięcia opaski uciskowej dochodzi do znamiennego wzrostu
aminotransferazy alaninowej i asparaginianowej, kinazy keratynowej, bilirubiny,
dehydrogenazy mleczanowej, albuminy, fosfatazy alkalicznej białka całkowitego,
cholesterolu, trójglicerydów, wapnia, kwasu moczowego oraz spadku poziomu
glukozy, fosforanów nieorganicznych, mocznika i kreatyniny. Wykazano ponadto
wpływ ucisku mięśni przedramienia na wzrost stężenia potasu we krwi. Inne
badania wskazują na znaczący wpływ ucisku stazy trwającego do 2 minut na
obniżenie poziomu pirogronianu, średnio o 18%, bez istotnych zmian na stężenie
mleczanów (wzrost średnio o 2,2%) [4]. W przypadku oznaczeń fibrynogenu
zmiany poziomu mierzonego parametru po 10 minutach ucisku stazy wynosiły
16% u zdrowych pacjentów i 26% u pacjentów z hiperlipidemią [5]. Obserwowane
wykazują różnice pomiędzy różnymi badaniami, niemniej jednak wszystkie
potwierdzają istotny statystycznie wzrost stężenia fibrynogenu po 1 minucie
ucisku [6].
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą
pierwotny czop hemostatyczny w miejscu uszkodzenia śródbłonka
naczyniowego oraz uczestniczą w reakcjach krzepnięcia krwi.
Źródło: Flickr, licencja: CC BY 2.0
Właściwe przygotowanie się do badania laboratoryjnego to nie tylko pozostawanie
na czczo i przybycie do punktu pobrań w godzinach porannych, ale także
odpowiedni czas i sposób odpoczynku przed pobraniem materiału biologicznego.
Czasami pobranie krwi może stwarzać trudności, zwłaszcza przy złej dostępności
żył lub innych problemach z pobraniem krwi, niemniej jednak należy pamiętać, iż
zbyt długie zaciśnięcie opaski uciskowej na przedramieniu pacjenta może w
istotny sposób zmieniać niektóre oznaczane parametry.
mgr Agnieszka Helis, diagnosta laboratoryjny
Zakresy referencyjne u dzieci
Wiele parametrów oznaczanych w laboratorium różni się w zależności od
czynników takich jak wiek i płeć. Wyznaczenie wartości referencyjnych
leży w gestii każdego laboratorium. Określenie wartości prawidłowych dla
poszczególnych badań jest szczególnie trudne u dzieci. Do przyczyn
takiego stanu rzeczy należą problemy z pozyskaniem odpowiedniej ilości
materiału badanego u noworodków i małych dzieci oraz to, że zakresy
mogą się gwałtownie zmieniać w miarę dorastania dziecka.
The Pediatric Group of the Canadian Society of Clinical Chemists ustanowiła
grupę CALIPER, która zajęła się ustaleniem pediatrycznych zakresów
referencyjnych. Jeden z projektów grupy prowadzony we współpracy z Abbott
Diagnostics miał na celu wyznaczenie wartości referencyjnych dla 18 parametrów
biochemicznych wykonywanych na jednym z analizatorów producenta — Abbott’s
ARCHITECT c8000. W badaniu wzięło udział 1459 pacjentów w pięciu grupach
wiekowych od noworodków po nastolatków. Wśród ocenianych parametrów
można wymienić bilirubinę całkowitą i bezpośrednią, magnez, dwutlenek węgla,
fosfor, LDL, HDL, cholesterol całkowity, trójglicerydy, Apo B, Apo A1, wapń,
białko całkowite, albuminę, ALT, kreatyninę, azot mocznika oraz żelazo. Uzyskane
dane przeanalizowano zgodnie z CLSI C28 Guideline, How to Define and
Determine Reference Intervals in the Clinical Laboratory [1].
Tabela 1. Wartości referencyjne wybranych parametrów laboratoryjnych z
podziałem na grupy wiekowe [1].
Część parametrów biochemicznych wykazuje niewielkie wahania zależne od
wieku.
W przypadku bilirubiny całkowitej wartości górnej granicy parametru pomiędzy
płciami w grupie wiekowej 15 – 20 lat oraz poniżej 1 roku życia różniły się nawet o
45%. Duże różnice wartości zaobserwowano także w przypadku kreatyniny.
Wahały się one w grupie dzieci poniżej 1 roku życia w porównaniu do grupy
wiekowej 15 – 20 roku życia o 54% w dolnej granicy i 64% w górnej granicy
uzyskanych wartości. Nieco mniejsze różnice wykazano w przypadku białka
całkowitego uzyskując wartości w grupie dzieci 6 – 10 roku życia o 20 % wyższe w
dolnej granicy i 26% wyższe w górnej granicy uzyskanych wartości w porównaniu
do grupy wiekowej poniżej 1 roku życia. Te przykłady doskonale ilustrują istotę
odpowiedniego doboru wartości referencyjnych zgodnie z płcią i wiekiem
pacjenta.
Podobnemu zagadnieniu przyjrzeli się bliżej australijscy naukowcy. Populację
około 1500 dzieci w wieku od 1 dnia życia do 18 roku życia przebadano w
kierunku poziomu TSH, fT3 oraz fT4. Wykazano najwyższe stężenie hormonów
tarczycy w pierwszym miesiącu życia. Po tym okresie wszystkie badane parametry
ulegają stopniowemu obniżeniu, za wyjątkiem fT3 pacjentów płci męskiej w wieku
między 1 a 5 rokiem życia oraz płci żeńskiej w wieku 6 do 10 lat. W badaniu
zaobserwowano istotnie statystycznie różnice poziomu zależne od wieku tylko w
przypadku fT3. Zakresy referencyjne stosowane u osób dorosłych nie powinny być
traktowane jak zakresy uniwersalne. Podczas dorastania stężenia hormonów
tarczycy we krwi ulegają ciągłym wahaniom, niezależnym od płci (wyjątek fT3),
dlatego też tak ważnym jest ustalenie odpowiednich zakresów referencyjnych
zależnych od wieku pacjenta. Należy przy tym jednak pamiętać o uwzględnieniu
stosowanej metody oznaczeń, użytego analizatora, badanej populacji oraz
warunków środowiskowych takich jak poziom selenu i jodu [2].
Amerykański zespół naukowców widząc wagę problemu braku wartości
referencyjnych niektórych parametrów krwi, podjął się trudu określenia
przedziałów referencyjnych u pacjentów pediatrycznych dla folikulotropiny (FSH),
lutropiny (LH), estradiolu (E2), trójjodotyroniny (T3), FT3, kortyzolu oraz
hormonu wzrostu (GH). Badano grupę 800 pacjentów w wieku od noworodków do
dziewiętnastolatków. Pomiary przeprowadzono na analizatorze DPC IMMULITE
1000. Poziom FSH i LH gwałtownie wzrastał w okresie dojrzewania płciowego
kobiet. Oznaczenie stężenia FSH we krwi wykazało różnice w zależności od wieku
i płci, osiągając u płci żeńskiej górny zakres rzędu od 4,3 IU/l (od 6 do 10 r.ż.) do
12,0 IU/l (od 11 do 14 r.ż.). W przypadku LH górny zakres wynosił u płci żeńskiej
od 3,3 IU/l (poniżej 6 r.ż.) do 16,4 IU/l (od 15 do18 r.ż.). U dojrzewających
chłopców poziom LH utrzymywał się na stałym poziomie. Tak jak w przypadku
gonadotropin stężenie estradiolu uzyskuje najwyższe wartości w okresie
dojrzewania, będąc znacznie wyższe u płci żeńskiej. Podobnie jak w innych
badaniach hormonów tarczycowych, zaobserwowano spadek poziomu T3 wraz z
wiekiem:
Tabela 2. Zmiany poziomu T3 wraz z wiekiem [3]
Wartości kortyzolu i hormonu wzrostu nie wykazywały natomiast różnic między
płciami. Średnie stężenie kortyzolu i E2 jest zazwyczaj wyższe do 2 tygodnia od
urodzenia. GH posiadał szczególnie szerokie zakresy referencyjne w grupie
pacjentów od 7 do 11 r.ż ( 0,1 – 16,4 mg/dl) [3].
Interesujące podsumowanie pediatrycznych zakresów referencyjnych dla badań
endokrynologicznych udostępnia LabCorp
Przedziały uwzględniają wiek i płeć pacjenta, a także wpływ czynników
środowiskowych. Wśród omówionych parametrów znajduje się aldosteron,
androstendion, testosteron, katecholaminy, kortyzol, peptyd C, estrogeny,
gastryna, insulina, prolaktyna, progesteron, osteokalcyna, renina, serotonina,
hormony tarczycy, witamina D i wiele innych [4].
Ustalenie pediatrycznych zakresów referencyjnych nie jest zadaniem łatwym.
Badając grupę 1765 dzieci w wieku od 6 miesięcy do 17 lat zaobserwowano
znaczne różnice w wartościach oznaczeń aldolazy (grupy 6-8 r.ż, 12-14 r.ż. oraz
15-17 r.ż.), a także ceruloplazminy i kwasu moczowego (grupy 12-14 r.ż i 15-17
r.ż.). Kinaza kreatynowa wykazywała istotnie statystycznie różnice zależne od płci.
Jedynym analizowanym związkiem, który w żadnej grupie wiekowej nie wykazał
istotnych zmian wartości zależnych płci była amylaza. Oznaczenia wykonano na
analizatorze Roche Modular P [5].
Także oznaczenia koagulologiczne wymagają regulacji norm w zależności od
uwarunkowań wiekowych. W tym celu w jednym z badań wybrano grupę 902
zdrowych dzieci w wieku 7 do 17 r.ż. u których oznaczono czas protrombinowy
(PT), czas częściowej tromboplastyny po aktywacji (APTT), czynnik VIII, IX, i X
Ioraz czynnik von Willebrand’a (vWF) za pomocą analizatora koagulologicznego
STA-R (Diagnostica Stago) oraz kofaktor rystocetyny (RCF) przy użyciu BCS
(Dade Behring) . Średnia wartość PT u dzieci była o 1 sekundę dłuższa niż u
dorosłych, wynosząc 14 sekund. Nie wykazano istotnych statystycznie różnic w
APTT pomiędzy grupą dzieci i dorosłych osób. Średnie wartości pediatryczne dla
czynnika VII, RCF oraz vWF były znacząco wyższe w porównaniu do dorosłych
[6].
Ustalenie zakresów referencyjnych u dzieci wciąż nastręcza problemów.
Niektóre parametry nie zostały jeszcze dostatecznie zbadane na
reprezentatywnej grupie pediatrycznej i określenie wartości prawidłowych
nie jest zbyt precyzyjne. Niemniej jednak powyższe przykłady pomagają
uzmysłowić istotność różnic pomiędzy wartościami referencyjnymi u dzieci
i osób dorosłych. Przed podjęciem decyzji klinicznej powinniśmy się
upewnić czy wartości referencyjne są odpowiednie dla grupy wiekowej
pacjenta.
***
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą
pierwotny czop hemostatyczny w miejscu uszkodzenia śródbłonka
naczyniowego oraz uczestniczą w reakcjach krzepnięcia krwi.
Źródło: Flickr, licencja: CC BY 2.0
Mayo Medical Laboratories udostępniają na swojej stronie internetowej istotne
dane, dotyczące zakresów referencyjnych, zawarte w Rochester 2014 Interpretive
Handbook. Zawiera on opis wielu badań laboratoryjnych wraz z kliniczną
informacją dotyczącą testu, zastosowaniem oznaczenia, interpretacją, zakresami
referencyjnymi wg wieku i płci oraz źródłem uzyskanych danych. Zachęcamy do
skorzystania z tej pomocy interpretacyjnej [7].
mgr Agnieszka Helis, diagnosta laboratoryjny
Piśmiennictwo:
1. Chan MK., Seiden-Long I., Aytekin M. et al. Canadian Laboratory Initiative on
Pediatric Reference Interval Database (CALIPER): pediatric reference intervals
for an integrated clinical chemistry and immunoassay analyzer, Abbott
ARCHITECT ci8200. Clin Biochem, 2009; 42, 9: 885-891.
2. Kapelari K., Kirchlechner C., Högler W. et al. Pediatric reference intervals for
thyroid hormone levels from birth to adulthood: a retrospective study. BMC
Endocrine Disorders, 2008, 8: 15.
3. Soldina OP.,Hoffmanc EG.,Waring MA. et al. Pediatric reference intervals for
FSH, LH, estradiol, T3, free T3, cortisol, and growth hormone on the DPC
IMMULITE 1000. Clinica Chimica Acta, 2005; 355: 205 – 210.
4. LabCorp. Endocrinology expected values& S.I. Unit Conversion Tables.
Pediatric Reference Ranges Endocrinology. LCA, 2009.
5. Clifford SM., Bunker AM., Jacobsen JR. et al. Age and gender specific pediatric
reference intervals for aldolase, amylase, ceruloplasmin, creatine kinase,
pancreatic amylase, prealbumin, and uric acid.Clin Chim Acta, 2011; 412: 9-10.
6. Flanders MM.,Crist RA., Roberts WL. et al. Pediatric Reference Intervals for
Seven Common Coagulation Assays. Clinical Chemistry, 2005; 51,9: 1738-1742.
7. Mayo Clinic. Rochester Interpretive Test Catalog, 2014.
Co może niepokoić w badaniu
ogólnym moczu – parametry
fizyczne i biochemiczne
Badanie ogólne moczu (BOM) jest jednym z najczęściej i najchętniej
zlecanych badań. Jest to badanie niedrogie, stosunkowo proste i szybkie w
wykonaniu. Wynik BOM może stać się wskazówką w diagnostyce szeregu
chorób i dać informację o ogólnym stanie zdrowia pacjenta. Stosuje się je
w rutynowych badaniach oraz doraźnie przy niektórych dolegliwościach.
W standardowych warunkach, po odpowiednim przygotowaniu się do badania
(patrz świadomy pacjent=wiarygodny wynik..czyli o pobieraniu próbki moczu),
dostarczamy próbkę moczu do laboratorium, gdzie rozpoczyna się proces
prowadzący do otrzymania wyniku badania.
Jakie są składowe wyniku BOM?
Należy do nich barwa, przejrzystość, ciężar właściwy, pH, urobilinogen,
bilirubina, ketony, białko, glukoza i azotyny. Ponadto w osadzie moczu określa się
zawartość elementów morfotycznych takich jak leukocyty, krwinki czerwone, a
także obecność rożnego rodzaju nabłonków, kryształów, wałeczków oraz bakterii.
Otrzymane wyniki mogą nieco różnić się formatem pomiędzy poszczególnymi
laboratoriami.
Barwa
Barwa moczu zależy od jego zagęszczenia, pH oraz ilości urochromu.
Fizjologicznie mocz może wykazywać barwę od słomkowej po ciemnożółtą. Mocz
osoób odwodnionych uzyskuje barwę intensywnie pomarańczowej z powodu
zagęszczenia, natomiast nadmierne nawodnienie skutkuje zmianą barwy moczu
na jasnożółtą [1]. Należy także pamiętać, że wiele substancji wchodzących w skład
diety oraz leków może powodować zmianę barwy moczu (patrz Farmakoterapia a
badanie ogólne moczu. Interferencje).
Przejrzystość
Świeżo oddany mocz zdrowej osoby jest przejrzysty lub lekko opalizujący. Często
obserwuje się mętny wygląd moczu w zakażeniach bakteryjnych oraz w przypadku
obecności dużej liczby nabłonków. Wśród czynników zmętnienia wymienia się
obecność spermy, krwi, leukocytów, bakterii, drożdży, kryształów, lipidów.
Czasami zbyt długie przechowywanie moczu w temperaturze pokojowej sprzyja
namnożeniu się bakterii, dając zmętnienie. Również długotrwałe chłodzenie
moczu może prowadzić do wzrostu mętności poprzez wytrącenie się moczanów
czy fosforanów [2].
Ciężar właściwy
Fizjologicznie ciężar właściwy moczu waha się w granicach od 1,016 do 1,022
kg/L, zależąc głównie od ilości wydalonych substancji (mocznik, sód, potas) oraz
od ilości wydalonej wody. Wysoki ciężar obserwuje się w przypadku dużego
zagęszczenia moczu. Taka sytuacja może mieć miejsce przy braku podaży płynów,
utracie płynów przez uporczywe wymioty, biegunki, nadmierne pocenie się, a
także w wyniku obecności leków, białka czy glukozy. Stan taki obserwuje się
również u chorych z niewydolnością nadnerczy, chorobami wątroby czy z
zastoinową niewydolnością serca. Bardzo niski ciężar moczu obserwuje się przy
dużym rozcieńczeniu moczu – przykładowo przy nadmiernej podaży płynów, w
przypadku moczówki prostej, w chorobie nerek (u pacjentów z kłębuszkowym
zapaleniem nerek, odmiedniczkowym zapalenie nerek i innych) lub użyciu
diuretyków [3].
Odczyn
Prawidłowo odczyn moczu jest lekko kwaśny, ale może wahać się aż do lekko
zasadowego. Zmiany zależą od ilości wydalanych z moczem wolnych jonów
wodorowych w wyniku usuwania przez nerki kwasów nieorganicznych oraz
organicznych. Można zatem rzec, że pH zależy od diety. Przykładowo osoby
spożywające dużo mięsa lub głodzone wykazują bardziej kwaśne pH, natomiast
wegetarianie bardziej zasadowe. Odczyn bardziej kwaśny może wynikać z kwasicy
(oprócz cewkowej), hipokaliemii, odwodnienia, leków, odmy płucnej,
niekontrolowanej cukrzycy, spożycia dużych ilości alkoholu. Odczyn bardziej
zasadowy obserwować można w przypadku zasadowicy (bez współistniejącej
hipokaliemii), kwasicach cewkowych typu dystalnego, w hiperkaliemii oraz
nadczynności przytarczyc [4]. Zasadowość moczu może wynikać także z
długotrwałego przechowywania materiału w temperaturze pokojowej czy dużej
liczby bakterii. Nieprawidłowe pH może być sygnałem odnośnie występowania
kamieni nerkowych, infekcji układu moczowego, przewlekłej choroby nerek i
innych schorzeń [1, 5].
Urobilinogen
Fizjologicznie niewielka ilość urobilinogenu znajduje się prawidłowo w moczu.
Występuje w moczu w ilości od 0.05 – 4.0 mg/dobę. Zwiększenie wydalania
urobilinogenu może wynikać z zapalenia wątroby, także toksycznego, marskości
wątroby, bloku w odpływie żółci z wątroby i pęcherzyka żółciowego oraz żółtaczce
hemolitycznej [4, 5].
Bilirubina
Fizjologicznie nie obserwuje się bilirubiny w moczu. Bilirubina może pojawić się w
moczu w przypadku wzrostu jej poziomu we krwi w wirusowym zapaleniu
wątroby, żółtaczce mechanicznej czy marskości wątroby [5].
Ciała ketonowe
W osób zdrowych nie obserwuje się ciał ketonowych w moczu (aceton, kwas
acetooctowy i kwas hydroksymasłowy). Pojawiają się one w wyniku zaburzeń
gospodarki węglowodanowej i lipidowej. u osób głodzonych, w gorączce,
niewyrównanej cukrzycy, po nadużyciu alkoholu lub stosowaniu diety bogato
tłuszczowej [4, 5].
Białko
Wg National Kidney Foundation występowanie białka w moczu nie jest stanem
prawidłowym i powinno być znakiem ostrzegawczym dla lekarza. Pojawienie się
białka w badaniu ogólnym moczu (typowe badaniami diagnostycznymi nie
wykrywają fizjologicznych ilości białka lub znajduje się ono na granicy czułości
stosowanych testów) może oznaczać, że został przekroczony próg nerkowy dla
białka. Utrzymywanie się obecności białka w moczu sugeruje uszkodzenie
kłębuszków nerkowych. Białkomocz czyli wydalanie białka nawet do
kilkudziesięciu gramów na dobę dotyczy zwykle chorób nerek i dróg moczowych.
Pojawienie się białka w moczu może mieć podłoże przednerkowe (obecność we
krwi białek niskocząsteczkowych takich jak hemoglobina, mioglobina, białko
Bence-Jonesa, gorączka, zastoinowa niewydolność krążenia), nerkowe (
uszkodzenie kłębuszków nerkowych, upośledzenie resorpcji białka w cewkach,
czynnościowe takie jak białkomocz ortostatyczny oraz powysiłkowy) lub
pozanerkowe (zapalenia dróg moczowych, dodatek wydzieliny z pochwy, choroby
prostaty). Istnieje także tak zwany białkomocz fizjologiczny obserwowany u kobiet
w ciąży, po dużym wysiłku fizycznym oraz u osób z gorączką [1, 4].
Wyniki uzyskane za pomocą pasków diagnostycznych mogą być oznaczone jako
negative, nieobecne, trace, ślad lub pólilościowo za pomocą plusów:
1+,2+,3+,4+.
Jeżeli pojawia się anormalnie wysoki poziom glukozy w moczu lekarz zazwyczaj
zleca powtórzenie badania. Powtórzenie się wyniku skłania ku wizycie u
nefrologa.
Glukoza
Fizjologicznie nie obserwuje się występowania glukozy w moczu. Pojawienie się
glukozy w moczu jest najczęściej związane z podwyższeniem jego poziomu we
krwi, zwykle z cukrzycą czy w glukozurii nerkowej, gdzie w wyniku
nieprawidłowej pracy cewek nerkowych, mimo prawidłowego stężeniu glukozy we
krwi, jest ona wydalana przez nerki [2]. Należy również pamiętać, że brak glukozy
we krwi nie oznacza braku problemu z cukrzycą. Standardowo stosowane testy
paskowe nie wykrywają galaktozy i fruktozy. Glukoza w moczu kobiety ciężarnej
może pojawić się na skutek przekroczenia zdolności reabsorpcyjnej cewek
nerkowych. Upośledzona reabsorpcja glukozy z moczu może ponadto wynikać z
uszkodzenia wątroby, mózgu, zatrucia specyficznymi substancjami, schorzeniami
nadnerczy oraz uszkodzenia kanalików nerkowych [4].
Ważnym elementem badania ogólnego moczu jest także określenie elementów
obecnych w osadzie moczu. Temat ten zostanie poruszony w kolejnym artykule.
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą
pierwotny czop hemostatyczny w miejscu uszkodzenia śródbłonka
naczyniowego oraz uczestniczą w reakcjach krzepnięcia krwi.
Źródło: Flickr, licencja: CC BY 2.0
Badanie ogólne moczu daje wiele informacji o ogólnym stanie pacjenta.
Jest to stosunkowo szybki sposób na ukierunkowanie dalszej diagnostyki.
mgr Agnieszka Helis, diagnosta laboratoryjny
Niejednoznaczność domowych
testów ciążowych z moczu
Wczesne wykrycie ciąży jest zjawiskiem bardzo pożądanym. Ciąża często wiąże się ze zmianą
pewnych nawyków, na przykład zaprzestaniem palenia, spożywania alkoholu, czy też
przedsięwzięciem zwiększonej ostrożności w stosunku do promieni rentgenowskich. Jeżeli testy
są czułe przynosi to wiele korzyści dla użytkownika, natomiast testy z wysokim odsetkiem
wyników fałszywych są tylko przyczyną niepotrzebnych stresów.
Kasetkowe testy ciążowe domowego użytku wprowadzono w latach 70-tych XX
wieku. Wszystkie te testy wykrywały określony poziom gonadotropiny
kosmówkowej w moczu jako wskaźnik zajścia w ciążę. Wartość predykcyjną
wczesnych testów ciążowych określano jako 98% dla testów pozytywnych oraz
80% dla testów negatywnych. Wyniki fałszywie negatywne wynikały z ekspozycji
na światło słoneczne czy też pojawienia się osadu z mydła [1].
Obecnie około 98% testów ciążowych daje wynik dodatni w czasie przypadającym
na dzień miesiączki lub 7 dni po zagnieżdżeniu zarodka.
Czułość dostępnych na rynku szybkich testów ciążowych wykrywających hCG w
moczu wynosi zwykle 25 mIU/l. Jest to wystarczające, bowiem takie stężenie hCG
w moczu przemawia za obecnością żywego zarodka.
Przyczyny fałszywie pozytywnych wyników:
– po porodzie;
– po poronieniu;
– okres okołomenopauzalny;
– po usunięciu jajnika;
– schorzenia nerek lub nadczynność tarczycy;
– przyjmowanie niektórych leków (np. hormonalnych, przeciwdepresyjnych);
– pacjenci, którzy mieli kontakt z przeciwciałami mysimi np. przyjmując preparaty
przeciwciał monoklonalnych (interferencja ludzkich porzeciwciał skierowanych
przeciwko przeciwciałom mysim, HAMA);
– choroby związane z wydzielaniem hCG do moczu (np. rak szyjki macicy czy jelita
grubego);
– białkomocz;
– ropień jajowodowo-jajnikowy;
– duża liczba leukocytów w moczu (>500 komórek/µL);
– hematuria;
– choroby trofoblastyczne [1, 2, 4, 5, 6].
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą
pierwotny czop hemostatyczny w miejscu uszkodzenia śródbłonka
naczyniowego oraz uczestniczą w reakcjach krzepnięcia krwi.
Źródło: Flickr, licencja: CC BY 2.0
Przyczyny fałszywie negatywnych wyników:
– niewłaściwy czas odczytu testu;
– niewłaściwe wykonanie testu np. nieodpowiednie nasączenie paska;
– zbyt wczesna ciąża;
– ciąża pozamaciczna;
– po spożyciu alkoholu;
– efekt prozonowy (zwykle nie obserwuje się go do stężenia hCG równego 600
IU/ml);
– niski ciężar właściwy moczu (rozcieńczenie moczu) [2, 3].
Pojedynczy pozytywny wynik testu ciążowego z moczu nie przesądza o
ciąży. Niemniej jednak podejrzenie ciąży powinno zmobilizować kobietę do
wizyty u ginekologa i potwierdzenia bądź wykluczenia rozpoznania przez
specjalistę.
mgr Agnieszka Helis, diagnosta laboratoryjny
Piśmiennictwo:
1. Valanis BG., Perlman CS. Home pregnancy testing kits: prevalence of use, false
negative rates, and compliance with instructions.Home pregnancy testing kits:
prevalence of use, false-negative rates, and compliance with instructions. Am J
Public Health, 1982; 72, 9: 1034–1036.
2. Griffey RT. et al. „Hook-like effect” causes false-negative point-of-care urine
pregnancy testing in emergency patients. J Emerg Med, 2013; 44, 1: 155-160.
3. Ikomi A. et al. The effect of physiological urine dilution on pregnancy test
results in complicated early pregnancies. Br J Obstet Gynaecol. 1998; 105, 4:
462-465.
4. Hsiu-Fen Jao MS. et al. False-positive urine pregnancy test due to leukocyte
interference. Ann Lab Med, 2012; 32, 2: 167–168.
5. Fahy BG. et al. Pregnancy tests with end-stage renal disease. J Clin
Anesth, 2008; 20, 8: 609-613.
6. Tageja N. et al. Positive pregnancy tests in a postmenopausal woman due to
beta-human chorionic gonadotropin production by multiple myeloma. Am J Med
Sci, 2010; 339, 2: 182-184.
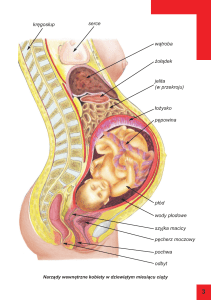
Diagnostyka prenatalna płodowego
DNA z krwi matki – lepsza niż
metody tradycyjne?
W ciągu ostatnich lat pojawiło się wiele doniesień dotyczących skutecznej
diagnostyki wad genetycznych płodu bez konieczności wykonywania
grożących poronieniem zabiegów inwazyjnych. Na czym polega ta
diagnostyka i czy faktycznie dorównuje skutecznością metodom uznanym
za złoty standard?
Złoty standard
Obecnie diagnostyka prenatalna obejmuje kilka badań przesiewowych i
potwierdzających rozpoznanie wad wrodzonych.
Pierwszym jest nieinwazyjne badanie USG przezierności karkowej u płodu w
końcówce pierwszego trymestru ciąży (zwykle między 11-tym a 14-tym
tygodniem). Jest to badanie przesiewowe, pozwalające wyłowić większość
przypadków zespołu Downa, Patau i niektóre inne nieprawidłowości,
spowodowanych (głównie) aberracjami chromosomowymi. Niestety test nie
zawsze pozwala na tym etapie wskazać przypadki nieprawidłowości, badanie
przezierności karkowej przy niskim ryzyku aberracji może też dawać wyniki
fałszywie dodatnie, powodując u ciężarnej spory stres. USG wykonane później, w
drugim i trzecim trymestrze ciąży, pozwala na wykrycie innych typów dysmorfii i
wielu różnych wad płodu, które mogą być spowodowane zaburzeniami struktury
genomu, ale także innymi, o charakterze niedziedzicznym.
Kolejnym badaniem przesiewowym jest zestaw testów laboratoryjnych, do których
zaliczają się poziom wolnego beta-hCG, białka PAPP-A (razem nazywane testem
podwójnym), oraz dodatkowo stężenie estradiolu i alfa-fetoproteiny. Cechuje je
relatywnie niska czułość i swoistość, ocena tych markerów pozwala jednak
znacząco zwiększyć moc badań ultrasonograficznych.
Resztę metod klasycznych można zaliczyć do diagnostyki inwazyjnej, związanej z
nakłuciem pęcherza płodowego (biopsja trofoblastu), pępowiny lub pobraniem
fragmentu tkanki samego płodu. W pobranym materiale jest następnie
wykonywane badanie cytogenetyczne i/lub molekularne (w przypadku nakłucia
pępowiny możliwe są także badania biochemiczne i hematologiczne krwi płodu)
[1].
Idzie nowe
Jak łatwo zauważyć, obecne metody diagnostyki prenatalnej są dalekie od ideału –
metody nieinwazyjne są stosunkowo mało dokładne, zaś metody inwazyjne
znacząco zwiększają ryzyko poronienia, mogą również być zawodne w diagnostyce
wad genetycznych niewidocznych w klasycznym badaniu kariotypu (np. zespoły
mikrodelecyjne).
Koncepcja detekcji pewnych wad rozwojowych u dziecka we krwi krążącej matki
nie jest innowacyjna – już w 1997 roku udowodniono, że pewne ilości wolnego
płodowego DNA (cfDNA) krążą w krwiobiegu ciężarnej, jeszcze wcześniej (w 1969
roku!) opisano fenomen przedostawania się nuklearów krwi płodowej do
krwiobiegu matki. Początkowo wykorzystywano ten fakt do szybkiej identyfikacji
płci płodu, możliwa była także diagnostyka pojedynczych aberracji
chromosomowych metodą nested-PCR. Stąd już tylko jeden krok do analizy całego
genomu płodu z krwi krążącej pobranej od ciężarnej. W przeszłości jedyny
problem polegał na braku dostępnych technologii analizy całogenomowej, które
pojawiły się kilka lat temu [2].
Obecnie, przy użyciu metod głębokiego sekwencjonowania możliwe stało się
odczytanie większości genomu dziecka już na etapie 8-tygodniowego zarodka (!)
[3].
Obecna diagnostyka vs sekwencjonowanie cfDNA
W najnowszej pracy, która ukazała się w NEJM w lutym 2014 r. autorzy wykazali
przewagę analizy cfDNA nad metodami tradycyjnymi, głównie w zakresie ilości
wyników fałszywie pozytywnych. Sekwencjonowanie pozwoliło także na
znalezienie 100% przypadków analizowanych zespołów Patau i Downa. Próbki
były pobierane w czasie rutynowo wykonywanych badań przesiewowych
(biochemicznych +USG) u prawie 2000 kobiet. Nie budzi wątpliwości także fakt,
że badanie cfDNA może być nie tylko konkurencyjne w stosunku do metod
nieinwazyjnych, ale przede wszystkim pozwoli na zastąpienie części metod
inwazyjnych. Co więcej, dzięki analizie całego genomu wykryjemy nie tylko
aberracje chromosomowe, ale przede wszystkim cały szereg chorób
jednogenowych, takich jak mukowiscydoza, wrodzone defekty enzymatyczne,
dyskinezja rzęsek i cała rzesza innych chorób rzadkich [4, 5].
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą
pierwotny czop hemostatyczny w miejscu uszkodzenia śródbłonka
naczyniowego oraz uczestniczą w reakcjach krzepnięcia krwi.
Źródło: Flickr, licencja: CC BY 2.0
Teraźniejszość czy niedaleka przyszłość?
Obecnie istnieje kilka firm oferujących badanie cfDNA, jednakże nie są to niestety
badania całogenomowe, a jedynie screening kilku anomalii kariotypu (gł. trisomie
18 i 21). Na obecną chwilę są to badania o małej dostępności i wysokiej cenie (od
1000 do nawet 3000 dolarów). Jednakże błyskawiczny rozwój platform głębokiego
sekwencjonowania pozwala mieć nadzieję, że w niedalekiej przyszłości w kropli
matczynej krwi da się wykryć wiele anomalii płodu, także tych
jednonukleotydowych. Pozostaje nam więc cierpliwie czekać na kolejne
doniesienia o wprowadzanych na rynek światowy i europejski lepszych testach
cfDNA [1, 3].
1. Science-Based Medicine, Baby’s DNA in Mom’s Blood: Noninvasive Prenatal
Testing , Articles, 2013.
2. Lo YMD., Corbetta N., Chamberlain PF. et al. Presence of fetal DNA in
maternal plasma and serum. Lancet, 1997.
3. Kitzman JO., Snyder MW., Ventura M. et al. Noninvasive whole-genome
sequencing of a human fetus. Sci Transl Med, 2012.
4. Bianchi DW., Parker RL., Wentworth J. et al. DNA Sequencing versus Standard
Prenatal Aneuploidy Screening. N Engl J Med, 2014.
5. Illumina Investor Relations, Illumina’s Non-Invasive verifi® Prenatal Test
Using cfDNA Significantly Reduces False Positive Rate of Fetal Aneuploidy
Detection Compared to Current Standard Pregnancy Screening Practices
Informacja prasowa, Illumina, Inc., 2014.
Choroby wątroby związane z ciążą
– zagrożenie dla matki i dziecka
Stan przedrzucawkowy, rzucawka, ostre stłuszczenie wątroby oraz zespół
HELLP to rzadkie schorzenia wątroby ciężarnych, których rozpoznanie
wiąże się z pogorszeniem rokowania dla matki i dziecka. Pojawiają się one
zazwyczaj w trzecim trymestrze ciąży i z uwagi na możliwość wystąpienia w
ich przebiegu licznych powikłań, są one oznaką ciąży wysokiego ryzyka.
Stan przedrzucawkowy i rzucawka występuje w trzecim trymestrze ciąży i
dotyczy 5-10% ciężarnych. Charakteryzuje się obecnością nadciśnienia tętniczego,
obrzęków i białkomoczu. Objawia się zaburzeniami neurologicznymi, takimi jak
ból głowy, zaburzenia ostrości widzenia, a także bólem w prawym nadbrzuszu lub
podżebrzu. Objawy kliniczne pojawiają się zwykle w 20. tygodniu ciąży.
Czynnikami ryzyka wystąpienia stanu przedrzucawkowego są wiek matki poniżej
16 lub powyżej 45 roku życia, przewlekłe nadciśnienie tętnicze, choroby nerek,
otyłość, ciąża mnoga oraz występowanie stanu przedrzucawkowego w poprzedniej
ciąży lub w rodzinie. Istotnym czynnikiem ryzyka ciężkiej postaci stanu
przedrzucawkowego jest wrodzona trombofilia związana z niedoborem czynnika V
układu krzepnięcia [3,4].
Rzucawka występuje u około 1% kobiet ze stanem przedrzucawkowym.
Towarzyszą jej drgawki toniczno-kloniczne, połączone z utratą przytomności.
Najpoważniejszymi powikłaniami stanu przedrzucawkowego i rzucawki u
ciężarnej jest krwotok mózgowy, ostra niewydolność oddechowa i powikłania
wątrobowe, w postaci dużych zawałów wątroby i zagrażających pęknięciem
krwiaków.
Zajęcie wątroby zwykle pogarsza rokowania, zwiększając śmiertelność
pacjentek.
Dla dziecka ryzyko obejmuje niską masę urodzeniową, wcześniactwo oraz w
rzadkich przypadkach obumarcie płodu. Średnio 2-12% przypadków ciężkich
stanów przedrzucawkowych, przebiegających z zajęciem wątroby wywołuje zespół
HELLP [3,4,5].
Zespół HELLP (ang. hemolysis, elevated liver tests, low platelets) jest to
niedokrwistość hemolityczna naczyń włosowatych związana z uszkodzeniem
śródbłonka, odkładaniem depozytów fibryny w naczyniach krwionośnych oraz
aktywacją i zużyciem płytek krwi. Zespół HELLP występuje w około 0,1-1%
wszystkich ciąż a także u od 10-20% ciężarnych, u których rozpoznano stan
przedrzucawkowy. Choroba najczęściej dotyczy młodych kobiet [3,5].
Objawy HELLP występują głównie między 27. a 36. tygodniem ciąży, rozwijając
się bezpośrednio po porodzie u około 25% kobiet. Objawy obejmują silny ból w
prawym nadbrzuszu, nudności, wymioty, ból głowy oraz charakterystyczne dla
stanu przedrzucawkowego obrzęki, nadciśnienie i białkomocz. Laboratoryjne
rozpoznanie zespołu HELLP obejmuje wskaźniki hemolizy (obniżenie poziomu
hemoglobiny, obecność retikulocytów i schistocytów w rozmazie krwi obwodowej,
spadek stężenia haptoglobiny, wzrost stężenia bilirubiny i LDH>600 U/L),
znaczny wzrost aktywności aminotransferaz oraz trombocytopenię.
Obniżenie liczby płytek krwi <100 G/L jest pierwszym objawem zespołu HELLP
i wynosi średnio 35-50% na dobę.
Zespół HELLP wymaga różnicowania z zespołem hemolityczno-mocznicowym,
ostrym stłuszczeniem wątroby, samoistną plamicą małopłytkową oraz zespołem
antyfosfolipidowym [3,5,6].
Wystąpienie zespołu HELLP wiąże się z pogorszeniem rokowania dla matki i
płodu, a pełnoobjawowy przebieg jest stanem zagrożenia życia. U większości
kobiet po porodzie następuje szybka normalizacja liczby płytek. Małopłytkowość
lub hemoliza trwające powyżej 72 godzin mogą zwiastować wystąpienie powikłań.
W przebiegu HELLP dochodzi do powstania ognisk krwotocznych i martwiczych w
wątrobie, obejmujących cały płat. Następstwem jest powstanie krwiaków,
przerwanie torebki i masywne krwawienia do jamy otrzewnej. Ryzyko śmierci
okołoporodowej noworodków wynosi około 11% i jest uzależnione od ciężkości
choroby w czasie porodu. W przypadku pęknięcia wątroby śmiertelność matek
osiąga 50%, a noworodków 10–60% głównie z powodu pęknięcia łożyska,
niedotlenienia wewnątrzmacicznego lub wcześniactwa [1,4,6].
Ostre stłuszczenie wątroby ciężarnych (ang. Acute fatty liver of pregnancy,
AFLP) występuje miedzy 30. a 38. tygodniem ciąży. Czasem może rozwinąć się
także zaraz po porodzie. Jest bardzo rzadkim powikłaniem ciąży, ale jednym z
najgroźniejszych. Dotyczy najczęściej pierwszej ciąży, ciąży mnogiej oraz ciąży z
płodem męskim. Często współwystępuje z objawami stanu przedrzucawkowego.
Początkowo obraz kliniczny jest niespecyficzny, zwykle najpierw pojawiają się
nudności, wymioty, bóle w prawym i środkowym nadbrzuszu, może wystąpić
gorączka i biegunka. Stopniowo może rozwijać się pogłębiająca żółtaczka,
kwasica metaboliczna, wodobrzusze, obrzęki obwodowe, krwotoki z dróg rodnych
i układu pokarmowego, a u około 60% pacjentek niewydolność nerek [1,3,5].
AFLP wiąże się ze zwiększoną aktywnością transaminaz (zwykle od 300 a 500
U/L), a wzrost bilirubiny powyżej 5 mg% jest złym prognostykiem. W przebiegu
tego schorzenia występuje koagulopatia (niski poziom fibrynogenu oraz
wydłużenia czasu protrombinowego), niedokrwistość normochromiczna,
leukocytoza, a rzadziej małopłytkowość. Najczęstszą przyczyną śmierci płodu jest
hipoglikemia płodowa, a jej częstość wynosi około 36%. Z powodu powikłań
towarzyszących AFLP umiera 18% matek [1,3].
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą
pierwotny czop hemostatyczny w miejscu uszkodzenia śródbłonka
naczyniowego oraz uczestniczą w reakcjach krzepnięcia krwi.
Źródło: Flickr, licencja: CC BY 2.0
Zaburzenia funkcji wątroby w ciąży występują stosunkowo rzadko,
niemniej jednak ich konsekwencje zdrowotne są bardzo poważne i często
mogą być niebezpieczne dla matki i dziecka. Dlatego też niezwykle ważne
jest ich wczesne rozpoznanie i podjęcie odpowiednich działań, mających
na celu zachowanie ich życia i zdrowia.
Piśmiennictwo:
1. Ahmed K.T., Almashhrawi A. A., Rahman R.N. et al. Liver diseases in
pregnancy: Diseases unique to pregnancy. World J Gastroenterol 2013; 19(43):
7639-7646.
2. Joshi D., James A., Quaglia A. et al. Liver disease in pregnancy.Lancet 2010;
375: 594–605.
3. Pawłowska M., Halota W., Olczak A. Problemy hepatologiczne kobiet
ciężarnych. Katedra Chorób Zakaźnych i Hepatologii CM UMK, Bydgoszcz,
Polska.
4. Cichoż-Lach H. Patogeneza chorób wątroby związanych z ciążą. Ginekol Pol.
2010, 81, 613-617.
5. Lee N.M., Brady C.W. Liver disease in pregnancy. World J Gastroenterol 2009;
15(8): 897-906.
6. Baszczuk A., Szlachtowska E., Kopczyński Z. Laboratoryjna diagnostyka
różnicowa zespołu HELLP. Nowiny Lekarskie 2011; 80(6): 461-468.
**
Zapraszamy do czytania o chorobach wątroby nie stanowiących bezpośredniego
zagrożenia życia (artykuł), ale uciążliwych dla ciężarnej.
Choroby wątroby uciążliwe dla
ciężarnej
Choroby wątroby w ciąży są stosunkowo rzadkie (średnio 1:1000 ciąż), ale
mogą stanowić istotny problem kliniczny z powodu prawdopodobieństwa
wystąpienia ciężkich powikłań, zagrażających życiu matki i dziecka.
Ciąża przebiega z fizjologicznymi zmianami czynności wątroby, które są
następstwem zmian hormonalnych i metabolicznych, zachodzących w organizmie
kobiety. U ciężarnych obserwuje się wzrost stężenia fibrynogenu, alfa- i betaglobulin, cholesterolu, trójglicerydów oraz obniżenie frakcji gamma-globulin i
albumin. W przebiegu ciąży wzrasta aktywność fosfatazy zasadowej (do nawet
300% wartości sprzed ciąży), co wynika ze wzmożonej produkcji izoenzymu
łożyskowego. W trzecim trymestrze ciąży dochodzi do zwiększenia objętości krwi
krążącej (o około 50%), co związane jest z obniżeniem stężenia bilirubiny oraz
aktywności aminotransferaz i gammaglutamylotranspeptydazy (GGTP). W ciążach
mnogich rośnie także poziom alfafetoproteiny (AFP). Podwyższone wartości
biochemicznych wykładników funkcji wątroby występują u około 3-5% kobiet
ciężarnych co nie zawsze wynika z patologii tego narządu. Mimo to wzrost
poziomu wskaźników wątrobowych (aminotransferaz, GGTP oraz bilirubiny),
wymaga wdrożenia postępowania diagnostycznego [2,3].
W diagnostyce chorób wątroby u ciężarnych ważne jest ustalenie momentu
pojawienia się schorzenia, ponieważ choroby specyficzne dla ciąży pojawiają się
w charakterystycznym momencie ciąży.
Do chorób wątroby występujących tylko w ciąży i mających z nią ścisły związek
patogenetyczny zalicza się następujące stany chorobowe:
− niepowściągliwe wymioty ciężarnych,
− wewnątrzwątrobowa samoistna cholestaza ciężarnych,
− stan przedrzucawkowy i rzucawka,
− ostre stłuszczenie wątroby ciężarnych,
− zespół HELLP [4].
Niepowściągliwe wymioty ciężarnych oraz wewnątrzwątrobowa samoistna
cholestaza ciężarnych pomimo uciążliwości dla ciężarnej i konieczności
monitorowania ich przebiegu, nie stanowią zagrożenia dla życia i zdrowia kobiety.
Niepowściągliwe wymioty ciężarnych (ang. Hyperemesis Gravidarum, HG)
dotyczą około 0,3-2% kobiet. Obfite i długotrwałe wymioty pojawiają się między 4.
a 10. tygodniem ciąży i ustępują zazwyczaj około 20. tygodnia. Niemniej jednak, u
10% kobiet HG trwa aż do rozwiązania. Niepowściągliwe wymioty dotykają
głównie młodych ciężarnych i związane są często ze schorzeniami
współistniejącymi, takimi jak nadczynność tarczycy, cukrzyca, zaburzenia
psychiczne. Częściej występują w ciążach mnogich [3,5].
Etiologia HG obejmuje czynniki hormonalne, immunologiczne i genetyczne.
U 50% kobiet cierpiących na niepowściągliwe wymioty pojawia się wzrost
aktywności transaminaz oraz żółtaczka o niewielkim nasileniu. W związku z
odwodnieniem pojawiają się zaburzenia równowagi kwasowo-elektrolitowej.
Oprócz uciążliwości i konieczności kontroli poziomu odwodnienia HG nie jest
niebezpieczne dla matki i dziecka. Jedynym odchyleniem od normy jest wzrost
częstotliwości niskiej masy urodzeniowej u dzieci matek z HG w trakcie ciąży
[1,2,5].
Wewnątrzwątrobowa samoistna cholestaza ciężarnych (ang. Intrahepatic
cholestasis of pregnancy, ICP) nie jest częstym powikłaniem ciąży, ale stanowi
zagrożenia dla dobrostanu płodu. Podwyższone stężenie kwasów żółciowych
definiuje cholestazę ciężarnych i determinuje jej nasilenie. Występuje w III
trymestrze ciąży (zwykle około 30. tygodnia). Najczęściej spotykana jest w
Ameryce Południowej, a w Europie występuje z częstością 0,5-1,5%. Cholestaza
ciężarnych najczęściej dotyczy wieloródek, kobiet stosujących doustną
antykoncepcję oraz kobiet rodzących w późnym wieku. Istnieje także aż 70%
prawdopodobieństwo powtórnego wystąpienia cholestazy w kolejnych ciążach
[3,5].
Patogeneza ICP związana jest z nieprawidłowym transportem kwasów żółciowych
na skutek zmian hormonalnych, zachodzących w organizmie ciężarnej. Pierwszym
objawem cholestazy ciężarnych jest świąd skóry, nasilający się w nocy, a
dotyczący głównie stóp i dłoni.
Podstawowym elementem rozpoznania ICP jest nawet 10-100-krotny wzrost
poziomu całkowitych kwasów żółciowych(ze wzrostem stężenia kwasu
cholowego i spadkiem stężenia kwasu chenodeoksycholowego).
Klinicznie jawna żółtaczka pojawia się u 10% chorych, zwykle między 1-4
tygodniem po wystąpieniu świądu. Występuje również zwiększone stężenie
transaminaz [3,4].
ICP zwiększa 3-krotnie prawdopodobieństwo wystąpienia kamicy żółciowej, a
także wiąże się z ryzykiem wystąpienia krwotoków okołoporodowych. Może być
również przyczyną poronień i przedwczesnych porodów, a także
wewnątrzmacicznego obumarcia płodu (1-3%). W związku z powyższym,
monitoruje się poziom kwasów żółciowych przyjmując, że ich stężenie powyżej 40
μmol/L jest związane z wysokim ryzykiem niewydolności łożyska i obumarcia
płodu. Objawy choroby ustępują w 48 godzin po porodzie, a u niewielkiego
odsetka kobiet mogą utrzymywać się do 40 dni po rozwiązaniu [1,3,4].
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą
pierwotny czop hemostatyczny w miejscu uszkodzenia śródbłonka
naczyniowego oraz uczestniczą w reakcjach krzepnięcia krwi.
Źródło: Flickr, licencja: CC BY 2.0
Mimo iż cholestaza oraz niepowściągliwe wymioty ciężarnych, nie
stanowią bezpośredniej przyczyny zagrożenia życia kobiety i jej dziecka, to
należy nieprawidłowości te diagnozować i leczyć, pamiętając, że wiążą się
one ze znacznym obniżeniem komfortu życia przyszłej matki.
Piśmiennictwo:
1. Ahmed K.T., Almashhrawi A. A., Rahman R.N. et al. Liver diseases in pregnancy:
Diseases unique to pregnancy. World J Gastroenterol 2013; 19(43): 7639-7646.
2. Joshi D., James A., Quaglia A. et al. Liver disease in pregnancy.Lancet 2010; 375:
594–605.
3. Pawłowska M., Halota W., Olczak A. Problemy hepatologiczne kobiet
ciężarnych. Katedra Chorób Zakaźnych i Hepatologii CM UMK, Bydgoszcz,
Polska.
4. Cichoż-Lach H. Patogeneza chorób wątroby związanych z ciążą. Ginekol Pol.
2010, 81, 613-617.
5. Lee N.M., Brady C.W. Liver disease in pregnancy. World J Gastroenterol 2009;
15(8): 897-906.
Różnorodność
morfologiczna
erytrocytów
—
pasożyty
wewnątrzerytrocytowe
Obejrzenie rozmazu krwi obwodowej — zadanie wydaje się łatwe. Pozory
jednak mylą. Jest to proces na który powinniśmy zwrócić szczególną
uwagę. Liczy się każdy etap począwszy od prawidłowego wykonania,
poprzez barwienie, aż po ocenę mikroskopową. Owszem rozmaz krwi
obwodowej to przede wszystkim ocena układu białokrwinkowego. Niemniej
jednak nie wolno nam skupiać uwagi wyłącznie na leukocytach, możemy
bowiem przeoczyć anomalia czerwonych krwinek, które odgrywają niemałą
rolę w diagnostyce różnych stanów chorobowych.
W poprzednich artykułach zostały omówione nieprawidłowości w wielkości i
kształcie erytrocytów, stopniu ich wybarwienia oraz obecności
wewnątrzerytrocytowych struktur. Ten artykuł zwróci Waszą uwagę na jeszcze
jeden aspekt, a mianowicie na pasożyty wewnątrz krwinek czerwonych.
Między moskitem a krwinką czerwoną
Malaria jest chorobą pasożytniczą wywołaną Plasmodium, przenoszonym na
człowieka dzięki ukąszeniu przez wektory jakimi są zainfekowane moskity
Anopheles. Wyróżnia się 5 gatunków mogących wywoływać malarię: zarodziec
sierpowaty (Plasmodium falciparum), zarodziecruchliwy (Plasmodium vivax),
zarodziecpasmowy (Plasmodium malariae), zarodziec owalny (Plasmodium ovale)
oraz zarodziec małpi (Plasmodium knowlesi). Najbardziej rozpowszechnione są
Plasmodium falciparum i Plasmodium vivax. Plasmodium falciparum wykazuje
najwyższą śmiertelność [1].
Symptomami choroby jest gorączka, dreszcze, ból głowy i wymioty, objawiające
się zwykle po 10 do 15 dni od zakażenia. Malaria jest uleczalna i można
skutecznie zapobiegać jej rozwojowi. Brak leczenia może szybko doprowadzić do
dysfunkcji ważnych dla życia organów wewnętrznych. Zatrważającym jest fakt, iż
w wielu częściach świata pasożyty wytworzyły oporność na leki
przeciwmalaryczne.
Ryzyko zarażenia i rozwoju malarii dotyczy połowy populacji ludzkiej. Co roku
WHO odnotowuje 250 milionów przypadków malarii i niemalże milion zgonów,
przeważnie wśród afrykańskich dzieci. Szacuje się, że w Afryce z powodu malarii
w każdej minucie umiera kolejne dziecko. Tam właśnie choroba jest przyczyną
77% zgonów wieku dziecięcego [2].
Cykl rozwojowy Plasmodium jest związany ze zmianami w obrębie erytrocytów.
Pasożyty rozwijają się w jelicie samic z rodzaju Anopheles, będących ich
żywicielem pośrednim. W wyniku ukąszenia zarodźce przenoszone są ze śliną do
żywiciela ostatecznego – człowieka. Wraz z krwią sporozoity trafiają do
hepatocytów, gdzie ulegają namnażaniu. Sporozoity zmieniają swój kształt,
kształtują się schizonty. Schizonty dzielą się, przekształcają i pękają uwalniając
tysiące merozoitów, uwalnianych do krwi. W zależności od gatunku zarodźca
proces ten trwa od 5 do 21 dni. Merozoity atakują erytrocyty. W krwinkach
czerwonych ponownie ulegają podziałom, ostatecznie niszcząc komórki. Po
powstaniu pewnej liczby pokoleń merozoity zamiast przekształcić się w
sporozoity, tworzą gamety. Możliwość zapłodnienia pojawia się dopiero w
momencie znalezienia się ich w jelicie komara – po wyssaniu krwi człowieka
chorego na malarię. Zygoty dzielą się w przewodzie pokarmowym moskita
tworząc nowe sporozoity. Wędrują one do jego ślinianek, gdzie czekają na okazję
do zarażenia kolejnej ofiary [1].
Cechy mikroskopowe zarodźców malarii
Pod mikroskopem wiele form pasożytniczych wygląda podobnie. W przypadku
Plasmodium falciparum we krwi widoczne są tylko wczesne trofozoity i
gametocyty. Bardzo rzadko widuje się dojrzałe trofozoity czy schizonty (izolowane
raczej z tkanek). Wewnątrz krwinek czerwonych obserwuje się dość duże ilości
pasożytów. Wielkością erytrocyty zarażone pasożytem nie różnią się od zdrowych.
Czasami na krwince są widoczne słabe, okrągłe, czerwone plamki zwane ‘Mauer’s
dots’ (szczeliny Maurera – widoczne po specjalnym barwieniu). Charakterystyczne
jest występowanie gametocytów w kształcie księżycowatym.
Erytrocyty zarażone gatunkiem Plasmodium vivax są bladoróżowe i nawet do
dwóch razy większe od zdrowych krwinek. Na powierzchni zainfekowanych
komórek pojawiają się ‘Schueffner’s dots’ (plamki Schüffnera). Wewnątrz
erytrocytów pojawia się pasożyt o ameboidalnym kształcie. Schizonty mają tutaj
do 20 merozoitów, które z kolei przyłączają się tylko do retykulocytów. Ze
względu na tą cechę trudno jest zobaczyć duże ilości zarażonych krwinek
krążących w krwioobiegu.
Trudności w diagnostyce różnicowej Plasmodium vivax i Plasmodium ovale
wynikają z podobieństwa obrazu mikroskopowego obu gatunków (przy małej
liczbie pasożytów w krwince). Plasmodium ovale powoduje pojawienie się ‘James’s
dots’ – nieco ciemniejszych i większych niż ‘Scueffner’s dots’. Około 20%
zainfekowanych erytrocytów ma kształt okrągły, czasami nierówne, jakby
postrzępione krawędzie. Dojrzałe schizonty posiadają mniej niż 12 jąder, co jest
doskonałą cechą diagnostyczną [1].
Erytrocyty zainfekowane Plasmodium malariae raczej nie wykazują powiększenia,
czasami nawet wydają się być mniejsze niż normalne krwinki. Brak jest
wybarwienia cytoplazmy i plamek na powierzchni krwinki (w specjalnym
barwieniu pojawia się kropkowanie Ziemanna). Pasożyt jest upakowany.
Charakterystyczne dla tego gatunku są formy pasmowe pod postacią grubych
pasów przebiegających przez całą szerokość zarażonego erytrocytu [3].
Diagnostyka malarii opiera się głównie na wykonaniu rozmazu krwi obwodowej.
Wykorzystuje się ponadto szybkie testy diagnostyczne z przeciwciałami
monoklonalnymi (BinaxNOW) oraz metody molekularne.
Między kleszczem a krwinką czerwoną
Babeszjoza to niezwykle groźna choroba przenoszona przez kleszcze Dermacentor
reticulatus, atakująca przede wszystkim nasze pupile – psy i koty, a także owce,
konie i inne. Nieleczona, leczona nieprawidłowo lub zbyt późno, prowadzi do
śmierci zwierzaka.
Czynnikiem etiologicznym jest pierwotniak Babesia canis. Ostatnio coraz częściej
wymienia się także Babesia gibsoni jako przyczynę choroby. Namnaża się on w
gruczołach ślinowych kleszcza i w trakcie pobierania krwi zostaje wprowadzony
do organizmu zwierzęcia. Schemat inwazyjny polega na atakowaniu erytrocytów i
namnażaniu się w nich. Opuszczenie krwinki wiąże się z jej zniszczeniem i
atakiem kolejnych krwinek. Ta reakcja łańcuchowa prowadzi do spadku ilości
erytrocytów w organizmie chorego i anemii. Dochodzi do hemolizy i często do
żółtaczki. Uszkodzeniu ulegają narządy wewnętrzne (zwłaszcza nerki i wątroba).
Należy wspomnieć, że pierwszy udokumentowany przypadek babeszjozy u ludzi
pochodzi z roku 1957. Obecnie Babesia spp. stanowi realne i istotne zagrożenie
dla osób z niską odpornością. Na całym świecie odnotowano znaczną ilość
przypadków babeszjozy. W Polsce został opisany tylko jeden taki przypadek.
Prawdopodobnie jednak wynika to bardziej z ograniczeń diagnostycznych niż z
rzeczywistego braku transmisji. Wydaje się, że przypadki malarii rozpoznawane w
Polsce w okresie międzywojennym mogły być w rzeczywistości babeszjozą.
Rozpoznanie babeszjozy jest trudne ze względu na mało specyficzne objawy
kliniczne u ludzi oraz podobieństwa obrazu mikroskopowego erytrocytów do
zmian malarycznych. Babeszjoza nazywana jest także ‘malarią Północy’.
W Europie czynnikiem etiologicznym babeszjozy u ludzi jest najczęściej Babesia
divergen. W Ameryce Północnej natomiast Babesia microti. Pierwotniak
przenoszony jest przez kleszcze, w Europie głównie Ixodes ricinus, a Ameryce
Północnej Ixodes scapularis. Przedstawieciele rodzajów Rhipicephalus i Boophilus
także mogą przenosić zakażenie.
Zakażenie przebiega najczęściej łagodnie, a w rejonach endemicznych nawet
bezobjawowo. Śmiertelne przypadki obserwuje się u osób z niedoborami
immunologicznymi, po splenektomii lub w starszym wieku (ponad 60 lat). Choroba
dość często współistnieje z różnymi innymi chorobami takimi jak borelioza.
W obrazie mikroskopowym krwi obwodowej w barwieniu MayGrunwald-Giemsa
widoczne są postacie pierwotniaka we wnętrzu erytrocytów. Metoda ta jest jednak
obarczona dużą ilością wyników fałszywie ujemnych, dlatego też stosuje się inne
badania potwierdzające: test immunofluorescencji pośredniej (IFA) lub test
ELISA. Można stosować także techniki biologii molekularnej [4].
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą
pierwotny czop hemostatyczny w miejscu uszkodzenia śródbłonka
naczyniowego oraz uczestniczą w reakcjach krzepnięcia krwi.
Źródło: Flickr, licencja: CC BY 2.0
Babesiaoraz Plasmodium należą do pasożytów wewnątrzerytrocytowych.
Krwinki czerwone potrzebne są patogenom do namnażania się, ale
ostatecznie są niszczone. Standardowa metoda barwienia rozmazów krwi
obwodowej może być pomocna w wykrywaniu ich obecności w obrębie
erytrocytów.
mgr Agnieszka Helis, diagnosta laboratoryjny
Piśmiennictwo:
1. Kaczkowski M. Między komarem a gorączką, czyli coś o malarii…Zakład
Biofizyki Obliczeniowej i Bioinformatyki, Wydział Biochemii, Biofizyki i
Biotechnologii UJ. Dostęp 12.02.2011.
2. WHO. World Malaria Report 2013.
3. Mali S., Steele S., Slutsker L. et al. Malaria Surveillance. MMWR, 2009; 58,
SS02: 1-16.
4. Wielkoszyński T. Babeszjoza. Materiały informacyjne.
Wskaźniki diagnostyczne raka
jajnika
Według danych Krajowego Rejestru Nowotworów co roku w Polsce
odnotowuje się około 3500 nowych zachorowań na raka jajnika, a średnio
2500 kobiet umiera z powodu tego nowotworu [1]. Około 80%
nowotworów jajnika jest wykrywanych w III i IV stadium rozwoju choroby,
kiedy 5-letnia przeżywalność wynosi 20-30% [2]. Trudna sytuacja
epidemiologiczna motywuje naukowców do poszukiwania metod
pozwalających na wykrywanie nowotworów jajników we wczesnej fazie
zaawansowania. Powstało bardzo wiele opracowań na temat diagnostyki
raka jajnika oraz kwalifikowania kobiet do grup ryzyka zachorowania na
ten nowotwór [3].
Markery nowotworowe są to substancje produkowane przez nowotwór lub przez
inne komórki w reakcji na rozwijający się guz. Znanych jest ponad 100 substancji,
które mogłyby stać się potencjalnymi markerami procesu nowotworowego w
jajniku [4,6]. Niestety niewiele z nich ma zastosowanie w medycynie klinicznej.
Markerem biochemicznym, który jest najczęściej zalecanym badaniem do
różnicowania zmian w obrębie przydatków jest wskaźnik CA125 (ang. Cancer
Antigen 125) [5].
U 99% zdrowych kobiet stężenie CA125 nie przekracza 35 U/mL. U kobiet po
menopauzie oraz po histerektomii wartość graniczna CA125 jest nieco niższa i
wynosi 20-26 U/mL. U około 85% chorych na nabłonkowego raka jajnika stężenie
CA125 jest wyższe niż 35 U/mL, ale jedynie u połowy z nich zwiększa się już w I
stadium choroby. Stężenie tego markera rzadko wzrasta w raku śluzówkowym i
jasnokomórkowym oraz w guzach granicznych. Zastosowanie CA125 dodatkowo
ogranicza fakt, że jego poziom może podnosić się w przebiegu innych
nowotworów, np. płuc, wątroby i trzustki oraz w innych chorobach, takich jak
mięśniaki macicy, endometrioza, niezłośliwe guzy jajników, marskość wątroby,
choroby zapalne w obrębie miednicy. Poziom CA125 u poszczególnych kobiet
waha się w przebiegu cyklu miesiączkowego, a także w I trymestrze ciąży [3,6].
Czułość i swoistość CA125 nie są wystarczające do różnicowania złośliwości
widocznych w badaniu ultrasonograficznym niewielkich guzów jajnika oraz do
wykrywania wczesnych zmian nowotworowych [5]. Z tego powodu oznaczanie
poziomu CA125 ma największe zastosowanie w monitorowaniu leczenia i progresji
nowotworów jajnika [3].
Stosunkowo niedawno pojawił się marker dający duże nadzieje na poprawę
diagnostyki różnicowej oraz skriningowej jajnika.
W 2008 roku Food and Drug Administration (FDA) zarejestrowała i dopuściła do
praktyki klinicznej oznaczanie antygenu HE4 jako nowego markera
nowotworów jajnika [3,7].
HE4 (ang. Human epididymis protein 4) ulega nadekspresji u kobiet z rakiem
przydatków. Jego czułość ocenia się na 67%, a specyficzność na 96%. HE4 ulega
nadekspresji w nabłonkowych rakach jajnika (93% surowiczych, blisko 100%
endometrialnych i 50% jasnokomórkowych nowotworów jajnika). Czułość HE4 jest
porównywalna z CA 125, ale stężenie HE4 rzadziej bywa zwiększone u kobiet z
chorobami nienowotworowymi. Za wartość graniczną dla HE4 przyjęto 50 pmol/L
[2,4].
Czułość HE4 jest zadowalająca dla nowotworów na różnym etapie
zaawansowania. Wykazano, że białko HE4 ulega wzmożonej ekspresji nie tylko we
wczesnej fazie rozwoju nowotworu, ale jest także wskaźnikiem nawrotu choroby.
Poziom tego białka wzrasta o 25% lub więcej u 60% kobiet z nawrotem raka
jajnika lub progresją choroby [2,4].
Niektóre histologiczne rodzaje omawianego nowotworu nie wykazują ekspresji
HE4 np. nowotwory śluzowe i zarodkowe. W pojedynczych przypadkach również
poziom tego markera był podwyższony u kobiet ze zmianami niezłośliwymi.
Dlatego oznaczenie poziomu HE4 nie może być stosowane jako bezwzględny
dowód na obecność lub brak procesu nowotworowego, co ogranicza zastosowanie
testu w ustalaniu rozpoznania [2].
Dalszy postęp w różnicowaniu zmian niezłośliwych i raka jajnika uzyskano dzięki
wprowadzeniu algorytmu ROMA (ang. Risk of Ovarian Malignancy Algorithm).
Łączy on oznaczanie HE4 i CA125 w jednym teście, uwzględniając status
menopauzalny pacjentki [6]. Algorytm jest skomplikowanym modelem
matematycznym, którego wzór jest przedstawiony poniżej:
Wyliczenie wartości ROMA [6]:
Kalkulator matematyczny do oceny algorytmu ROMA dostępny jest na stronie
internetowej http://romatools.he4test.com/calculator_row_en.html.
Algorytm ROMA klasyfikuje kobiety z guzem przydatków do grupy obciążonej
dużym lub małym ryzykiem występowania raka nabłonkowego jajnika. Wartości
odcięcia szacowanego algorytmu uzyskane z różnych laboratoriów różnią się i
zależą od metody analitycznej oznaczenia poziomu CA125 i HE4. Z algorytmu
wykluczone są kobiety uprzednio leczone na nowotwór, pacjentki w trakcie
chemioterapii oraz kobiety poniżej 18. roku życia [4]. Wysoka wartość
diagnostyczna algorytmu ROMA została potwierdzona w wielu publikacjach
naukowych. Czułość testu wynosi 92% u kobiet po menopauzie i 76% przed
menopauzą, natomiast swoistość 75% [6, 7].
W 2009 roku opublikowano wyniki badań nad nowym testem służącym do
wykrywania raka jajnika – OVA1.
Test łączy oznaczanie stężenia 5 parametrów we krwi: CA125, apolipoproteiny A1,
β-2-mikroglobuliny, prealbuminy oraz transferryny. U chorych na raka jajnika
poziom CA125 oraz β-2-mikroglobuliny wzrasta, a stężenie pozostałych trzech
parametrów jest niższe, niż u zdrowych kobiet [8]. Punktacja, wyliczona na
podstawie algorytmu OVA1, pozwala na określenie prawdopodobieństwa
rozpoznania złośliwego nowotworu jajnika. O dużym ryzyku świadczy uzyskanie u
kobiet przed menopauzą 5,0 lub więcej punktów, a u kobiet po menopauzie 4,4
lub więcej [7]. Mimo wysokiej czułości (ok. 96%), swoistość OVA1 nie jest
zadowalająca. Obawy budzi również niska powtarzalność wyników oraz wysoki
koszt badania [7].
Płytki krwi w hemostazie odgrywają dwie zasadnicze funkcje – tworzą
pierwotny czop hemostatyczny w miejscu uszkodzenia śródbłonka
naczyniowego oraz uczestniczą w reakcjach krzepnięcia krwi.
Źródło: Flickr, licencja: CC BY 2.0
Wybiórcze zastosowanie w diagnostyce pacjentek oznaczania markerów
nowotworowych może przyczynić się do skuteczniejszego wykrywania złośliwych
zmian nowotworowych, a także do uniknięcia leczenia chirurgicznego u pacjentek
ze zmianami łagodnymi. Mimo że wciąż brakuje doskonałego markera do
przesiewowego badania kobiet z grup ryzyka, należy pamiętać, że w niektórych
przypadkach wzrost stężenia CA125 i HE4 rozpoczyna się już 3 lata przed
rozpoznaniem raka.
Małgorzata Kalaga
Piśmiennictwo:
1. Dane Zakład Epidemiologii i Prewencji Nowotworów Centrum Onkologii –
Instytut w Warszawie.
2. Human Epididymis Protein 4 (HE4). For monitoring recurrence of progressive
disease in women with epithelial ovarian cancer. ARUP Laboratories, 2010.
3. Kulpa J. K., Wójcik E., Rychlik U. i wsp. HE4 i CA125 – porównanie metod
oznaczeń. Diagn Lab, 2012; 48: 41-49.
4. Woźniak S., Szkodziak P., Czuczwar P. i wsp. Guz jajnika u kobiety w późnym
wieku rozrodczym – jak ocenić ryzyko onkologiczne. Przegl Menopauzalny, 2013;
1: 78-82 .
5. Van Gorp T. I wsp. HE4 and CA125 as a diagnostic test in ovarian cancer:
prospective validation of the Risk of Ovarian Malignancy Algorithm. Br J Cancer,
2011; 5, 104: 863-870.
6. Nowak-Markwitz E., Oznaczanie HE4, CA 125 i algorytm ROMA w diagnostyce
i różnicowaniu guzów jajnika. LabForum, 2013; 55: 3-5
7. Li A.J., Nowe markery biologiczne w raku jajnika. Przydatność OVA1 i ROMA w
ustaleniu rozpoznania. Ginekologia po dyplomie, 2012; 7: 14-19.
8. Toss A., Matteis De E., Rossi E. et al. Ovarian cancer: Can proteomics give new
insights for therapy and diagnosis? Int J Mol Sci, 2013; 14: 8271-8290.