PLAN WYNIKOWY DO KLASY III GIMNAZJUM
Przygotowany na postawie :
Poziom wymagań
podstawowe
(P)
ponadpodstawowe
(PP)
Chemia Nowej Ery
Programu nauczania chemii w gimnazjum autorstwa Teresy Kulawik i Marii Litwin,
Wymagań programowych na poszczególne oceny Małgorzaty Mańskej
Hierarchizacja wymagań
Ocena
niedostateczna
dopuszczająca
Dostateczna
Dobra
bardzo dobra
K
P
R
[1]
[1+2]
[1+2+3]
D
[1+2+3+4]
Opis wymagań
uczeń nie opanował nawet połowy wymagań koniecznych (najbardziej elementarnych)
uczeń opanował wymagania konieczne
uczeń opanował wymagania konieczne i podstawowe
uczeń opanował wymagania konieczne, podstawowe i większą część wymagań
ponadpodstawowych (rozszerzających)
dopełniające)
Kursywą, szarym kolorem wpisano treści nadobowiązkowe, m.in. wymagane na ocenę celującą, mogą zostać zrealizowane na godzinie przedmiotowej w miarę możliwości czasowych –
decyduje nauczyciel (np. na końcu roku, gdy zostaną wolne tematycznie jednostki lekcyjne)
Rozdział
podręcznika
Zagadnienia
tematyczne
Wymagania edukacyjne
Treści nauczania
podstawowe (P)
ponadpodstawowe (PP)
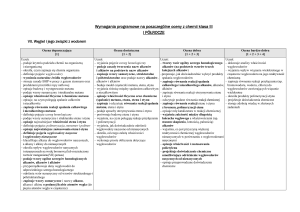
DZIAŁ 7 - Węgiel i jego związki z wodorem
System oceniania i
kryteria wymagań z
chemii
10. Poznajemy
naturalne źródła
węglowodorów
Poznajemy
naturalne źródła
węglowodorów
11. Poznajemy
węglowodory
nasycone
Szereg
homologiczny
alkanów
system oceniania, kryteria wymagań na
poszczególne oceny z przedmiotu chemii
zeszyt, podręcznik przedmiotowy, zbiór
zadań
zasady bhp w pracowni chemicznej
Uczeń:
zna system oceniania i wymagania na
poszczególne oceny z przedmiotu (K)
stosuje zasady bezpieczeństwa obowiązujące w
pracowni chemicznej (K)
Uczeń:
wymienia kryteria podziału chemii na
organiczną i nieorganiczną (K)
określa, czym zajmuje się chemia organiczna (K)
definiuje pojęcie „węglowodory” (K)
wymienia naturalne źródła węglowodorów (K)
podaje zasady bezpiecznego obchodzenia się z
gazem ziemnym, ropą naftową i produktami jej
przeróbki (K)
opisuje skład gazu ziemnego (K)
wymienia najważniejsze zastosowania gazu
ziemnego oraz ropy naftowej i produktów jej
przeróbki (K)
wykrywa obecność węgla w związkach
organicznych
Uczeń:
definiuje pojęcie „szereg homologiczny” (K)
definiuje pojęcie „węglowodory nasycone” (K)
klasyfikuje klasyfikuje alkany do węglowodorów
nasyconych (K)
podaje wzór ogólny szeregu homologicznego
alkanów (K)
odróżnia wzór sumaryczny od wzorów
strukturalnego i półstrukturalnego (K)
zapisuje wzór sumaryczny i podaje nazwę
alkanu o określonej liczbie atomów węgla w
cząsteczce (do pięciu atomów węgla) (K)
zapisuje wzory strukturalne i półstrukturalne
związki organiczne i nieorganiczne
przykłady nieorganicznych związków węgla
węglowodory
naturalne źródła węglowodorów
właściwości i zastosowania ropy naftowej
destylacja frakcjonowana ropy naftowej i jej
produkty
właściwości i zastosowania gazu ziemnego oraz
gazu świetlnego
węglowodory nasycone – alkany
szereg homologiczny alkanów
wzór ogólny alkanów
wzory sumaryczne, strukturalne i
półstrukturalne alkanów
izomeria łańcuchowa
modelowanie cząsteczek alkanów za pomocą
modeli czaszowych i pręcikowo--kulkowych
Uczeń:
opisuje niektóre zastosowania produktów
destylacji ropy naftowej (R)
omawia skutki wydobywania i
wykorzystywania ropy naftowej (R)
planuje i wykonuje doświadczenie
chemiczne umożliwiające wykrycie
obecności węgla i wodoru w związkach
organicznych (D)
opisuje właściwości i zastosowania gazu
ziemnego i ropy naftowej (D)
wyjaśnia pojęcie „destylacja frakcjonowana
ropy naftowej”
wymienia produkty destylacji frakcjonowanej
ropy naftowej
Uczeń:
tworzy wzór ogólny szeregu homologicznego
alkanów na podstawie wzorów trzech
kolejnych alkanów (R)
zapisuje wzory sumaryczne, strukturalne i
półstrukturalne oraz podaje nazwy alkanów
z wykorzystaniem ich wzoru ogólnego (R)
Właściwości metanu
i etanu
Właściwości i
zastosowania
alkanów
występowanie metanu
właściwości fizyczne i chemiczne metanu i
etanu
reakcje spalania (spalanie całkowite i
niecałkowite) – zapis równań
badanie rodzajów produktów spalania metanu
zastosowania metanu i etanu
gaz błotny, mieszanina wybuchowa, czad
właściwości fizyczne i chemiczne alkanów
– zależność od liczby atomów węgla
spalanie całkowite i niecałkowite alkanów
właściwości benzyny
zastosowanie alkanów
kraking, destylacja ropy naftowej –
właściwości i zastosowania produktów
alkanów (do pięciu atomów węgla w cząsteczce)
(K)
zapisuje wzory strukturalne i półstrukturalne
alkanów (P)
wyjaśnia pojęcie „szereg homologiczny” (P)
buduje model cząsteczek metanu i etanu (P)
wykonuje proste obliczenia dotyczące
węglowodorów (P)
Uczeń:
wyjaśnia, czym jest metan i wymienia miejsca
jego występowania (K)
zapisuje wzór sumaryczny i strukturalny metanu
(K)
wymienia właściwości fizyczne i chemiczne (np.
reakcje spalania) metanu i etanu (P)
opisuje właściwości fizyczne i chemiczne metanu
(K)
opisuje na czym polegają spalania całkowite i
niecałkowite (K)
wyjaśnia, na czym polegają spalanie całkowite i
niecałkowite (P)
zapisuje i odczytuje równania reakcji spalania
całkowitego oraz niecałkowitego metanu i etanu
(P)
wymienia zastosowania metanu i etanu (P)
wykonuje proste obliczenia dotyczące
węglowodorów (P)
Uczeń:
wskazuje warunki, od których zależą właściwości
węglowodorów (K)
wyjaśnia, na czym polegają spalanie całkowite i
niecałkowite (P)
określa od czego zależą właściwości
węglowodorów (P)
opisuje zastosowania alkanów (P)
wymienia właściwości benzyny (K)
Uczeń:
projektuje doświadczenie chemiczne –
identyfikacja rodzajów produktów spalania
węglowodorów (R)
opisuje przeprowadzone doświadczenia
chemiczne (R)
odczytuje podane równania reakcji
chemicznej (R)
Uczeń:
zapisuje równania reakcji spalania
całkowitego i niecałkowitego alkanów (R)
odczytuje podane równania reakcji
chemicznej (R)
opisuje przeprowadzane doświadczenia
chemiczne (R)
wyjaśnia zależność między długością
łańcucha węglowego a właściwościami
alkanów (np. stanem skupienia, lotnością,
palnością) alkanów (R)
dokonuje analizy właściwości
węglowodorów nasyconych (D)
projektuje doświadczenia chemiczne (D)
stosuje zdobytą wiedzę w złożonych
zadaniach (D)
opisuje kraking, omawia destylacje ropy
naftowej oraz właściwości i zastosowania jej
produktów
12. Poznajemy
węglowodory
nienasycone
Szeregi
homologiczne
alkenów i alkinów
Właściwości etenu i
etynu
węglowodory nienasycone
budowa alkenów i alkinów
zasady nazewnictwa alkenów i alkinów
wzory ogólne szeregów homologicznych
alkenów i alkinów
wzory strukturalne i półstrukturalne alkenów i
alkinów
izomeria położeniowa
otrzymywanie etenu i etynu
zapis w. sumarycznego i strukturalnego oraz
nazwy zwyczajowej węgliku wapnia
właściwości fizyczne etenu i etynu
właściwości chemiczne etenu i etynu – reakcje
spalania, przyłączania- bromu i wodoru oraz
polimeryzacja
odróżnianie węglowodorów nasyconych od
nienasyconych
właściwości i zastosowania polietylenu
pojęcia polimer, monomer i katalizator
zastosowania etenu i etynu
piroliza metanu
reakcja substytucji metanu
Uczeń:
definiuje pojęcie „węglowodory nienasycone” (K)
klasyfikuje alkeny i alkiny do węglowodorów
nienasyconych (P)
wymienia zasady tworzenia nazw alkenów i
alkinów na podstawie nazw alkanów (P)
zapisuje wzory ogólne szeregów
homologicznych alkenów i alkinów (K)
przyporządkowuje dany węglowodór do
odpowiedniego szeregu homologicznego (K)
odróżnia wzór sumaryczny od wzorów
strukturalnego i półstrukturalnego (K)
zapisuje wzory sumaryczne oraz nazwy alkenu
i alkinu o określonej liczbie atomów węgla w
cząsteczce (do pięciu atomów węgla) (P)
Uczeń:
opisuje właściwości fizyczne oraz chemiczne
(reakcje spalania, przyłączania bromu i wodoru)
etenu i etynu (P)
opisuje najważniejsze właściwości etenu i etynu
(K)
buduje model cząsteczki etenu i etynu (P)
podaje wzory sumaryczne i strukturalne etenu i
etynu (K)
porównuje budowę etenu i etynu (P)
wymienia sposoby otrzymywania etenu i etynu
(K)
opisuje najważniejsze zastosowania etenu i etynu
(K)
wyjaśnia, na czym polegają reakcje przyłączania i
polimeryzacji (P)
definiuje pojęcia: „polimeryzacja”, „monomer” i
„polimer” (K)
wykonuje proste obliczenia dotyczące
węglowodorów (P)
Uczeń:
zapisuje wzory sumaryczne, strukturalne i
półstrukturalne oraz podaje nazwy alkenów
i alkinów z wykorzystaniem wzorów ogólnych
(R)
wykonuje obliczenia dotyczące alkenów i
alkinów (R)
Uczeń:
zapisuje równania reakcji otrzymywania
etenu i etynu (R)
odczytuje podane równania reakcji chemicznej
(R)
podaje interpretacje słowne równań reakcji
chemicznych (reakcje spalania,
przyłączania bromu i wodoru) (R)
zapisuje równania reakcji etenu i etynu z
bromem oraz polimeryzacji etenu (R)
opisuje rolę katalizatora w danej reakcji
chemicznej (R)
opisuje właściwości i zastosowania
polietylenu (R)
wyjaśnia, jakie związki mogą ulegać reakcji
polimeryzacji (R)
wyjaśnia, na czym polega reakcja
polimeryzacji (R)
wymienia produkty polimeryzacji etynu (R)
dokonuje analizy właściwości
węglowodorów (D)
wyjaśnia wpływ wiązania wielokrotnego w
cząsteczce węglowodoru na jego reaktywność
chemiczną (D)
określa produkty polimeryzacji etynu (D)
Właściwości
alkenów i alkinów
Tworzywa sztuczne
Podsumowanie
działu
właściwości alkenów i alkinów
doświadczalne odróżnianie węglowodorów
nasyconych od węglowodorów nienasyconych
rola węglowodorów nienasyconych w
przyrodzie
Uczeń:
zalicza alkeny i alkiny do węglowodorów
nienasyconych (K)
opisuje właściwości węglowodorów nienasyconych
(P)
przewiduje zachowanie wody bromowej (lub
rozcieńczonego roztworu manganianu(VII) potasu)
wobec węglowodoru nasyconego i nienasyconego
(K)
odróżnia doświadczalnie węglowodory nasycone
od węglowodorów nienasyconych (K) : wyjaśnia –
(P)
określa od czego zależą właściwości
węglowodorów (P)
właściwości i zastosowania wybranych tworzyw
sztucznych
polimery naturalne, sztuczne i syntetyczne
tworzywa biodegradowalne, wulkanizacja
Uczeń:
wymienia rodzaje tworzyw sztucznych
podaje właściwości i zastosowania wybranych
tworzyw sztucznych
Uczeń:
wyjaśnia przyczyny większej aktywności
chemicznej węglowodorów nienasyconych w
porównaniu z węglowodorami nasyconymi
(R)
analizuje właściwości węglowodorów (D)
wyjaśnia wpływ wiązania wielokrotnego w
cząsteczce węglowodoru na jego reaktywność
chemiczną (R)
wyjaśnia , jak doświadczalnie odróżnić
węglowodory nasycone od nienasyconych (R)
zapisuje równania reakcji przyłączania
cząsteczek do wiązania wielokrotnego, np.
bromowodoru, wodoru i chloru (D)
projektuje doświadczenie chemiczne
umożliwiające odróżnienie węglowodorów
nasyconych od węglowodorów
nienasyconych (R)
opisuje przeprowadzane doświadczenie
chemiczne (R)
stosuje zdobytą wiedzę w złożonych
zadaniach (D)
Uczeń:
określa zalety i wady tworzyw sztucznych
Podsumowanie wiadomości o węglowodorach. Test wiadomości z działu „Węgiel i jego związki z wodorem”. Omówienie testu
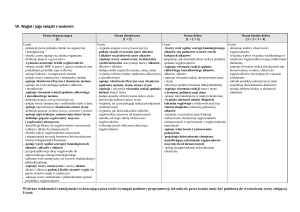
DZIAŁ 8 - Pochodne węglowodorów
13. Poznajemy
alkohole
Szereg
homologiczny
alkoholi
alkohole – pochodne węglowodorów
budowa alkoholi – grupa funkcyjna
wzory sumaryczne, strukturalne i
nazewnictwo alkoholi
szereg homologiczny alkoholi, wzór ogólny
szeregu
tiole (merkaptany)
Uczeń:
dowodzi, że alkohole są pochodnymi
węglowodorów (K)
opisuje budowę pochodnych węglowodorów
(grupa alkilowa + grupa funkcyjna) (K)
wymienia pierwiastki chemiczne wchodzące w
skład pochodnych węglowodorów (K)
definiuje alkohole jako pochodne węglowodorów
(K)
wyjaśnia, czym jest grupa funkcyjna (K)
zaznacza grupę funkcyjną w alkoholach (K);
nazywa i podaje jej wzór (P)
zapisuje wzór ogólny alkoholi (K)
wymienia reguły tworzenia nazw
systematycznych alkoholi (A)
zapisuje wzory sumaryczne i strukturalne prostych
alkoholi monohydroksylowych i podaje ich nazwy
(K)
zapisuje wzory i wymienia nazwy alkoholi (P)
Uczeń:
tworzy wzór ogólny szeregu homologicznego
alkoholi na podstawie wzorów trzech
kolejnych alkoholi (R)
zapisuje wzory sumaryczne, strukturalne i
półstrukturalne oraz podaje nazwy
dowolnych alkoholi z wykorzystaniem ich
wzoru ogólnego (R)
Budowa i
właściwości
metanolu i etanolu
Glicerol jako
przykład alkoholu
polihydroksylowego
właściwości metanolu i etanolu –
doświadczenia chemiczne
zastosowanie metanolu i etanolu
zapis równań reakcji spalania metanolu i
etanolu
negatywne skutki działania etanolu na
organizm ludzki
wpływ etanolu na białko
pojęcia „fermentacja alkoholowa” , „enzym”,
„kontrakcja”, „fermentacja mlekowa”
doświadczalne wykrywanie etanolu w roztworze
formalina, spirytus drzewny
porównanie budowy alkoholi
monohydroksylowych i polihydroksylowych
budowa glicerolu, zapis wzorów
doświadczalne badanie właściwości
glicerolu
znaczenie nazwy systematycznej
spalanie glicerolu
zastosowania glicerolu
etanodiol - wzory, nitrogliceryna
Uczeń:
określa, co to są nazwy zwyczajowe i
systematyczne (K)
opisuje najważniejsze właściwości metanolu i
etanolu (K)
opisuje fermentację alkoholową (R)
zapisuje równania reakcji spalania metanolu (K) i
etanolu (P)
wymienia podstawowe zastosowania metanolu i
etanolu (K)
wymienia toksyczne właściwości alkoholi (K)
opisuje zagrożenia związane z alkoholami
(metanol, etanol) (K)
opisuje negatywne skutki działania etanolu na
organizm ludzki (K)
uzasadnia stwierdzenie, że alkohole tworzą
szereg homologiczny (P)
podaje odczyn roztworu etanolu (P)
opisuje fermentację alkoholową (P)
zapisuje obserwacje do wykonywanych
doświadczeń chemicznych (P)
Uczeń:
rozróżnia alkohole monohydroksylowe i
polihydroksylowe (K)
wyjaśnia, czym są alkohole polihydroksylowe,
zaznacza grupy funkcyjne (K)
zapisuje wzory sumaryczny i strukturalny
glicerolu (P)
podaje odczyn roztworu glicerolu (P)
określa, co to są nazwy zwyczajowe i
systematyczne (K)
opisuje najważniejsze właściwości glicerolu (P)
wymienia zastosowania glicerolu (K)
Uczeń:
zapisuje równania reakcji spalania alkoholi (R)
wyjaśnia, dlaczego alkohol etylowy wykazuje
odczyn obojętny (R)
projektuje i wykonuje doświadczenia
chemiczne, za których pomocą można
zbadać właściwości metanolu i etanolu (D)
opisuje przeprowadzone doświadczenia
chemiczne (R)
formułuje wnioski z doświadczeń
chemicznych (D)
zapisuje równania reakcji chemicznych dla
alkoholi (D)
identyfikuje poznane substancje (D)
Uczeń:
projektuje i wykonuje doświadczenia
chemiczne, w których wyniku można zbadać
właściwości glicerolu (D)
zapisuje wzory i równanie reakcji spalania
glicerolu (R)
wyjaśnia sposób tworzenia nazwy
systematycznej glicerolu (R)
opisuje przeprowadzone doświadczenia
chemiczne (R)
formułuje wnioski z doświadczeń
chemicznych (D)
zapisuje równania reakcji chemicznych dla
alkoholi (D)
identyfikuje poznane substancje (D)
zapisuje wzór i wymienia właściwości
etanodiolu
omawia sposób otrzymywania oraz
właściwości nitrogliceryny; podaje nazwę
sysytematyczna
Właściwości
alkoholi
14. Poznajemy
kwasy
karboksylowe
Szereg
homologiczny
kwasów
karboksylowych
zależność między długością łańcucha
węglowego a stanem skupienia i reaktywnością
chemiczną alkoholi
odczyn alkoholi
równania reakcji spalania alkoholi
Uczeń:
określa odczyn roztworu alkoholu (K)
zapisuje równania reakcji spalania poznanych
alkoholi monohydroksylowych (P)
zapisuje wzory i wymienia nazwy alkoholi (P)
opisuje zastosowania alkoholi (K)
występowanie kwasów organicznych w
przyrodzie
budowa i nazewnictwo kwasów karboksylowych
grupa funkcyjna
nazwy i wzory strukturalne i sumaryczne
prostych kwasów karboksylowych
nazwy zwyczajowe i systematyczne kwasów
karboksylowych
kwasy karboksylowe jako pochodne
węglowodorów – szereg homologiczny
wzór ogólny szeregu
zastosowania kwasów karboksylowych
kwasy dikarboksylowe - przykłady
Uczeń:
opisuje budowę kwasów karboksylowych (grupa
węglowodorowa + grupa funkcyjna) (K)
definiuje kwasy karboksylowe jako pochodne
węglowodorów (K)
wymienia przykłady kwasów organicznych
występujących w przyrodzie (K)
zaznacza i nazywa grupę funkcyjną w kwasach
karboksylowych (K)
zapisuje wzór ogólny kwasów karboksylowych
(K)
zapisuje wzory sumaryczne i strukturalne prostych
kwasów karboksylowych (do 2 atomów węgla w
cząsteczce) oraz wymienia ich nazwy zwyczajowe i
systematyczne (K)
tworzy nazwy prostych kwasów karboksylowych
(do 5 atomów węgla w cząsteczce) oraz
zapisuje ich wzory sumaryczne i strukturalne (P)
zaznacza we wzorze kwasu karboksylowego
resztę kwasową (K)
wymienia reguły tworzenia nazw
systematycznych kwasów karboksylowych (K)
wyjaśnia pochodzenie danych nazw
zwyczajowych i systematycznych (P)
uzasadnia stwierdzenie, że kwasy karboksylowe
tworzą szeregi homologiczne (P)
podaje przykłady kwasów organicznych
występujących w przyrodzie i wymienia ich
zastosowania (P)
Uczeń:
uzasadnia rodzaj odczynu roztworu alkoholu
(R)
zapisuje równania reakcji spalania alkoholi
(R)
zapisuje wzory dowolnych alkoholi (D)
wyjaśnia zależność między długością
łańcucha węglowego a stanem skupienia i
reaktywnością chemiczną alkoholi (D)
proponuje doświadczenie chemiczne
do podanego tematu (D)
formułuje wnioski z doświadczeń
chemicznych (D)
przeprowadza doświadczenia chemiczne (D)
zapisuje równania reakcji chemicznych dla
alkoholi (D)
potrafi wykorzystać swoją wiedzę do
rozwiązywania złożonych zadań (D)
identyfikuje poznane alkohole (D)
potrafi wykorzystać swoją wiedzę do
rozwiązywania złożonych zadań (D)
Uczeń:
tworzy wzór ogólny szeregu homologicznego
kwasów karboksylowych (na podstawie
wzorów trzech kolejnych kwasów
karboksylowych) (R)
zapisuje wzory sumaryczne, strukturalne i
półstrukturalne kwasów karboksylowych z
wykorzystaniem ich wzoru ogólnego (R)
podaje nazwy zwyczajowe i systematyczne
kwasów karboksylowych (R)
wymienia przykłady kwasów dikarboksylowych
Kwas metanowy
i kwas etanowy jako
przykłady kwasów
karboksylowych
Wyższe kwasy
karboksylowe
właściwości kwasu metanowego i kwasu
etanowego (r. spalania, dysocjacji, z
zasadami, metalami i tlenkami metali) – zapis
równań reakcji
otrzymywanie soli kwasów karboksylowych
zastosowania kwasu metanowego i kwasu
etanowego
pojęcia: „dysocjacja jonowa kwasów, reakcja
zobojętniania, fermentacja octowa”
Uczeń:
podaje nazwy zwyczajowe omawianych kwasów
karboksylowych (mrówkowy, octowy) (K)
wymienia podstawowe zastosowania kwasu
metanowego (mrówkowego) i kwasu etanowego
(octowego) (K)
podaje przykłady kwasów organicznych
występujących w przyrodzie i wymienia ich
zastosowania (P)
opisuje najważniejsze właściwości kwasów
metanowego i etanowego (K)
zaznacza we wzorze kwasu karboksylowego
resztę kwasową (K)
zaznacza we wzorze kwasu karboksylowego
grupę funkcyjną (K)
omawia dysocjację jonową kwasów
karboksylowych (P)
zapisuje równania reakcji kwasów metanowego i
etanowego z metalami, tlenkami metali i
zasadami oraz równania reakcji spalania i
dysocjacji jonowej tych kwasów (P)
podaje nazwy soli pochodzących od kwasów
metanowego i etanowego (P)
zapisuje obserwacje do wykonywanych
doświadczeń chemicznych (P)
Uczeń:
podaje nazwy zwyczajowe i systematyczne
kwasów karboksylowych (R)
projektuje i wykonuje doświadczenia
chemiczne, w których wyniku można zbadać
właściwości kwasu octowego (reakcja
dysocjacji elektrolitycznej, reakcja z
zasadami, metalami i tlenkami metali) oraz
formułuje wnioski z doświadczeń
chemicznych (D)
porównuje właściwości kwasów
organicznych i nieorganicznych (R)
omawia metodę otrzymywania kwasu
etanowego (R)
wyjaśnia proces fermentacji octowej (R)
zapisuje równania reakcji chemicznych
otrzymywania soli kwasów metanowego i
etanowego w postaci cząsteczkowej, jonowej
oraz jonowej skróconej (R)
podaje nazwy soli kwasów organicznych (R)
opisuje równania reakcji chemicznych dla
kwasów karboksylowych (R)
identyfikuje poznane substancje (D)
budowa i nazewnictwo wyższych kwasów
karboksylowych
właściwości fizyczne i chemiczne wyższych
kwasów karboksylowych
wyższe kwasy nasycone – palmitynowy,
stearynowy i nienasycone – oleinowy (wzory
sumaryczny i półstrukturalny oraz nazwy)
doświadczalne odróżnianie nasyconych
wyższych kwasów karboksylowych od
nienasyconych wyższych kwasów
karboksylowych
zastosowania wyższych kwasów
karboksylowych
równania reakcji spalania w. kw.
karboksylowych oraz reakcje z zasadą sodową
sole wyższych kwasów tłuszczowych
mydło kastylijskie
Uczeń:
podaje nazwy wyższych kwasów
karboksylowych nasyconych (palmitynowy,
stearynowy) i nienasyconych (oleinowy) oraz
zapisuje ich wzory (P)
dzieli kwasy karboksylowe na nasycone i
nienasycone (K)
wyjaśnia, jak doświadczalnie udowodnić, że
dany kwas karboksylowy jest kwasem
nienasyconym (P)
definiuje pojęcie „mydło” (K)
opisuje właściwości wyższych kwasów
karboksylowych (kwasów tłuszczowych
stearynowego i oleinowego) (K)
opisuje zastosowania wyższych kwasów
karboksylowych (K)
zapisuje obserwacje do wykonywanych
doświadczeń chemicznych (P)
Uczeń:
wyjaśnia, dlaczego wyższe kwasy
karboksylowe nazywane są kwasami
tłuszczowymi (R)
zapisuje równania reakcji spalania wyższych
kwasów tłuszczowych oraz równania reakcji
wyższych kwasów karboksylowych z
zasadami (R)
wskazuje wiązanie podwójne w cząsteczce
kwasu oleinowego (R)
projektuje doświadczenie chemiczne
umożliwiające odróżnienie kwasu
oleinowego od kwasów palmitynowego lub
stearynowego (R)
opisuje przeprowadzone doświadczenia
chemiczne (R)
identyfikuje poznane substancje (D)
otrzymywanie mydła kastylijskiego
Właściwości
kwasów
karboksylowych
15. Poznajemy
estry
Właściwości estrów
porównanie budowy oraz właściwości niższych i
wyższych kwasów karboksylowych
zależność między długością łańcucha
węglowego a stanem skupienia i
reaktywnością chemiczną kwasów
karboksylowych
porównanie właściwości kwasów organicznych
i kwasów nieorganicznych
hydroksykwasy, kwas askorbowy
Uczeń:
porównuje właściwości kwasów karboksylowych (P)
podaje przykłady kwasów organicznych
występujących w przyrodzie i wymienia ich
zastosowania (P)
nazywa proste sole kwasów organicznych (P)
reakcja estryfikacji, ogólne równanie reakcji
otrzymywanie estrów w reakcjach prostych
kw. karboksylowych z alkoholami
monohydroksylowymi
budowa estrów, wzór ogólny
nazwy estrów pochodzących od podanych
nazw kwasów i alkoholi
otrzymywanie estrów o podanej nazwie
wzór i nazwa grupy funkcyjnej
właściwości i zastosowania estrów
występowanie estrów w przyrodzie
hydroliza estrów, równania reakcji hydrolizy
estrów
Uczeń:
definiuje estry (K)
wyjaśnia, na czym polega reakcja estryfikacji (P)
zaznacza i nazywa grupę funkcyjną we wzorze
estrów (K)
zapisuje wzór ogólny estrów (K)
wymienia związki chemiczne biorące udział w
reakcji estryfikacji (K)
podaje przykłady występowania estrów w
przyrodzie (K)
wymienia reguły tworzenia nazw
systematycznych estrów (K)
podaje przykłady estrów (K)
tworzy nazwy estrów pochodzących od
podanych nazw kwasów karboksylowych i
alkoholi (proste przykłady) (P)
wymienia związki biorące udział w reakcji
estryfikacji (P)
określa sposób otrzymywania estru o podanej
nazwie, np. octanu etylu (P)
wymienia właściwości octanu etylu (P)
zapisuje obserwacje do wykonywanych
doświadczeń chemicznych (P)
Uczeń:
wyjaśnia zależność między długością
łańcucha węglowego a stanem skupienia i
reaktywnością chemiczną kwasów
karboksylowych (D)
zapisuje równania reakcji chemicznych dla
kwasów karboksylowych w postaci
cząsteczkowej, jonowej oraz skróconej
jonowej (R)
przewiduje produkty reakcji chemicznej (D)
identyfikuje poznane substancje (D)
nazywa sole kwasów organicznych (R)
porównuje właściwości kwasów
organicznych i kwasów nieorganicznych (R)
potrafi wykorzystać swoją wiedzę do
rozwiązywania złożonych zadań (D)
hydroksykwasy wyjaśnia pojęcie, przykłady,
kwas askorbowy- zastosowanie
Uczeń:
zapisuje równania reakcji chemicznych
prostych kwasów karboksylowych z
alkoholami monohydroksylowymi (R)
określa warunki przebiegu reakcji estryfikacji
(R)
tworzy wzory estrów od podanych nazw
kwasów i alkoholi (R)
projektuje doświadczenie chemiczne
umożliwiające otrzymanie estru o podanej
nazwie (D)
zapisuje równania reakcji otrzymywania
estru o podanej nazwie lub podanym
wzorze (D)
opisuje właściwości estrów w aspekcie ich
zastosowań (D)
opisuje mechanizm reakcji estryfikacji (R)
przewiduje produkty reakcji chemicznej (D)
identyfikuje poznane substancje (D)
omawia różnicę między reakcją estryfikacji a
reakcją zobojętniania (D)
potrafi wykorzystać swoją wiedzę do
rozwiązywania złożonych zadań (D)
definiuje pojęcie „reakcja hydrolizy estru”
zapisuje równania reakcji otrzymywania i
hydrolizy estru o podanej nazwie lub wzorze
16. Poznajemy
pochodne
węglowodorów
zawierające azot
Podsumowanie
działu
Aminy i
aminokwasy jako
pochodne
węglowodorów
zawierające azot
budowa amin na przykładzie metyloaminy
grupa funkcyjna amin
właściwości fizyczne i chemiczne amin na
przykładzie metyloaminy
zastosowania amin
budowa i nazewnictwo aminokwasów na
przykładzie glicyny
grupy funkcyjne aminokwasów
właściwości fizyczne i chemiczne
aminokwasów na przykładzie glicyny
wiązanie peptydowe – mechanizm tworzenia
peptydy, wiązania peptydowe, białka
aminy pierwszorzędowe, drugorzędowe i
trzeciorzędowe
aminokwasy białkowe
Uczeń:
zaznacza i nazywa grupy funkcyjne w aminach i
aminokwasach (K)
definiuje aminy i aminokwasy (K)
podaje przykłady występowania amin i
aminokwasów (K)
opisuje budowę oraz właściwości fizyczne i
chemiczne amin na przykładzie metyloaminy (P)
zapisuje wzór metyloaminy (P)
zaznacza w cząsteczce wiązanie peptydowe (P)
definiuje pojęcia: „peptyd, wiązanie peptydowe,
białka” (K)
opisuje budowę oraz właściwości fizyczne i
chemiczne aminokwasów na przykładzie glicyny
(C)
Podsumowanie wiadomości o pochodnych węglowodorów. Test wiadomości z działu „Pochodne węglowodorów”. Omówienie testu.
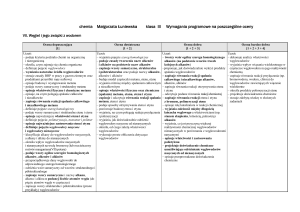
DZIAŁ 9 - Substancje o znaczeniu biologicznym
17. Poznajemy
składniki
żywności
Uczeń:
zapisuje wzory poznanych amin i
aminokwasów (R)
opisuje budowę, właściwości fizyczne
i chemiczne aminokwasów na przykładzie
glicyny (R)
analizuje konsekwencje istnienia dwóch grup
funkcyjnych w cząsteczce aminokwasu (D)
zapisuje równanie reakcji tworzenia
dipeptydu (D)
wyjaśnia mechanizm powstawania wiązania
peptydowego (D)
potrafi wykorzystać swoją wiedzę do
rozwiązywania złożonych zadań (D)
dzieli aminy na pierwszorzędowe,
drugorzędowe i trzeciorzędowe na
podstawie wzoru
wymienia aminokwasy białkowe
Poznajemy składniki
żywnościP
rola składników żywności w prawidłowym
funkcjonowaniu organizmu
występowanie składników chemicznych
żywności
makroelementy, mikroelementy, sole
mineralne, witaminy
Uczeń:
wymienia główne pierwiastki chemiczne
wchodzące w skład organizmu ludzkiego (K)
wymienia podstawowe składniki żywności i
miejsca ich występowania (K)
definiuje makro- i mikroelementy (K)
opisuje znaczenie wody, tłuszczów, białek,
sacharydów, witamin i mikroelementów dla
organizmu człowieka (K)
wymienia funkcje podstawowych składników
żywności (K)
wyjaśnia rolę składników żywności w
prawidłowym funkcjonowaniu organizmu (P)
18. Poznajemy
tłuszcze
Tłuszcze –
otrzymywanie,
właściwości i rodzaje
19. Poznajemy
białka
Występowanie,
skład i budowa
białek
wyjaśnienie chemicznego charakteru tłuszczów,
budowa tłuszczów
podział tłuszczów ze względu na stan
skupienia i pochodzenie
występowanie tłuszczów
właściwości fizyczne tłuszczów
doświadczalne odróżnianie tłuszczów
nasyconych od tłuszczów nienasyconych
otrzymywanie tłuszczów w wyniku estryfikacji
glicerolu wyższym kwasem tłuszczowym
identyfikacja tłuszczów- próba akroleinowa
utwardzanie tłuszczów
zmydlanie tłuszczów – równania reakcji
metaboliczna przemiana tłuszczów
pojęcie „lipaza”
Uczeń:
wymienia pierwiastki chemiczne, których atomy
wchodzą w skład cząsteczek tłuszczów (K)
klasyfikuje tłuszcze ze względu na pochodzenie,
stanu skupienia i charakter chemiczny (K)
podaje przykłady tłuszczów (K)
podaje najważniejsze właściwości omawianych
związków chemicznych (K)
wyjaśnia, czym są tłuszcze (P)
opisuje właściwości fizyczne tłuszczów (P)
określa wpływ oleju roślinnego na wodę bromową
(P)
białka jako związki chemiczne powstające z
aminokwasów
występowanie i podział białek
skład pierwiastkowy białek
planowanie doświadczenia umożliwiającego
zbadanie składu pierwiastkowego białek
rodzaje białek prostych i złożonych
Uczeń:
wymienia pierwiastki chemiczne, których atomy
wchodzą w skład cząsteczek białek (K)
wymienia rodzaje białek (K)
wymienia miejsca występowania białek (K)
definiuje białka jako związki chemiczne
powstające z aminokwasów (K)
podaje przykłady białek (K)
opisuje, co to są związki wielkocząsteczkowe
i wymienia ich przykłady (K)
Uczeń:
podaje wzór ogólny tłuszczów (R)
wyjaśnia różnicę w budowie tłuszczów
stałych i ciekłych (R)
podaje wzór tristearynianu glicerolu (D)
planuje doświadczenie chemiczne
umożliwiające zbadanie składu
pierwiastkowego tłuszczów (D)
projektuje doświadczenie chemiczne
umożliwiające odróżnienie tłuszczu
nasyconego od tłuszczu nienasyconego (R)
planuje doświadczenia chemiczne
umożliwiające badanie właściwości
omawianych związków chemicznych (D)
identyfikuje poznane substancje (D)
opisuje przeprowadzane doświadczenia
chemiczne (D)
wyjaśnia, dlaczego olej roślinny odbarwia
wodę bromową (R)
wyjaśnia, na czym polega metoda
utwardzania tłuszczów
potrafi przeprowadzić reakcję zmydlania
tłuszczów
zapisuje równania reakcji otrzymywania i
zmydlania podanego tłuszczu, np.
tristearynianu glicerolu
wyjaśnia, na czym polega próba akroleinowa
potrafi zaplanować i przeprowadzić
doświadczenie otrzymywania tłuszczów w
wyniku reakcji estryfikacji glicerolu z wyższym
kwasem tłuszczowym, podać obserwacje,
wnioski i zapisać równania reakcji
omawia hydrolityczny metabolizm tłuszczów w
organizmach i znaczenie lipaz
Uczeń:
projektuje doświadczenie chemiczne
umożliwiające zbadanie składu
pierwiastkowego białek
wymienia rodzaje białek
Właściwości białek
20. Poznajemy
sacharydy
Budowa i rodzaje
cukrów.
Monosacharydy
doświadczalne badanie właściwości białekwpływ ogrzewania, stęż. etanolu, kwasów i
zasad, soli metali ciężkich oraz soli
kuchennej
próba ksantoproteinowaP
reakcja biuretowa
denaturacja i koagulacja – czynniki,
różnice
reakcje charakterystyczne białek –
wykrywanie białek
efekt Tyndalla
Uczeń:
opisuje właściwości białek (P)
wymienia czynniki, które powodują denaturację
białek (K)
wymienia czynniki, które powodują koagulację
białek (P)
definiuje pojęcia „denaturacja” i „koagulacja” (K)
opisuje różnice w przebiegu denaturacji i
koagulacji białek (P)
wykrywa obecność białka w produktach
spożywczych (P)
podaje reakcje charakterystyczne białek (K)
budowa sacharydów (cukrów)
podział sacharydów – monosacharydy,
oligosacharydy, polisacharydy
wzory ogólne cukrów prostych i złożonych
budowa i wzory sumaryczne glukozy i
fruktozy
właściwości fizyczne, występowanie oraz
zastosowanie glukozy
pojęcie „izomer”
przebieg fotosyntezy
reakcje charakterystyczne glukozy- próby:
Trommera i Tollensa
pojęcia ”hipoglikemia, hiperglikemia, galaktoza,”
glikogen
Uczeń:
wymienia pierwiastki chemiczne, których atomy
wchodzą w skład cząsteczek cukrów (K)
dokonuje podziału sacharydów (K)
podaje przykłady sacharydów (K)
definiuje pojęcie „węglowodany” (K)
zapisuje wzory sumaryczne glukozy i fruktozy (K)
opisuje właściwości fizyczne glukozy (K)
omawia budowę glukozy (P)
wymienia zastosowania glukozy (K)
omawia fotosyntezę (P)
Uczeń:
projektuje i wykonuje doświadczenie
chemiczne badające zachowanie białka pod
wpływem: ogrzewania, stężonego roztworu
etanolu, kwasów i zasad, soli metali ciężkich
(np. CuSO4) i soli metali lekkich (np. NaCl)
(D)
opisuje przeprowadzane doświadczenia
chemiczne (R)
objaśnia pojęcia: „peptydy”, „zol”, „żel”,
„koagulacja”, „peptyzacja” (R)
definiuje pojęcie wiązanie peptydowe (R)
planuje doświadczenie chemiczne
umożliwiające zbadanie składu
pierwiastkowego białek (D)
projektuje doświadczenie chemiczne
umożliwiające wykrycie białka (D)
wyjaśnia, na czym polega wysalanie białka
(D)
identyfikuje poznane substancje (D)
umie zaplanować i przeprowadzić reakcje
weryfikujące postawioną hipotezę (D)
podaje produkty hydrolizy białka
demonstruje i omawia efekt Tyndalla
Uczeń:
projektuje doświadczenie chemiczne
umożliwiające zbadanie składu
pierwiastkowego cukrów (D)
projektuje i wykonuje doświadczenie
chemiczne umożliwiające zbadanie
właściwości glukozy (D)
opisuje przeprowadzane doświadczenia
chemiczne (R)
opisuje znaczenie i zastosowania sacharozy
(R)
definiuje pojęcie izomery (D)
umie zaplanować i przeprowadzić reakcje
weryfikujące postawioną hipotezę (D)
identyfikuje poznane substancje (D)
wyjaśnia sposób wykrywania glukozy
udowadnia redukujące właściwości glukozy i
wyjaśnia je
przeprowadza próbę Trommera i próbę
Tollensa dla glukozy
wyjaśnia pojęcie galaktoza
omawia znaczenie glikogenu (D)
Substancje silnie
działające na
organizm
człowieka
Podsumowanie
działu
Budowa i
właściwości
disacharydów
budowa i wzór sumaryczny sacharozy
właściwości sacharozy
występowanie i zastosowania sacharozy
hydroliza sacharozy i jej znaczenie w organizmie
podczas trawienia
reakcja sacharozy z wodą
maltoza, laktoza
Uczeń:
zapisuje wzór sumaryczny sacharozy (K)
opisuje właściwości fizyczne sacharozy (P)
wymienia zastosowania sacharozy (K)
definiuje pojęcie „reakcja hydrolizy” (K)
zapisuje za pomocą wzorów sumarycznych
równanie reakcji sacharozy z wodą (P)
Budowa i
właściwości
polisacharydów –
skrobia i celuloza
Uczeń:
opisuje występowanie celulozy i skrobi w
przyrodzie (K)
zapisuje wzory sumaryczne skrobi i celulozy (K)
opisuje właściwości fizyczne skrobi
i celulozy (P)
zapisuje reakcję charakterystyczną dla skrobi (K)
definiuje związki wielkocząsteczkowe i podaje
ich przykłady (K)
omawia przebieg reakcji hydrolizy skrobi i
celulozy (P)
wykrywa obecność skrobi w produktach
spożywczych (P)
opisuje zastosowania skrobi i celulozy (P)
Substancje silnie
działające na
organizm człowieka
rodzaje uzależnień
substancje powodujące uzależnienia
skutki uzależnień
występowanie skrobi i celulozy w przyrodzie
budowa i wzory skrobi i celulozy
właściwości fizyczne skrobi i celulozy
znaczenie i zastosowania skrobi i celulozy
doświadczalne wykrywanie skrobi w produktach
spożywczych
schemat reakcji hydrolizy skrobi
kleik skrobiowy, dekstryny
Uczeń:
wymienia rodzaje uzależnień
wymienia i opisuje substancje powodujące
uzależnienia oraz skutki uzależnień
Uczeń:
wyjaśnia, że sacharoza jest disacharydem (R)
projektuje doświadczenia chemiczne
umożliwiające zbadanie właściwości
sacharozy (R)
opisuje przeprowadzane doświadczenia
chemiczne (R)
opisuje znaczenie i zastosowania sacharozy
(R)
umie zaplanować i przeprowadzić reakcje
weryfikujące postawioną hipotezę (D)
identyfikuje poznane substan. (D)
podaje wzory i charakteryzuje maltozę i
laktozę
doświadczalnie odróżnienia glukozę od
sacharozy
Uczeń:
porównuje budowę cząsteczek skrobi i
celulozy (R)
wymienia różnice we właściwościach
fizycznych skrobi i celulozy (R)
zapisuje poznane równania reakcji hydrolizy
sacharydów (R)
planuje doświadczenia chemiczne
umożliwiające zbadanie właściwości skrobi i
celulozy (R)
opisuje przeprowadzane doświadczenia
chemiczne (R)
opisuje znaczenie i zastosowanie skrobi i
celulozy (R)
udowadnia, że skrobia i celuloza są
polisacharydami (D)
wyjaśnia, czym są dekstryny (D)
omawia hydrolizę skrobi (D)
projektuje doświadczenia chemiczne
umożliwiające wykrycie obecności skrobi w
produktach spożywczych (D)
weryfikuje postawione hipotezy (D)
Uczeń:
definiuje pojęcie „uzależnienie”
opisuje szkodliwy wpływ niektórych
substancji uzależniających na organizm
ludzki
Podsumowanie wiadomości o substancjach mających znaczenie biologiczne. Test wiadomości z działu „Substancje o znaczeniu biologicznym”. Omówienie testu.
Wewnętrzna budowa
materii
Substancje i ich właściwości
Substancje i ich
właściwości
LEKCJE POWTÓRZENIOWE DO EGZAMINU GIMNAZJALNEGO
Właściwości substancji.
Obliczanie gęstości,
Zjawisko fizyczne a reakcja chemiczna,
Mieszaniny substancji – otrzymywanie,
Rozdzielanie mieszanin,
Pierwiastek chemiczny a związek chemiczny,
Metale i niemetale. Stopy metali
Związek chemiczny a mieszaninap
Uczeń ma pełen zakres wiadomości i umiejętności
opanowanych na poziomie podstawowym z
podstawy programowej gimnazjum
przewidzianych wymaganiami edukacyjnymi dla
klasy I
Uczeń ma pełen zakres wiadomości i
umiejętności opanowanych na poziomie
ponadpodstawowym z podstawy programowej
gimnazjum przewidzianych wymaganiami
edukacyjnymi dla klasy I
Powietrze,
Tlen i jego właściwości,
Tlenki – związki chemiczne tlenu z innymi
pierwiastkami,
Azot- główny składnik powietrza. Gazy
szlachetne,
Tlenek węgla(IV) –właściwości i rola w
przyrodzie,
Rola pary wodnej w powietrzu,
Zanieczyszczenia powietrza,
Wodór i jego właściwości.
Reakcje egzoenergetyczne, endoenergetyczne,
Synteza, analiza, wymiana
Uczeń ma pełen zakres wiadomości i umiejętności
opanowanych na poziomie podstawowym z
podstawy programowej gimnazjum
przewidzianych wymaganiami edukacyjnymi dla
klasy I
Uczeń ma pełen zakres wiadomości i
umiejętności opanowanych na poziomie
ponadpodstawowym z podstawy programowej
gimnazjum przewidzianych wymaganiami
edukacyjnymi dla klasy I
Powtórzenie
wiadomości o
budowie materii i
budowie układu
okresowego
pierwiastków
chemicznych
Ziarnista budowa materii
Masa i rozmiary atomów,
Obliczanie mas cząsteczkowych,
Budowa atomu,
Liczba atomowa i liczba masowa,
Zadania na zastosowanie liczb: atomowej i
masowej,
Izotopy.
Układ okresowy pierwiastków chemicznych.
Charakter chemiczny pierwiastków grup
głównych,
Zależność między budową atomu pierwiastka a
jego położeniem w układzie okresowym
Uczeń ma pełen zakres wiadomości i umiejętności
opanowanych na poziomie podstawowym z
podstawy programowej gimnazjum
przewidzianych wymaganiami edukacyjnymi dla
klasy I
Uczeń ma pełen zakres wiadomości i
umiejętności opanowanych na poziomie
ponadpodstawowym z podstawy programowej
gimnazjum przewidzianych wymaganiami
edukacyjnymi dla klasy I
Wiązania chemiczne.
Wartościowość,
Równania reakcji
chemicznych,
prawa chemiczne przypomnienie
Wiązania kowalencyjne i jonowe,
Znaczenie wartościowości pierwiastków przy
ustalaniu wzorów związków chemicznych,
Prawo stałości składu związku chemicznego
Równania reakcji chemicznych. Bilansowanie
równań
Prawo zachowania masy
Obliczenia stechiometryczne
Uczeń ma pełen zakres wiadomości i umiejętności
opanowanych na poziomie podstawowym z
podstawy programowej gimnazjum
przewidzianych wymaganiami edukacyjnymi dla
klasy I i II
Uczeń ma pełen zakres wiadomości i
umiejętności opanowanych na poziomie
ponadpodstawowym z podstawy programowej
gimnazjum przewidzianych wymaganiami
edukacyjnymi dla klasy I i II
Powtórzenie
wiadomości o
substancjach i ich
właściwościach –
zagadnienia
podstawowe
Powietrze.
Typy reakcji
chemicznych powtórzenie
Woda i roztwory
wodne
Kwasy
Wodorotlenki
Sole
Woda. Roztwory
wodne- powtórzenie.
Woda- właściwości i rola w przyrodzie.
Zanieczyszczenia wód.
Woda jako rozpuszczalnik
Szybkość rozpuszczania się substancji
Rozpuszczalność substancji w wodzie
Rodzaje roztworów,
Stężenie procentowe roztworu
Uczeń ma pełen zakres wiadomości i umiejętności
opanowanych na poziomie podstawowym z
podstawy programowej gimnazjum
przewidzianych wymaganiami edukacyjnymi dla
klasy II
Uczeń ma pełen zakres wiadomości i
umiejętności opanowanych na poziomie
ponadpodstawowym z podstawy programowej
gimnazjum przewidzianych wymaganiami
edukacyjnymi dla klasy II
Kwasy tlenowe i
beztlenowe powtórzenie
Poznajemy elektrolity i nieelektrolity,
Kwas chlorowodorowy i kwas siarkowodorowy,
Kwas siarkowy(VI), Kwas siarkowy(IV),
Kwas azotowy(V), Kwas węglowy, kwas
fosforowy(V) – właściwości reakcje i
zastosowanie, Kwaśne opady.
Uczeń ma pełen zakres wiadomości i umiejętności
opanowanych na poziomie podstawowym z
podstawy programowej gimnazjum
przewidzianych wymaganiami edukacyjnymi dla
klasy II
Uczeń ma pełen zakres wiadomości i
umiejętności opanowanych na poziomie
ponadpodstawowym z podstawy programowej
gimnazjum przewidzianych wymaganiami
edukacyjnymi dla klasy II
Wodorotlenki i
zasady przypomnienie
Wodorotlenek sodu i wodorotlenek potasu,
Wodorotlenek wapnia, wodorotlenek glinu i
innych wodorotlenków, zasady a wodorotlenki.
Dysocjacja jonowa zasad,
pH roztworów
Uczeń ma pełen zakres wiadomości i umiejętności
opanowanych na poziomie podstawowym z
podstawy programowej gimnazjum
przewidzianych wymaganiami edukacyjnymi dla
klasy II
Uczeń ma pełen zakres wiadomości i
umiejętności opanowanych na poziomie
ponadpodstawowym z podstawy programowej
gimnazjum przewidzianych wymaganiami
edukacyjnymi dla klasy II
Sole ich
otrzymywanie i
zastosowanie powtórzenie
Wzory i nazwy soli,
Dysocjacja jonowa soli,
Otrzymywanie soli w reakcjach zobojętniania,
w reakcjach metali z kwasami, tlenków metali
z kwasami, wodorotlenków metali z tlenkami
niemetali, w reakcjach strąceniowych.
Zastosowania soli
Uczeń ma pełen zakres wiadomości i umiejętności
opanowanych na poziomie podstawowym z
podstawy programowej gimnazjum
przewidzianych wymaganiami edukacyjnymi dla
klasy II
Uczeń ma pełen zakres wiadomości i
umiejętności opanowanych na poziomie
ponadpodstawowym z podstawy programowej
gimnazjum przewidzianych wymaganiami
edukacyjnymi dla klasy II