Przedmiotowy System Oceniania z Chemii.
Klasa 3.
Nauczanie chemii w Miejskim Zespole Szkół w Kłodzku w Gimnazjum nr 2 odbywa się według programu nauczania chemii w gimnazjum Nowa
Era. Do nauki chemii wykorzystujemy podręczniki ,,Chemia Nowej Ery” część 1,2,3” (nr dopuszczenia : 49/1/2009 49/2/2010, 49/3/2011) jest
to praca zbiorowa pod redakcją Kulawik T., Litwin M., a wydawcą jest Nowa Era
Przedmiotowy system oceniania zgodny jest z WSO Miejskiego Zespołu Szkół w Kłodzku
1. Przedmiotowy System Oceniania z chemii obejmuje ocenę wiadomości i umiejętności wynikających z programu nauczania oraz postawy ucznia na
lekcji.
2. Ocenie podlegają następujące umiejętności i wiadomości:
Rozumienie pojęć chemicznych
Posługiwanie się pojęciami chemicznymi
Posługiwanie się chemicznym językiem naukowym i słownictwem
Rozwiązywanie problemów z zakresu chemii
Stosowanie wiedzy z chemii w sytuacjach praktycznych, problemowych – typowych i nietypowych
Aktywność na lekcji
Umiejętność pracy w grupie
Wkład pracy ucznia
Planowanie i przeprowadzanie doświadczenia. Analizowanie wyników, przedstawianie wyników w tabelce lub na wykresie, wyciąganie wniosków,
wskazywanie źródła błędów
Odczytywanie oraz przedstawianie informacji za pomocą tabeli, rysunku, schematu.
Rozwiązywanie zadań rachunkowych, a w tym:
- dokonanie analizy zadania,
- tworzenie planu rozwiązania zadania,
- znajomość wzorów,
- znajomość wielkości fizycznych i ich jednostek,
- przekształcanie wzorów,
- wykonywanie obliczeń na liczbach i jednostkach,
- analizę otrzymanego wyniku,
- sformułowanie odpowiedzi.
• Systematyczne i staranne prowadzenie zeszytu przedmiotowego.
3. Przy ocenie wyżej wymienionych umiejętności i wiadomości stosowane będą następujące formy oceniania:
• Wypowiedzi ustne dotyczące wiadomości i umiejętności wynikających z aktualnie realizowanych treści programowych(przynajmniej raz w
semestrze ). Podstawą oceny jest rzeczowość, stosowanie języka przedmiotu, formułowanie dłuższych wypowiedzi. Przy odpowiedzi
obowiązuje znajomość materiału z trzech ostatnich lekcji, a w przypadku lekcji powtórzeniowej z całego działu. Uczeń dwa razy w semestrze
może zgłosić nieprzygotowanie do odpowiedzi, jednak nie dotyczy to lekcji powtórzeniowych.
• Sprawdziany pisemne sprawdzające wiadomości i umiejętności, przeprowadzane po zakończeniu każdego działu. Będą zapowiedziane
przynajmniej tydzień wcześniej. W przypadku nieobecności ucznia w tym dniu w szkole obowiązek napisania sprawdzianu zostaje przesunięty
na następną, najbliższą lekcję. W przypadku dłuższej nieobecności, spowodowanej np. chorobą, uczeń może uzgodnić z nauczycielem inną
formę i termin zaliczenia materiału objętego sprawdzianem.
• Kartkówki obejmujące wiadomości i umiejętności z trzech ostatnich lekcji (nie muszą być zapowiadane) lub z większej partii materiału
(zapowiadane wcześniej), od 2 do 5 w semestrze.
• Prezentacja wiedzy i umiejętności w czasie lekcji, obejmująca ustne odpowiedzi na pytania związane z zagadnieniami poruszanymi w czasie
lekcji. Będzie oceniana za pomocą plusów (gdy uczeń zgromadzi trzy „+” otrzymuje ocenę bardzo dobrą).
• Rozwiązywanie zadań rachunkowych . Podstawą oceny jest znajomość odpowiednich praw i wzorów, samodzielność pracy i poprawność
rozwiązania.
• Prace domowe polegające na sprawdzeniu umiejętności nabywanych w trakcie realizowania bieżącego działu programowego lub umiejętności
kluczowych.
• Zeszyt przedmiotowo-ćwiczeniowy sprawdzany pod względem staranności, systematyczności i poprawności rzeczowej przynajmniej raz w ciągu
roku szkolnego.
Praca w grupie. Organizacja grupy, komunikacja w grupie, prezentowanie rezultatów pracy grupy przez ucznia.
Prace długoterminowe, prace projektowe -zrozumienie zadania; zaplanowanie rozwiązań (oryginalność), realizacja rozwiązań;
prezentacja otrzymanych wyników; zastosowanie posiadanej wiedzy przedmiotowej, estetyka wykonania.
Przeprowadzone doświadczenia i eksperymenty.
Wykonane samodzielnie modele, urządzenia i pomoce naukowe.
Aktywność poza lekcjami chemii np. udział i wyniki w konkursach.
4. W przypadku sprawdzianów lub kartkówek przyjmuje się skalę punktową przeliczaną na oceny cyfrowe wg kryteriów:
100% - 90%
bardzo dobry
89,99% - 75%
dobry
74,99% - 51%
dostateczny
50% - 40%
dopuszczający
39,99% - 0,00
niedostateczny
Ocenę celującą uczeń otrzymuje wówczas, gdy z części obowiązkowej dostanie ocenę bardzo dobrą a ponadto prawidłowo rozwiąże zadanie
dodatkowe o zwiększonym stopniu trudności lub wykraczające poza treści obowiązkowe. W przypadku uzyskania innej oceny niż bardzo dobra,
rozwiązanie zadania dodatkowego podwyższa ocenę o jedną wzwyż.
5. Nauczyciel oddaje sprawdzone prace pisemne w terminie dwóch tygodni.
6. Uczeń ma prawo poprawić ocenę niedostateczną ze sprawdzianu w ciągu dwóch tygodni po oddaniu sprawdzianu. Dla wszystkich chętnych
ustala się jeden termin poprawy. Do dziennika, obok oceny uzyskanej poprzednio, wpisuje się ocenę „poprawioną”.
7. Ocena śródroczna i końcowo-roczna jest oceną ważoną. Podstawą do wystawiania oceny jest średnia ważona w następujący sposób: a) Każdej
ocenie cząstkowej przyporządkowuje się liczbę naturalną oznaczającą jej wagę w hierarchii ocen. b )Średnią ważoną oblicza się jako iloraz.
Średniej ważonej przypisuje się następujące wartości w skali ocen:
Poniżej 1,9
niedostateczny
1,9 – 2,60
dopuszczający
2,61 – 3,60
dostateczny
3,61 – 4,60
dobry
4,61 – 5,34
bardzo dobry
Powyżej 5,35
celujący
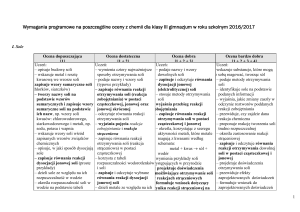
Zasady oceniania i waga poszczególnych zadań na lekcjach chemii i fizyki.
Progi procentowe i średnia ważona oceny jest zapisana w Statucie MZS.
Zadanie
Sprawdziany semestralne, projekty edukacyjne, konkursy,
Sprawdziany i testy sprawdzające po danym dziale,
Kartkówki, odpowiedź ustna, aktywność na lekcji, referaty, praca w grupach
(karty pracy), zeszyt przedmiotowy, Zadania domowe związane z podstawą
programową.
Waga
4
3
2
* fakultety dla klas trzecich
Zadania domowe, zadania dodatkowe,
1
8. Na pierwszej lekcji w roku szkolnym uczniowie zapoznawani są z PSO. Wymagania na poszczególne oceny są udostępniane uczniom. Oceny
są jawne, oparte o poznane kryteria.
Na zajęciach wprowadza się elementy oceniania kształtującego: czyli określa się cele lekcji i formułuje je w języku zrozumiałym dla ucznia.
Nauczyciel określa co chce, aby uczniowie osiągnęli. Pod koniec lekcji wraz z uczniami nauczyciel sprawdza, czy cel został osiągnięty. Ustala
wraz z uczniami kryteria oceniania, czyli to, co będzie brał pod uwagę przy ocenie pracy ucznia. Nauczyciel sam lub wraz z uczniami ustala
kryteria oceniania - co będzie brane pod uwagę przy ocenianiu .
- na zajęciach stosuje się informację zwrotną w postaci komentarza do pracy ucznia (ustnie lub pisemnie)
* wyszczególnienie i docenienie dobrych elementów pracy ucznia * wyszczególnienie i wskazówki do tego, co wymaga poprawy lub
powtórzenia przez ucznia, * wskazówki do dalszej pracy
9. Sprawdziany i inne prace pisemne są przechowywane w szkole.
10. Rodzice informowani są o sposobie oceniania z przedmiotu oraz o ocenach cząstkowych i semestralnych na zebraniach rodzicielskich lub w
czasie indywidualnych spotkań rodziców z nauczycielem. Na życzenie rodziców, podczas takich spotkań, są udostępniane do wglądu
pisemne sprawdziany.
11. Prace klasowe, krótkie sprawdziany i odpowiedzi ustne są obowiązkowe.
12. Jeżeli uczeń opuścił pracę klasową z przyczyn losowych, to powinien napisać ją w ciągu dwóch tygodni od powrotu do szkoły.
13. Przy poprawianiu prac klasowych i pisaniu w drugim terminie kryteria ocen nie zmieniają się, a otrzymana ocena jest wpisana do dziennika
obok poprzedniej.
14. Uczeń, który nie poprawił oceny w wyznaczonym terminie, traci prawo do następnych poprawek.
15. Krótkie sprawdziany mogą obejmować materiał z ostatnich trzech lekcji.
16. Kartkówki nie podlegają poprawie – chyba, że uczeń wykazuje chęć poprawy w jak najbliższym terminie (1 tydzień od oddania pracy).
17. Uczeń ma prawo do poprawienia jednej oceny ustnej w ciągu semestru.
18. Nie ma możliwości poprawienia oceny tydzień przed posiedzeniem rady klasyfikacyjnej.
19. Nie ocenia się ucznia do trzech dni po dłuższej (co najmniej tygodniowej) usprawiedliwionej nieobecności w szkole.
20. Nie ocenia się ucznia znajdującego się w trudnej sytuacji losowej. O takiej sytuacji powiadamia nauczyciela Rodzic lub Wychowawca klasy.
21. Uczeń, który opuścił więcej niż 50% lekcji, może być niesklasyfikowany z przedmiotu.
22. Dla uczniów, o którym mowa w punkcie 21 przeprowadza się egzamin klasyfikacyjny.
23. Uczeń ma prawo dwa razy w ciągu semestru zgłosić nieprzygotowanie do lekcji nie ponosząc z to żadnych konsekwencji (nie dotyczy prac
klasowych i kartkówek). Zgłoszenie następuję na początku lekcji i jest odnotowywane przez nauczyciela w rubryce „np”.
24. W czasie pisania prac klasowych i kartkówek uczeń nie może korzystać z żadnych pomocy (podręczników, zeszytów, opracowań itp.). Jeśli
uczeń „ściąga”, to najpierw otrzymuje ostrzeżenie ustne, następnie otrzymuje ocenę niedostateczną bez sprawdzania pracy.
25. Wymagania edukacyjne na poszczególne oceny: (wymagania edukacyjne w zależności od omawianej partii materiału są dostępne na stronie
internetowej Miejskiego Zespołu Szkół)
a) Ocenę celującą otrzymuje uczeń, który:
• posiada wiadomości i umiejętności wykraczające poza program nauczania,
• samodzielnie wykorzystuje wiadomości w sytuacjach nietypowych i problemowych (np. rozwiązując dodatkowe zadania o podwyższonym
stopniu trudności, wyprowadzając wzory, analizując wykresy),
• formułuje problemy i dokonuje analizy lub syntezy nowych zjawisk
• wzorowo posługuje się językiem przedmiotu,
• udziela oryginalnych odpowiedzi na problemowe pytania,
• swobodnie operuje wiedzą pochodzącą z różnych źródeł,
• osiąga sukcesy w konkursach szkolnych i pozaszkolnych,
• sprostał wymaganiom na niższe oceny.
b) Ocenę bardzo dobrą otrzymuje uczeń, który:
• w pełnym zakresie opanował wiadomości i umiejętności programowe,
• zdobytą wiedzę stosuje w nowych sytuacjach, swobodnie operuje wiedzą podręcznikową,
• stosuje zdobyte wiadomości do wytłumaczenia sytuacji problemowych i wykorzystuje je w praktyce,
• interpretuje wykresy, tabele np. układ okresowy pierwiastków
• uogólnia i wyciąga wnioski,
• podaje nie szablonowe przykłady zjawisk w przyrodzie,
• rozwiązuje nietypowe zadania,
• potrafi biegle pisać i samodzielnie uzgadniać równania reakcji chemicznych
• potrafi zaplanować i bezpiecznie przeprowadzić doświadczenie, przeanalizować wyniki, wyciągnąć wnioski, wskazać źródła błędów,
• poprawnie posługuje się językiem przedmiotu,
• udziela pełnych odpowiedzi na zadawane pytania problemowe,
• sprostał wymaganiom na niższe oceny.
c) Ocenę dobrą otrzymuje uczeń, który:
• opanował w dużym zakresie wiadomości i umiejętności określone programem nauczania (mogą wystąpić nieznaczne braki),
• potrafi korzystać z układu okresowego pierwiastków, wykresów, tablic i innych źródeł wiedzy chemicznej,
- potrafi bezpiecznie wykonać doświadczenia chemiczne,
- potrafi pisać i uzgadniać równania reakcji chemicznych.
• rozwiązuje typowe zadania rachunkowe i problemowe, wykonuje konkretne obliczenia, również na podstawie wykresu (przy ewentualnej
niewielkiej pomocy nauczyciela),
• potrafi sporządzić wykres,
• sprostał wymaganiom na niższe oceny.
d) Ocenę dostateczną otrzymuje uczeń, który:
• opanował w podstawowym zakresie wiadomości i umiejętności określone programem nauczania (występują tu jednak braki),
• potrafi z pomocą nauczyciela, pisać i uzgadniać równania reakcji chemicznych
• potrafi korzystać, z pomocą nauczyciela, z takich źródeł wiedzy, jak: układ okresowy pierwiastków, wykresy, tablice,
• językiem przedmiotu posługuje się z usterkami,
• sprostał wymaganiom na niższą ocenę.
e) Ocenę dopuszczającą otrzymuje uczeń, który:
• ma braki w wiadomościach i umiejętnościach określonych programem, ale braki te nie przekreślają możliwości dalszego kształcenia,
• z pomocą nauczyciela potrafi bezpiecznie wykonać bardzo proste eksperymenty chemiczne, pisać proste wzory chemiczne i proste
równania chemiczne.
• rozwiązuje bardzo proste zadania i problemy przy wydatnej pomocy nauczyciela,
• językiem przedmiotu posługuje się nieporadnie,
• prowadzi systematycznie i starannie zeszyt przedmiotowy.
f) Ocenę niedostateczną otrzymuje uczeń, który:
- nie opanował tych wiadomości i umiejętności, które są niezbędne do dalszego kształcenia,
- nie potrafi rozwiązać zadań teoretycznych lub praktycznych o elementarnym stopniu trudności, nawet z pomocą nauczyciela.
-nie zna symboliki chemicznej,
- nie potrafi napisać prostych wzorów chemicznych i najprostszych równań chemicznych nawet z pomocą nauczyciela,
- nie potrafi bezpiecznie posługiwać się prostym sprzętem laboratoryjnym i odczynnikami chemicznymi.
Na ocenę wpływ także mają indywidualne możliwości uczniów, ich wkład pracy. Aktywność uczniów. Rozwiązywanie prostych zadań z
pomocą nauczyciela. Wykonywanie zadań dodatkowych.
Do powyższego PSO dołączone są wymagania na poszczególne oceny zgodne z programem nauczania Chemia Nowej Ery w gimnazjum cz.3.
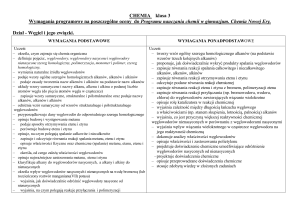
Wymagania programowe na poszczególne oceny
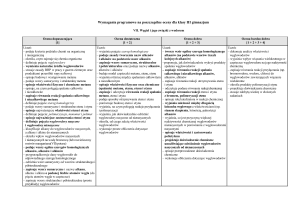
VII. Węgiel i jego związki z wodorem
Ocena dopuszczająca
[1]
Ocena dostateczna
[1 + 2]
Ocena dobra
[1 + 2 + 3]
Ocena bardzo dobra
[1 + 2 + 3 + 4]
Uczeń:
– podaje kryteria podziału chemii na organiczną
i nieorganiczną
– określa, czym zajmuje się chemia organiczna
– definiuje pojęcie węglowodory
– wymienia naturalne źródła węglowodorów
– stosuje zasady BHP w pracy z gazem ziemnym oraz
produktami przeróbki ropy naftowej
– opisuje budowę i występowanie metanu
– podaje wzory sumaryczny i strukturalny metanu
– opisuje właściwości fizyczne i chemiczne metanu
– opisuje, na czym polegają spalanie całkowite
i niecałkowite
– zapisuje równania reakcji spalania całkowitego
i niecałkowitego metanu
– definiuje pojęcie szereg homologiczny
– podaje wzory sumaryczne i strukturalne etenu i etynu
– opisuje najważniejsze właściwości etenu i etynu
– definiuje pojęcia: polimeryzacja, monomer i polimer
– opisuje najważniejsze zastosowania etenu i etynu
– definiuje pojęcia węglowodory nasycone
i węglowodory nienasycone
– klasyfikuje alkany do węglowodorów nasyconych,
a alkeny i alkiny do nienasyconych
– określa wpływ węglowodorów nasyconych
i nienasyconych na wodę bromową (lub rozcieńczony
roztwór manganianu(VII) potasu)
– podaje wzory ogólne szeregów homologicznych
alkanów, alkenów i alkinów
– przyporządkowuje dany węglowodór do
odpowiedniego szeregu homologicznego
– odróżnia wzór sumaryczny od wzorów strukturalnego i
półstrukturalnego
– zapisuje wzory sumaryczne i nazwy alkanu,
alkenu i alkinu o podanej liczbie atomów węgla (do
pięciu atomów węgla w cząsteczce)
Uczeń:
– wyjaśnia pojęcie szereg homologiczny
– podaje zasady tworzenia nazw alkenów
i alkinów na podstawie nazw alkanów
– zapisuje wzory sumaryczne, strukturalne
i półstrukturalne oraz podaje nazwy alkanów,
alkenów i alkinów
– buduje model cząsteczki metanu, etenu, etynu
– wyjaśnia różnicę między spalaniem całkowitym
a niecałkowitym
– opisuje właściwości fizyczne oraz chemiczne
(spalanie) metanu, etanu, etenu i etynu
– zapisuje i odczytuje równania reakcji spalania
metanu, etenu i etynu
– podaje sposoby otrzymywania etenu i etynu
– porównuje budowę etenu i etynu
– wyjaśnia, na czym polegają reakcje przyłączania
i polimeryzacji
– wyjaśnia, jak doświadczalnie odróżnić
węglowodory nasycone od nienasyconych
– określa, od czego zależą właściwości
węglowodorów
– wykonuje proste obliczenia dotyczące
węglowodorów
Uczeń:
– tworzy wzór ogólny szeregu homologicznego
alkanów (na podstawie wzorów trzech
kolejnych alkanów)
–proponuje, jak doświadczalnie wykryć produkty
spalania węglowodorów
– zapisuje równania reakcji spalania
całkowitego i niecałkowitego alkanów,
alkenów, alkinów
– zapisuje równania reakcji otrzymywania etenu
i etynu
– odczytuje podane równania reakcji chemicznej
– zapisuje równania reakcji etenu i etynu
z bromem, polimeryzacji etenu
– opisuje rolę katalizatora w reakcji chemicznej
– wyjaśnia zależność między długością
łańcucha węglowego a właściwościami (np.
stanem skupienia, lotnością, palnością)
alkanów
– wyjaśnia, co jest przyczyną większej
reaktywności chemicznej węglowodorów
nienasyconych w porównaniu z węglowodorami
nasyconymi
– opisuje właściwości i zastosowania
polietylenu
– projektuje doświadczenie chemiczne
umożliwiające odróżnienie węglowodorów
nasyconych od nienasyconych
– opisuje przeprowadzane doświadczenia
chemiczne
Uczeń:
– dokonuje analizy właściwości
węglowodorów
– wyjaśnia wpływ wiązania wielokrotnego w
cząsteczce węglowodoru na jego reaktywność
chemiczną
– zapisuje równania reakcji przyłączania (np.
bromowodoru, wodoru, chloru) do
węglowodorów zawierających wiązanie
wielokrotne
– określa produkty polimeryzacji etynu
– projektuje doświadczenia chemiczne
– stosuje zdobytą wiedzę w złożonych
zadaniach
– zapisuje wzory strukturalne i półstrukturalne (proste
przykłady) węglowodorów
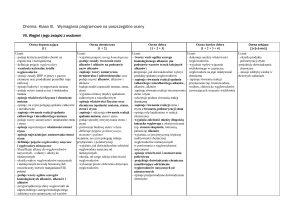
Wybrane wiadomości i umiejętności wykraczające poza treści wymagań podstawy programowej; ich nabycie przez ucznia może być podstawą do wystawienia
oceny celującej. Uczeń:
– potrafi wykryć obecność węgla i wodoru w związkach organicznych
– wyjaśnia pojęcie destylacja frakcjonowana ropy naftowej
– wymienia produkty destylacji frakcjonowanej ropy naftowej
– określa właściwości i zastosowania produktów destylacji frakcjonowanej ropy naftowej
– omawia jakie skutki dla środowiska przyrodniczego, ma wydobywanie i wykorzystywanie ropy naftowej
– wyjaśnia pojęcia: izomeria, izomery
– wyjaśnia pojęcie kraking
– zapisuje równanie reakcji podstawienia (substytucji)
– charakteryzuje tworzywa sztuczne
– podaje właściwości i zastosowania wybranych tworzyw sztucznych
– wymienia przykładowe oznaczenia opakowań wykonanych z polietylenu
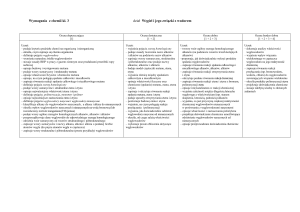
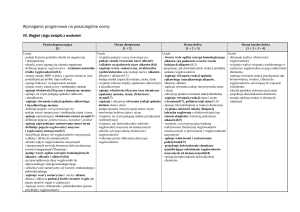
VIII. Pochodne węglowodorów
Ocena dopuszczająca
[1]
Uczeń:
– dowodzi, że alkohole, kwasy karboksylowe, estry,
aminy, aminokwasy są pochodnymi węglowodorów
– opisuje budowę pochodnych węglowodorów (grupa
węglowodorowa + grupa funkcyjna)
– wymienia pierwiastki chemiczne wchodzące w skład
pochodnych węglowodorów
– klasyfikuje daną substancję organiczną do
odpowiedniej grupy związków chemicznych
– określa, co to jest grupa funkcyjna
– zaznacza grupy funkcyjne w alkoholach, kwasach
karboksylowych, estrach, aminach i aminokwasach i
podaje ich nazwy
– zapisuje wzory ogólne alkoholi, kwasów
karboksylowych i estrów
– zapisuje wzory sumaryczne i strukturalne prostych
alkoholi monohydroksylowych i kwasów
karboksylowych (do 2 atomów węgla w cząsteczce)
oraz tworzy ich nazwy
– zaznacza we wzorze kwasu karboksylowego resztę
kwasową
Ocena dostateczna
[1 + 2]
Uczeń:
– zapisuje nazwy i wzory omawianych grup
funkcyjnych
– zapisuje wzory i wymienia nazwy alkoholi
– zapisuje wzory sumaryczny i strukturalny
glicerolu
– uzasadnia stwierdzenie, że alkohole i kwasy
karboksylowe tworzą szeregi homologiczne
– podaje odczyn roztworu alkoholu
– opisuje fermentację alkoholową
– zapisuje równania reakcji spalania etanolu
– podaje przykłady kwasów organicznych
występujących w przyrodzie i wymienia ich
zastosowania
Ocena dobra
[1 + 2 + 3]
Uczeń:
– wyjaśnia, dlaczego alkohol etylowy wykazuje
odczyn obojętny
– wyjaśnia, w jaki sposób tworzy się nazwę
systematyczną glicerolu
– zapisuje równania reakcji spalania alkoholi
– podaje nazwy zwyczajowe i systematyczne
kwasów karboksylowych
– wyjaśnia, dlaczego wyższe kwasy karboksylowe
nazywa się kwasami tłuszczowymi
– porównuje właściwości kwasów organicznych i
nieorganicznych
– porównuje właściwości kwasów
karboksylowych
– tworzy nazwy prostych kwasów
– podaje metodę otrzymywania kwasu octowego
karboksylowych (do 5 atomów węgla w
– wyjaśnia proces fermentacji octowej
cząsteczce) oraz zapisuje ich wzory sumaryczne i – opisuje równania reakcji chemicznych dla
strukturalne
kwasów karboksylowych
– podaje nazwy soli kwasów organicznych
– podaje właściwości kwasów metanowego
– określa miejsce występowania wiązania
(mrówkowego) i etanowego (octowego)
podwójnego w cząsteczce kwasu oleinowego
– omawia dysocjację jonową kwasów
Ocena bardzo dobra
[1 + 2 + 3 + 4]
Uczeń:
– proponuje doświadczenie chemiczne
do podanego tematu
– formułuje wnioski z doświadczeń
chemicznych
– przeprowadza doświadczenia chemiczne
– zapisuje wzory dowolnych alkoholi
i kwasów karboksylowych
– zapisuje równania reakcji chemicznych
dla alkoholi, kwasów karboksylowych
o wyższym stopniu trudności (np. więcej
niż 5 atomów węgla w cząsteczce) (dla
alkoholi i kwasów karboksylowych)
– wyjaśnia zależność między długością
łańcucha węglowego a stanem skupienia
i reaktywnością chemiczną alkoholi
oraz kwasów karboksylowych
– zapisuje równania reakcji otrzymywania
estru o podanej nazwie lub podanym
wzorze
– projektuje doświadczenie chemiczne
– określa, co to są nazwy zwyczajowe i systematyczne
– wymienia reguły tworzenia nazw systematycznych
związków organicznych
– podaje nazwy zwyczajowe omawianych kwasów
karboksylowych (mrówkowy, octowy)
– opisuje najważniejsze właściwości metanolu,
etanolu, glicerolu oraz kwasów etanowego
i metanowego
– zapisuje równanie reakcji spalania metanolu
– opisuje podstawowe zastosowania etanolu i kwasu
etanowego
– dokonuje podziału alkoholi na monohydroksylowe,
polihydroksylowe oraz kwasów karboksylowych na
nasycone i nienasycone
– określa, co to są alkohole polihydroksylowe
– wymienia dwa najważniejsze kwasy tłuszczowe
– opisuje właściwości długołańcuchowych kwasów
karboksylowych (kwasów tłuszczowych:
stearynowego i oleinowego)
– definiuje pojęcie mydła
– wymienia związki chemiczne, będące substratami
reakcji estryfikacji
– definiuje pojęcie estry
– wymienia przykłady występowania estrów w
przyrodzie
– opisuje zagrożenia związane z alkoholami (metanol,
etanol)
– zna toksyczne właściwości poznanych substancji
– określa, co to są aminy i aminokwasy
– podaje przykłady występowania amin i
aminokwasów
karboksylowych
– zapisuje równania reakcji spalania, reakcji
dysocjacji jonowej, reakcji z: metalami,
tlenkami metali i zasadami kwasów
metanowego i etanowego
– podaje nazwy soli pochodzących od kwasów
metanowego i etanowego
– podaje nazwy wyższych kwasów
karboksylowych
– zapisuje wzory sumaryczne kwasów
palmitynowego, stearynowego i oleinowego
– opisuje, jak doświadczalnie udowodnić, że dany
kwas karboksylowy jest kwasem nienasyconym
– podaje przykłady estrów
– tworzy nazwy estrów pochodzących
od podanych nazw kwasów i alkoholi (proste
przykłady)
– wyjaśnia, na czym polega reakcja estryfikacji
– określa sposób otrzymywania wskazanego estru,
np. octanu etylu
– wymienia właściwości fizyczne octanu etylu
– opisuje budowę i właściwości amin na
przykładzie metyloaminy
– zapisuje wzór najprostszej aminy
– opisuje negatywne skutki działania etanolu
na organizm ludzki
– zapisuje obserwacje do wykonywanych
doświadczeń chemicznych
– projektuje doświadczenie chemiczne
umożliwiające odróżnienie kwasów
oleinowego od palmitynowego lub
stearynowego
– zapisuje równania reakcji chemicznych
prostych kwasów karboksylowych
z alkoholami monohydroksylowymi
– zapisuje równania reakcji otrzymywania
podanych estrów
– tworzy wzory estrów na podstawie podanych
nazw kwasów i alkoholi
– zapisuje wzory poznanej aminy i aminokwasu
– opisuje budowę, właściwości fizyczne
i chemiczne aminokwasów na przykładzie
glicyny
– opisuje przeprowadzone doświadczenia
chemiczne
umożliwiające otrzymanie estru
o podanej nazwie
– opisuje właściwości estrów w kontekście
ich zastosowań
– przewiduje produkty reakcji chemicznej
– identyfikuje poznane substancje
– dokładnie omawia reakcję estryfikacji
– omawia różnicę między reakcją
estryfikacji a reakcją zobojętniania
– zapisuje równania reakcji chemicznych
w postaci cząsteczkowej, jonowej oraz
skróconej jonowej
– analizuje konsekwencje istnienia dwóch
grup funkcyjnych w cząsteczce aminokwasu
– zapisuje równanie reakcji tworzenia
dipeptydu
– wyjaśnia mechanizm powstawania
wiązania peptydowego
– potrafi wykorzystać swoją wiedzę do
rozwiązywania złożonych zadań
Wybrane wiadomości i umiejętności wykraczające poza treści wymagań podstawy programowej; ich nabycie przez ucznia może być podstawą do wystawienia
oceny celującej. Uczeń:
– opisuje właściwości i zastosowania wybranych alkoholi
– określa właściwości i zastosowania wybranych kwasów karboksylowych
– zapisuje równania reakcji chemicznych zachodzących w twardej wodzie po dodaniu mydła sodowego
– wyjaśnia pojęcie hydroksykwasy
– wymienia zastosowania aminokwasów
– zapisuje równania reakcji hydrolizy estru o podanej nazwie lub wzorze
– wyjaśnia, co to jest hydroliza estru
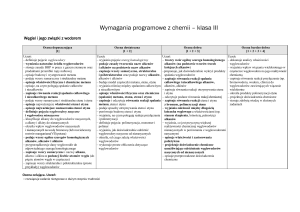
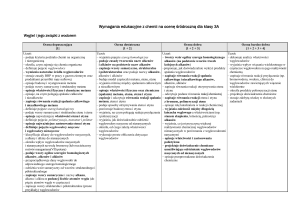
IX. Substancje o znaczeniu biologicznym
Ocena dopuszczająca
[1]
Uczeń:
– wymienia główne pierwiastki chemiczne
wchodzące w skład organizmu człowieka
– wymienia podstawowe składniki żywności
oraz miejsce ich występowania
– wymienia miejsca występowanie celulozy i
skrobi w przyrodzie
– określa, co to są makroelementy i mikroelementy
– wymienia pierwiastki chemiczne, które wchodzą
w skład tłuszczów, sacharydów i białek
Ocena dostateczna
[1 + 2]
Uczeń:
– wyjaśnia rolę składników żywności w
prawidłowym funkcjonowaniu organizmu
– definiuje pojęcie: tłuszcze
– opisuje właściwości fizyczne tłuszczów
– opisuje właściwości białek
– opisuje właściwości fizyczne glukozy,
sacharozy, skrobi i celulozy
– wymienia czynniki powodujące koagulację
białek
– opisuje różnice w przebiegu denaturacji
– klasyfikuje tłuszcze ze względu na
koagulacji białek
pochodzenie, stan skupienia i charakter – iokreśla
wpływ oleju roślinnego na wodę
chemiczny
bromową
– omawia budowę glukozy
– wymienia rodzaje białek
– klasyfikuje sacharydy
– zapisuje za pomocą wzorów sumarycznych
– definiuje białka, jako związki chemiczne
równanie reakcji sacharozy z wodą
– określa przebieg reakcji hydrolizy skrobi
powstające z aminokwasów
– wymienia przykłady tłuszczów, sacharydów i białek – wykrywa obecność skrobi i białka w różnych
– określa, co to są węglowodany
produktach spożywczych
– podaje wzory sumaryczne: glukozy, sacharozy,
skrobi i celulozy
– podaje najważniejsze właściwości omawianych
związków chemicznych
– definiuje pojęcia denaturacja, koagulacja
– wymienia czynniki powodujące denaturację
białek
– podaje reakcję charakterystyczną białek i skrobi
– opisuje znaczenie: wody, tłuszczów, białek,
sacharydów, witamin i mikroelementów dla
organizmu człowieka
– opisuje, co to są związki wielkocząsteczkowe
i wymienia ich przykłady
– wymienia funkcje podstawowych składników
pokarmu
Ocena dobra
[1 + 2 + 3]
Uczeń:
– podaje wzór ogólny tłuszczów
– omawia różnice w budowie tłuszczów stałych
i ciekłych
– wyjaśnia, dlaczego olej roślinny odbarwia wodę
bromową
Ocena bardzo dobra
[1 + 2 + 3 + 4]
Uczeń:
– podaje wzór tristearynianu glicerolu
– projektuje doświadczenia chemiczne
umożliwiające wykrycie białka
– określa, na czym polega wysalanie białka
– definiuje pojęcie izomery
– definiuje pojęcia: peptydy, zol, żel, – wyjaśnia, dlaczego skrobia i celuloza są
polisacharydami
koagulacja, peptyzacja
– wyjaśnia, co to są dekstryny
– omawia hydrolizę skrobi
– wyjaśnia, co to znaczy, że sacharoza jest
– umie zaplanować i przeprowadzić reakcje
disacharydem
– porównuje budowę cząsteczek skrobi i celulozy weryfikujące postawioną hipotezę
– identyfikuje poznane substancje
– wymienia różnice we właściwościach
fizycznych skrobi i celulozy
– zapisuje poznane równania reakcji hydrolizy
sacharydów
– definiuje pojęcie wiązanie peptydowe
– projektuje doświadczenie chemiczne
umożliwiające odróżnienie tłuszczu
nienasyconego od nasyconego
– planuje doświadczenia chemiczne
umożliwiające badanie właściwości
omawianych związków chemicznych
– opisuje przeprowadzane doświadczenia
chemiczne
– opisuje znaczenie i zastosowania skrobi,
celulozy oraz innych poznanych związków
chemicznych
Wybrane wiadomości i umiejętności wykraczające poza treści wymagań podstawy programowej; ich nabycie przez ucznia może być podstawą do wystawienia
oceny celującej. Uczeń:
– zapisuje równania reakcji otrzymywania i zmydlania, np. tristearynianu glicerolu
– potrafi zbadać skład pierwiastkowy białek i cukru
– udowadnia doświadczalnie, że glukoza ma właściwości redukujące
– przeprowadza próbę Trommera i próbę Tollensa
– definiuje pojęcia: hipoglikemia, hiperglikemia
– projektuje doświadczenie umożliwiające odróżnienie tłuszczu od substancji tłustej (próba akroleinowa)
– opisuje na czym polega próba akroleinowa
– wyjaśnia pojęcie uzależnienia
– wymienia rodzaje uzależnień
– opisuje szkodliwy wpływ niektórych substancji uzależniających na organizm człowieka
– opisuje substancje powodujące uzależnienia oraz skutki uzależnień
– wyjaśnia skrót NNKT
– opisuje proces utwardzania tłuszczów
– opisuje hydrolizę tłuszczów
– wyjaśnia, na czym polega efekt Tyndalla.