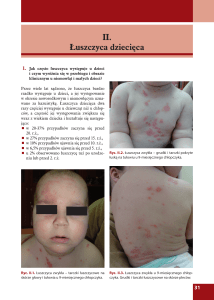
Biosymilary
a
leki oryginalne
w leczeniu łuszczycy
– czy są to te same leki?
Prof. dr hab. Zygmunt Adamski
Katedra i Klinika Dermatologii
Uniwersytetu Medycznego w Poznaniu
Nastąpiła zmiana paradygmatów:
Łuszczyca jako zaburzenie hiperkeratotyczne
Komórki keratynocytów
Łuszczyca jako dysregulacja układu immunologicznego zależna od cytokin
Komórki limfocytów T i dendrytyczne
Nowe metody leczenia łuszczycy
Na opracowanie leków
biologicznych stosowanych w
łuszczycy miało wpływ odkrycie:
• limfocyty T i prozapalne cytokiny (np.TNF)
odgrywają rolę w patogenezie tej choroby,
• konieczność rozwoju bezpiecznych,
długoterminowych sposobów leczenia
LEKI BIOLOGICZNE
Przeciwciała
monoklonalne
(MCA)
Białka fuzyjne
(FP)
Rekombinowane
białka ludzkie
Sobell JM: Overview of biologic agents in medicine and dermatology.
Semin Cutan Med. Surg 2005;24: 2-9
PRZECIWCIAŁA MONOKLONALNE (MCA)
Grupa białek swoiście
wiążących się z innymi
białkami na powierzchni
komórek w krążeniu i w
obrębie tkanek
Powodują zmianę
aktywności białka
docelowego
• (najczęściej zahamowanie
czynności)
Pierwsze MCA były
przeciwciałami mysimi
(ryzyko reakcji
immunologicznej)
Singri P, West D, Gordon K: Biologic therapy for psoriasis.
The new therapeutic frontier. Arch Dermatol 2002; 138: 657-63
PRZECIWCIAŁA MONOKLONALNE (MCA)
Przeciwciała chimeryczne
• (25% mysie, 75% ludzkie)
• końcówka – iximab
• np. Infliksimab
Najnowsza generacja
• przeciwciała ludzkie, produkowane przez transgeniczne myszy, których
odpowiednie loci mysiego DNA, zostało zastąpione DNA kodującym ludzkie
immunoglobuliny
• końcówka – umab,
• np. Adalimumab
• W pełni humanizowe przeciwciało monoklonalne skierowane przeciw
interleukinie IL-12/23
• Ustekinumab
BIAŁKA FUZYJNE (FP)
Cząsteczki złożone z elementów pochodzących od różnych białek
2 typy:
• połączenie ludzkiego białka i toksyny (np.połączenie IL-2 i toksyny błoniczej –
hamujące wzrost pobudzonych limfocytów)
• przypominające humanizowane MCA
Końcówka – cept
• np. Etanercept, Alefacept
Singri P, West D, Gordon K: Biologic therapy for psoriasis.
The new therapeutic frontier. Arch Dermatol 2002; 138: 657-63
Cytokiny to małe, rozpuszczalne białka o
działaniu plejotropowym
Rodziny cytokin
Przykłady interleukin
Interleukiny
Interferony
Czynnik martwicy nowotworu (TNF)
Transformujący czynnik wzrostu (TGF)
Czynniki stymulujące wzrost kolonii (CSF)
•
•
Delves P, Roitt I. N Engl J Med. 2000;343:37-49.
Ozaki K i wsp. J Biol Chem. 2002;277:29355-29358.
Charo I, Ransohoff R. N Engl J Med. 2006;354:610-621
Rodzina IL-1
IL-2 – czynnik wzrostu limfocytów T
IL-6
IL-12
Rodzina IL-17
Cytokiny
• Są integralną częścią sieci sygnałów przekazywanych
pomiędzy komórkami układ immunologicznego
• Regulują działanie układu immunologicznego
• Są wytwarzane przez wiele rodzajów komórek
wrodzonego i nabytego układu immunologicznego
• Wiążą się z receptorami na powierzchni komórek
docelowych
Chemokiny
to małe cząsteczki kierujące migracją i przekazywaniem
sygnałów przez komórki immunologiczne za pomocą
innych mechanizmów niż cytokiny
CELE TERAPII BIOLOGICZNEJ
1.
Zmniejszenie liczby patogennych limfocytów T
2.
Zahamowanie aktywacji limfocytów T
3.
Zmiana dominacji profilu cytokin
4.
Blokada aktywności cytokin prozapalnych
Singri P, West D, Gordon K: Biologic therapy for psoriasis.
The new therapeutic frontier. Arch Dermatol 2002; 138: 657-63
Łuszczyca –konieczność terapii
lekami biologicznymi
Patogeneza: rola zaburzeń układu
immunologicznego:
Łuszczyca: schorzenie z zaburzeniami nie tylko
skóry, stawów a także schorzenie ogólnoustrojowe
Łuszczyca: choroba nie pozwalająca na normalne
życie i funkcjonowanie społeczne
Nadzieja: terapia
biologiczna
Celuje w dany
element
patofizjologii
łuszczycy
skuteczna redukcja
zmian skórnych
działanie
protekcyjne
współist. zaburzeń
powrót do
normalnego
funkcjonowania
Zalety terapii biologicznej w łuszczycy
Leki biologiczne
są alternatywą dla
konwencjonalnej terapii
systemowej w
przypadku średnio i
ciężko nasilonej postaci
łuszczycy zwykłej oraz
stawowej.
dają szansę ustąpienia
objawów chorobowych
u leczonych nimi
pacjentów,
co potwierdza szybka
odpowiedź kliniczna.
pozwalają na
prowadzenie
długotrwałej
bezpiecznej terapii
łuszczycy.
stosowane wg. zasad
dają chorym szansę na
poprawę jakości życia,
co jest niezwykle istotne
dla osób zmęczonych
przewlekłą, nawracającą, uciążliwą
chorobą.
Sukces terapii lekami biologicznymi w
łuszczycy:
Sukces:
Leczyć kiedy
trzeba!
Przestrzegać
zasad kwalifikacji
– ocena: benefit
risk ratio!
Mieć
świadomość
powikłań,
ale się ich nie
bać!
Współpraca z
chorym!
Być otwartym na
nowe
informacje!
Uzyskać
możliwości
refundacyjne
terapii
biologicznej!
Porównanie skuteczności leków
biologicznych
PASI 75
Reich et al. , 2012, British journal of dermatology, 166(1), 179–88.
Dawkowanie i sposób podawania
Etanercept2
Infliximab3
Adalimumab4
Ustekinumab
Sposób podania
podskórnie
wlewy dożylne
podskórnie
podskórnie
Dawka inicjująca
NIE
TAK
TAK
TAK
Dawkowanie
1 x w tygodniu
Co 8 tygodni
Co 2 tygodnie
0, 4 i co 12 tygodni
Samodzielne
podawanie
TAK
NIE
TAK
TAK
Dawka zależna od
wagi
NIE
TAK
NIE
TAK
1.2. Etanercept SPC. 3. Infliximab SPC. 4. Adalimumab SPC 5. Ustekinumab SPC.
Zalety i wady
Lek biologiczny
Skuteczność
Zalety
Niedogodności
Infliksimab
> 85%
Szybki efekt
Wlewy dożylne
Dawka zależna od masy ciała
zwiększa koszt.
Czasami konieczne podawanie
MTX
Nie możliwe podawanie w
domu
Adalimumab
70-80%
Łatwy w użyciu (pen)
Terapia ciągła
Etanercept
50%
Możliwa podawanie
weekendowe (pen)
Od 6 roku życia
Terapia uciążliwa (1xtydz)
Ustekinumab
>80%
Podawanie 4x w roku
Dobry szybki efekt
Terapie biologiczne w łuszczycy
Lek
Wskazania
Adalimumab
Akceptacja FDA
Wskazania w
łuszczycy
Wygaśnięcie patentu
w USA
RZS, MIZS, ŁZS,
31 grudnia 2002
łuszczyca plackowata,
choroba Crohna
21 stycznia 2008
31 grudnia 2016
Alefacept
Łuszczyca plackowata
30 stycznia 2003
30 stycznia 2017
Etanercept
RZS, MIZS, ŁZS,
27 maja 1999
łuszczyca plackowata,
3 maja 2004
23 października 2012
Infliximab
Choroba Crohna,
wrzodziejące
zap.jelita grubego,
ŁZS, łuszczyca
plackowata
29 grudnia 2000
28 września 2006
29 grudnia 2014
Ustekinumab
Łuszczyca plackowata
ŁZS
25 września 2009
09 września 2013
25 września 2009
25 września 2023
30 stycznia 2003
Biopharmaceuticals and Biosimilars in Psoriasis: What the Dermatologist Needs to Know.(2012 B.E. Strober, K. Armour, R. Romiti, C. Smith, P.W. Tebbey, A.
Menter and C. Leonardi, on behalf of the International Psoriasis Council. Journal of the American Academy of Dermatology. 66 (2) 317-322.
Farmakogenetyka w świetle leków
biologicznych
Dlaczego u jednych pacjentów obserwuje się
świetne wyniki a u innych mierne?
Przypuszcza się że POLIMORFIZM (SNP) obrębie PROMOTORA IL-6
ma znaczenie w kontekscie skuteczności terapi anty TNF-a
Otyli pacjenci z allelem G+ w poz 174 promotora IL-6
mieli 2x większą szansę na niepowodzenie terapii
Kwalifikacja na podstawie badania DNA?
Rozwój p/ciał neutralizujących u leczonych
Human IgG
5%
Ustekinumab
1. Baert NEJM 2003; 348:601-8; 2. Lipsky NEJM 2000; 343:1594-602; 3. Maini A&R 2004; 50; 1051-64;
4. St Clair A&R 2004; 50:3432-42; 5. Geborek ARD 2002; 61:793-8; 6. Durez Rheumatol 2005; 44:465-8; 7. Stern J Rheumatol 2004; 31:1538-45; 8. Adalimumab EU SmPC Jan 2008; 9.
Etanercept SmPC Nov 2007; 1 O. Infliximab EU SmPC Dec 2007;
Formowanie przeciwciał przeciwko
inhibitorom TNF-a
•
Niewiele wiadomo o immunogenności leków biologicznych
•
Ok 6 – 60 % pacjentów wytwarza przeciwciała neutralizujące (ch.
reumatyczne)
•
Niewiele doniesień nt. łuszczycy
•
Niekiedy wymusza zwiększenie dawki leku
•
MTX zapobiega formowaniu przeciwciał
•
(stąd możliwie jego synergistyczne działanie z lekami biologicznymi)
Aikawa et al. Clinic Rev Allerg Immunol (2010) 38:82–89
Biosimilar drugs
= leki biopodobne
LEKI BIOTECHNOLOGICZNE
Lek biotechnologiczny:
Jest to lek otrzymany z żywego
organizmu uprzednio zmienionego w
kierunku wytwarzania danego produktu
LECZNICZE REKOMBINOWANE BIAŁKA
Leczenie nie biologiczne
Synteza chemiczna
Leki biologiczne
Leki biologiczne
Paracetamol
Hormon wzrostu
Przeciwciała
Czym jest lek biopodobny?
•
„Biosimilar drugs” = leki biopodobne
•
W USA „follow-on biologics”=„leki bionastępcze”
•
Produkt biologicznie podobny do zarejestrowanego już leku
•
Produkowany po wygaśnięciu praw patentowych leków
oryginalnych
•
Lek oryginalny i biopodobny mają taki sam profil
bezpieczeństwa, skuteczności i wskazania do stosowania
Psoriasis International Network, Paryż, 4-6 Lipca 2013 r.
Co to są biosymilary?
• Biosymilary to leki dopuszczone
do użycia o zbliżonej
jakości, bezpieczeństwie stosowania i skuteczności do
już zatwierdzonych preparatów referencyjnych.
• Biosymilary produkowane
są przy użyciu tych samych
standradów jakości jak w przypadku nowoczesnych
leków biologicznych
• Biosymilary muszą spełnić rygorystyczne warunki
typowe dla oryginalnych preparatów referencyjnych.
Opracowanie biosymilarów polega na udowodnieniu ich
podobieństwa na etapie badań technicznych i klinicznych
Podejście
•
Zrozumienie struktury molekuły
•
•
Opanowanie techniki inżynierii
wstecznej
Cząsteczka w odpowiednim
stopniu zbliżona do oryginalnej
•
Proces produkcji o
odpowiedniej wydajności i
opłacalności
•
Rozwój
techniczny
Badania
kliniczne
Oczekiwany wynik
Oczyszczenie procesu i
zwiększenie efektywności
Porównywalne wyniki w
badaniach na zwierzętach
Skrócony program kliniczny =
opłacalność
Porównywalne wyniki
farmakokinetyczne i
farmakodynamiczne w badaniach
pierwszej fazy
Szerokie zastosowanie
Porównywalne wyniki badań
klinicznych
Akceptacja przez lekarzy i
pacjentów
Wymagania dopuszczenia leków
biosymilarnych
Lek oryginalny
Badania
kliniczne
Pełne badania
farmakokinetyczne i
farmakodynamiczne
in vivo
i toksykologiczne
Lek biopodobny
Badania
kliniczne
Skrócone
badania
przedkliniczne
Porównawcze
badanie in vitro
Charakterystyka biologiczna in
vivo
Analiza porównawcza
Produkcja, charakterystyka produktu
leczniczego, kontrola, stabilność
Produkcja, charakterystyka produktu
leczniczego, kontrola, stabilność
Opracowanie leków biosymilarnych generuje
więcej czasu i kosztów niż generyków
Generyki
Biosymilary
Koszty
2-3 mln $
100-250 mln $
Czas do wprowadzenia na
rynek
2-3 lata
7-8 lat
Klinika
Badania porównawcze na
zdrowych ochotnikach
Porównawcze badania
farmakokinetyczne i III fazy
Pharmacovigilance
Badania IV fazy
Badania oceny ryzyka (w tym
pharmacovigilance)
Po wprowadzeniu na rynek
Zgodność struktury pierwszo- i
drugorzędowej
Mapowanie peptydów
Spektroskopia
mAU
Biosimilar
Original
-0,0
5,0
10,0
15,0
20,0
25,0
30,0
35,0
40,0
Time [min]
Biosimilar
Original
Do rejestracji produktu biopodobnego
wg WHO i EMA wymagana jest:
Dokładna dokumentacja
procesu produkcyjnego
Min. 1 badanie przedkliniczne
toksykologiczne z użyciem
dawki wielokrotnej na
zwierzętach
Badanie III fazy „head to
head” oceniające skuteczność
i bezpieczeństwo leku
badanego w stosunku do
oryginalnego preparatu
Zbieranie danych dotyczących
stabilności preparatu
Badania przedkliniczne
porównujące preparat z
lekiem oryginalnym
(oceniające cechy
fizykochemiczne i biologiczne
substancji czynnej)
Badania oceniające
farmakokinetykę i
farmakodynamikę produktu
Badanie kliniczne typu „head
to head” z użyciem
pojedynczej dawki preparatu
w porównaniu z lekiem
oryginalnym
Badanie immunogenności
u ludzi
Przedstawienie
długofalowego planu nadzoru
bezpieczeństwa
farmakoterapii, który jest
ściśle monitorowany
Biosymilary –
Powstanie
przeciwciał
immunogenność
Tworzenie
przeciwciał
neutralizujących
Cząsteczki
białkowe
Reakcje wczesne
(anafilaksja)
Późne (choroba
surowicza)
Nowicki M., Zimmer-Nowicka J.: Biofarmacetyki oryginalne i biopodobne. Onkol w Prakt Klin 2007,3,3:120-127
Thrope R., Wadhwa M.: Protein therapeutics and their immunity. EJHP Practice 2006;12:17-19
Leki biotechnologiczne różnią się od leków chemicznych
właściwościami molekularnymi oraz skomplikowaną
produkcją
Leki biotechniczne
Leki chemiczne
Duże, złożone, niestabilne cząsteczki
Małe, proste stabilne cząsteczki
Produkowane przez wyspecjalizowane
organizmy
Produkowane w procesie
technologicznym na linii produkcyjnej
Precyzyjna charakterystyka niemożliwa
z racji mieszaniny cząsteczek
Łatwiejsze do dokładnego
scharakteryzowania
Większa imuunogenność
Mniejsza immunogenność
Sharma BG. Eur J Hosp Pharm 2007;13:54-6; Prugnaud JL. Br J Clin Pharmacol 2008;65:619-20; Graphic
adapted from 2000 Schering-Plough Research Institute/ EuropaBio http://www.europabio.org
“PRODUKT JEST PROCESEM”
• małe zmiany w procesie produkcyjnym mogą zmienić, często nieznacznie, cechy strukturalne
końcowego produktu
•
Produkt 1
Produkt 2
Wyglądają podobnie...Jak podobne są w
rzeczywistości?
•nieznaczne różnice strukturalne mogą wpłynąć na bezpieczeństwo i skuteczność
•różnice pomiędzy partiami leków biotechnologicznych mogą być bardzo istotne
OD NAUKI DO PRZEPISÓW EMA
•
EMA: Biopodobny (lub podobny biologicznie lek, lek
bionastępczy, Follow-on-biologics):
•
Określenie nadawane przez EMA lekowi biotechnologicznemu
nakazuje, aby był podobny do innowacyjnego produktu w każdym
porównywanym punkcie jakości, skuteczności i poziomów
bezpieczeństwa
•
WHO: Bioterapeutyczny produkt podobny (ta sama dawka, forma
terapeutyczna, droga podawania)
Regulacje dotyczące biosimilarów
0d 2002 Brak rozróżnienia między
generykami i biosymilarami
GENERYK
•
badanie biorównoważności
•
Czas: 3 miesiące
•
•
Od 2006 konkretne uregulowane homologacje
szlaku z wysokimi wymaganiami
BIOSYMILAR
•
Pełna jakościowa dokumentacja i
znaczące ( wstępnie ) badania kliniczne
i dane
Koszty: < 3.000.000 $
•
Czas: 2-3 lata do rozwoju
Zatwierdzenie - w ciągu 1 roku
•
Koszty: $ 40-100 mln koszty rozwoju *
•
Zatwierdzenie po > 1-1.5 roku
Leki biologiczne są białkowymi
kompleksami
Aspirin®
G-CSF
Glycoprotein
Epoetin
Monoclonal
Antibody
Mała cząsteczka chemiczna
Prosty lek biologiczny
0,18 kDa
0 aminokwasów
≈ 19kDa
175 aminokwasów
≈ 30kDa
≈180 kDa
≈ 193 aminokwasów/ ≈ 1300 aminokwasów
Synteza chemiczna
Produkowany przez
bakterie
Produkowany w komórkach ssaka
Złożony lek biologiczny
Biosymilary w dermatologii
•
Biopodobne przeciwciało monoklonalne zastępujące infliksimab
•
Zarejestrowane w Indiach i Korei Południowej
•
CT-P13, Remsima (Celltrion) w sprzedaży w Korei Południowej
•
Kolejny lek biopodobny infliksimabu pozostaje w fazie badań
klinicznych (Reliance Life Sciences, India)
•
Mullard A. Can next-generation antibodies offset biosimilar competition? Nat Rev Drug Discov 2012;11:426-8
Biosymilary - podsumowanie
Temat dyskusji na całym świecie
(bezpieczeństwo terapii, normy
regulacyjne, prawne,
ekonomiczne)
Będą wprowadzone do terapii
schorzeń we wskazaniach
odpowiadających ich
oryginalnym produktom
Niższe koszty leczenia o ok.1530% łatwiejszy dostęp
Część preparatów biopodobnych
pozostaje lub planowana jest w II
fazie badań klinicznych w
badaniach typu „head to head”
w wielu ośrodkach na świecie,
również w Polsce
Wnioski:
nie jest możliwe tworzenie strukturalne identycznych leków biotechnologicznych, gdy modyfikuje się
proces wytwarzania (jest to możliwe w przypadku leków otrzymywanych chemicznie)
zmiany strukturalne mogą mieć istotne klinicznie konsekwencje, takie jak zmniejszenie skuteczności i
poważne szkodliwe działanie np.: immunogenność
aby zagwarantować, że takie zmiany strukturalne nie przyniosą szkodliwych klinicznych konsekwencji
wymagane jest porównania punkt po punkcie na przedklinicznym i klinicznym poziomie (próby na
pacjentach) pomiędzy kandydatem na lek biopodobny a produktem odniesienia
tylko gdy spełnione zostaną wymagania prawne dany produkt może zostać uznany za „biopodobny”
produkt „biopodobny” NIE JEST generykiem
STANOWISKO PTHiT dotyczące stosowania leków biopodobnych w hematologii
Czas i doświadczenie kliniczne
zweryfikuje obawy co do leków
biopodobnych
Dziękuję za uwagę.