Chwała C i wsp.
Pojawienie się objawów łuszczycy w trakcie odczulania...
53
Pojawienie się objawów łuszczycy w trakcie odczulania
alergenową szczepionką podjęzykową
– opis przypadku
Recurrence of psoriasis symptoms during specific sublingual immunotherapy
– case report
CEZARY CHWAŁA, KRZYSZTOF BUCZYŁKO, ANETA WAGNER
Zakład Alergologii i Rehabilitacji Oddechowej, Uniwersytet Medyczny w Łodzi
Streszczenie
Summary
Immunoterapia alergenowa jest metodą leczenia przyczynowego
chorób o podłożu atopowym, a immunoterapia podjęzykowa (SLIT
– sublingual immunotherapy) to obecnie coraz częściej i chętniej stosowana jej formą. W pracy przedstawiono przypadek niezamierzonej
indukcji łuszczycy po 13 latach remisji, w trakcie leczenia podjęzykową szczepionką pyłkową u 18-letniej pacjentki.
Specific immunotherapy is the casual method of the treatment of
atopic and allergic diseases, and sublingual immunotherapy (SLIT) is
the form of SIT, often and willingly used. The authors present the case
study of psoriasis induction after 13 years from remission, during the
treatment by sublingual immunotherapy in a 18-year-old patient.
Słowa kluczowe: immunoterapia podjęzykowa, łuszczyca, indukcja
objawów
© Alergia Astma Immunologia 2010, 15 (1): 53-55
www.alergia-astma-immunologia.eu
Przyjęto do druku: 1.12.2009
Istnieje ogromne zapotrzebowanie na bezpieczniejszą
niż iniekcyjna drogę podania szczepionki odczulającej. Na
podstawie wielu wiarygodnych badań klinicznych z podwójnie ślepą próbą kontrolowanych placebo (DBPC – double blind placebo controlled) udowodniono skuteczność
SLIT porównywalną do immunoterapii iniekcyjnej (SCIT
– subcutaneous immunotherapy) [1,2,3]. SLIT, podobnie jak SCIT indukuje swoistą immunotolerancję, jednak
obarczona jest mniejszym ryzykiem powstawania reakcji
anafilaktycznej, a jej bezpieczeństwo potwierdzono u dorosłych i dzieci na podstawie wielu wiarygodnych badań
[4]. Istnieją ścisłe wskazania do zastosowania tej formy terapii, jak i określone przeciwwskazania, które podzielono
na względne i bezwzględne. Immunoterapia alergenowa
nie powinna być zlecana między innymi pacjentom, u których współistnieje klinicznie jawna choroba autoimmunologiczna (przeciwwskazanie bezwzględne) [5].
Łuszczyca obejmująca około 2% populacji w Europie
i USA jest klinicznie bez trudu rozpoznawalna, jednak
do dziś, pomimo licznych wieloośrodkowych badań, jej
patogeneza nie jest do końca wyjaśniona [6]. Jednak na
podstawie występujących w łuszczycy zjawisk immunologicznych i efektów terapeutycznych z zastosowaniem
Key words: sublingual immunotherapy, psoriasis, symptoms
induction
Adres do korespondencji / Address for correspondence
Cezary Chwała
Zakład Alergologii i Rehabilitacji Oddechowej
Uniwersytet Medyczny w Łodzi
pl. Hallera 1
90-923 Łódź
e-mail: [email protected]
leków systemowych najnowsze doniesienia pozwalają na
zakwalifikowanie łuszczycy do grupy chorób autoimmunologicznych [7,8].
Celem pracy było opisanie przypadku pojawienia się objawów łuszczycy w trakcie leczenia podjęzykową szczepionką
alergenową u 18-letniej pacjentki po okresie 13-letniej remisji.
Opis przypadku
18-letnia kobieta, u której od 5. roku życia okresowo
występowały objawy łzawienia oczu, kataru oraz kichania
w okresie wiosennym oraz (z największym nasileniem)
w okresie letnim, została zakwalifikowana do leczenia
za pomocą immunoterapii swoistej. Do 17. roku życia
u chorej prowadzono jedynie sezonową farmakoterapię
pyłkowicy. Ponadto u chorej całorocznie występowały objawy dyspeptyczne oraz zespołu uczuleniowego jamy ustnej (OAS – oral allergy syndrome) po spożyciu surowych
warzyw i owoców, głównie jabłek i marchwi. U pacjentki
przeprowadzono diagnostykę alergologiczną w postaci
punktowych testów skórnych. Na podstawie testów potwierdzono uczulenie na pyłek drzew, traw, w tym zbóż,
chwastów oraz alergię na marchew.
54
Na podstawie uzupełnionego wywiadu stwierdzono,
iż w 5. roku życia u chorej po raz pierwszy pojawiły się
zmiany skórne, pierwotnie rozpoznane jako wyprysk
w przebiegu atopowego zapalenia skóry. Ze względu
na to, że dziecko było leczone i diagnozowane w innym
ośrodku nie było możliwości weryfikacji trafności rozpoznania ówczesnych zmian skórnych. W późniejszym okresie do 17. roku życia u pacjentki nie występowały żadne
zmiany skórne (poza lekko nasiloną suchością). W 17. roku
życia po raz pierwszy w sezonie pylenia drzew wczesnych,
brzozy i traw u pacjentki wystąpiły napady duszności
i suchego kaszlu. Ciężkość objawów skłoniła rodziców
dziecka do przeprowadzenia ponownej diagnostyki alergologicznej, na podstawie której potwierdzono wcześniej
rozpoznane uczulenie na pyłek trawy i brzozy. Ze względu
na znaczne nasilenie objawów alergicznego nieżytu nosa
i spojówek (silniejsze niż w poprzednich sezonach) oraz
pojawienie się epizodycznych duszności i napadowego
suchego kaszlu za zgodą rodziców zostało rozpoczęte
leczenie przyczynowe pacjentki (obok leczenia objawowego) w formie immunoterapii alergenowej. Na podstawie
wywiadu zebranego od matki ustalono, iż przed rozpoczęciem immunoterapii u córki były wykonane punktowe
testy skórne z alergenami powietrznopochodnymi i ocena
stężenia całkowitego IgE (577 IU/ml). U pacjentki nie wykonywano atopowych testów płatkowych ani naskórkowych testów płatkowych. Wynik badania spirometrycznego (z wywiadu) wykonanego w okresie bezobjawowym
był prawidłowy. Na podstawie aktualnych wyników badań
oraz po rozważeniu wskazań i przeciwwskazań zarówno
bezwzględnych jak i względnych pacjentka została zakwalifikowana do całorocznego odczulania pyłkiem brzozy
i traw podjęzykową szczepionką alergenową Staloral
300 o składzie indywidualnie dobranym 60% pyłku traw
i 40% pyłku brzozy. Ponowna diagnostyka przed immunoterapią była wykonana w innym ośrodku przez specjalistę
alergologa, tam też podjęto decyzję o kwalifikacji do SLIT.
Po rutynowych procedurach przed pierwszym szczepieniem, a więc po otrzymaniu pisemnej zgody na podanie
szczepionki, po szczegółowym poinformowaniu rodziców
i dziecka o zaleceniach producenta o sposobie stosowania
(oprócz schematu w książeczce szczepień) i po udzieleniu praktycznych wskazówek i ćwiczeniach – rozpoczęto
podawanie szczepionki. Osiągnięto maksymalną jednorazową dawkę (10 dawek) stężenia 10 IR (niebieska fiolka)
i następnie 8 dawek stężenia 300 IR (fioletowa fiolka) we
wstępnej fazie leczenia. W leczeniu podtrzymującym pacjentka zdecydowała się na schemat dawkowania zgodny
z zaleceniami producenta – w postaci 4 dawek stężenia
300 IR podawanych podjęzykowo sześć razy w tygodniu.
W trakcie stosowania pierwszego opakowania u pacjentki
nie wystąpiły żadne objawy niepożądane, ani miejscowe,
ani ogólne. Natomiast po rozpoczęciu nowego (drugiego)
opakowania u pacjentki pojawiły się objawy typu OAS
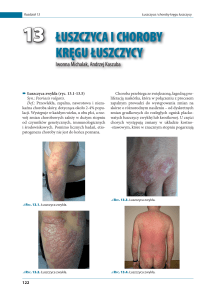
oraz grudki łuszczycowe o lokalizacji i obrazie typowym
dla łuszczycy zwyczajnej (psoriasis vulgaris). Najwięcej
zmian zaobserwowano na łokciach i kolanach, a pojedyncze – na owłosionej skórze głowy. Stwierdzono też występowanie rozsianych, drobnych wykwitów na kończynach i tułowiu charakterystycznych dla psoriasis guttata.
Alergia Astma Immunologia 2010, 15 (1): 53-55
W trakcie leczenia u pacjentki występowały ponadto typowe dla łuszczycy objawy Auspitza oraz Koebnera. Po
badaniu przedmiotowym przeprowadzonym w naszym
ośrodku przez specjalistę dermatologa bez trudności zostało potwierdzone rozpoznanie. Ustalono, iż wystąpienie
zmian łuszczycowych nie było sprowokowane zachorowaniem, infekcją, urazem czy stresem. Obecne wykwity
różniły się od zmian, które wystąpiły w 5. roku życia dziecka i, zdaniem matki, miały odmienną lokalizację. Przed
pojawieniem się pierwszych wykwitów pacjentka poza
szczepionką alergenową nie przyjmowała żadnych leków
ani nie była narażona na działanie substancji chemicznych
czy drażniących. Po rozmowie z chorą i jej rodzicami
podjęto decyzję o zakończeniu odczulania. Dla 18-letniej
dziewczyny większym problemem niż epizodycznie występujące duszności, kaszel czy sezonowy katar było pojawienie się „szpecących” zmian na skórze, które niekorzystnie
wpływały zarówno na urodę, jak i na psychikę chorej
(brak akceptacji ze strony rówieśników). W badaniu FeNO
(fractioned exhaled nitric oxide) – stężenia tlenku azotu
w wydychanym powietrzu, wykonanym w naszym ośrodku, wykazano podwyższony poziom jednostek tlenku
azotu (86 ppb) u pacjentki. Natomiast wynik badania spirometrycznego nie odbiegał od normy. W związku z przerwaniem immunoterapii i zbliżającym się okresem pylenia
zastosowano u pacjentki leczenie objawowe oraz wydano
zalecenia dietetyczne (eliminacja alergenów pokarmowych krzyżowo reagujących z uczulającymi pyłkami). Po
kilku miesiącach od zakończenia immunoterapii pacjentka
jest leczona z powodu astmy i nieżytu błony śluzowej nosa
objawowo z dobrym skutkiem. Leczenie zmian łuszczycowych polegające na miejscowym stosowaniu glikokortykosteroidów i preparatów złuszczających jest prowadzone
także z dobrym skutkiem, ale zmiany mają tendencję do
częstszych nawrotów.
Omówienie
Rozpoznanie łuszczycy u dzieci może sprawiać bardzo duże trudności. Naskórek w tym wieku jest cienki,
szczególnie jego warstwa rogowa, natomiast warstwa
ziarnista jest słabo wykształcona. Występuje także bardzo
duże uwodnienie naskórka i skóry właściwej. Specyficzna
budowa skóry dziecka tłumaczy skłonność do obrzęku,
który manifestuje się odmiennymi obrazami klinicznymi
łuszczycy. Dlatego u dzieci, szczególnie małych, zmiany
łuszczycowe są zwykle rumieniowo-obrzękowe, sączące,
ze znacznym świądem i klinicznie mogą przypominać
wyprysk. Łuszczyca u małego dziecka jest często rozpoznawana jako zmiany alergiczne [9]. Dodatkową trudność
w rozpoznaniu łuszczycy dziecięcej stanowi, nie zawsze charakterystyczny, wynik badania histopatologicznego [10].
Coraz częściej obserwuje się współistnienie łuszczycy
z AZS, za czym przemawia udział limfocytów regulatorowych Treg w patomechanizmie obu chorób [11]. Niektórzy
autorzy przedstawiają jednak znaczne różnice w patogenezie obu schorzeń [12].
Dane z literatury potwierdzają koncepcję indukowanego przez INF-γ patomechanizmu rozwoju łuszczycy jako
choroby autoimmunologicznej Th1-zależnej. Aktywacja
Chwała C i wsp.
Pojawienie się objawów łuszczycy w trakcie odczulania...
komórek Th1 prowadzi do uwolnienia INF-γ i TNF-α. INF-γ
aktywuje czynniki transkrypcyjne konieczne do syntezy
cząsteczek zapalnych, chemokin i cząsteczek adhezyjnych,
stwierdzanych w skórnych ogniskach łuszczycy. Interferon γ
może być także uwalniany przez aktywowane w skórze
komórki predendrytyczne, które prawdopodobnie odgrywają istotną rolę w patomechanizmie łuszczycy [7,13].
W opisanym przypadku najprawdopodobniej doszło do
błędnego wcześniejszego (w 5. roku życia) rozpoznania
wyprysku w przebiegu AZS zamiast łuszczycy, co w konsekwencji doprowadziło do zakwalifikowania pacjentki
do leczenia szczepionką alergenową i pojawienia się
u pacjentki objawów klinicznych łuszczycy w 18. roku życia. Przypadek ten uświadamia znaczenie specjalistycznej
diagnostyki zmian skórnych od najwcześniejszych lat życia
chorego.
Po przedstawieniu opisu przypadku wypada rozważyć
możliwą rolę swoistych epitopów pospolitych alergenów
wziewnych lub innych zawartych w szczepionce składowych.
Pigatto zwrócił uwagę na częste współistnienie łuszczycy
i alergii atopowej. Choroby uczuleniowe w jego materiale
dotyczyły 21% pacjentów z łuszczycą, a dodatnie rezultaty
RAST uzyskano aż w 44%. Były one częstsze w łuszczycy typu
plaque (58%) niż active (22%). Co ciekawe, najczęstszym ro-
55
dzajem alergenu spotykanego w łuszczycy w cytowanych badaniach włoskich okazał się również pyłek traw (64%) [14].
Mechanizmy autoalergii, powszechnie wiązane z antygenami drobnoustrojów, być może w pewnej grupie chorych są
zależne od alergenów i ich determinant liniowych. Wiadomo,
że profilina, w opisanym przypadku prawdopodobnie obecna w szczepionce jako Bet v 2, występuje nie tylko w wielu
pokarmach, ale także w ustroju człowieka. Nie do końca
poznane związki alergii typu I i łuszczycy, mogą kryć tajemnice ważne dla przyszłych terapii obu chorób, odkrywane
obecnie w badaniach molekularnych. Nadzieję pokłada się
w szczepionkach bazujących na tolerogennych komórkach
dendrytycznych, które mogą wzbudzać tolerancję komórek T
z poprawą zarówno w stosunku do chorób autoimmunologicznych, jak i alergicznych [15].
Z praktycznego punktu widzenia celowe wydaje się
opracowanie bardziej precyzyjnych niż dotychczasowe
kryteriów rozpoznawania chorób z autoagresji przed
długotrwałą immunoterapią alergenem. Ze względów
ekonomicznych mogłoby to dotyczyć przynajmniej chorych z obciążającym wywiadem rodzinnym lub nietypową
lokalizacją zmian.
Piśmiennictwo
1.
2.
3.
Passalacqua G, Musarra A, Pecora S i wsp. Quantitative assessment
of the compliance with once-daily sublingual immunotherapy in
children (EASY project: evaluation of a novel SLIT formulation during a year). Pediatr Allergy Immunol. 2007; 18: 58-62.
Penagos M, Passalacqua G, Compalati E i wsp. Meta-analysis of the
efficacy of sublingual immunotherapy in the treatment of allergic
asthma in pediatric patients, 3 to 18 years of age. Chest. 2008; 133:
599-609.
Röder E, Berger MY, de Groot H i wsp. Immunotherapy in children
and adolescents with allergic rhinoconjunctivitis: a systematic review. Pediatr Allergy Immunol. 2008; 19: 197-207.
4.
Rossi RE, Monasterolo G. A pilot study of feasibility of ultra-rush
(20-25 minutes) sublingual-swallow immunotherapy in 679
patients (699 sessions) with allergic rhinitis and/or asthma. Int
J Immunopathol Pharmacol. 2005; 18: 277-285.
5.
Alvarez-Cuesta E, Canonica G W, Bousquet J i wsp. Standards for
practical allergen – specific immunoterapy. Allergy 2006 supl. 82:
24-28.
6.
Christophers E. Psoriasis – epidemiology and clinical spectrum. Clin
Exp Dermatol 2001; 26: 314-320.
7.
Krueger J G, Bowcock A. Psoriasis pathophysiology. Ann Rheum Dis
2005, 64 (supl 2): 30-36.
8.
Chamian F, Krueger JG. Psoriasis vulgaris: an interplay of T lymphocytes, dendritic cells, and inflammatory cytokines in pathogenesis.
Curr Opin Rheumatol 2004; 16: 331-337.
9.
Rosińska-Borkowska D. Specyfika łuszczycy u dzieci. (w) Łuszczyca.
Wolska H, Langner A. (red.) Czelej, Lublin 2006; 73-100.
10.
Jacobs A. H. Psoriasis. (w) Textbook of pediatric dermatology. RuizMaldonado R. Grunne-Stratton (red.) Filadelfia, 1989: 203-217.
11.
Gao L, Li K, Li F i wsp. Polymorphisms in the FOXP3 gene in Han
Chinese psoriasis patients. J Dermatol Sci. 2009; 30.
12.
Kamsteeg M, Jansen PA, van Vlijmen-Willems IM i wsp. Molecular
diagnostics of psoriasis, atopic dermatitis, allergic contact dermatitis and irritant contact dermatitis. Br J Dermatol. 2009; 10.
13.
Prinz JC. The role of T cells in psoriasis. JEADV 2003; 17: 257-270.
14.
Pigatto PD. Atopy and contact sensitization in psoriasis. Acta Derm
Venereol Suppl. 2000; 211: 19-20.
15.
Medi BM, Singh J. Prospects for vaccines for allergic and other immunologic skin disorders. Am J Clin Dermatol. 2006; 7: 145-153.