224
Alergia Astma Immunologia 2014, 19 (4): 224-231
Immunomodulacyjne działania
i zastosowania immunoglobulin
Immunomodulatory activities and the use of immunoglobulins
Sławomir Tokarski1,2, Marek L. Kowalski3
Wydział Medyczny Uniwersytetu Rzeszowskiego w Rzeszowie
Oddział Pulmonologii i Chorób Alergicznych Układu Oddechowego
Podkarpackiego Centrum Chorób Płuc w Rzeszowie
3
Klinika Immunologii, Reumatologii i Alergii, Uniwersytet Medyczny w Łodzi
1
2
Streszczenie
Summary
Dożylne preparaty immunoglobulin są wykorzystywane w praktyce klinicznej już od wielu lat. Początkowo stosowano je w terapii substytucyjnej niedoborów odporności. Odkrycie efektu immunomodulacyjnego
IVIg zależnego od dużej dawki, zaowocowało użyciem ich w terapii chorób o podłożu zapalnym. Mechanizm immunosupresyjnego działania
dużych dawek nie jest do końca poznany i wynika z wielu niewykluczających się wzajemnie zjawisk. Ze względu na wielokierunkowy wpływ na
funkcjonowanie układu odpornościowego znalazły one zastosowanie
w wielu dziedzinach medycyny.
Intravenous immunoglobulin (IVIg) preparations have been in use in
clinical practice for many years. Initially they were used in replacement
therapy in cases of immunodeficiency. The discovery of a significant and
dose-dependent immuomodulative IVIg effect resulted in their use in
treatment of inflammatory disorders. The mechanism of immunosuppressive effects of large doses is not fully understood and is dependent
upon numerous mutually non-excluding phenomena. Due to multi-directional influence on the functioning of immune system, IVIg have been
used in various areas of medicine.
Słowa kluczowe: immunoglobuliny, immunomodulacja, IVIg
Keywords: immunoglobulin, immunomodulation, IVIg
© Alergia Astma Immunologia 2014, 19 (0): 224-231
www.alergia-astma-immunologia.eu
Adres do korespondencji / Address for correspondence
Dr n. med. Sławomir Tokarski
Podkarpackie Centrum Chorób Płuc
ul. Rycerska 4, 35-241 Rzeszów
tel. 17 86 11 421 wew. 330, e-mail: [email protected]
Przyjęto do druku: 06.11.2014
Immunoglobuliny (Immunoglobulins, Ig) po raz pierwszy
zostały zastosowane w roku 1952 przez Brutona w leczeniu pacjenta z agammaglobulinemią z dobrym efektem
klinicznym [1]. Pierwsze preparaty były podawane drogą
domięśniową, co wiązało z małą efektywnością i szeregiem
działań niepożądanych. Stopniowo udoskonalano procesy
pozyskiwania oraz oczyszczania immunoglobulin dostosowując je do podawania drogą dożylną (Intravenous Immunoglobulin, IVIg).
Obecnie preparaty immunoglobulin produkowane są
z osocza 1000-15000 zdrowych dawców. Zawierają one
głównie przeciwciała klasy IgG (>95%). Pozostałą pulę
stanowią immunoglobuliny IgM i IgA. Spośród podklas immunoglobulin IgG największą część stanowią IgG1 i IgG2,
w większości preparatów znajduje się niewielka ilość IgG4
i tylko w nielicznych obecne są IgG3. Stosuje się je zarówno
w terapii substytucyjnej pierwotnych oraz wtórnych niedoborów odporności celem uzupełnienia brakujących przeciwciał jak i w leczeniu chorób autoimmunizacyjnych oraz
przewlekłych chorób zapalnych [2]. IgG bowiem wykazują
zarówno efekt pro- jak i przeciwzapalny. Efekt prozapalny
obserwowany jest przy niskich dawkach (200-400 mg/kg
m.c.) podawanego preparatu, natomiast efekt przeciwzapalny obserwowany jest po podaniu wysokich dawek immunoglobulin (1-2 g/kg m.c.).
Budowa immunoglobuliny i mechanizm działania
przeciwzapalnego
Cząsteczka immunoglobuliny (ryc. 1) zbudowana jest
z dwóch łańcuchów ciężkich oraz dwóch łańcuchów lekkich
połączonych wiązaniami dwusiarczkowymi. W łańcuchach
ciężkich i lekkich wyróżnia się części zmienne (V) leżące
w odcinku N-końcowym oraz części stałe (C) znajdujące się
w odcinku C-końcowym. W wyniku poddania cząsteczki IgG
działaniu pepsyną powstaje fragment F(ab’)2, składający
się z łańcuchów lekkich i z fragmentów łańcuchów ciężkich
wraz z mostkami disiarczkowymi oraz fragment Fc’ (ryc. 1).
Immunoglobuliny wiążą się z określonym antygenem
obecnym na powierzchni zmienionych komórek organizmu
(np. nowotworowych lub zakażonych wirusem), bakterii.
Powstanie kompleksu antygen-przeciwciało uruchamia kaskadę procesów biologicznych, zmierzających do neutralizacji czynnika chorobotwórczego poprzez:
Tokarski S i wsp.
Immunomodulacyjne działania i zastosowania immunoglobulin
– aktywację dopełniacza,
– indukcję fagocytozy,
– indukcję cytotoksyczności komórkowej zależnej od przeciwciał (ang. antibody-dependent cell-mediated cytotoxicity, ADCC),
– bezpośrednią neutralizację.
Immunoglobuliny samodzielnie nie uszkadzają i nie niszczą antygenu, dlatego też konieczny jest udział innych cząsteczek i komórek układu odpornościowego, posiadających
na swojej powierzchni receptory dla fragmentu Fc.
Mechanizm immunosupresyjnego działania dużych dawek immunoglobulin nie jest do końca wyjaśniony i prawdopodobnie wynika z szeregu niewykluczających się wzajemnie procesów. Zidentyfikowano liczne prawdopodobne
mechanizmy działań IVIg. Poprzez receptor dla fragmentu
FcIgG mogą wpływać na aktywność różnych komórek układu odpornościowego. Uważa się, iż immunoglobuliny blokują receptory aktywujące (FcγRI, FcγRIIa, FcγRIII) i indukują
czynniki hamujące [3-5].
Łączą się również z noworodkowym receptorem Fc (FcRn)
przypominającym budową cząsteczki MHC klasy I, obecnym na powierzchni syncytiotrofoblastu łożyska- (transport
matczynych IgG przez łożysko), ale także u osób dorosłych
na powierzchni wielu komórek, w tym na powierzchni
śródbłonka naczyń, nabłonka jelit, hepatocytach. Podstawową funkcją tego receptora jest regulacja stężenia IgG
w surowicy krwi. Zablokowanie tego receptora przez fragment Fc immunoglobuliny z preparatu IVIg uniemożliwia
wiązanie go z autoreaktywnymi Ig, co w efekcie prowadzi
do skrócenia okresu ich półtrwania w surowicy [6].
Wykazano, iż IVIg inaktywują lub prowadzą do apoptozy
komórki T i jednocześnie przywracają równowagę cytokin
anty- i pro-zapalnych. Zaobserwowano, iż IVIg hamują migrację autoprzeciwciał przez barierę krew–nerw. Znany jest
również wpływ tych egzogennych przeciwciał na komórki
B. IVIg obniżają produkcję przeciwciał przez komórki B oraz
zakłócają ich proliferację. Immunoglobuliny dożylne mogą
również zawierać liczne przeciwciała antyidiotypowe, które
neutralizują przeciwciała patogenne. Udowodniono rów-
225
nież, że terapia IVIg przerywa kilka etapów kaskady aktywacji układu dopełniacza.
Bayry i wsp. [7] wykazali, że podawanie wysokich dawek
IVIg hamuje różnicowanie i dojrzewanie komórek dendrytycznych (Dendritic Cells, DC), powoduje wzrost ekspresji
cząstek HLA, CD80, CD86na ich powierzchni. Stwierdzili
również zmniejszenie zdolność DC do przetwarzania i prezentacji własnych antygenów oraz aktywacji limfocytów T.
Ponadto autorzy zaobserwowali obniżenie produkcji IL-12,
przy jednoczasowym zwiększeniu produkcji IL-10 o własnościach przeciwzapalnych. W innych badaniach Rhoades
i wsp. [8] zaobserwowali zmniejszenie aktywności komórek
żernych w rozwoju układowej reakcji zapalnej poprzez immunomodulujący wpływ wysokich dawek IVIg na równowagę cytokin pro- i anty-zapalnych.
Niewielki odsetek immunoglobulinobecnych w IVIg, posiada glikan fragmentu Fc sprzężony z kwasem sjalowym.
Zwrócono uwagę, że po rozerwaniu tego wiązania nie jest
możliwe uzyskanie działania przeciwzapalnego, natomiast
podanie prepartu z procentowo dużą ilością immunoglobulin ze sjalowanymi fragmentami Fc prowadzi do wywołania
silnego efektu przeciwzapalnego [9]. Dodatkowo Anthony
i wsp. [10] wykazali, że rekombinowane sjalowe Fc IgG1,
wykazują 35-krotnie silniejsze działanie przeciwzapalne,
w porównianiu do IgG zawartych w standardowym preparacie. Ponadto autorzy uważają, że efekt przeciwzapalny
jest skutkiem pobudzenia receptora hamującego FcγRIIb na
komórkach efektorowych, powstałym po interakcji sjalowanych Fc IgG z receptorem lektynowym makrofagów śledziony SIGN-R1 (Specific ICAM-3 Grabibing Non-integrin-Related 1) [11].
Podsumowując należy podkreślić, iż działanie przeciwzapalne obserwowane po podaniu dużych dawek IVIg
wynika z wielu niezależnych mechanizmów immunologicznych, składu preparatu zawierającego nie tylko same IgG,
ale również p/c przeciwko cytokinom, rozpuszczalne CD4
i CD8, cząstki HLA, których obecność w dużych ilościach
może potencjalizować działanie immunomodulujące.
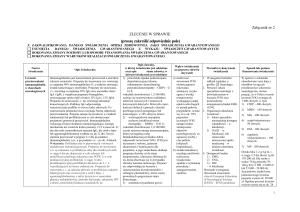
W tabeli I przedstawiono wpływ składowych Ig na układ
odpornościowy, natomiast na rycinie 2 wpływ IVIg na poszczególne komórki układu odpornościowego [10,12-15].
W ostatnich latach nastąpił znaczny postęp w rozumieniu
mechanizmów, poprzez które IVIg wywierają swoje działanie immunomodulacyjnei równocześnie immunoglobuliny znalazły zastosowanie w wielu dziedzinach medycyny.
W tabeli II podano rejestracyjne wskazania do zastosowań
preparatu IVIg (Octagam 10%) - efekt immunomodulacyjny, a w tabeli III zestawienie poziomu wiarygodności i siły
zaleceń zastosowań IVIg w terapii różnych schorzeń (efekt
immunomodulacyjny), zgodnie z zasadami EBM (Evidence
Based Medicine).
Zastosowania w chorobach neurologicznych
Ryc. 1. Schemat budowy przeciwciał
Terapia IVIg jest uznaną i przyjętą metodą leczenia wielu
neuropatii m.in. zespołu Guillain-Barre, przewlekłej zapalnej
polineuropatii demielinizacyjnej, wieloogniskowej neuropatii ruchowej, stwardnienia rozsianego, miastenii gravis czy
też zespołu sztywności uogólnionej [16-18]. Skuteczność
226
Alergia Astma Immunologia 2014, 19 (4): 224-231
Tabela I. Wpływ składowych immunoglobulin na układ odpornościowy
Fragment Immunoglobuliny
Efekt działania
Fragment Fc
•
•
•
•
•
•
•
zahamowanie fagocytozy
zahamowanie ADCC
wpływ na wytwarzanie i krążenie p/c za pośrednictwem FcR
zahamowanie dojrzewania komórek dendrytycznych
hamowanie wiązania kompleksów immunologicznych z FcR
wpływ na receptor FcRn
wpływ na aktywność CD4 (Treg- CD4+CD25+FOXP3+)
Fragment Fab
•
•
•
•
•
•
•
•
zahamowanie namnażania komórek
modulacja procesu apoptozy (CD95) i cyklu komórkowego
aktywacja swoistych limfocytów
wpływ na proces adhezji komórek
p/c antyidiotypowe
wpływ na stężenie cytokin
p/c przeciwko patogenom
hamowanie aktywacji dopełniacza
Pozostałe składniki obecne w
preparacie IVIg
Związki o własnościach immunoregulacyjnych np.
• cytokiny
• rozpuszczalne inhibitory cytokin
• cząstki HLA
• rozpuszczalne CD4, CD8
Tabela II. Wskazania rejestracyjne - efekt immunomodulacyjny.
Immunomodulacyjny efekt IVIg - wskazania rejestracyjne
(preparat Octagam 10%)
•
Pierwotna małopłytkowość immunologiczna u pacjentów z dużym ryzykiem krwawień lub przed zabiegiem
chirurgicznym w celu skorygowania liczby płytek krwi
•
Zespół Guillain-Barré
•
Choroba Kawasaki
•
Wieloogniskowa neuropatia ruchowa
•
Allogeniczne przeszczepianie szpiku
Tabela III. Siła zaleceń i poziomu wiarygodności stosowania IVIg
Rodzaj schorzeń
Poziom wiarygodności i siła zaleceń
Choroby neurologiczne
I A- IV C
Choroby reumatyczne
I A- III B
Choroby zakaźne
II A- III C
Transplantologia
I A- III
Choroby hematologiczne
I A- III C
Choroby skóry
II A- II B
Tokarski S i wsp.
Immunomodulacyjne działania i zastosowania immunoglobulin
immunoglobulin w tych jednostkach chorobowych została potwierdzona w licznych badaniach randomizowanych. Poziom wiarygodności uzyskanych danych zgodnie
z EBM (Evidence Based Medicine) w tych jednostkach chorobowych został określony jako I, a siła zaleceń na poziomie
A lub B. Publikowane są również prace, w których autorzy
na podstawie uzyskanych wyników nie potwierdzają skuteczności IVIg w terapii tych chorób [19].
Dobrą odpowiedź kliniczną po podaniu IVIg obserwowano również w zespole miastenicznym Lamberta-Eatona,
w zapaleniu skórno-mięśniowym i wielomięśniowym [20].
Choroby te występują rzadko, dlatego też prowadzone badania zgromadziły niewielką liczbę osób. Poziom wiarygodności danych i siła zaleceń zostały w tym przypadku określone w przedziale IIIB-IVC.
Billiau i wsp. [21] przeprowadzili badanie otwarte mające wykazać skuteczność terapeutyczną IVIg w opornej
na leczenie padaczce, a Farbu i wsp. [22] w zespole post-polio, spowodowanym postępującą degeneracją jednostek ruchowych, po przebytym ostrym zapaleniu rogów
przednich rdzenia kręgowego (choroba Heinego-Medina).
Wyniki tych badań były obiecujące, obserwowano zmniejszenie ilości napadów padaczkowych, poprawę zapisu EEG,
a w przypadku zespołu post-polio poprawę siły mięśniowej, ale były one przeprowadzone na niewielkiej liczbie
badanych. Uważa się, że zastosowanie IVIg w leczeniu lekoopornej padaczki należy rozważać tylko u tych chorych,
u których wykorzystano inne metody leczenia i nie uzyskano poprawy, a przypadku zespołu post-polio rutynowe zastosowanie immunoglobulin nie jest zalecane.
227
Zastosowanie IVIg w chorobach reumatycznych
Od wielu lat niesterydowe leki przeciwzapalne, glikokortykosteroidy oraz preparaty immunosupresyjne są podstawowymi lekami stosowanymi w leczeniu chorób reumatycznych. Wprowadzenie leczenia biologicznego zdecydowanie
poprawiło zarówno efekt terapeutyczny jak i jakość życia
pacjentów. Preparaty IVIg znane i stosowane w innych jednostkach chorobowych z bardzo dobrym efektem, w przypadku chorób reumatycznych zalecane są rzadko, dodatkowo badania kliniczne z wykorzystaniem immunoglobulin
prowadzone były z udziałem niewielkich grup pacjentów.
Jednostką chorobową, w której IVIg są zalecane jest
choroba Kawasaki (Kawasaki Syndrome, KS). Etiologia tej
choroby nie jest do końca poznana, postulowany jest patomechanizm autoimmunizacyjny indukowany czynnikami
infekcyjnymi. Metaanaliza Oates-Whitehead i wsp. [23] wykazała wysoką terapeutyczną skuteczność immunoglobulin
w leczeniu KS.
Również wyniki badań z zastosowaniem IVIg w młodzieńczym idiopatycznym zapaleniu stawów (Juvenile
Rheumathoid Arthritis, JRA) wskazują na korzystny efekt
podania: zaobserwowano mniejsze zużycie glikokortykosteroidów oraz leków immunosupresyjnych [24,25].
Do chwili obecnej nie przeprowadzono dużych badań
klinicznych oceniających skuteczność podawanych immunoglobulin chorym z toczniem układowym (Systemic Lupus
Erythematosus, SLE). Większość dostępnych danych uzyskano z niewielkich badań lub na podstawie opisów pojedynczych przypadków. Levy i wsp. [26] przeprowadzili badanie
Ryc. 2. Mechanizm immunomodulacyjnego działania IVIG na elementy układu odpornościowego (wg Ballow M)
ADCC - cytotoksyczność zależna od przeciwciał; IL - interleukina; IFN - interferon; Mo - monocyt; NK - natural Killer
228
kliniczne, w którym 20 chorym na SLE podawano wysokie dawki IVIg, uzyskując pozytywna odpowiedź kliniczną
u 85% badanych. Sherer i wsp. [27] w badaniu retrospektywnym z udziałem 62 osób stwierdził istotną poprawę
w większości przypadków, obniżenie aktywności choroby
mierzoną wskaźnikiem SLEDAI (Systemic Lupus Erythematosus Diseases Activity Index), po podaniu IVIgw dawce 500
mg/kg m.c. Jednocześnie autorzy zwrócili uwagę na nadal
utrzymującą się trombocytopenię, łysienie i zapalenie naczyń, pomimo zastosowanego leczenia.
Przeprowadzono również badania z zastosowaniem
IVIg w zespole antyfosfolipidowym, twardzinie układowej,
reumatoidalnym zapaleniu stawów [28-30], w zapaleniach
naczyń (ziarniniak Wegenera, zespół Churga-Strauss, mikroskopowe zapalenie naczyń), jednak uzyskane wyniki nie
dają jednoznacznych podstaw do zastosowania IVIg w leczeniu I-rzutu. Autorzy podkreślali konieczność prowadzenia dalszych badań, dobrze zaprojektowanych, prowadzonych na dużych grupach pacjentów [31-33].
Należy podkreślić, iż lekami z wyboru w terapii chorób
reumatycznych są glikokortykosteroidy oraz leki immunosupresyjne, a zastosowanie IVIg zgodnie z obecnym stanem
wiedzy, należy rozpatrywać w sytuacjach całkowitego braku poprawy po leczeniu klasycznym lub sytuacjach zagrożenia życia, przy wtórnym niedoborze odporności, cytopenii
niepoddającej się leczeniu.
Zastosowanie IVIg w transplantologii
Do chwili obecnej opublikowano szereg opracowań,
w których autorzy opisywali efekty stosowania IVIg w tej
dziedzinie medycyny.
W latach 90. Bass i wsp. [34] przeprowadził metaanalizę dwunastu prac, wykazując skuteczność terapeutyczną
IVIg w zapobieganiu chorobie przeszczep przeciw gospodarzowi (Graft versus Host Disease, GvHD). Abdell i wsp.
[35] wykazali, iż tylko wyższe dawki IVIg są skuteczne
w zapobieganiu GvHD. Inni autorzy nie zaobserwowali
istotnej różnicy w odniesieniu do grupy kontrolnej w częstości występowania GvHD u chorych otrzymujących zredukowane dawki IVIg (500 mg/kg m.c.) [36].
Wiele uwagi poświęcono zastosowaniu IVIg w leczeniu
biorców wysoko immunizowanych przygotowywanych do
przeszczepu nerki. Wyniki badań Yussim i wsp. [37], jak
i Jordana i wsp. [38] potwierdzają, że wykorzystanie synergistycznego działania immunoglobulin oraz innych interwencji modyfikujących funkcjonowanie układu odpornościowego daje co najmniej porównywalne, a nawet lepsze
wyniki.
Wiele kontrowersji budzi również stosowanie IVIg w leczeniu ostrego odrzucania humoralnego przeszczepu.Mongomery i wsp. [39] dowiedli wysokiej skuteczności (80%)
terapii IVIg skojarzonej z plazmafarezami. Zgodnie z aktualnym stanem wiedzy uważa się, że preparaty immunoglobulin nie należą do środków stosowanych w terapii ostrego
odrzucania przeszczepu opornego na steroidy, a zastosowanie ich powinno być łączone z plazmafarezą [40].
Natomiast zastosowanie immunoglobulin konieczne jest
u dzieci, u których przeprowadzono zabieg transplantacji
Alergia Astma Immunologia 2014, 19 (4): 224-231
komórek hematopoetycznych (Hematopoetic Stem Cell
Transplantation, HSCT), celem zarówno uzupełnienia niedoborów jak i immunomodulacji niekorzystnych zjawisk
autoimmunizacyjnych. Zalecono prowadzenie tej terapii do
czasu rekonstytucji limfocytów B i uzyskania odpowiedniego stężenia immunoglobulin w osoczu krwi [41].
Zastosowanie IVIg w chorobach
hematologicznych
Najlepiej udokumentowany i korzystny wpływ IVIg
w hematologii, wykazano w leczeniu samoistnej plamicy
małopłytkowej (Immune Thrombocytopenic Purpura, ITP),
zwanej też pierwotną małopłytkowością autoimmunizacyjną. Beck i wsp. [42] w metaanalizie wielu badań klinicznych, artykułów oraz doniesień zjazdowych wykazali, że
chorzy po 48 godzinach terapii ostrej fazy ITP i otrzymujący
duże dawki IVIg, mają o 26% wyższe prawdopodobieństwo
uzyskania liczby płytek krwi > 20 tysięcy, w porównaniu do
leczonych glikokortykosteroidami.
W 2010 roku została opublikowana praca, w której autorzy przedstawili zalecenia odnośnie diagnostyki i leczenia
samoistnej plamicy małopłytkowej, w której IVIg są podstawą terapii [43].
Poważnym schorzeniem płodu, w którym podawanie
IVIg ma również udokumentowane zastosowanie jest alloimunologiczna małopłytkowość noworodków (Neonatal Alloimmune Thrombocytopenia, NAIT), wywołanym
niezgodnością antygenów płytkowych pomiędzy matka
a płodem. Włączenie IVIg matkom jest terapią z wyboru, bowiem zwiększa szanse na urodzenie zdrowego dziecka [44].
Natomiast w przypadku zespołu Evansa oraz autoimmunizacyjnej hemolitycznej niedokrwistości zastosowanie IVIg
jest ograniczone tylko do przypadków opornych na leczenie
glikokortykosteroidami [45].
Zastosowanie IVIg w terapii chorób zakaźnych
Immunomodulacyjne działanie IVIg może być wykorzystywane w terapii chorób zakaźnych, jako leczenie wspomagające. W literaturze światowej opublikowano wiele
prac opisujących pozytywny efekt terapeutyczny po zastosowaniu dużych dawek IVIg. Uwagę zwrócono na zakażenia
wywołane przez Parvovirus B-19, częste wśród dzieci, które
przebiega łagodnie, a nawet w 20% przypadków bezobjawowo. Natomiast w przypadku kobiet ciężarnych u 8-20%
zakażonych może być przyczyną nieimmunologicznego
obrzęku płodu, ze zgonem wewnątrzmacicznym włącznie
[46]. Skutkiem transmisji zakażenia może być aplazja układu czerwonokrwinkowego płodu prowadząca do anemii,
niewydolności krążenia oraz obrzęku. Wyniki badań dowodzą, że włączenie do terapii aplazji preparatów IVIg prowadzi do poprawy stanu zdrowia tej grupy pacjentów [47-49].
Z powodzeniem stosowano również IVIg z leczeniu zespołu wstrząsu septycznego wywołanego toksyną gronkowcową. Di Rosa i wsp. [50] przeprowadzili metaanalizę
dostępnych badań, przeglądów systematycznych poświęconych zastosowaniu IVIg w leczeniu wstrząsu wywołanego ciężkim zakażeniem gronkowcowym. Autorzy zwrócili
uwagę, iż pomimo pewnych niespójności w uzyskanych
Tokarski S i wsp.
Immunomodulacyjne działania i zastosowania immunoglobulin
wynikach, małych liczebnie grup badanych, uzyskane
dane dowodzą pozytywnego efektu po zastosowaniu IVIg
w terapii. Jednocześnie podkreślili konieczność przeprowadzenia dalszych badań w większych grupach chorych.
Alejandria i wsp. [51] po przeanalizowaniu piśmiennictwa
z lat 1966-2012 dotyczącego leczenia posocznicy, zarówno
u noworodków jak i u osób dorosłych, stwierdzili, że zastosowanie IVIg w terapii zmniejsza śmiertelność osób dorosłych, natomiast nie zmniejsza jej u noworodków.
Zastosowanie IVIg w dermatologii
Immunoglobuliny ze względu na efekt immunomodulujący mogą być również stosowane w niektórych chorobach
skóry. Prins i wsp. [52] w wieloośrodkowym retrospektywnym badaniu z udziałem 12 chorych z zespołem Stevensa-Johnsona (Stevens-Johnson Syndrom, SJS), zaobserwowali
całkowite wygojenie skóry średnio w ciągu8 dni oraz 100%
przeżywalność, po zastosowaniu IVIg w dawce 0,6g/kg m.c.
W 2014 roku ukazała się metaanaliza Barron i wsp. [53]
prac opublikowanych w latach 1966-2011, poświęconych
stosowaniu preparatów immunoglobulin w leczeniu zespołu
SJS oraz w toksycznej epidermolizie naskórka (Toxic Epidermal
Necrolysis, TEN). Autorzy wykazali dużą wartość terapeutyczną IVIg, zwracając szczególną uwagę na zmniejszenie śmiertelności w grupie chorych otrzymujących immunoglobuliny
w dawce >2 g/kg m.c (p=0,009). Podjęto również próby
zastosowania IVIg w terapii ciężkiego atopowego zapalenia
skóry, niepoddającego się klasycznej terapii. W dostępnym
piśmiennictwie światowym podwójnie zaślepionych, kontrolowanych placebo badań nie opublikowano.
Paul i wsp. [54] w randomizowanym badaniu z udziałem
9 dorosłych chorych na ciężkie atopowe zapalenie skóry nie
wykazali istotnej poprawy klinicznej po zastosowaniu IVIg
w monoterapii. Publikowane są natomiast opisy przypadków i niekontrolowanych badań, w których autorzy dowodzą skuteczności klinicznej IVIg u dzieci [55,56]. Preparaty
immunoglobulin podano tym pacjentom, u których nie uzyskano efektów terapeutycznych po zastosowaniu klasycznego leczenia i jednocześnie obserwowano skutki uboczne
związane ze stosowaniem glikokortykosteroidów (GKS). Po
zakończeniu obserwacji stwierdzono poprawę miejscową,
przy jednoczasowej redukcji dawek GKS oraz obniżenie stężenia całkowitego IgE w surowicy krwi u tych chorych.
IVIg w astmie oskrzelowej
Wyniki badań dotyczących stosowania IVIg w ciężkiej
astmie są kontrowersyjne. Kishiyama i wsp. [57] w randomizowanym, podwójnie zaślepionym, wieloośrodkowym
badaniu, ocenili skuteczność wysokich dawek dożylnych
gammaglobulin w leczeniu ciężkiej, steroidozależnej astmy
oskrzelowej u 16 pacjentów w wieku 6-68 lat. Autorzy nie
stwierdzili klinicznej i statystycznej różnicy w grupie otrzymującej IVIg w porównaniu do grupy placebo.
Odmienne są rezultaty badań prowadzonych w innych
ośrodkach. Salmun i wsp. [58], a także Haques i wsp. [59]
wykazali, że podawanie IVIg chorym z ciężką astmą oskrzelową wiązało się z mniejszym zapotrzebowaniem na glikokortysteroidy systemowe.
229
Terapie eksperymentalne
Już od 2002 r. prowadzone są badania nad wykorzystaniem IVIg w terapii choroby Alzheimera (Alzheimer Disease, AD). We wczesnych próbach klinicznych stwierdzono
redukcję zaburzeń poznawczych i zwiększenie metabolizmu glukozy mózgu. Obserwowano wzrost stężenia immunoglobulin w osoczu i w płynie mózgowo-rdzeniowego oraz redukcję stężenia beta amyloidu w osoczu u osób
poddanych tej terapii. Efekt ten autorzy wiążą z obecnością
przeciwciał przeciwko beta-amyloidowi w preparatach immunoglobulin. Chociaż wyniki badań klinicznych przeprowadzonych do chwili obecnej nie pozwalają na stosowanie IVg w leczeniu AD, to prowadzenie dalszych badań jest
konieczne. Uzyskane dane być może pomogą opracować
skuteczne metody leczenia tego schorzenia [60-62].
Działania niepożądane po podawaniu IVIg
Podawanie preparatów IVIg wiąże się również z możliwością wystąpienia działań niepożądanych, które obserwuje się o około 20% leczonych. Najczęściej występują objawy
lekkie takie jak gorączka, dreszcze, ból głowy, ale mogą wystąpić również poważne działania niepożądane, do wstrząsu anafilaktycznego włącznie. Nasilenie objawów zależy
również od szybkości podawania leku, ale również od rodzaju preparatu, które mogą różnić się m.in. rodzajem stabilizatora czy też stężeniem białka [63]. W tabeli IV podano
najczęściej obecne objawy niepożądane po podaniu IVIg.
Podsumowanie
W ostatnich latach nastąpił znaczny postęp w rozumieniu mechanizmów, poprzez które IVIg wywierają swoje
działanie immunomodulacyjne w chorobach zakaźnych
i autoimmunizacyjnych. Sposób działania IVIg jest kompleksowy, wywołuje modulacje ekspresji i funkcji receptora Fc,
wpływa na cząstki ko-stymulujace, adhezyjne, na sieć cytokin i chemokin, Można przyjąć, że IgG jest składnikiem
układu odpornościowego prawdopodobnie o największym
potencjale immunomodulacyjnym.
Zastosowanie kliniczne IVIg jest coraz częstsze, ze wzrastającym spektrum zastosowań klinicznych. Z tego powodu
kontynuuje się badania nie tylko by polepszyć ich jakość,
ale poprzez zdobycze bioinżynierii wzmocnić ich działanie immunomodulacyjne. Proponuje się nowe wskazania,
w których IVIg wywiera korzystny efekt kliniczny i stanowi alternatywę terapeutyczna w chorobach, w których nie
ma dostępnej terapii. W Polsce zastosowanie preparatów
immunoglobulin poza wskazaniami producenta jest skomplikowane ze względu na obowiązujące przepisy. Nie ma
również rekomendacji dla zastosowania immunoglobulin
we wskazaniach pozarejestracyjnych, tak jak w innych krajach europejskich. Dla przykładu, w Wielkiej Brytanii zespół
ekspertów powołany przez Ministerstwo Zdrowia, na podstawie opublikowanych wyników badań z zastosowaniem
IVIg, opracował przewodnik omawiający ich stosowanie
w różnych jednostkach chorobowych. Jest to cenna pozycja
dostarczająca wskazówek, w jakich sytuacjach i jak długo,
możemy je stosować (Guidelines for Immunoglobulin Use-www.ivig.nhs.uk/documents).
230
Alergia Astma Immunologia 2014, 19 (4): 224-231
Tabela IV. Objawy niepożądane mogące wystąpić po podawaniu IVIg.
Układowe umiejscowienie
reakcji niepożądanych
Objawy ogólnoustrojowe
Objawy miejscowe
Układ nerwowy
Narząd wzroku
Układ krwionośny
Układ oddechowy
Układ krwiotwórczy
Układ moczowy
Objawy
Dreszcze, gorączka, osłabienie, zmęczenie, ból w klatce piersiowej, objawy
grypopodobne.
Bóle mięśni i kostno-stawowe, reakcje anafilaktyczne, wstrząs anafilaktyczny.
Ból i rumień w miejscu podania.
Ból i zawroty głowy, zaburzenia czucia, drżenia, drgawki, aseptyczne zapalenie
mózgu.
Udar OUN, krwotok do OUN.
Światłowstręt, zaburzenia widzenia, ból oka.
Nadciśnienie, zaczerwienie twarzy, zakrzepowe zapalenie żył, zaburzenia rytmu
serca, zawał mięśnia sercowego, zatorowość płucna.
Kaszel, uczucie duszności, obturacja dróg oddechowych, hiperwentylacja.
Hemoliza krwinek, trombocytopenia, anemia, limfadenopatia.
Niewydolność nerek.
Piśmiennictwo
1. Bruton O. Agammaglobulinemia (congenital absence of gamma globulin); report of a case. Med Ann Dist Columbia. 1953;
22: 648-50.
16. Kuitwaard K, de Gelder J, Tio-Gillen A. Pharmacokinetics of intravenous immunoglobulin and outcome in Guillain-Barré syndrome. Ann Neurol. 2009; 66: 597-603.
2. Gürcan H, Ahmed A. Efficacy of various intravenous immunoglobulin therapy protocols in autoimmune and chronic inflammatory disorders. Ann Pharmacother. 2007; 41: 812-23.
17. Stangel M, Klaus V, Toyka M. Mechanisms of High-Dose Intravenous Immunoglobulins in Demyelinating Diseases. Arch Neurol.
1999; 56: 661-3.
3. Samuelsson A, Towers T, Ravetch J. Anti-inflammatory activity of
IVIg mediated through the inhibitory Fc receptor. Science 2001;
291: 484-6.
18. Rieckmann P, Toyka K, Bassetti C. Escalating immunotherapy of
multiple sclerosis--new aspects and practical application. J Neurol. 2004; 251: 1329-39.
4. Nimmerjahn F. Ravetch J. Anti-inflammatory actions of intravenous immunoglobulin. Ann Rev Immunol. 2008; 26: 513-33.
19. Hughes R, Swan A, van Doorn P. Intravenous immunoglobulin
for Guillain-Barré syndrome. Cochrane Database Syst Rev. 2014;
9: CD002063.
5. Nimmerjahn F, Ravetch J. The anti-inflammatory activity of IgG:
the intravenous IgG paradox. J Exp Med 2007; 204: 11-15.
6. Jordan SC, Toyoda M, Vo A. Intravenous immunoglobulin a natural regulator of immunity and inflammation. Transplantation.
2009; 88: 1-6.
7. Bayry J, Lacroix-Desmazes S, Kazatchkine M i wsp. Common variable immunodeficiency is associated with defective functions
of dendritic cells. Blood. 2004; 104: 2441-3.
8.
9.
Rhoades C, Williams M, Kelsey S. Monocyte-macrophage system as targets for immunomodulation by intravenous immunoglobulin. Blood Rev. 2000; 14: 14-30.
Kaneko Y, Nimmerjahn F, Ravetch J. Anti-inflammatory activity of immunoglobulin G resulting from Fc sialylation. Science
2006; 313: 670-3.
10. Anthony R, Nimmerjahn F, Ashline D i wsp. Recapitulation of
IVIG anti-inflammatory activity with a recombinant IgG Fc.
Science 2008; 320: 373-6.
11. Anthony R, Wermeling F, Karlsson M. Identification of a receptor required for the anti-inflammatory activity of IVIG. Proc Natl
Acad Sci USA 2008; 105: 19571-8.
12. Ballow M. The IgG molecule as a biological immune response
modifier: mechanisms of action of intravenous immune serum
globulin in autoimmune and inflammatory disorders. J Allergy
Clin Immunol. 2011; 127: 315-23.
13. Bayry J, Dasgupta S, Misra N i wsp. Intravenous immunoglobulin in autoimmune disorders: an insight into the immunoregulatory mechanisms. Int Immunopharmacol. 2006; 6: 528-34.
14. Kasztalska K, Ciebiada M, Górski P. Mechanizm działania immunoglobuliny dożylnie. Pol Merkur Lekarski. 2010; 29: 263-8.
15. Hemmer B, Nessler S, Zhou D i wsp. Immunopathogenesis and
immunotherapy of multiple sclerosis. Nat Clin Pract Neurol
2006; 2: 201-11.
20. Patwa H, Chaudhry V, Katzberg H, Rae-Grant A. Evidence-based guideline: intravenous immunoglobulin in the treatment of
neuromuscular disorders: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of
Neurology. Neurology 2012; 78: 1009-15.
21. Billiau A, Witters P, Ceulemans B. Intravenous immunoglobulins in refractory childhood-onset epilepsy: effects on seizure
frequency, EEG activity, and cerebrospinal fluid cytokine profile.
Epilepsia. 2007; 48: 1739-49.
22. Farbu E, Rekand T, Vik-Mo E i wsp. Post-polio syndrome patients
treated with intravenous immunoglobulin: a double-blinded
randomized controlled pilot study. Eur J Neurol. 2007; 14: 60-5.
23. Oates-Whitehead R, Baumer J, Haines L i wsp. Intravenous immunoglobulin for the treatment of Kawasaki disease in children. Cochrane Database Syst Rev. 2003; 4: CD004000.
24. Opperman J, Mobius D. Therapeutical and immunological effects of methylprednisolone pulse therapy in comparison with
intravenous immunoglobulin. Treatment in patients with juvenile chronic arthritis. Acta Univ Carol Med 1994; 40: 117-21.
25. Uziel Y, Laxer R, Schneider R, Silverman E. Intravenous immunoglobulin therapy in systemic onset juvenile rheumatoid arthritis:
a followup study. J Rheumatol 1996; 23: 910-18.
26. Levy Y, Sherer Y, Ahmed A. A study of 20 SLE patients with intravenous immunoglobulin – clinical and serologic response.
Lupus 1999; 8: 705-12.
27.
Sherer Y, Kuechler S, Jose Scali J. Low dose intravenous immunoglobulin in systemic lupus erythematosus: analysis of 62
cases. Isr Med Assoc J. 2008; 10: 55-7.
28. Dendrinos S, Sakkas E, Makrakis E. Low-molecular-weight heparin versus intravenous immunoglobulin for recurrent abortion
associated with antiphospholipid antibody syndrome. Int J Gynaecol Obstet. 2009; 104: 223-5.
Tokarski S i wsp.
Immunomodulacyjne działania i zastosowania immunoglobulin
29. Triolo G, Ferrante A, Accardo-Palumbo A. IVIG in APS pregnancy. Lupus 2004; 13: 731-5.
30. Nacci F, Righi A, Conforti M. Intravenous immunoglobulins improve the function and ameliorate joint involvement in systemic
sclerosis: a pilot study. Ann Rheum Dis. 2007; 66: 977-9.
31. Kanik K, Yarboro C, Naparstek Y. Failure of low-dose intravenous immunoglobulin therapy to suppress disease activity in patients with treatment-refractory rheumatoid arthritis. Arthritis
Rheum. 1996; 39: 1027-9.
32. Martinez V, Cohen P, Pagnoux C. Intravenous immunoglobulins
for relapses of systemic vasculitides associated with antineutrophil cytoplasmic autoantibodies: results of a multicenter,
prospective, open-label study of twenty-two patients. Arthritis
Rheum. 2008; 58: 308-17.
33. Taniguchi M, Tsurikisawa N, Higashi N. Treatment for Churg-Strauss
syndrome: induction of remission and efficacy of intravenous immunoglobulin therapy. Allergol Int. 2007; 56: 97-103.
34. Bass EB, Powe N, Goodman S. Efficacy of immune globulin
in preventing complications of bone marrow transplantation:
a meta-analysis. Bone Marrow Transplant. 1993; 12: 273-82.
35. Abdel-Mageed A, Graham-Pole J, Del Rosario M. Comparison
of two doses of intravenous immunoglobulin after allogeneic
bone marrow transplants. Bone Marrow Transplant. 1999; 23:
929-32.
36. Feinstein LC, Seidel K, Jocum J. Reduced dose intravenous immunoglobulin does not decrease transplant-related complications in adults given related donor marrow allografts. Biol Blood Marrow Transplant. 1999; 22: 369-78.
37. Yussim A, Klein T, Or H. Use of intravenous immunoglobulin in
organ transplantation for noninfectious indications. Transplant
Proc. 1997; 29: 3058-9.
38. Jordan SC, Tyan D, Stablein D, McIntosh M. Evaluation of intravenous immunoglobulin as an agent to lower allosensitization and improve transplantation in highly sensitized adult patients with end-stage renal disease: report of the NIH IG02 trial.
J Am Soc Nephrol. 2004; 15: 3256-62.
39. Montgomery R, Zachary A, Racusen L. Plasmapheresis and intravenous immune globulin provides effective rescue therapy for refractory humoral rejection and allows kidneys to be
successfully transplanted into cross-match-positive recipients.
Transplantation. 2000; 70: 887-95.
40. Shehata N, Palda V, Meyer R. The use of immunoglobulin therapy for patients undergoing solid organ transplantation: an
evidence-based practice guideline. Transfus Med Rev. 2010; 24
Suppl 1: S7.
41. Provan D, Chapel H, Sewell W. Prescribing intravenous immunoglobulin: summary of Department of Health guidelines. BMJ
2008; 337: 1831.
42. Beck C, Nathan P, Parkin P. Corticosteroids versus intravenous
immune globulin for the treatment of acute immune thrombocytopenic purpura in children: a systematic review and meta-analysis of randomized controlled trials. J Pediatr. 2005; 147:
521-7.
43. Provan D, Stasi R, Newland A. International consensus report on
the investigation and management of primary immune thrombocytopenia. Blood 2010; 115: 168-86.
44. Radder C, Brand A, Kanhai H. A less invasive treatment strategy
to prevent intracranial hemorrhage in fetal and neonatal alloimmune thrombocytopenia. Am J Obstet Gynecol. 2001; 185:
683-8.
45. Provan D, Chapel H, Sewell W. Prescribing intravenous immunoglobulin: summary of Department of Health guidelines. BMJ
2008; 337: a1831.
231
46. Yaegashi N, Niinuma T, Chisaka H i wsp. The incidence of, and
factors leading to, parvovirus B19-related hydrops fetalis following maternal infection; report of 10 cases and meta-analysis.
J Infect. 1998; 37: 28-35.
47. Gigler A, Dorsch S, Hemauer A i wsp. Generation of neutralizing
human monoclonal antibodies against parvovirus B19 proteins.
J Virol. 1999; 73: 1974-9.
48. Matsuda H, Sakaguchi K, Shibasaki T i wsp. Intrauterine therapy
for parvovirus B19 infected symptomatic fetus using B19 IgG-rich high titer gammaglobulin. J Perinat Med. 2005; 33: 561-3.
49. Selbing A, Josefsson A, Dahle LO, Lindgren R. Parvovirus B19
infection during pregnancy treated with high-dose intravenous
gammaglobulin. Lancet 1995; 345: 660-1.
50. Di Rosa R, Pietrosanti M, Luzi G. Polyclonal intravenous immunoglobulin: an important additional strategy in sepsis? Eur
J Intern Med. 2014; 25: 511-6.
51. Alejandria M, Lansang M, Dans L: Intravenous immunoglobulin
for treating sepsis, severe sepsis and septic shock. Cochrane Database Syst Rev. 2013; 9: CD001090.
52. Prins C, Vittorio C, Padilla R. Effect of high-dose intravenous
immunoglobulin therapy in Stevens-Johnson syndrome: a retrospective, multicenter study. Dermatology 2003; 207: 96-9.
53. Barron S, Del Vecchio M, Aronoff S. Intravenous immunoglobulin in the treatment of Stevens-Johnson syndrome and toxic
epidermal necrolysis: a meta-analysis with meta-regression
of observational studies. Int J Dermatol. 2014. doi: 10.1111/
ijd.12423
54. Paul C, Lahfa M, Bachelez H i wsp. A randomized controlled
evaluator-blinded trial of intravenous immunoglobulin in adults
with severe atopic dermatitis. Br J Dermatol. 2002; 147: 518-52.
55. Jolles S, Hughes J, Rustin M. The treatment of atopic dermatitis
with adjunctive high-dose intravenous immunoglobulin: a report of three patients and review of the literature. Br J Dermatol. 2000; 142: 551-4.
56. Jolles S, Sewell C, Webster D i wsp. Adjunctive high-dose intravenous immunoglobulin treatment for resistant atopic dermatitis: efficacy and effects on intracellular cytokine levels and
CD4 counts. Acta Derm Venereol. 2003; 83: 433-7.
57. Kishiyama J, Valacer D, Cunningham-Rundles C. A multicenter,
randomized, double-blind, placebo-controlled trial of high-dose intravenous immunoglobulin for oral corticosteroid-dependent asthma. Clin Immunol. 1999; 91: 126-33.
58. Salmun L, Barlan I, Wolf H. Effect of intravenous immunoglobulin on steroid consumption in patients with severe asthma:
a double-blind, placebo-controlled, randomized trial. J Allergy
Clin Immunol. 1999; 103: 810-5.
59. Haque S, Boyce N, Thien F. Role of intravenous immunoglobulin
in severe steroid-dependent asthma. Intern Med J. 2003; 33:
341-4.
60. Dodel R, Du Y, Depboylu C, Hampel H. Intravenous immunoglobulins containing antibodies against beta-amyloid for the
treatment of Alzheimer's disease. J Neurol Neurosurg Psychiatry
2004; 75: 1472-4.
61. Relkin N. Clinical trials of intravenous immunoglobulin for Alzheimer's disease. J Clin Immunol. 2014; 34: 74-9.
62. Wuest D, Lee K. Amyloid-β concentration and structure influences the transport and immunomodulatory effects of IVIG.
J Neurochem. 2014; 130: 1376-44.
63. Rose F, Palabrica R, Kwong S i wsp. Adverse events of intravenous immunoglobulin infusions: a ten-year retrospective study.
Asia Pac Allergy 2013; 3: 249-56.