MIEDŹ – PREZENTACJA
Kamil Adam Marudziński
Duże Koło Chemiczne w ZS UMK
(rok szkolny 2012/2013)
Miedź
Info ogólne
Miedź ma symbol Cu
Występuje w grupie metali przejściowych
układu okresowego (doczegokolwiek
wam się to przyda).
Posiada 26 izotopów ale tylko 2 trwałe
63 i 65
Barwi kolor płomienia na zielony
Info nieogólne
Konfiguracja elektronowa :
1s22s22p63s23p64s13d10
Elektroujemność wg Paulinga : 1,9
Przewodność elektryczna :
584.8 * 105 1/(m*Ω)
Gęstość (293K) : 8.96 g/cm3
Przewodność cieplna : 401 W (m*K)
bla bla bla…
Opis
Miedź jest jasnym metalem, mało
aktywnym chemicznie. Wykazuje dobrą
ciągliwość i kowalność, jest też bardzo
dobrym przewodnikiem elektryczności i
ciepła. Czysta miedź pokrywa się patyną
(węglanem hydroksomiedzi(II))
Liczba koordynacyjna :
Cu(I) : 2
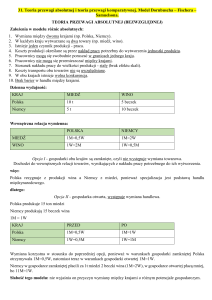
Cu(II) : 4
Właściwości chemiczne
Miedź jest metalem średnio aktywnym chemicznie
w temperaturze pokojowej. Z powietrzem w
temperaturze pokojowej reaguje powoli
pokrywając się cienką warstwą czerwonego
Cu2O. W obecności wilgoci i CO2 tworzy się
zielona warstwa zasadowych węglanów, chroniąca
miedź przed dalszym działaniem innych
czynników. Miedź łatwo reaguje z fluorowcami
tworząc odpowiednie halogenki. Nie rozpuszcza
się w kwasach nieutleniających. Metal ten ulega
działaniu kwasu azotowego. Tlenek miedzi (II)
CuO wykazuje charakter amfoteryczny.
Amoniakalne roztwory zawierające tlen dają
rozpuszczalne w wodzie kompleksy miedzi
Właściwości fizyczne
Po wytopie i oczyszczeniu jest miękkim metalem o
bardzo dobrym przewodnictwie cieplnym i
elektrycznym. W przeciwieństwie do metali z niepełnymi
powłokami d, wiązanie metaliczne w miedzi nie ma
charakteru kowalencyjnego i jest względnie słabe. Niska
twardość miedzi częściowo tłumaczy jej wysoką
przewodność elektryczną i wysoką przewodność
cieplną, które są drugie pod względem wielkości wśród
czystych metali w temperaturze pokojowej.
Charakterystyczny kolor miedzi pochodzi od przejść
elektronów pomiędzy wypełnionymi powłokami 3d, a
półpustymi 4s – różnice energetyczne pomiędzy tymi
powłokami odpowiadają energii światła
pomarańczowego.
Zastosowania
Pierwiastek ten znany jest od starożytności, od
kiedy to był podstawowym składnikiem brązów.
Głównym zastosowaniem miedzi jest produkcja
kabli elektrycznych, pokryć dachów i instalacji
wodociągowych i maszyn przemysłowych. Miedź
głównie używana jest jako metal, ale gdy
wymagana jest większa twardość, wtedy łącząc z
innymi metalami tworzy się stopy, takie
jak brąz czy mosiądz. Mała część miedzi jest
używana w produkcji związków będących
dodatkami do żywności i fungicydami w
rolnictwie oraz stosowana jako barwnik szkła
czy katalizator.
Występowanie
Występuje w skorupie ziemskiej w ilościach
55 ppm(z jęz angielskiego – parts per
milion). W naturze występuje w postaci rud
oraz w postaci czystej jako minerał – miedź
rodzima. Miedź rodzima jest rzadko
spotykana.
Głównym źródłem tego metalu są minerały:
Siarczki: chalkopiryt CuFeS2, chalkozyn Cu2S
, bornit Cu5FeS4;
Węglany: azuryt Cu3(CO3)2(OH)2, malachit
Cu2CO3(OH)2.
Chalkantyt
CuSO4 * 5H2O
Bornit ten niebieski
Chalkopiryt ten u
góry
Bornit Cu5FeS4
Chalkopiryt CuFeS2,
Chalkozyn
Cu2S
Azuryt
Cu3(CO3)2(OH)2
Malachit
Cu2CO3(OH)2.