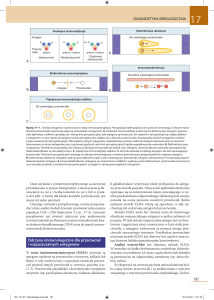
Pozyskiwanie i ulepszanie szczepów
produkcyjnych ;
mutageneza, fuzja protoplastów,
inżynieria genetyczna
Pełna analiza struktury
i screening aktywności
Drobnoustroje jako biologiczne źródło nowych substancji czynnych
Procentowy rozkład aktywności (n = 268) w przypadku ekstraktów z morskich
promieniowców z rodzaju Streptomyces. (wg O Kayser)
Ważne dla patentowania prace i wynalazki
Wg Kayser I Muller
Przechowywanie szczepów -banki kultur
matecznych
• Kultury komórkowe
suszy się w stanie zamrożenia np. zawiesinę
komórek w sterylnym odtłuszczonym mleku
poddaje się liofilizacji a następnie topi pod
próżnią lub w obecności azotu. Przechowuje
się w ciekłym azocie.
• Hodowle bakteryjne
można zamrażać w postaci
zawiesiny i przechowywać
w 10-20% glicerynie lub
w DMSO, w ciekłym azocie.
• Organizmy sporulujące
(grzyby strzępkowe, laseczki,
promieniowce) przechowuje się jako
hodowle glebowe:
zaschnięte hodowle na glinie leczniczej -
tworzą formy przetrwalnikowe
przechowywane w temp. 0o C.
W biotechnologii istnieją dwie metody optymalizacji
procesu biosyntezy metabolitów wtórnych
(np. podwyższania produktywności szczepu)
1. Optymalizacja
warunków procesu
2. Modyfikacja szczepu
produkcyjnego
Ad 1. Ustawicznie prowadzona optymalizacja warunków
wzrostu, składu podłoża hodowlanego, poszukiwanie
prekursorów biosyntezy i promotorów wzrostu
Ad. 2. Metody ulepszania szczepów
• metody nieukierunkowanych zmian
genetycznych, jak mutageneza z użyciem
środków chemicznych i fizycznych
• wytwarzanie, fuzja i odnawianie
protoplastów komórek zdolnych do
namnażania się
• aby uniknąć produktów ubocznych oraz
przedwczesnego przerwania biosyntezy,
do zwiększenia wydajności używa się dziś
również - w bardziej lub mniej
ukierunkowany sposóbmetod i strategii inżynierii genetycznej
Mutageneza
Najczęściej stosowane czynniki mutagenne
• UV 230-260nm
• Związki chemiczne - alkilujące
Kierunki i skutki zmian genotypu w wyniku mutagenezy
Mechanizmy naprawcze
Niemutagenne (2)
• Fotoreaktywacja
aktywowany światłem enzym rozszczepiający
dimery tyminy
Mutagenne (3)
•Mechanizm SOS indukowany
po zatrzymaniu replikacji
• Wycinanie uszkodzonych fragmentów
DNA
Inhibitory mechanizmów naprawczych:
• Resynteza DNA
Kofeina, metylopuryny, chinony KHSO3
Metody selekcji szczepów produkujących
substancje czynne biologicznie
Wg A. Chmiel
Metoda płytek gradientowych selekcji mutantów opornych
na toksyczną substancje
ST - stężenie substancji toksycznej,
A - płytka z podłożem zawierającym ST,
B - płytka zalana drugą warstwą podłoża (bez ST),
C - w wyniku dyfuzji powstaje gradient stężenia ST
D - rozmieszczenie kolonii na płytce gradientowej
Wg A. Chmiel
Fuzja protoplastów
1.
•
•
•
2.
3.
•
•
4.
5.
6.
Hydroliza ściany komórkowej ( w roztworze hipertonicznym!)
dla bakterii G+, w tym promieniowców - lizozym
dla bakterii G- - lizozym i EDTA
dla drożdży i grzybów - sok żołądkowy
ślimaka Helix pomatia
Wirowanie protoplastów
Agregacja
30% PEG, sole Ca2+, pH=9
elektrofuzja
Heterokarion
Rekombinacja
Haploidyzacja i segregacja genotypów
Fuzja komórek roślinnych
http://www.zbtr.wbbib.uj.edu.pl
http://www.syntheticsomaticseeds.org/protoplast-fusion
Uproszczony zarys technologii rekombinowanego DNA
Wektory plazmidowe
Plazmidy - autonomiczne, pozachromosalne elementy
genetyczne występujące u wielu organizmów prokariotycznych
i niektórych eukariotów, zdolne do autonomicznej replikacji.
Mogą być przekazywane pomiędzy komórkami poprzez horyzontalny
transfer genów np. w procesie koniugacji, transdukcji i transformacji.
Kosmidy – sztucznie wytworzone wektory poprzez połączenie plazmidu
z sekwencją cos bakteriofaga.
http://www.bio.davidson.edu/Courses/Molbio/MolStudents/spring2003/WilsonE/home.cosmids.html
Transformacja roślin i grzybów za pomocą bakterii
z rodzaju Agrobacterium
• bakterie fitopatogenne, odpowiadają za
horyzontalny transfer genów
• mają zdolność do przekazania
gospodarzowi plazmidu, który ingeruje
w jego genom.
• Agrobacterium tumefaciens - zakażenie
rośliny objawia się powstawaniem
guzowatych narośli
• Agrobacterium rhizogenes - w miejscu
infekcji powstają korzenie włośnikowe
Kamil Maciąg |
Proces transgenezy z wykorzystaniem Agrobacterium :
- Wprowadzenie odpowiedniego fragmentu DNA do wektora binarnego,
- Transformacja komórek bakteryjnych oraz namnożenie odpowiedniej ilości
transgenicznych bakterii
- Zainfekowanie komórek roślinnych poprzez bakterie i przekazanie
zmodyfikowanego fragmentu T-DNA.
- Eliminacja Agrobacterium np. poprzez wykorzystanie antybiotyków
- Wyselekcjonowanie pozytywnych mutantów
•http://www.bio.davidson.edu/Courses/Molbio/MolStudents/spring2003/WilsonE/home.cosmids.html
Transformacja grzybów - przykład
Agaricus bisporus
Lentinula edodes
Pleurotus ostreatus
Flammulina velutipes
Pleurotus nebrodensis
Agrobacterium tumefaciens
transfer genów do
roślin, drożdży,
grzybów
grzyby transgeniczne
http://www.pakissan.com/english/allabout/horticulture/veget
ables/mashroom/gene.transfer.techn
http://www.docbrown.info/page20/AQAscibio17.htm
Przykładowe cele stosowania technologii
rekombinowanego DNA – z zakresu
biotechnologii farmaceutycznej
•
przeniesienie całego procesu biosyntezy do lepiej
przystosowanego do niej heterologicznego organizmu
produkcyjnego.
•
amplifikacja genów biosyntezy całego szlaku lub jego części
•
zwiększenie oporności na antybiotyki przez manipulacje na
genach oporności
•
zwiększenie wydzielania produktu przez manipulacje na genach
odpowiedzialnych za specyficzne, związane z błoną systemy
wydzielania
•
manipulacja na genach regulatorów ogólnych
lub specyficznych dla szlaku
•
celowe usunięcie etapów limitujących szybkość
metabolizmu,
•
wyłączenie genów, które prowadzą do
niepożądanych produktów ubocznych
•
hydroliza in vivo b-laktamów do wytwarzanych
dotychczas chemicznie produktów wyjściowych
w celu dalszego poszukiwania półsyntetycznych
aktywnych farmaceutyków
Rekombinowane leki białkowe
Pierwsze wprowadzone na rynek światowy
leki produkowane metodami inżynierii
genetycznej (1982-1992)
Rok
1982
1985
1986
Substancja czynna
Ludzka insulina
Firma
Wskazanie
Cukrzyca
Eli Lilly
Genentech
Ludzki hormon wzrostu
Hoffmann-La Roche
Interferon a-2a
Karłowatość
Białaczka
1986
Interferon a-2b
Schering-Plough
Miesak Kaposiego
1987
t-PA
Genentech
Zawał serca
1988
Erytropoetyna
Amgen
Anemia
1989
Interleukina 2
Chiron/Cetus
Nowotwór nerek
1989
Interferon y
Biogen
Reumatoidalne zapalenie
stawów
1989
Antygen hepatitis B
Merck/SK, Beecham
Profilaktyka
Rok
Substancja czynna
Firma
Wskazania
1990
Interferon a-3
Interferon Science Brodawczak narządów
płciowych
Genentech
Ziarnica przewlekła
1990
Interferon y-1
1990
Czynnik IX
Alpha Therapeutics
Hemofilia B
1991
G-CSF
Amgen
1991
GM-CSF
Irnmunex
1992
Czynnik VIII
Baxter/Genetics
Neutropenia, leczenie
raka
Autologiczna
transplantacja szpiku
kostnego
Hemofilia A
1992
Glukagon
Inst. Novo Nordisc
Hipoglikemia
Szczepy i linie komórkowe
• Modyfikowane szczepy E. coli
• Modyfikowane szczepy S. cerevisiae
• Komórki linii CHO (chinese hamster ovary cell line) –
linia komórkowa z jajnika chomika chińskiego
• Komórki linii BHK (baby hamster kidney) – linia
komórkowa z noworodka chomika
• hybrydy
Przeciwciała monoklonalne
MAbs
Produkcja przeciwciał monoklonalnych Milstein i
Kohler – metoda hybrydomowa
Główne obszary
zastosowania
*środki diagnostyczne
(in vivo i in vitro),
*w terapii
nowotworów,
*w profilaktyce
kardiologicznej,
*w terapii
immunologicznej.
•chimeryczne przeciwciała monoklonalne (zawierające 10-30%
sekwencji aminokwasowych mysich). Modyfikacja genetyczna, dzięki której na poziomie
DNA dochodzi do zastąpienia regionu stałego łańcucha lekkiego i ciężkiego przeciwciała
mysiego analogicznymi fragmentami przeciwciała pochodzenia ludzkiego
•humanizowane przeciwciała monoklonalne (zawierające do 10%
sekwencji aminokwasowych mysich), metoda polega na pozostawieniu w cząsteczce
przeciwciała obcogatunkowego wyłącznie regionów wiążących
antygen (hiperzmiennych).
•w pełni ludzkie przeciwciała monoklonalne (zawierające wyłącznie ludzką
sekwencję aminokwasową).
Nazewnictwo
Dla wszystkich przeciwciał monoklonalnych używana
jest wspólna końcówka „-mab”.
W przypadku przeciwciała mysiego dodaje się literę „o”
(np. ang. Edrecolomab =Panorex),
Chimerowego „xi” (np. ang. Cetuximab=Erbitux),
Humanizowanego „u” (np. ang. Trastuzumab=
Hrceptyna, Bevacizumab=Avastin).
Czy istnieją przeciwciała monoklonalne ludzkie?
Jak je można otrzymać?
•W roku 1980 w Wistar Institute of Anatomy and Biology w Filadelfii
otrzymano stabilne hybrydomy produkujące monoklonalne przeciwciała
ludzkie.
• Fuzji poddane były limfocyty B izolowane od pacjenta chorego na raka
(myeloma) z peryferyjnymi limfocytami chorego na przewlekłe
pancephalitis.
•Otrzymane komórki hybrydowe wydzielały ludzką immunoglobulinę M
specyficzną w stosunku do wirusa odry.
•Jednak wykorzystanie tej metody do otrzymywania np. leków
przeciwnowotworowych nie jest możliwe z kilku przyczyn, do których
należy brak odpowiednich ludzkich linii szpiczakowych oraz na względy
etyczne. W metodzie tej konieczna byłaby bowiem immunizacja ludzi
celem otrzymania uczulonych limfocytów B, poddawanych następnie fuzji .
• Jedną z alternatywnych metod jest wykorzystanie techniki
prezentacji białek regionu wiążącego antygen na powierzchni
bakteriofagów (ang. – Phage Display).
• Inna metoda wytwarzania ludzkich MAbs polega na
immunizacji odpowiednim antygenem myszy cierpiących
niedobór odporności, których układ immunologiczny
uprzednio rekonstruuje się poprzez podanie limfocytów z krwi
obwodowej człowieka. Podobnie jak poprzednio opisanych
metodach uczulone limfocyty B są następnie izolowane i
łączone z komórkami szpiczaka.
• Alternatywną metodą produkcji ludzkich MAbs polega na
wykorzystaniu myszy transgenicznych, u których mysie geny
kodujące immunoglobuliny zostały zastąpione ludzkimi.
Zmodyfikowane genetycznie myszy poddaje się następnie
immunizacji antygenem.
Zarejestrowane są pierwsze w pełni ludzkie
przeciwciała monoklonalne , do których należy
Adalimumab - stosowany w leczeniu
reumatoidalnego zapalenia stawów
Denosumab (Lek Prolia) - zarejestrowany w
leczeniu osteoporozy u kobiet po menopauzie
Oftamumab (Arzerra) - wskazany w przewlekłej
białaczce limfocytowej
Opracowane zostały rozliczne sposoby
zwiększania efektywności terapeutycznej MAbs
poprzez jest łączenie z różnymi aktywnymi
biologicznie cząsteczkami takimi jak:
toksyny, cytokiny, leki przeciwnowotworowe,
radioizotopy, czy enzymy aktywujące leki.
http://waynesword.palomar.edu/images/antibod2.gif
Toxins2011, 3(7), 848-883; doi:10.3390/toxins3070848
Preparaty insulinowe wytwarzane
metodami technologii genowej
Stosowne procesy:
1. Ekspresja genów obu łańcuchów (A i B) w dwóch
szczepach E. coli i przetwarzanie chemiczne
2. Wytwarzanie metodami technologii genowej
•
w E. coli ( Berlin-Chemie, Hoechst, Lilly)
•
w S. cerevisiae (Nowo Nordisk) poprzez proinsulinę–
mini-proinsulin
Muteiny – modyfikacje w łańcuchach A i B