Modele atomu – Thomsona i Rutherforda
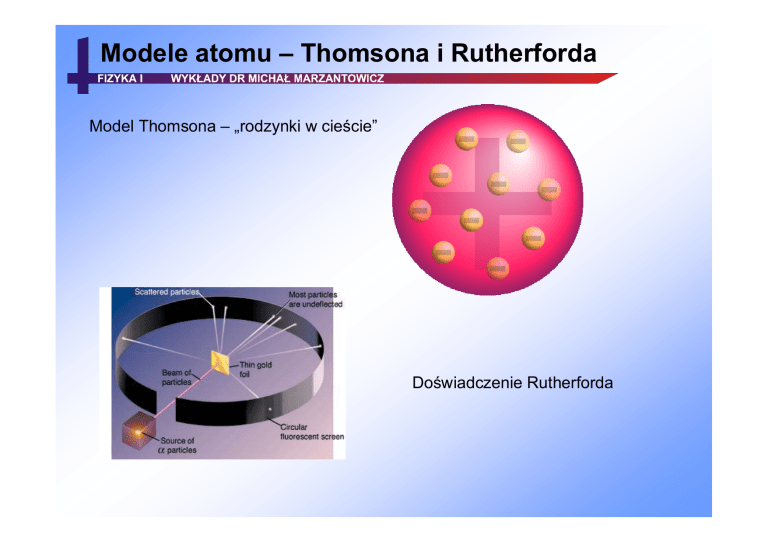
Model Thomsona – „rodzynki w cieście”
Doświadczenie Rutherforda
Model budowy atomu Rutherforda
10-15
Masa i ładunek dodatni atomu
skupione w jądrze
m
10-10 m
Model Bohra
Problemy modelu Rutherforda:
-promieniowanie synchrotronowe (elektron „spada” na jądro)
-widma atomowe (np. świecącego gazu) nie są ciągłe
Model Bohra
Balmer – układ linii w widmie wodoru
Rydberg
RH =10 972 000 m−1
Lyman – widmo w nadfiolecie
n=2,3,4...
Serie Paschena, Bracketta, Pfunda, Humphreya - podczerwień
n’=1,2,3... n>m’
Model Bohra – postulaty
1. Elektron porusza się po orbicie kołowej dookoła jądra. Energia
elektronu jest stała (nie wypromieniowuje energii)
2. Dozwolone są orbity, dla których orbitalny moment pędu elektronu jest
równy całkowitej wielokrotności wyrażenia h/2π
3. Wypromieniowanie lub pochłanianie kwantu następuje wtedy, kiedy
elektron przeskakuje z jednej dozwolonej orbity na drugą.
Częstotliwość wyemitowanego (pochłoniętego) promieniowania jest
taka, że ∆E = hν
h
Ln = n
2π
n- liczba kwantowa
Model Bohra – energia elektronu
2
me u n
Ze 2
=
rn
4πε 0 rn2
E ( n) = E p ( n) + E k ( n)
E ( n) = −
h
Ln = me u n rn = n
2π
me Z 2 e 4
1
(4πε 0 )2 2h 2 n 2
n=1 stan podstawowy
n=∞ stan zjonizowany
Długość
promieniowania
1 ⎛ 1
= ⎜⎜
λ ⎝ 4πε 0
2
⎞ me e 4 ⎛ 1
1 ⎞
⎟⎟
−
⎜
3
2
2 ⎟
m ⎠
⎠ 4πh c ⎝ n
RH
R
Rµ =
1 + me M
Model Bohra – widmo wodoru
Doświadczenie Franka-Hertza
Widmo charakterystyczne promieniowania rentgenowskiego
Prawo Moseley’a – linie Kα
Efekt ekranowania – powłoka K
Powłoki elektronowe
Powłoki elektronowe
K,L,M,N,O,P,Q
2n2 elektronów na powłoce
Układ okresowy pierwiastków
