Nowa Tablica Układu Okresowego Pierwiastków Chemicznych
Nowa Tablica
Tablica Klasyczna
Strona 1 z 5
Układu Okresowego Pierwiastków
D. Mendelejew
Układ Okresowy a budowa atomu
NOWA TABLICA
1-168
Chemicznych
zgłoś uwagi
str. główna
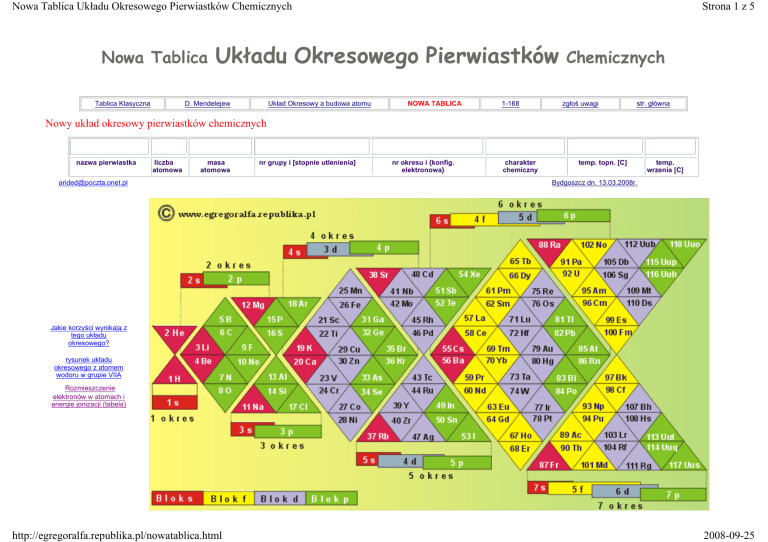
Nowy układ okresowy pierwiastków chemicznych
nazwa pierwiastka
liczba
atomowa
masa
atomowa
[email protected]
nr grupy i [stopnie utlenienia]
nr okresu i {konfig.
elektronowa}
charakter
chemiczny
temp. topn. [C]
temp.
wrzenia [C]
Bydgoszcz dn. 13.03.2008r.
Jakie korzyści wynikają z
tego układu
okresowego?
rysunek układu
okresowego z atomem
wodoru w grupie VIIA
Rozmieszczenie
elektronów w atomach i
energie jonizacji (tabela)
http://egregoralfa.republika.pl/nowatablica.html
2008-09-25
Nowa Tablica Układu Okresowego Pierwiastków Chemicznych
Strona 2 z 5
Ponieważ na rysunku "układu" nie zaznaczono grup, poniżej umieszczono tabelę z linkami do ich prezentacji na rysunkach.
Grupy układu okresowego pierwiastków chemicznych
tymczasowa grupa IIIC*
blok s
blok
f
blok d
blok p
IA IIA IIIC IIIB IVB VB VIB VIIB VIIIB VIIIB VIIIB IB IIB IIIA IVA VA VIA VIIA VIIIA
1
2
3C
3
4
5
6
7
8
9
10
11 12 13
14 15 16
17
18
Uwagi do rysunku układu okresowego
W widocznym wyżej układzie okresowym pierwiastków chemicznych (podobnie jak w innych) istnieje 7 okresów.
Zaletą tego układu jest to, że sposób rozmieszczenia okresów w zasadzie nie ogranicza ilości pierwiastków jak i ilości
okresów. Ilość okresów teoretycznie jest nieograniczona o ile nie istnieje nieznana jeszcze zasada uniemożliwiająca
dalsze ich dodawanie do UKŁADU. Znamy dzisiaj nieco ponad sto pierwiastków a ostatni (118 Uuo) otrzymano w ilości
kilku atomów. Pierwiastek 117 Uus nie został jeszcze odkryty (otrzymany), ale możemy wnioskować o jego miejscu w
układzie okresowym.
Ilość pierwiastków w każdym okresie określona jest wzorem:
i wynosi:
dla 1 okresu 2, dla 2 i 3 po 8, dla 4 i 5 po 18, dla 6 i 7 po 32. Czy ta zasada spełni się również dla okresów 8 i 9 i będą
miały po 50 miejsc w okresie?
Jak łatwo zauważyć wygląd podwójnych okresów różni się. Jeżeli dla przykładu wziąć okresy 6 i 7 (mające po 32
pierwiastki), a okres 6 określić jako dwa trójkąty złączone podstawami, to okres 7 można określić jako dwa takie
same trójkąty lecz złączone wierzchołkami. Jeżeli w okresie 7 zamienić miejscami owe trójkąty, to uzyskamy
okres 7 identyczny z okresem 6. Również podział na grupy w tych okresach będzie bardziej czytelny.
Rozmieszczenie elementów układu oraz jego geometria wynika z potrzeby zapewnienia układowi maksymalnej
różnorodności i jak najmniejszej energii.
(rysunek animowany z 6 i 7 okresem)
http://egregoralfa.republika.pl/nowatablica.html
2008-09-25
Nowa Tablica Układu Okresowego Pierwiastków Chemicznych
Strona 3 z 5
Jakie są korzyści wynikające z tego układu.
1. Układ stosuje się do zasad teorii chemii kwantowej.
2. Układ jest formą otwartą i zwartą w tym sensie, że można w nim umieścić dowolną ilość pierwiastków, a pierwiastki f
elektronowe (lantanowce i aktynowce) mieszczą się we właściwych sobie okresach (6 i 7) i nie ma tu potrzeby
umieszczania ich w osobnych tabelach pozaokresowych.
3. Każdy okres stanowi powłokę zbudowaną dla właściwej dla niego liczby kwantowej 'n', określającej ilość pierwiastków
w powłoce wg wzoru: 2n2. Ilość podpowłok w każdym okresie jest równa głównej liczbie kwantowej 'n'. Ilość pierwiastków
w podpowłoce danego okresu określona jest wzorem i zależna jest od pobocznej liczb kwantowej l, która może przybierać
wartości: 0,1,2,3,4. Wyrażenie określające ilość pierwiastków w podpowłoce (bloku) ma postać: 2(2l+1) gdzie: l=n-1
okres
1
2
3
4
5
6
7
blok s blok f blok d blok p
2
2
2
2
2
2
2
14
14
10
10
10
10
6
6
6
6
6
6
ilość
elementów
2
8
8
18
18
32
32
4. W każdej podpowłoce – bloku wyróżnić można orbitale (poprzez analogię do budowy orbitali elektronowych w atomie)
złożone z dwóch pierwiastków (zakaz Pauliego). Na rysunku widoczne to jest jako dwa trójkąty (symbolizujące
pierwiastki) złączone podstawami lub wierzchołkami (analogia do spinu, - są jakby przeciwnie zorientowane).
Pozostaje pytanie czy występowanie aż 3 podwójnych okresów (o tej samej ilości pierwiastków) 2 i 3, 4 i 5, 6 i 7 jest tu
zasadą, czy zakłóceniem powstałym w wyniku wzajemnego oddziaływania elektronów?
Zakaz Pauliego:
Dwa elektrony mogą zajmować ten sam orbital tylko w sytuacji kiedy ich spiny są przeciwnie
zorientowane.
5. Układ zbudowano tak, aby uzyskać maksymalne zróżnicowanie w położeniu pierwiastków chemicznych, a
jednocześnie uzyskać efekt minimalnej jego energii, stąd różnice w wyglądzie okresów podwójnych. W
rzeczywistości tych różnic nie ma co wykazano na podstawie przykładu przedstawionego na animowanym
rysunku.
http://egregoralfa.republika.pl/nowatablica.html
2008-09-25
Nowa Tablica Układu Okresowego Pierwiastków Chemicznych
Strona 4 z 5
Powrót do rysunku
*Grupa IIIC
Z grupą zaznaczoną jako IIIC istnieje pewien problem. Do grupy tej zaliczono pierwiastki znane jako lantanowce i
aktynowce z Lantanem i Aktynem włącznie. Pierwiastków tych jest 2*14 =28 w okresach 6 i 7 układu okresowego. O ile
na rysunku tego układu problem wydaje się nie istnieć, to jednak dotychczasowy obowiązujący podział na grupy układu
okresowego wydaje się być niewystarczający, ponieważ pierwiastki te nazywa lantanowcami i aktynowcami nie
przypisując im tak jak innym pierwiastkom określonej liczby (związanej z grupą). Prawdopodobnie wynika to z tego, iż
pierwiastki te wykazują większe podobieństwo w obrębie okresu niż w obrębie grupy. Każdy lantanowiec ma swój
odpowiednik w postaci występującego pod nim w układzie okresowym aktynowca, ale różnice te są większe niż różnice
wynikające z podobieństw kolejnego lantanowca w okresie.
Z przynależnością do określonej grupy wiąże się podstawowa własność każdego pierwiastka, a mianowicie jego
wartościowość główna. Wszystkie lantanowce i aktynowce przyporządkowano do bloku f, jednak oficjalne stanowiska w
tej sprawie brzmią nieco inaczej: Lantan, Aktyn oraz Tor zaliczane są do bloku d, a Lutet i Lorens do bloku f.
Pierwiastki grupy Lantanu (z Lantanem) tworzą trójwartościowe kationy i są typowymi metalami. Oprócz cechy
trójwartościowości dla pierwiastków całej grupy w grupie tej istnieją inne wartościowości dla Sm+2, Eu+2, Tm+2, Yb+2, Ce+4,
Pr+4, Tb+4.
Pierwiastki grupy Aktynu (z Aktynem) za wyjątkiem dwóch (Th i Pa) wykazują również (jak lantanowce)
trójwartościowość. Oprócz tego w tej grupie pierwiastków istnieją wartościowości: Md i No: (+2); Th, Pa, U, Np, Pu,
Am, Cm: (+4); Pa, U, Np, Pu, Am: (+5); U, Np, Pu, Am: (+6).
W powyższym układzie pierwiastki bloku f (lantanowce i aktynowce) sklasyfikowano w grupie IIIC co również (tak jak w
innych układach) nie jest dobrym rozwiązaniem. Wydaje się że powinien istnieć bardziej subtelny podział na grupy dla
tych pierwiastków, ale wiąże się to z dodaniem do układu kolejnych grup. W tym układzie okresowym jest to możliwe
jednak brak jest danych doświadczalnych, które by to uzasadniały. Niestety na razie zadanie to wydaje się być
niewykonalne. powrót
Kilka linków do stron traktujących o tej tematyce:
http://old.iupac.org/general/FAQs/elements.html
- Międzynarodowa Unia Chemii Czystej i Stosowanej
http://www.geocities.com/rihanij/classicblue.html
- Nowy układ okresowy - rozszerzony
http://www.apsidium.com/
http://www.webelements.com/
http://www.meta-synthesis.com/webbook/35_pt/pt.html
http://egregoralfa.republika.pl/nowatablica.html
- Rozszerzony i nowy układ okresowy z pierwiastkami (również rozszerzony)
- Serwis chemiczny
- Periodic Table: Formulations
2008-09-25
Nowa Tablica Układu Okresowego Pierwiastków Chemicznych
Strona 5 z 5
http://www.theodoregray.com/
nowy UOP
Drewniane Tablice UOP
na górę
układ rozszerzony
wyślij adres strony do przyjaciela
tablica klasyczna UOP
Czytaj Księgę Gości
teoria
Dopisz się do księgi
Copyright © Bydgoszcz 2008r. Paweł Najderek. Wszystkie prawa zastrzeżone.
kontakt: [email protected]
http://egregoralfa.republika.pl/nowatablica.html
2008-09-25
