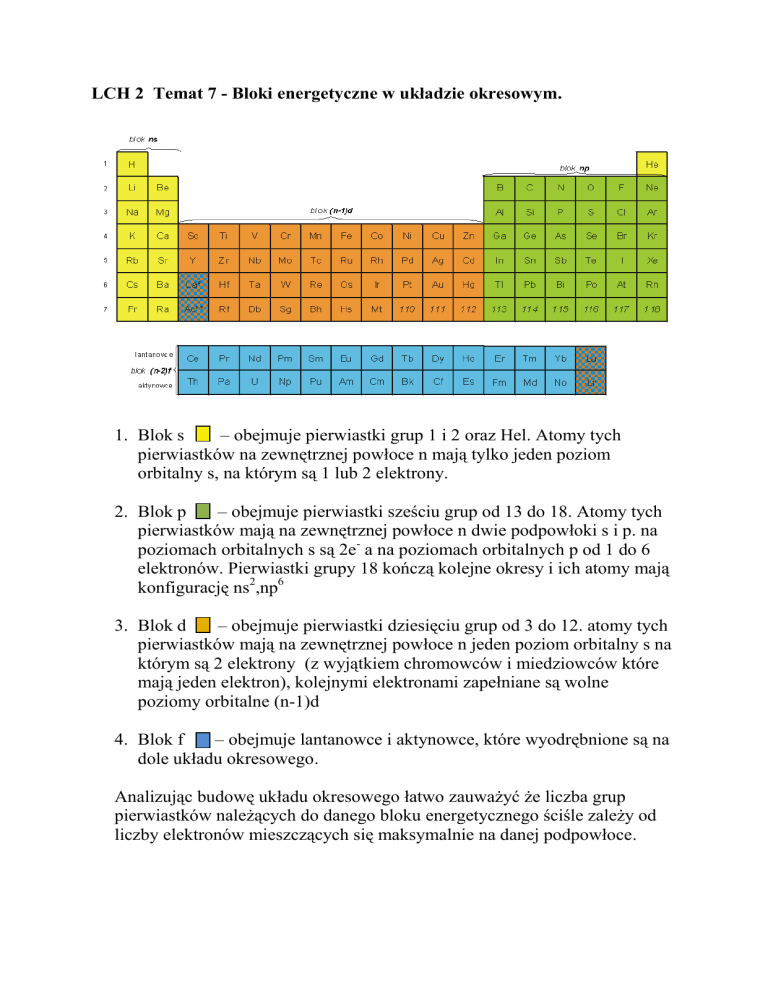
LCH 2 Temat 7 - Bloki energetyczne w układzie okresowym.
1. Blok s
– obejmuje pierwiastki grup 1 i 2 oraz Hel. Atomy tych
pierwiastków na zewnętrznej powłoce n mają tylko jeden poziom
orbitalny s, na którym są 1 lub 2 elektrony.
2. Blok p
– obejmuje pierwiastki sześciu grup od 13 do 18. Atomy tych
pierwiastków mają na zewnętrznej powłoce n dwie podpowłoki s i p. na
poziomach orbitalnych s są 2e- a na poziomach orbitalnych p od 1 do 6
elektronów. Pierwiastki grupy 18 kończą kolejne okresy i ich atomy mają
konfigurację ns2,np6
3. Blok d
– obejmuje pierwiastki dziesięciu grup od 3 do 12. atomy tych
pierwiastków mają na zewnętrznej powłoce n jeden poziom orbitalny s na
którym są 2 elektrony (z wyjątkiem chromowców i miedziowców które
mają jeden elektron), kolejnymi elektronami zapełniane są wolne
poziomy orbitalne (n-1)d
4. Blok f
– obejmuje lantanowce i aktynowce, które wyodrębnione są na
dole układu okresowego.
Analizując budowę układu okresowego łatwo zauważyć że liczba grup
pierwiastków należących do danego bloku energetycznego ściśle zależy od
liczby elektronów mieszczących się maksymalnie na danej podpowłoce.
Podstawowym kryterium przynależności pierwiastka do danego bloku
energetycznego jest rodzaj poziomów orbitalnych zapełnianych jako ostatnie
przez atomy tego pierwiastka, np.:
1s22s22p6 3s2 – jako ostatnie zapełniane są orbitale s (na powłoce 3)
więc magnez należy do bloku s.
12Mg
