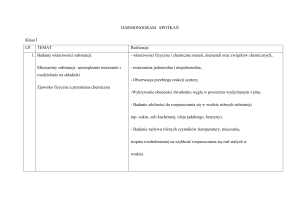
PLAN WYNIKOWY
CHEMIA KLASA I
II semestr
NAUCZYCIEL : Jolanta Galach
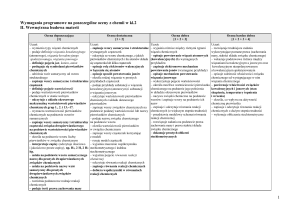
Nr
lekcji
NUMER PROGRAMU
Temat lekcji
Wymagania
Podstawowe
uczeń wie, umie:
Ponadpodstawowe
uczeń wie, umie:
DZIAŁ: ATOM I CZĄSTECZKA
czym się różni atom od cząsteczki,
jaka rolę w tworzeniu cząsteczek spełniają elektrony walencyjne,
że oktet elektronowy jest trwałym stanem atomu,
jak tworzy się cząsteczki pierwiastków,
na czym polega tworzenie się wspólnych par elektronowych,
na czym polega tworzenie się wiązania kowalencyjnego
niespolaryzowanego,
zapisać określone liczby cząsteczek pierwiastków gazowych,
budować modele cząsteczek pierwiastków gazowych (O2, N2, H2,
Cl2, Br2),
napisać wzór kreskowy cząsteczek pierwiastków gazowych (O 2,
N2, H2, Cl2, Br2),
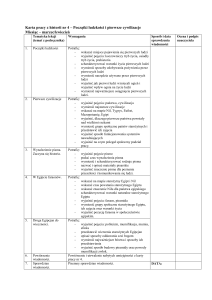
1.
Wiązanie kowalencyjne
jako jeden ze sposobów
łączenia się atomów.
2.
Wiązanie kowalencyjne
spolaryzowane
i niespolaryzowane.
jak się tworzy cząsteczki związków chemicznych,
na czym polega tworzenie się wiązania kowalencyjnego
spolaryzowanego,
podać przykład związku chemicznego, w którym występuje
wiązanie kowalencyjne spolaryzowane,
zapisać określone liczby cząsteczek związków chemicznych,
Wiązanie jonowe – inny
sposób łączenia się
atomów.
3.
DKW-4014-95/99
co to są jony,
jakie są rodzaje jonów,
na czym polega tworzenie się wiązania jonowego,
podać przykłady pierwiastków skrajnie różniących się
elektroujemnością,
poda przykład związku chemicznego, w którym występuje
wiązanie jonowe,
napisać wzór elektronowy cząsteczek pierwiastków gazowych
(O2, N2, H2, Cl2, Br2),
napisać wzór: sumaryczny, elektronowy i kreskowy cząsteczek
związków chemicznych,
budować modele cząsteczek,
wskazać i wyjaśnić kierunek polaryzacji wiązania,
czym się różnią kationy od anionów,
w jaki sposób powstają jony,
zapisać powstawanie jonów,
budować modele cząsteczek o wiązaniu jonowym,
przewidzieć kiedy pomiędzy atomami wytwarza się wiązanie
jonowe, a kiedy wiązanie kowalencyjne spolaryzowane,
4.
5.
Rodzaje wiązań
chemicznych – ćwiczenia.
jakie są rodzaje wiązań chemicznych,
czym się różnią poszczególne rodzaje wiązań chemicznych,
6.
7.
Wartościowość
pierwiastków
w związkach
chemicznych.
Ustalanie wzorów
związków chemicznych
na podstawie
wartościowości – wzory
sumaryczne
i strukturalne.
8.
Ćwiczenia w ustalaniu
wzorów sumarycznych
i strukturalnych.
9.
Prawo stałości składu
związku chemicznego.
10.
11.
Obliczenia chemiczne
z zastosowaniem prawa
zachowania masy i prawa
stałości składu związku
chemicznego.
Uczymy się pisać
równania reakcji
chemicznych.
rozróżnić, kiedy powstaje pomiędzy atomami wiązanie
kowalencyjne spolaryzowane, a kiedy niespolaryzowane,
rozróżnić, kiedy powstaje pomiędzy atomami wiązanie
kowalencyjne spolaryzowane, a kiedy jonowe,
określić typ wiązania w podanych cząsteczkach pierwiastków i
związków chemicznych,
pisać wzory sumaryczne, elektronowe i kreskowe cząsteczek,
co to jest wartościowość pierwiastka,
że pierwiastek może mieć kilka wartościowości,
że pierwiastki w stanie wolnym mają wartościowość równą zero,
określić możliwe wartościowości pierwiastka na podstawie
położenia w układzie okresowym,
jak należy tworzyć wzór sumaryczny związku chemicznego,
określić liczbę pierwiastków wchodzących w skład związku
chemicznego,
podać liczbę atomów wchodzących w skład cząsteczki
określonego związku chemicznego,
zapisać wzór sumaryczny na podstawie liczby atomów
pierwiastków tworzących dany związek chemiczny, korzystając
z wartościowości tych pierwiastków,
określić wartościowość pierwiastków w związkach chemicznych,
zapisać wzór sumaryczny cząsteczki związku chemicznego na
podstawie znajomości wzoru strukturalnego,
podać nazwę związku chemicznego na podstawie jego wzoru
sumarycznego,
modelowo przedstawić cząsteczki związków chemicznych na
podstawie wzorów: sumarycznego i strukturalnego,
jaka jest treść prawa stałości składu związku chemicznego,
kto sformułował prawo stałości składu związku chemicznego,
co to jest stosunek wagowy pierwiastków w związku chemicznym,
obliczyć stosunek wagowy pierwiastków w związku
chemicznym,
określić wzór związku chemicznego na podstawie stosunku
wagowego pierwiastków w tym związku,
co można obliczyć, stosując prawo zachowania masy,
co można obliczyć, stosując prawo stałości składu związku
chemicznego,
dokonywać obliczeń związanych z zastosowaniem prawa stałości
składu związku chemicznego i prawa zachowania masy,
co to jest równanie reakcji chemicznej,
co to są współczynniki stechiometryczne równania reakcji,
prawidłowo pisać równania różnych reakcji chemicznych,
przewidzieć i prawidłowo zapisać produkty wybranych reakcji
12.
13.
14.
15.
Równania reakcji
chemicznych – zapis,
bilansowanie, odczyt
i modelowanie przebiegu.
Ćwiczenia w pisaniu
równań reakcji
chemicznych.
Podsumowanie
wiadomości o atomach
i cząsteczkach.
na czym polega bilansowanie równania reakcji chemicznej,
zapisać za pomocą symboli pierwiastków i wzorów związków
chemicznych oraz uzgodnić równania reakcji chemicznych
przeprowadzonych na lekcjach,
odczytywać zapisane równanie reakcji chemicznej,
modelowo przedstawić przebieg określonej reakcji chemicznej,
pisać wzory sumaryczne i strukturalne związków chemicznych
i odczytywać ich nazwy,
pisać, uzgadniać i odczytywać równania niektórych reakcji
chemicznych,
przedstawić modelowo przebieg reakcji,
16.
Sprawdzian wiadomości
z działu „Atom
i cząsteczka”.
Sprawdzenie wiadomości i umiejętności z działu „Atom i cząsteczka”
17.
Woda i jej rola
w przyrodzie.
18.
Zanieczyszczenia wód
naturalnych zagrożeniem
dla organizmów żywych.
chemicznych,
DZIAŁ: WODA I ROZTWORY WODNE
gdzie i w jakiej postaci występuje woda w przyrodzie,
jakie są rodzaje wód,
na czym polega krążenie wody w przyrodzie,
jakie procesy w przyrodzie zachodzą przy udziale i pod
wpływem wody,
wymienić poznane właściwości fizyczne wody,
podać nazwy procesów fizycznych zachodzących podczas
zmiany stanów skupienia wody,
wyjaśnić, jaka jest rola wody dla organizmów żywych,
wymienić główne źródła i rodzaje zanieczyszczeń wód
naturalnych,
wyjaśnić, jakie mogą być skutki poszczególnych rodzajów
zanieczyszczeń ,
podać przykłady zanieczyszczeń pochodzenia rolniczego,
przemysłowego i komunalnego,
wyjaśnić, jak można zapobiegać poszczególnym rodzajom
zanieczyszczeń,
określić rodzaj wiązania chemicznego w cząsteczce,
pisać, uzgadniać, modelować i odczytywać równania reakcji
chemicznych,
wyjaśnić, dlaczego wiele produktów należy przechowywać
w szczelnie zamkniętych naczyniach,
wyjaśnić, jakie znaczenie ma obieg wody w przyrodzie,
wyjaśnić wpływ właściwości fizycznych wody na środowisko
naturalne, np.
o wpływ dużych zbiorników wodnych na klimat,
o temperatura wody w zamarzniętych zbiornikach
wodnych,
o zwiększanie się objętości wody podczas
zamarzania,
wyjaśnić, jaką rolę w ochronie i zanieczyszczaniu wód
naturalnych odgrywa obieg wody w przyrodzie,
wyjaśnić, na czym polega zamknięty obieg wody w przyrodzie,
19.
20.
wyjaśnić, na czym polega oczyszczanie mechaniczne,
chemiczne i biologiczne,
usunąć z wody niektóre jej zanieczyszczenia,
wymienia przykłady reakcji, które dowodzą, że woda jest
związkiem chemicznym tlenu z wodorem,
co to jest dipol,
jak zbudowana jest cząsteczka wody,
co to znaczy, że woda ma budowę polarną,
na czym polega asocjacja,
wyjaśnić, jakie są konsekwencje polarnej budowy cząsteczki
wody,
co to jest rozpuszczalnik,
co to jest substancja rozpuszczona,
podać przykłady substancji rozpuszczalnych i trudno
rozpuszczalnych w wodzie, z jakimi styka się w życiu
codziennym,
otrzyma roztwór danej substancji,
wyjaśnić, dlaczego woda dla jednych substancji jest
rozpuszczalnikiem, a dla innych nie,
wyjaśnić, dlaczego woda naturalna praktycznie nie może być
czystą substancją,
podać znaczenia wody jako rozpuszczalnika w życiu codziennym
i w procesach zachodzących w przyrodzie,
jakie procesy zachodzą podczas rozpuszczania substancji,
zakwalifikować substancje do tych, które rozpuszczają się w
wodzie lub nie,
jakie czynniki wpływają na szybkość rozpuszczania się
substancji w wodzie,
w jaki sposób czynniki te wpływają na szybkość
rozpuszczania się substancji w wodzie,
podać znane mu z życia codziennego przykłady zwiększania
szybkości rozpuszczania substancji stałej w wodzie,
wykazać doświadczalnie, jakie czynniki wpływają na szybkość
rozpuszczania się substancji,
wyjaśnić, posługując się wiedzą o budowie substancji, dlaczego
podwyższona temperatura (mieszanie, rozdrobnienie) zwiększa
szybkość rozpuszczania substancji stałej w wodzie,
wyjaśnić, odwołując się do przykładów z życia codziennego,
jakie czynniki wpływają na szybkość rozpuszczania się gazów w
wodzie,
Co to jest i od czego
zależy rozpuszczalność
substancji?
Analiza wykresów
rozpuszczalności różnych
substancji w wodzie.
Sposoby usuwania
zanieczyszczeń –
uzdatnianie wody.
Budowa cząsteczki wody.
21.
Woda jako
rozpuszczalnik.
22.
Co to jest roztwór?
23.
Od czego zależy szybkość
rozpuszczania się
substancji?
24.
25.
co to jest roztwór,
że w wodach naturalnych występują rozpuszczone substancje,
co to jest rozpuszczalność substancji,
od czego zależy rozpuszczalność substancji,
zbadać rozpuszczalność substancji w wodzie,
co to jest roztwór nasycony, a co nienasycony,
jak posługiwać się wykresem rozpuszczalności substancji,
odczytać z wykresu ilość substancji rozpuszczonej w danej
temperaturze,
wyjaśnić praktyczne znaczenie, jakie ma znajomość
rozpuszczalności substancji,
omówić, posługując się znanymi przykładami, zależność między
rozpuszczalnością gazów w wodzie a ciśnieniem i temperaturą,
wymienić kolejne czynności, jakie powinien wykonać, aby
sporządzić wykres krzywej rozpuszczalności danej substancji,
26.
Proces krystalizacji.
na podstawie wykresu rozpuszczalności określić zależność
między rozpuszczalnością a temperaturą,
na czym polega proces krystalizacji,
podać kilka przykładów zastosowania procesu krystalizacji
w życiu codziennym,
.27.
Rozpuszczalność zadania rachunkowe.
odczytać z wykresu ilość substancji rozpuszczonej w danej
temperaturze,
28.
Rodzaje roztworów.
29.
Stężenie procentowe
roztworów.
30.
31.
Obliczanie stężenia
procentowego roztworów.
co to jest roztwór nasycony, a co nienasycony,
co to jest roztwór stężony, a co rozcieńczony,
co to jest zawiesina,
co to jest roztwór koloidalny, a co właściwy,
podać przykłady roztworu rozcieńczonego, stężonego,
zawiesiny, roztworu koloidalnego i właściwego,
co to jest stężenie procentowe roztworu,
jaki jest wzór na stężenie procentowe roztworu,
obliczyć stężenie procentowe roztworu,
obliczyć ilość substancji rozpuszczonej w danym roztworze,
jaki jest wzór na stężenie procentowe roztworu,
rozwiązywać zadania tekstowe z uwzględnieniem stężenia
procentowego,
Sporządzanie roztworów
o określonym stężeniu
procentowym.
co to jest roztwór: 2-%, 5-%, 10-%, n-%,
przygotować roztwór o określonym stężeniu procentowym,
obliczyć maksymalną ilość danej substancji, którą można będzie
rozpuścić w określonej temperaturze w podanej masie wody,
obliczyć, ile gramów danej substancji wydzieli się podczas
oziębiania jej nasyconego roztworu do odpowiedniej
temperatury,
dokonać podziału roztworów ze względu na: wielkość cząsteczek
substancji rozpuszczonej i ilości substancji rozpuszczonej,
zakwalifikować roztwory i zawiesiny do mieszanin,
rozwiązywać zadania tekstowe z uwzględnieniem stężenia
procentowego,
rozwiązywać zadania tekstowe na stężenie procentowe
z uwzględnieniem gęstości,
obliczać stężenie procentowe roztworów powstałych przez
zmieszanie roztworów o różnych stężeniach,
obliczać stężenie procentowe roztworów powstałych przez
zagęszczanie lub rozcieńczanie roztworu,
32.
33.
wyjaśnić, posługując się wiedzą o budowie substancji, na czym
polega proces krystalizacji,
określi warunki krystalizacji, od których zależy wielkość
otrzymanych kryształów,
wyjaśnić, jaki wpływ ma obecność wody krystalizacyjnej na
właściwości kryształów,
rozwiązywać dowolne zadania tekstowe z uwzględnieniem
stężenia procentowego,
34.
Stężenie procentowe
a rozpuszczalność.
jaka jest zależność między stężeniem procentowym
a rozpuszczalnością substancji,
obliczyć stężenie procentowe roztworu w danej temperaturze,
obliczyć rozpuszczalność substancji w danej temperaturze, znając
stężenie procentowe jej nasyconego w tej temperaturze roztworu,
Podsumowanie
wiadomości o wodzie
i roztworach wodnych.
wyjaśnić, dla jakich substancji i dlaczego woda jest dobrym
rozpuszczalnikiem,
rozdzielić na składniki roztwory właściwe i zawiesiny,
dokonywać obliczeń związanych ze stężeniem procentowym
roztworów,
„Woda i roztwory wodne
– sprawdzenie
wiadomości”.
Sprawdzenie wiadomości i umiejętności z działu „Woda i roztwory wodne”.
35.
przyporządkować definicje poznanym pojęciom,
wskazać czynniki wpływające na szybkość rozpuszczania,
korzystać z wykresu rozpuszczalności substancji,
dokonywać prostych obliczeń związanych ze stężeniem
procentowym roztworów,
otrzymać roztwór nasycony danej substancji z nienasyconego i
odwrotnie,
sporządzać roztwory o określonym stężeniu,
przeprowadzić krystalizację substancji,
36.