WYMAGANIA Z CHEMII Kl I
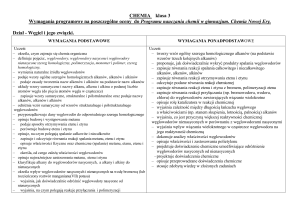
Dział I
Chemia wokół nas
Wymagania konieczne ( ocena dopuszczająca )
-
uczeń wymienia przykłady substancji chem. występujących w najbliższym otoczeniu
podaje przykłady zjawisk fizycznych i przemian chemicznych
określa właściwości fizyczne wybranej substancji
rozróżnia mieszaninę jednorodną od niejednorodnej i wymienia jej składniki
określa stan skupienia substancji
zna najważniejsze sposoby rozdzielania mieszanin
wskazuje substrat, produkt ,reagenty w reakcji chemicznej
odróżnia metal od niemetalu
zna symbole 10 pierwiastków chemicznych
Wymagania podstawowe ( ocena dostateczna )
-
wyjaśnia na czym polega reakcja chemiczna a zjawisko fizyczne
wymienia substancje chemiczne ze swojego otoczenia z podziałem na związki chem. i pierwiastki, a te na
metale i niemetale
odróżnia właściwości chemiczne od fizycznych
wymienia substancje z jakich składa się ciało fizyczne
wie jak przeprowadzić ogrzewanie , odparowanie i sączenie
podaje przykłady związków chem. i stopów
zna cechy charakterystyczne metali
wie , na czym polega różnica między mieszaniną a związkiem chem.
Wymagania rozszerzone ( ocena dobra )
-
definiuje pojęcia : substancja, mieszanina jednorodna i niejednorodna
dokonuje podziału podanych substancji na pierwiastki i związki chem.
identyfikuje znaną mu substancję na podstawie wykazu jej właściwości
porównuje metale z niemetalami i zna symbole chemiczne tych powszechnie znanych
dowodzi, że roztwór jest mieszaniną jednorodną, a zawiesina- niejednorodną
proponuje doświadczenie pozwalające rozdzielić składniki roztworów
zestawia szkło i sprzęt niezbędny do sączenia
rozróżnia podane przemiany na fizyczne i chemiczne
Wymagania dopełniające ( ocena bardzo dobra )
-
wyjaśnia w oparciu o wewnętrzną budowę substancji przyczynę różnic między mieszaniną jednorodną a
niejednorodną
wyjaśnia, jaka jest zależność między rodzajem mieszaniny a sposobem rozdzielania jej składników
zna symbole wyznaczonych pierwiastków chem.
formułuje obserwacje i proste wnioski do doświadczenia
wskazuje zastosowania substancji chem.
podaje przykłady kilku reakcji chem. , znanych z życia codziennego
oblicza masę, gęstość i objętość substancji z wzoru
Dział II Atom i jego budowa
Wymagania konieczne ( ocena dopuszczająca )
-
uczeń korzysta z układu okresowego pierwiastków w celu odczytywania pierwiastków
odczytuje ze wzoru sumarycznego liczby atomów wchodzących w skład cząsteczki
zapisuje wzory strukturalne na podstawie modelu
zapisuje i odczytuje proste równania reakcji syntezy i analizy
zna cząstki elementarne wchodzące w skład atomu
zna prawa stałości składu i zachowania masy
Wymagania podstawowe ( ocena dostateczna )
-
poprawnie posługuje się terminami „ atom” i „ cząsteczka”
opisuje budowę atomu
rozumie masę atomu jako jedną z właściwości odróżniających od siebie atomy
zapisuje wzór sumaryczny związku na podstawie informacji o liczbie atomów wchodzących w skład
cząsteczki
-
oblicza wartościowość pierwiastków ( jako liczbę wiązań chemicznych) w związkach z tlenem
formułuje nazwy związków z uwzględnieniem wartościowości pierwiastków
zapisuje wzór strukturalny na podstawie sumarycznego i odwrotnie
kojarzy pierwiastki gazowe z cząsteczkami dwuatomowymi
definiuje pojęcie: wiązanie atomowe ( kowalencyjne )
wyjaśnia różnicę między cząsteczką pierwiastka a związku chemicznego
Wymagania rozszerzone ( ocena dobra )
-
wyjaśnia pojęcie: liczba atomowa pierwiastka
korzysta z układu okresowego do przedstawienia budowy atomu
oblicza wartościowość pierwiastków w związkach z wodorem
samodzielnie zapisuje i dobiera współczynniki równań reakcji chem.
podaje pozytywne i negatywne skutki wytwarzania i zastosowania izotopów promieniotwórczych
Wymagania dopełniające ( ocena bardzo dobra )
-
oblicza masy cząsteczkowe pierwiastków i związków chem.
modeluje cząsteczki trójatomowe
przedstawia równania reakcji i ilościowo je interpretuje
omawia budowę i właściwości pierwiastka na podstawie położenia w układzie okresowym
ustala wartościowość pierwiastka na podstawie wzoru sumarycznego
Dział III. Powietrze i jego składniki
Wymagania konieczne ( ocena dopuszczająca )
-
zna składniki powietrza
określa właściwości fizyczne składników powietrza ( tlen, azot, dwutlenek węgla, wodór) np. : stan
skupienia, barwa, zapach, rozpuszczalność w wodzie
podaje definicję tlenku, reakcji syntezy, analizy, wymiany
dostrzega źródła i przyczyny zanieczyszczeń
Wymagania podstawowe ( ocena dostateczna )
-
kwalifikuje podane procesy chemiczne do jednego z trzech typów reakcji
podaje różnice między spalaniem a utlenianiem
wskazuje substraty i produkty w podanych schematach reakcji
rozpoznaje składniki powietrza na podstawie ich charakterystycznych właściwości
Wymagania rozszerzone ( ocena dobra )
-
zapisuje schematy przeprowadzonych reakcji ( syntezy, analizy, wymiany)
wyjaśnia procesy redukcji i utleniania
bada doświadczalnie skład powietrza
formułuje obserwacje i wnioski z przeprowadzonych doświadczeń
wskazuje sposoby ochrony powietrza
omawia reakcje egzo- i endotermiczne
odczytuje jakościowo i ilościowo równanie reakcji utleniania
porównuje właściwości pierwiastków i ich tlenków
Wymagania dopełniające ( ocena bardzo dobra )
-
określa skład związku na podstawie produktów reakcji
projektuje proste doświadczenia
rozumie znaczenie warstwy ozonowej, przyczyny powstawania dziury ozonowej i efektu cieplarnianego
zna gazy szlachetne i ich zastosowanie
Dział IV. Woda i roztwory wodne
Wymagania konieczne ( ocena dopuszczająca )
-
uczeń dostrzega fakt występowania wody w różnych postaciach w przyrodzie
wymienia właściwości wody
rozumie pojęcia: roztwór, substancja rozpuszczalna, rozpuszczalnik
wie jak rozdzielić mieszaninę niejednorodną np.: piasek i woda
Wymagania podstawowe ( ocena dostateczna )
-
rozróżnia roztwory właściwe, koloidalne i zawiesiny
rozumie pojęcia: roztwór nasycony, nienasycony, stężony i rozcieńczony
zna czynniki wpływające na rozpuszczanie substancji
oblicza stężenie procentowe roztworu przy znanych masach substancji rozpuszczonej i rozpuszczalnika
-
przeprowadza krystalizację substancji stałej z roztworu
definiuje pojęcie rozpuszczalności
odczytuje z wykresu rozpuszczalność substancji
Wymagania rozszerzone ( ocena dobra )
-
zna zmiany stanu skupienia wody
rozumie zależność pomiędzy rozpuszczalnością gazów i substancji stałych w wodzie i temperaturą
umie dobierać ilości substancji rozpuszczonej i rozpuszczalnika w celu sporządzenia roztworu o określonym
stężeniu procentowym
oblicza stężenie procentowe roztworu po dodaniu rozpuszczalnika lub substancji rozpuszczonej
oblicz masę substancji rozpuszczonej
dostrzega możliwość zmniejszenia zużycia wody w najbliższym otoczeniu
Wymagania dopełniające ( ocena bardzo dobra )
-
oblicza stężenia roztworów powstałych przez mieszanie roztworów o różnych stężeniach
oblicza stężenia roztworów powstałych przez rozcieńczanie danej ilości roztworu o określonym stężeniu
oblicza stężenia roztworów z uwzględnieniem objętości i gęstości
rozumie proces oczyszczania ścieków
omawia wykresy rozpuszczalności różnych substancji
wykonuje proste obliczenia z wykorzystaniem rozpuszczalności
WYMAGANIA Z CHEMII Kl II
Dział V. Kwasy i zasady
Wymagania konieczne ( ocena dopuszczająca )
-
zna nazwy poznanych kwasów
zna najważniejsze właściwości kwasów: solnego, siarkowego (VI), azotowego (V), węglowego
zna budowę cząsteczek ww. kwasów
umie podzielić kwasy na tlenowe i beztlenowe
umie nazwać wodorotlenki (zasady)
zna budowę cząsteczek zasad ( wskazywanie metalu i grupy wodorotlenowej )
zna właściwości zasady sodowej, potasowej, wapniowej
umie odróżnić kwasy od zasad za pomocą wskaźników
wyjaśnia konieczność zachowania ostrożności podczas posługiwania się substancjami o właściwościach
żrących
Wymagania podstawowe ( ocena dostateczna )
-
dobiera substraty w reakcji powstawania kwasu tlenowego
wyznacza wartościowość reszty kwasowej na podstawie wzoru
oblicza wartościowość metalu w cząsteczce wodorotlenku
zapisuje wzory sumaryczne i strukturalne kwasów i wodorotlenków
zapisuje równania reakcji otrzymywania wodorotlenków: metal+woda, tlenek metalu+woda
odczytuje równania reakcji otrzymywania kwasów i wodorotlenków
zna zależność pomiędzy odczynem roztworu i obecnością jonów H + i OH-
Wymagania rozszerzone ( ocena dobra )
-
potrafi ustalić na podstawie wzorów ogólnych wzory sumaryczne kwasów i wodorotlenków
oblicza liczbę atomów wchodzących w skład cząsteczki kwasu i wodorotlenku
identyfikuje kwasy i wodorotlenki na podstawie ich charakterystycznych właściwości
zapisuje równania dysocjacji kwasów i zasad i je odczytuje
dostrzega zależność pomiędzy pojęciami: wodorotlenek i zasada
wyjaśnia pojęcia: kwas trwały i kwas nietrwały
przedstawia wzory i nazywa inne kwasy: siarkowy (IV), siarkowodorowy, fosforowy (V)
oblicza masy cząsteczkowe kwasów i zasad
wyznacza wzory związków, które uległy dysocjacji, na podstawie obecności jonów w roztworze
Wymagania dopełniające ( ocena bardzo dobra )
-
zapisuje równania reakcji powstawania zasad i kwasów
rozwiązuje zadania rachunkowe z wykorzystaniem masy cząsteczkowej i stężenia procentowego
dostrzega zależność między powstawaniem kwaśnych deszczów a obecnością w atmosferze bezwodnika
kwasowego ( tlenków azotu, siarki węgla )
Dział VI Sole
Wymagania konieczne ( ocena dopuszczająca )
-
uczeń nazywa sole na podstawie podanego wzoru
wskazuje, z jakich atomów składają się cząsteczki soli
otrzymuje sole metodą zobojętniania
zna właściwości NaCl i CaCO3 i ich zastosowanie
wie, że roztwory soli przewodzą prąd elektryczny
Wymagania podstawowe ( ocena dostateczna )
-
przedstawia wzór soli na podstawie nazwy
podaje definicję wiązania jonowego
wskazuje resztę kwasową
oblicza wartościowość metalu i reszty kwasowej ze wzoru
zapisuje równania reakcji otrzymywania soli metodami :
kwas + zasada, metal + kwas, tlenek metalu + kwas, tlenek niemetalu + zasada
zapisuje równania reakcji dysocjacji jonowej soli i odczytuje je
odczytuje równania reakcji otrzymywania soli
przewiduje na podstawie tablicy rozpuszczalności, czy wytrąci się osad w reakcji zmieszania odpowiednich
soli
Wymagania rozszerzone ( ocena dobra )
-
tworzy wzory soli kwasów : siarkowego ( VI ), siarkowodorowego, azotowego ( V ), węglowego i nazywa
te sole na podstawie wzoru
przewiduje wzór soli po odparowaniu wody ( z jonów )
wyjaśnia pojęcie wiązania jonowego
przedstawia równania wytrącania osadu na podstawie tablicy rozpuszczalności
zapisuje równania reakcji otrzymywania soli w formie jonowej
omawia zastosowania i właściwości soli poprzez wyjaśnienie reakcji zachodzących w najbliższym
otoczeniu, np. mętnienie wody wapiennej, otrzymywanie napoju gazowanego, spulchnianie ciasta
Wymagania dopełniające ( ocena bardzo dobra )
-
zna i zapisuje równania reakcji otrzymywania soli wszystkimi poznanymi metodami
oblicza masy cząsteczkowe soli
ustala wzór soli na podstawie masy cząsteczkowej, zawartości procentowej
przewiduje odczyn roztworu powstałego w wyniku mieszania różnych ilości kwasu i zasady
rozwiązuje zadania rachunkowe z wykorzystaniem stężenia procentowego i masy cząsteczkowej
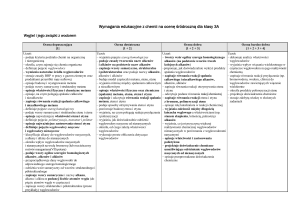
Klasa III
Dział VII Węglowodory
Wymagania konieczne ( ocena dopuszczająca )
-
zna odmiany alotropowe węgla i opisuje ich właściwości ( diament, grafit )
wskazuje różnice między właściwościami diamentu i grafitu
zna odmiany węgli kopalnych
wskazuje występowanie węglowodorów
zapisuje wzór sumaryczny węglowodoru na podstawie modelu i wzoru strukturalnego
zna naturalne surowce energetyczne i wymienia produkty ich przeróbki ( węgla i ropy naft. )
- zna zastosowanie metanu, etanu i acetylenu
Wymagania podstawowe ( ocena dostateczna )
-
rozumie zależność pomiędzy właściwościami fizycznymi a wykorzystaniem w technice alotropowych
odmian węgla
zna produkty destylacji ropy naftowej i węgla oraz ich zastosowanie
rozumie różnice w budowie kolejnych węglowodorów szeregu homologicznego
dostrzega zależność między rodzajem wiązań a nazwą węglowodoru
umie otrzymać acetylen z węgliku wapnia
zna nazwy pierwszych pięciu węglowodorów z szeregu homologicznego: alkanów, alkenów i alkinów
zna produkty spalania węglowodorów i umie je identyfikować
Wymagania rozszerzone ( ocena dobra )
-
zapisuje równania reakcji spalania węglowodorów ( całkowitego, półspalania i niecałkowitego )
identyfikuje węglowodory nienasycone
-
rozumie zależność pomiędzy wielkością cząsteczki węglowodoru, jego lotnością, palnością i
wybuchowością
wyjaśnia fakt, że podczas spalania acetylenu wytwarza się wysoka temperatura
Wymagania dopełniające ( ocena bardzo dobra )
-
rozumie mechanizm reakcji węglowodoru nienasyconego z chlorowcem i umie ją zapisać w postaci
równania
umie otrzymać węglowodór nasycony z nienasyconego
wyznacza wzór elementarny węglowodoru na podstawie masy cząsteczkowej i zawartości procentowej
interpretuje chemografy
wykonuje obliczenia z zastosowaniem gęstości
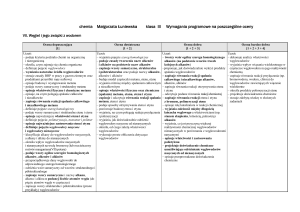
Dział VIII Pochodne węglowodorów
Wymagania konieczne ( ocena dopuszczająca )
-
uczeń modeluje cząsteczki alkoholi i kwasów organicznych ( karboksylowych )
układa wzory sumaryczne i strukturalne alkoholi i kwasów na podstawie modelu
nazywa alkohole i kwasy
opisuje właściwości fizyczne alkoholi i kwasów
przyporządkowuje związki do odpowiedniego szeregu na podstawie podanego wzoru
dostrzega szkodliwe działanie alkoholi na organizm ludzki
Wymagania podstawowe ( ocena dostateczna )
-
wyprowadza wzór alkoholu ze wzoru węglowodoru
rozumie zależność między grupą funkcyjną a nazwą związku
zapisuje wzory pięciu pierwszych alkoholi z szeregu homologicznego
zapisuje wzory kwasów : mrówkowego i octowego
zapisuje wzory cząsteczek kwasu stearynowego, palmitynowego i oleinowego
przedstawia równania reakcji charakterystycznych dla kwasów
rozumie zależność pomiędzy długością łańcucha i właściwościami fizycznymi kwasu organicznego
podaje zastosowania estrów
zna substancje tworzące mydło
Wymagania rozszerzone ( ocena dobra )
-
wskazuje glicerynę jako alkohol wielowodorotlenowy
wskazuje wzory : alkoholi, kwasów, estrów wśród podanych związków
modeluje cząsteczki estrów
zapisuje równania reakcji spalania alkoholi i kwasów
wymienia właściwości gliceryny i zapisuje jej wzór strukturalny
układa równanie reakcji, w której wyniku powstaje mydło
oblicza masy cząsteczkowe alkoholi, kwasów i estrów
Wymagania dopełniające ( ocena bardzo dobra )
-
zapisuje wzór estru i podaje jego nazwę na podstawie wzoru
zapisuje wzór mydła
ocenia wpływ detergentów na środowisko
rozwiązuje zadania z zastosowaniem masy cząsteczkowej ww. związków i stężenia procentowego
Dział IX Związki chemiczne w żywieniu
Wymagania konieczne ( ocena dopuszczająca )
-
wykrywa węgiel i wodę w produktach spożywczych
omawia rolę, jaką odgrywają w organizmie poszczególne składniki żywności
podaje podstawowe zawiązki chemiczne występujące w żywności
podaje podstawowe czynniki prowadzące do denaturacji białek
wskazuje substancje należące do cukrów
podaje właściwości fizyczne cukrów, ich występowanie i zastosowanie
podaje właściwości tłuszczów, ich rodzaje i zastosowanie
zna właściwości i zastosowanie polietylenu i PCV
Wymagania podstawowe ( ocena dostateczna )
-
omawia skład pierwiastkowy białek
zna metodę wykrywania skrobi za pomocą jodyny
wyjaśnia rozpuszczalność tłuszczów w różnych rozpuszczalnikach
wybiera odczynnik służący do wykrywania obecności glukozy i białka
omawia reakcje : Tollensa, Trommera, ksantoproteinową i biuretową
zna substancje szkodliwe dla zdrowia
Wymagania rozszerzone ( ocena dobra )
-
wykrywa obecność glukozy
wykrywa białko
wyjaśnia proces hydrolizy cukrów złożonych i tłuszczów i zapisuje reakcje
kwalifikuje tłuszcze jadalne do związków nasyconych i nienasyconych
odróżnia tłuszcze od substancji tłustej, np.oleju maszynowego
Wymagania dopełniające ( ocena bardzo dobra )
-
wyjaśnia fakt, że tłuszcz to ester gliceryny i kwasu tłuszczowego
zapisuje równania reakcji hydrolizy i zmydlania tłuszczów
wyjaśnia pozytywny i negatywny wpływ wybranych produktów spożywczych na organizm człowieka ( np.
masła, mleka )
wyjaśnia wpływ alkoholu, leków narkotyków, trucizn, nawozów,środków ochrony roslin na organizm
człowieka
wykonuje obliczenia stechiometryczne w oparciu prawo stałości składu i prawo zachowania masy.
Ważne informacje dla ucznia
1. Na każdą lekcję obowiązuje Cię przygotowanie do lekcji; Twoje wiadomości będą sprawdzane podczas
2.
3.
4.
5.
6.
7.
8.
9.
odpowiedzi ustnych i pisemnych – zawsze obowiązuje szczegółowy materiał z trzech ostatnich i
podstawowe wiadomości z całego zakresu biologii. Możesz raz w semestrze zgłosić nieprzygotowanie
do lekcji i raz brak pracy domowej ; co nie zwalnia z obowiązku uzupełnienia braków i przygotowania
się na następną lekcję.
Sprawdziany są obowiązkowe, jeśli nie będzie Cię w szkole w dniu sprawdzianu musisz zdać daną
partię materiału w ciągu 2 tygodni od powrotu do szkoły. W szczególnych sytuacjach np. długotrwała
choroba , termin może być ustalony z nauczycielem indywidualnie.
Większe partie materiału będą kończyć się sprawdzianem pisemnym. O ich formie i czasie zostaniesz
powiadomiona/y co najmniej z tygodniowym wyprzedzeniem. Każdy sprawdzian obejmujący większą
partię materiału poprzedzony będzie lekcją powtórzeniową.
Kartkówki obejmujące zakres trzech ostatnich lekcji nie muszą być zapowiadane. W zakres kartkówki
może wejść materiał przerabiany wcześniej, jeśli zostanie zapowiedziany.
W przypadku otrzymania oceny negatywnej masz możliwość jej poprawienia w czasie nie dłuższym niż
2 tygodnie od jej wystawienia. Do oceny końcowej liczy się ocena poprawiona ( nie dotyczy prac
niesamodzielnych- ściągania ).
Niesamodzielne prace klasowe- sprawdziany, kartkówki itp. ( ściąganie) oceniane są na ocenę
niedostateczną. Możesz poprawić ocenę, ale otrzymasz średnia z dwóch ocen.
Niesamodzielne prace domowe ( np. odpisane od kolegi, „ściągnięte” z Internetu) nie są oceniane i
wymagają powtórzenia- w terminie jednego tygodnia
Zaliczanie sprawdzianów i poprawa ocen odbywa się po lekcjach
Jeśli na koniec pierwszego półrocza otrzymasz ocenę niedostateczną, będziesz zobowiązany uzupełnić
zaległości i zaliczyć materiał z tego półrocza do 15 marca. O formie tego zaliczenia ( odpowiedź ustna
lub pisemna ) zadecydujesz sam.
Sposób oceniania z chemii .
I.
Oceny będą wystawiane w następujących kategoriach :
1.
2.
3.
4.
5.
6.
praca klasowa ( sprawdzian ) – praca pisemna godzinna z większej partii materiału
poprzedzona powtórzeniem
kartkówka - praca pisemna z bieżącego materiału ( trzy ostatnie lekcje ) od 5 do 15 minut
odpowiedź pełna
odpowiedź cząstkowa , wykonanie ćwiczenia, doświadczenia na lekcji z bieżącego materiału
poprzedzona zapisanymi przez nauczyciela plusami lub minusami ewentualnie oceniona
stopniem
praca domowa
opinia nauczyciela ( składa się na nią : - pilność
- stosunek do przedmiotu, przyrody, własnego
zdrowia
- aktywność
- systematyczność i terminowość
- samodyscyplina
- estetyka zeszytu
- umiejętność współpracy w grupie
- pomoc kolegom mającym trudności
II.
Ocenę śródroczną wystawia się w sposób następujący :
1.
2.
3.
oblicza się średnią arytmetyczną ocen z prac klasowych ( sprawdzianów )
oblicza się średnią arytm. pozostałych ocen
dodaje się obie średnie i dzieli przez dwa
średnia od 1 do 1,5 to ocena niedostateczna
1,6 do 2,5 - ocena dopuszczająca
2,6 do 3,5 – ocena dostateczna
3,6 do 4,5 – ocena dobra
4,6 do 5,1 – ocena bardzo dobra
5,25 do 6,0 – ocena celujaca
III.
Ocenę roczną uzyskuje się jako średnią arytm. średnich z obydwu półroczy