Basal ganglia
The basal ganglia and the cerebellum may
be viewed as key elements in two parallel
reentrant systems that receive input from
and return their influences to the cerebral
cortex through discrete and separate
portions of the ventrolateral thalamus. They
also influence the brain stem and,
ultimately, spinal mechanisms.
Basal ganglia
The four principal nuclei of the basal ganglia are (1) the striatum, (2) the globus pallidus (or
pallidum), (3) the substantia nigra (consisting of the pars reticulata and pars compacta), and
(4) the subthalamic nucleus. The striatum consists of three important subdivisions: the
caudate nucleus, the putamen, and the ventral striatum (which includes the nucleus
accumbens – not shown).
Basal ganglia-thalamocortical circuit
The anatomic connections of the basal gangliathalamocortical circuitry show the parallel direct
and indirect pathways from the striatum to the
basal ganglia output nuclei. Two types of dopamine
receptors (D1 and D2) are located on different sets
of output neurons in the striatum that give rise to
the direct and indirect pathways. Inhibitory
pathways are shown as gray arrows; excitatory
pathways, as pink arrows. GPe = external
segment of the globus pallidus; GPi = internal
segment of the globus pallidus; SNc = substantia
nigra pars compacta; STN = subthalamic nucleus.
The direct pathway provides positive feedback and
the indirect pathway negative feedback in the
circuit between the basal ganglia and the thalamus.
Activation of the direct pathway disinhibits the
thalamus, thereby increasing thalamocortical
activity, whereas activation of the indirect pathway
further inhibits thalamocortical neurons. As a
result, activation of the direct pathway facilitates
movement, whereas activation of the indirect
pathway inhibits movement.
Movement disorders and the basal ganglia
The basal ganglia-thalamocortical circuitry under
normal conditions and in Parkinson disease,
hemiballism (undesired movements) and chorea
(involuntary movement disorder). Inhibitory
connections are shown as gray and black arrows;
excitatory connections, as pink and red.
Degeneration of the dopamine pathway in
Parkinson disease leads to differential changes in
activity in the two striatopallidal projections,
indicated by changes in the darkness of the
connecting arrows (darker arrows indicate
increased neuronal activity and lighter arrows,
decreased activity). Basal ganglia inhibitory
output to the thalamus is increased in Parkinson
disease and is decreased in hemiballism and
chorea.
Parkinson disease – surgical therapies
Lesions of the subthalamic nucleus (STN) (left) or internal segment of the globus pallidus
(right) effectively reduce parkinsonian signs by respectively normalizating or eliminating
abnormal and excessive inhibitory output from the internal pallidal segment.
Parkinson disease – drug therapies
Parkinson disease ilustration in A
Manual of Diseases of the
Nervous System,1886
„Awakenings” movie based on Oliver Sacks book telling true story of a
discovery of beneficial effects of then-new drug L-DOPA in cataonic patients.
L-DOPA is produced from the amino acid Ltyrosine. L-DOPA crosses the protective
blood–brain barrier, whereas dopamine itself
cannot. Dopamine is formed by the
decarboxylation of L-DOPA.
L-DOPA is used to increase dopamine
concentrations in the treatment of Parkinson's
disease.
L-DOPA is also converted into dopamine from
within the peripheral nervous system causing
side effects (fight-or-flight response).
Therefore L-DOPA is administered with
carbidopa and entacapon which
prevent the peripheral synthesis of dopamine
from L-DOPA.
L – levadopa, C – carbidopa, E - entacapon
Parkinson disease – deep brain stimulation
Implantation of electrode for deep brain stimulation. Globus pallidus interna (Gpi) and
subthalamic nucleus (STN) are the stimulation targets.
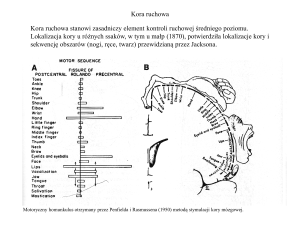
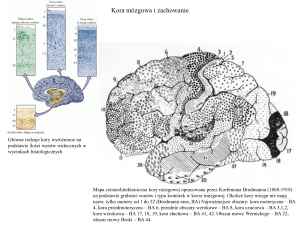
Kora ruchowa
Kora ruchowa stanowi zasadniczy element kontroli ruchowej średniego poziomu.
Lokalizacja kory u różnych ssaków, w tym u małp (1870), potwierdziła lokalizacje kory i
sekwencję obszarów (nogi, ręce, twarz) przewidzianą przez Jacksona.
Motoryczny homunkulus otrzymany przez Penfielda i Rasmussena (1950) metodą stymulacji kory mózgowej.
Trzy obszary kory ruchowej
Kora ruchowa znajduje się w płacie czołowym (frontal lobe), tuż przed bruzdą centralną (Central Sulcus)
nazywaną też bruzdą Rolanda (Rolandic fissure) i jest podzielona na trzy wzajemnie połączone obszary,
pierwszorzędową korę ruchową (MI), dodatkową korę ruchową (SMA) i korę przedruchową (PM). SMA i
PM stanowią wspólnie drugorzędową korę ruchową (MII). Funkcjonalnie oznacza to wielokrotną
reprezentację mapy ruchowej w korze mózgowej.
Stymulacja pierwszorzędowej kory ruchowej
A. Stymulacja magnetyczna kory motorycznej lub odcinka szyjnego rdzenia kręgowego (cervical spine)
aktywuje drogę drogę korowo-rdzeniową i wywołuje odpowiedz EMG mięśni. B. Zapisy z kontralateralnych
mięśni ramienia i dłoni wykazują wcześniejszą odpowiedź na stymulacje rdzenia niż na stymulacje kory.
Załamek S jest artefaktem związanym z przyłożonym impulsem magnetycznym. Pierwszorzędowa kora
ruchowa kontroluje proste własności ruchu.
Elektryczna stymulacja pierwszorzędowej kory ruchowej
Dokładniejsze studia za pomocą mikrolektrod implantowanych (intracortical microstimulation or ICMS)
pokazały, ze neurony w pierwszorzedowej korze ruchowej (MI) aktywują nie tylko pojedyncze mięśnie oraz
że te same mięśnie są aktywowane przez wiele różnych obszarów kory. Na wykresach widać miejsca w MI,
stymulacja których wywołuje aktywność EMG (wskazując na połączenie monosynaptyczne) w mięśniu
ramienia (deltoid muscle) i nadgarstka (extensor carpi radialis; ECR). Mapy topograficzne (1/próg stymulacji)
ukazują zarówno redundancje jak i przekrywanie się reprezentacji. Umożliwia to aktywacje różnych grup
mięśni w różnych zadaniach.
Obszary przedruchowe - połączenia
U naczelnych istnieją cztery główne obszary przedruchowe. A. Wejścia do kory pierwszorzedowej u małpy:
PMd (dorsal premotor area); PMv (ventral premotor area), S1 (primary sensory cortex), SMA
(supplementary motor area.), CMA (cingulate motor area). B. Wejścia do kory przedruchowej: pola 5 i 7
Brodmana, kora przedczołowa (prefrontal cortex, pole Brodmana 46). Obszary 5 i 7 Brodmana zajmują się
integracją multisensoryczną w celu planowania ruchu. Obszar 46 zajmuje się pamięcią operacyjną (working
memory) i przetrzymuje w pamięci informacje o lokalizacji przestrzennej obiektów, w czasie wykonania
ruchu. Występują również gęste połączenia pomiędzy obszarami przedruchowymi, nie pokazane na
rysunku.
Połączenia z móżdżkiem i zwojami podstawy
Kora przedruchowa i pierwszorzędowa kora ruchowa dostają również wejścia ze zwojów podstawy i
móżdżku poprzez wzgórze. Zwoje podstawy i móżdżek nie wysyłają bezpośrednio połączeń do rdzenia
kręgowego.
Plastyczność somatotopicznej organizacji kory ruchowej
Organizacja kory ruchowej jest plastyczna i zmienia się pod wpływem uczenia i uszkodzeń. A. Widok
normalny somatotopicznej organizacji kory ruchowej szczura z obszarami reprezentującymi mięśnie łap
przednich, wąsów i okołooczne. B. Po przecięciu połączeń nerwowych z wąsami obszary mięśni łap
przednich i okołooczne są zwiększone kosztem obszaru wąsów. Reorganizacja może się odbyć nawet w
czasie paru godzin. Prawdopodobnie jest ona wynikiem utraty wejść sensorycznych z wąsów do kory
ruchowej.
Plastyczność somatotopicznej organizaji kory ruchowej cd
Ruchy zamierzone ulegają poprawie wraz z praktyką. B. Skany fMRI ukazujące aktywacje kory MI
podczas wykonywania sekwencji ruchowej ćwiczonej przez 3 tygodnie 20 min. dziennie (prawo) oraz
nowej sekwencji ruchowej (lewo). Reprezentacja wyćwiczonej sekwencji jest większa niż sekwencji
kontrolnej. W eksperymencie tempo wykonania zadania było w obu sytuacjach takie samo.
Komórki V warstwy kory motorycznej dają początek drodze
piramidowej
Z lewej: siedem warstw kory motorycznej wg.
klasyfikacji Cajala. Warstwy są wyróżnione na podstawie
względnej ilości dużych ciał neuronów (komórki
piramidalne) i małych ciał neuronów (komórki
piramidalne, gwiaździste i ziarniste). Z prawej: komórka
Betza kory motorycznej obrazowana metodą Golgiego.
Porównanie sześciu warstw kory w różnych obszarach
mózgu. W V warstwie kory motorycznej widoczne ciała
neuronów komórek Betza. Komórki Betza znajdują się
głównie w obszarze ruchowym nogi.
Równoległe drogi ruchowe
Pośrednie i bezpośrednie
połączenia kory ruchowej i pnia
mózgu z boczną i przyśrodkową
częścią rdzenia kręgowego.
Bezpośrednia droga korowordzeniowa (droga piramidowa,
corticospinal tract) omija
wybrzuszenie piramidowe w pniu
mózgu i schodzi do pnia mózgu,
gdzie tworzy połączenia
polisynaptyczne (u wyzszych
ssaków) lub monosynaptyczne (u
naczelnych) z motoneuronami. 85
% włókien przekracza linię
środkową i tworzy boczną drogę
korowo-rdzeniową, pozostałe
aksony tworzą grzbietową drogę
korowo-rdzeniową.
Drogi pośrednie: droga
czerwienno-rdzeniowa i droga
korowo-siatkowo-rdzeniowa.
Równoległe drogi ruchowe
Przecięcie drogi korowordzeniowej powoduje
jednostronną słabość w mięśniach
u małpy. Ustępuje ona po upływie
paru miesięcy i zwierzęta
odzyskują normalne funkcje
ruchowe dzięki przejęciu funkcji
przez drogi pośrednie. Jednakże
indywidualne ruchy palców są
utracone na zawsze.
Kodowanie siły mięśni
Częstość odpalania neuronów w korze ruchowej koduje siłę mięśni. A1,2 - dwa rodzaje zachowania
neuronów w korze ruchowej podczas momentu siły przyłożonego do nadgarstka. B. W obu rodzajach
neuronów częstość odpalania wzrasta (liniowo) z siłą mięśni. (torque – ang. moment obrotowy)
Kodowanie populacyjne kierunku ruchu
Kierunek ruchu jest kodowany w korze motorycznej poprzez populacje
neuronów. (A) Wytrenowana małpa porusza ręką w ośmiu różnych
kierunkach. (B) Aktywność neuronu ruchowego w korze podczas ruchów
w ośmiu kierunkach. C.Krzywa strojenia neuronu. D. Wiele neuronów
korowych jest aktywnych w trakcie ruchu w danym kierunku. Kierunek
każdej linii reprezentuje preferowany kierunek danej komórki, a długość
linii jest proporcjonalna do częstotliwości jej wyładowań. Wypadkowy
‘wektor’ aktywności (czerwona strzałka) koduje wykonywany kierunek
ruchu (czarna strzałka) (Georgopoulos, 1982)
Potencjał przygotowujący
W ruchach generowanych wewnętrznie, przed ruchem obserwowany jest ujemny potencjał w EEG w
obszarze dodatkowej kory ruchowej (SMA) zanim nastąpi aktywacja pierwszorzędowej kory ruchowej. Jest
to tzw. potencjał gotowości (ang. readiness potential RP lub niem. Bereitschaftspotential, BP), który
sygnalizuje planowanie ruchu. W eksperymentach pokazano, że BP jest widoczny na ok. 400 ms przed zanim
badany relacjonował świadom myślenie o wykonaniu ruchu.
Doświadczenie Libeta (1983):
świadomość, że chce się ruszyć palcem
początek BP
Obszary przedruchowe – funkcje
Visual cue: małpa miała dotykać paneli na podstawie ich podświetlania w pewnej sekwencji. Prior training: dotykanie paneli
wg. wcześniej wyuczonej sekwencji. Neurony w korze ruchowej MI odpalały przed i w trakcie ruchu, tak samo w obu
zadaniach. Dodatkowa kora ruchowa (SMA) była aktywna tylko przed i w trakcie zadania wyuczonego. Boczna kora
przedruchowa była aktywna tylko przed i w trakcie zadania wykonywanego na podstawie informacji wzrokowej. Wniosek:
dodatkowa kora ruchowa programuje programy motoryczne wyuczonych sekwencji ruchowych. Boczna kora przedruchowa
bierze udział w przygotowaniu i wykonaniu ruchu w odpowiedzi na bodziec zewnętrzny. Po długotrwałym treningu,
aktywność w dodatkowej korze ruchowej zanika – sekwencje wykonywane automatycznie ‘przenoszą się’ do kory
pierwszorzędowej.
Obszary przedruchowe
Neuron w bocznej grzbietowej korze
przedruchowej staje się aktywny gdy
małpa przygotowuje się do ruchu w lewo.
Instrukcja (podświetlenie jednego z
czterech paneli) wskazuje panel do
naciśnięcia po bodźcu wyzwalającym
(zapalenie się diody). Odpalanie neuronu
rozpoczyna się po pojawieniu się
instrukcji i trwa do wykonania zadania
po bodźcu wyzwalającym. Wniosek: kora
przedruchowa bierze udział w
przygotowaniu i wykonaniu ruchu w
odpowiedzi na bodziec zewnętrzny (w
tym doświadczeniu - wzrokowy).
Zachodzi w niej uczenie asocjacyjne
(Associative learning) pomiędzy
bodzcem sensorycznym a dana reakcja
ruchowa.
Transformacja sensomotoryczna
Transformacja reprezentacji sensorycznej otoczenia na sygnały kontroli mięśni nazywa się transformacją sensomotoryczną.
Oddzielne, równoległe drogi zapewniają transformację wzrokowo-motoryczną wymaganą do sięgania i chwytania. PMd –
premotor dorsal, PMv – premotor ventral.
Komórki zwierciadlane
Komórki w bocznej grzbietowej korze przedruchowej wykazują aktywność gdy małpa wykonuje zadanie lub gdy obserwuje
wykonanie zadania. Komórki te są więc zaangażowane w abstrakcyjną reprezentację ruchu. A. Aktywność neuronu podczas
obserwacji chwytania wykonywanego przez inna małpę. B. Aktywność neuronu podczas obserwacji chwytania
wykonywanego przez eksperymentatora. C. Aktywność neuronu podczas chwytania wykonywanego przez małpę. Neurony te
nazwano neuronami zwierciadlanymi (mirror neurons).
Obwody ruchowe - synteza
1.
Ruch zamierzony
rozpoczyna się ‘programem
centralnym’, który aktywuje
w odpowiedniej sekwencji
obszary kory ruchowej.
2.
Włókna korowo-rdzeniowe
pobudzają motoneurony.
3.
Motoneurony wywołują ruch
mięśni.
4.
Poprzez kolaterale, włókna
korowo-rdzeniowe
pobudzają komórki czuciowe
(informacja o wysłanych
komendach).
5 i 6 Wyjścia czuciowe z mięśni,
stawów i skóry dostarczają
informacji zwrotnej o stanie
skurczu mięśni i fazie
wykonania ruchu.