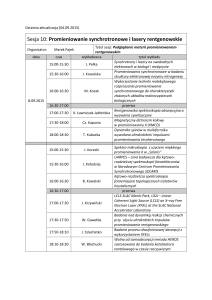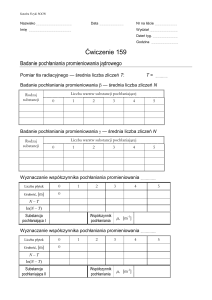
Jan Drzymała
ANALIZA INSTRUMENTALNA
SPEKTROSKOPIA W ŚWIETLE WIDZIALNYM I PODCZERWONYM
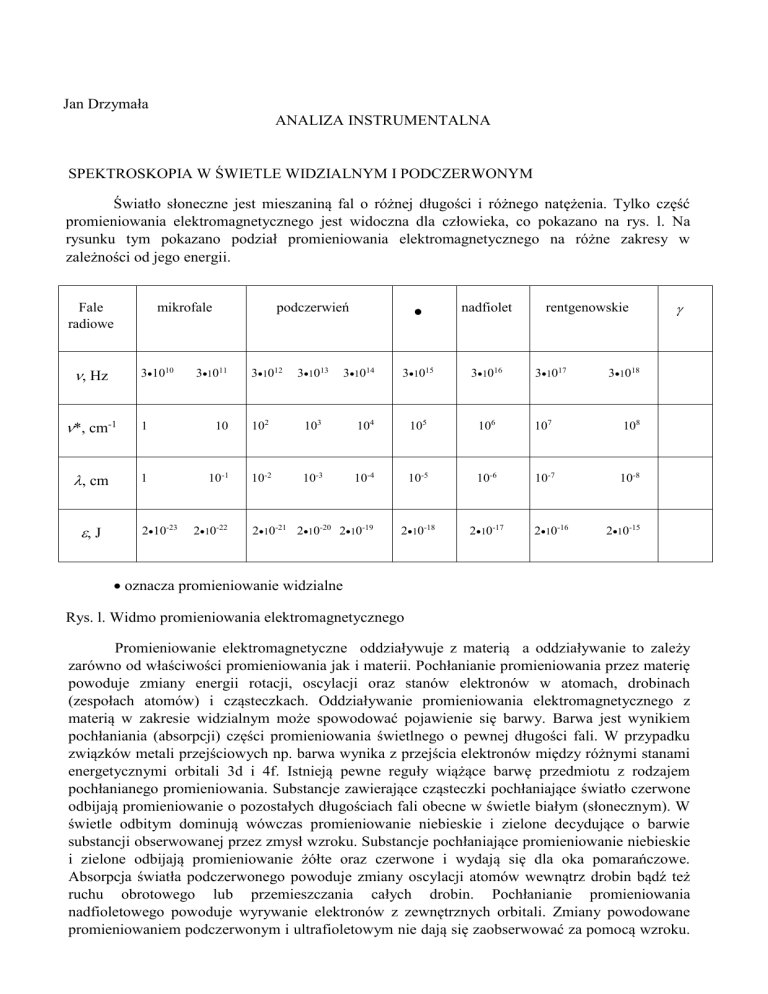
Światło słoneczne jest mieszaniną fal o różnej długości i różnego natężenia. Tylko część
promieniowania elektromagnetycznego jest widoczna dla człowieka, co pokazano na rys. l. Na
rysunku tym pokazano podział promieniowania elektromagnetycznego na różne zakresy w
zależności od jego energii.
Fale
radiowe
, Hz
31010
nadfiolet
31015
31016
podczerwień
mikrofale
31011
31012
31013
31014
rentgenowskie
31017
31018
*, cm-1
1
10
102
103
104
105
106
107
108
, cm
1
10-1
10-2
10-3
10-4
10-5
10-6
10-7
10-8
210-18
210-17
, J
210-23
210-22
210-21 210-20 210-19
210-16
210-15
oznacza promieniowanie widzialne
Rys. l. Widmo promieniowania elektromagnetycznego
Promieniowanie elektromagnetyczne oddziaływuje z materią a oddziaływanie to zależy
zarówno od właściwości promieniowania jak i materii. Pochłanianie promieniowania przez materię
powoduje zmiany energii rotacji, oscylacji oraz stanów elektronów w atomach, drobinach
(zespołach atomów) i cząsteczkach. Oddziaływanie promieniowania elektromagnetycznego z
materią w zakresie widzialnym może spowodować pojawienie się barwy. Barwa jest wynikiem
pochłaniania (absorpcji) części promieniowania świetlnego o pewnej długości fali. W przypadku
związków metali przejściowych np. barwa wynika z przejścia elektronów między różnymi stanami
energetycznymi orbitali 3d i 4f. Istnieją pewne reguły wiążące barwę przedmiotu z rodzajem
pochłanianego promieniowania. Substancje zawierające cząsteczki pochłaniające światło czerwone
odbijają promieniowanie o pozostałych długościach fali obecne w świetle białym (słonecznym). W
świetle odbitym dominują wówczas promieniowanie niebieskie i zielone decydujące o barwie
substancji obserwowanej przez zmysł wzroku. Substancje pochłaniające promieniowanie niebieskie
i zielone odbijają promieniowanie żółte oraz czerwone i wydają się dla oka pomarańczowe.
Absorpcja światła podczerwonego powoduje zmiany oscylacji atomów wewnątrz drobin bądź też
ruchu obrotowego lub przemieszczania całych drobin. Pochłanianie promieniowania
nadfioletowego powoduje wyrywanie elektronów z zewnętrznych orbitali. Zmiany powodowane
promieniowaniem podczerwonym i ultrafioletowym nie dają się zaobserwować za pomocą wzroku.
Do tego służą spektrofotometry. Pochłonięcie promieniowania, które posiada częstość v oznacza, że
cząsteczki obecne w próbce pochłaniają kwant energii hv, a zatem przechodzą od energii E' do
energii E" co opisuje równanie l.
E’’ – E’ = h
(l).
Zamiast częstości v wyrażonej w s-1 częściej posługujemy się wielkością od niej proporcjonalną
zwaną liczbą falową v*, która stanowi odwrotność długości fali użytego promieniowania.
v* = l/.=/c,
v* - liczba falowa, cm-1
- długość fali, w jednostce długości
- częstość, s-1
c - prędkość światła, cm/s.
Rejestrator w spektrofotometrze kreśli zwykle na osi rzędnych przepuszczalność (transmisję
T, która jest stosunkiem natężenia promieniowania opuszczającego próbkę I od natężenia
promieniowania padającego IO, tzn. T = I/IO) jako funkcję liczby falowej promieniowania. Na
rysunkach 2-6 pokazano widma pochłaniania promieniowania podczerwonego przez kwarc (SiO2),
kalcyt (CaC03), goslaryt (ZnS04), hematyt (Fe2O3), i kwas palmitylowy (C15H31COOH).
Na rysunkach 7-8 podano widma pochłaniania roztworów wodnych K2Cr2O7 i NiSO4 a na
rys.9 widma w świetle widzialnym wodnych roztworów CuS04 o różnych stężeniach.
gdzie
WYKONANIE ĆWICZENIA
l. Spektroskopia w podczerwieni. Analiza jakościowa substancji chemicznych
Odważ w małym naczyńku wagowym dokładnie 0.0015g otrzymanej od prowadzącego
ćwiczenia substancji. Dodaj do tego samego naczyńka 100 mg KBr. Zmieszaj dokładnie obie
substancje za pomocą bagietki szklanej. Przesyp całość do moździerza agatowego i dokładnie utrzyj na
proszek. Następnie przenieś uzyskaną mieszaninę do pastylkarki, umieść pastylkarkę w prasie
hydraulicznej i sporządź pastylkę.
UWAGA:
Nie wolno przekroczyć ciśnienia wywieranego przez prasę hydrauliczną na pastylkarkę
oznaczonego na manometrze na czerwono, gdyż prasa ulegnie zniszczeniu!
Pastylkę umieść w specjalnej ramce, którą wstaw do spektrofotometru Specord 71 IR.
Sporządź widmo w podczerwieni w zakresie liczby falowej 4600 -700 cm-1. Porównaj uzyskane
widmo z widmami wzorcowymi pokazanymi na rys. 2-6. Podaj nazwę mineralogiczną i wzór
chemiczny analizowanej substancji. W jakim zakresie fal zachodziła absorpcja?
2. Spektroskopia w zakresie widzialnym a) analiza jakościowa zakresie widzialnym
Pobierz od prowadzącego ćwiczenia roztwór wodny nieznanej substancji. Wlej do kuwety
szklanej 1cm3 roztworu i sporządź widmo za pomocą spektrofotometru SPECORD UV VIS.
Porównaj uzyskane widmo ze spektrami roztworów wodnych substancji wzorcowych. Podaj wzór
chemiczny badanej substancji. W jakim zakresie fal badana substancja pochłania promieniowanie?
W oparciu o tabelę l podaj jak można objaśnić barwę badanego roztworu?
Tabela l Długości fal świetlnych w obrębie widzialnych części widma
Barwa
długość fali [nm]
fiołkowa
błękitna niebieska
zielona
żółta
pomarańczowa
czerwona
397-424
424-455 • 455-492
492-575
575-589
589-647
647-723
b) analiza ilościowa roztworów siarczanu miedzi
Za pomocą SPECORDU UV Vis sporządź widmo w zakresie widzialnym otrzymanego do
analizy roztworu CuS04. Uzyskane widmo powinno być jakościowo identyczne z widmami
pokazanymi na rys. 9 lecz różniące się jedynie intensywnością pasm pochłaniania („wysokością
pików”). Sporządź krzywą kalibracyjną dla widm wzorcowych roztworu CuS04 kreśląc zależność :
wysokość pasma pochłaniania przy cm-l względem stężenia siarczanu miedzi w skali
logarytmicznej. Jakie było stężenie badanego roztworu CuS04
Zwróć uwagę na to, aby widma i wykresy miały dokładnie opisane osie tzn. miały podaną
nazwę wielkości i ich wymiar. Każdy rysunek powinien także posiadać numeru i tytuł.
30
28
26
24
22
20
Liczba falowa
Rys. 7
18
16
14
x 100cm-1