BROMAT. CHEM. TOKSYKOL. – XLI, 2008, 4, str. 949–956
Juliusz Przysławski, Ilona Górna
OSTEOPOROZA U DZIECI I MŁODZIEŻY
Katedra i Zakład Bromatologii Uniwersytetu Medycznego w Poznaniu
Kierownik: prof. UM dr hab. J. Przysławski
Hasła kluczowe: dzieci, młodzież, osteoporoza, czynniki ryzyka.
Key words: children, adolescents, osteoporosis, risk factors.
Osteoporoza (gr. osteon – kość, łac. porus – otwór, ubytek) jest układową chorobą szkieletu odznaczającą się niską masą kostną oraz zaburzeniami mikroarchitektury kostnej, czego następstwem jest kruchość i podatność kości na złamania (1).
Według kryteriów WHO, osteoporoza to obniżona gęstość mineralna kości (BMD)
równa lub mniejsza – 2,5 odchylenia standardowego (SD) w stosunku do szczytowej masy kostnej zdrowych, młodych, dorosłych kobiet (T-score) (1, 2). U dzieci
jako kryterium diagnostyczne wykorzystywany jest wskaźnik Z-score. Jest on odniesieniem wyniku BMD do średniej wartości w analogicznej pod względem wieku
grupie kontrolnej tej samej płci, uwzględniający również wzrost oraz masę ciała.
Obniżenie mineralizacji kości w granicach od –1 do –2 SD (Z-score) określa się
mianem osteopenii, natomiast wartości poniżej –2 SD (Z-score) – osteoporozy (3,
4). Giampiero i współpr. podają jednak, iż dla mężczyzn i kobiet poniżej 20 roku
życia można użyć terminu „niska gęstość kości dla chronologicznego wieku”, jeśli
Z-score jest mniejszy niż –2. Równocześnie stwierdza, że jest to lepsza terminologia
niż osteopenia/osteoporoza (5). U osób dorosłych punktem odniesienia w diagnostyce osteoporozy i kontroli jej leczenia jest szczytowa masa kostna, która zmienia się
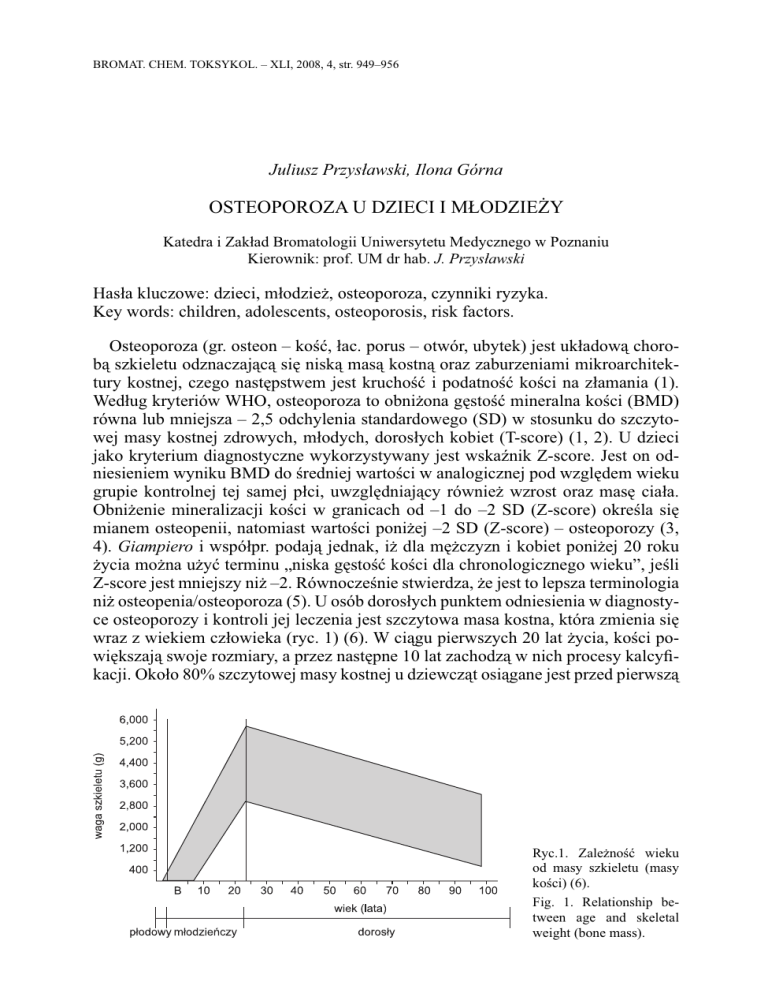
wraz z wiekiem człowieka (ryc. 1) (6). W ciągu pierwszych 20 lat życia, kości powiększają swoje rozmiary, a przez następne 10 lat zachodzą w nich procesy kalcyfikacji. Około 80% szczytowej masy kostnej u dziewcząt osiągane jest przed pierwszą
Ryc.1. Zależność wieku
od masy szkieletu (masy
kości) (6).
Fig. 1. Relationship between age and skeletal
weight (bone mass).
950
J. Przysławski, I. Górna
Nr 4
miesiączką, przy czym połowa tej ilości kumulowana jest między 10 a 12 rokiem
życia, czyli przed dojrzewaniem. Druga część gromadzona jest w bardzo szybkim
tempie w okresie dojrzewania w ciągu następnych 2–4 lat. Po okresie dojrzewania
tworzenie masy kostnej przebiega powoli (7, 8). W wieku 25–35 lat organizm osiąga
szczytową masę kostną, a przez następne 10–15 lat gęstość tkanki kostnej ulega niewielkim zmianom. Uważa się, że 50% szczytowej masy kostnej układ kostny osiąga
w pierwszej dekadzie życia, 40% w drugiej, a 10% w trzeciej (3, 9, 10). Po 45 roku
życia przeważają procesy resorpcji i rozpoczyna się zanik kostny.
Tradycyjnie, osteoporoza postrzegana jest jako choroba ludzi dorosłych, szczególnie kobiet w podeszłym wieku, jednakże występuje ona również w wieku rozwojowym i coraz częściej dotyczy dzieci i młodzieży. Na osteoporozę choruje 75
milionów osób w USA, Europie i Japonii oraz 1,4 miliona osób w Kanadzie. Jednocześnie prognozuje się dwukrotny wzrost tej populacji do końca 2020 r. W Polsce
szacuje się, iż dotkniętych osteoporozą jest ok. 25% kobiet i 13–29% mężczyzn
(11). Choroba ta zwana jest „cichym zabójcą” lub „cichym złodziejem kości” ze
względu na bardzo długi okres bezobjawowy.
Czynniki ryzyka wystąpienia osteoporozy można podzielić na (12, 13):
1. genetyczne i demograficzne – wiek powyżej 65 lat, płeć żeńska, niski ciężar
ciała, rasa biała i żółta, osteoporoza u matki, niska gęstość mineralna kości;
2. hormonalne – menopauza u kobiet, zaburzenia miesiączkowania, przedwczesne wygaśnięcie funkcji jajników, pierwotny lub wtórny brak miesiączki, nierodzenie;
3. żywieniowe, środowiskowe, styl życia – niska podaż wapnia lub witaminy D,
niedobór lub nadmiar białka w diecie, dieta wegetariańska ścisła, mała dostępność
do światła naturalnego, używki (kawa, papierosy, alkohol), siedzący tryb życia;
4. związane ze stosowaniem określonych grup leków – np. glikokortykoidy, leki
przeciwpadaczkowe, przeciwnowotworowe, przeciwzakrzepowe;
5. związane z przebiegiem różnych chorób – przewodu pokarmowego, nerek, endokrynologicznych, tkanki łącznej.
Klasyfikacja osteoporozy
Wyróżniamy dwa główne rodzaje osteoporozy: pierwotną oraz wtórną. Do osteoporozy pierwotnej zaliczamy osteoporozę idiopatyczną (samoistną) oraz inwolucyjną. Osteoporoza idiopatyczna jest odmianą rzadko występującą o nieznanej
etiologii, będącą pierwotną chorobą tkanki kostnej. Drugi rodzaj osteoporozy to osteoporoza wtórna występująca w przebiegu różnych chorób (1, 10, 14).
Idiopatyczna osteoporoza młodzieńcza po raz pierwszy została opisana przez
Schippers’a w roku 1938 (15). W chorobie tej sugeruje się podłoże endokrynologiczne, niedobór witaminy D, możliwy czynnik zakaźny, zaburzenia immunologiczne a także czynniki genetyczne. Mechanizm tej choroby nie jest do końca poznany.
Diagnoza zostaje ustalona w wyniku wykluczenia znanych przyczyn osteoporozy,
do których należą: wrodzona łamliwość kości, choroba trzewna, zespół Turnera,
homocystynuria, białaczka i unieruchomienie. Idiopatyczna osteoporoza młodzieńcza występuje u dzieci wcześniej zdrowych i prowadzi do załamań, konsekwencją,
których mogą być trwałe deformacje. Intensywność objawów jest bardzo zróżnicowana podobnie jak rozpiętość wieku (5–17 lat). Objawy idiopatycznej osteoporozy
Nr 4
Osteoporoza u dzieci i młodzieży
951
młodzieńczej opisane przez Denta występują zwykle przed okresem dojrzewania.
Odznaczają się bólami w okolicy kręgosłupa i kończyn, szczególnie dolnych, osłabieniem siły mięśniowej, wielomiejscowymi złamaniami przynasad kończyn długich
i kręgów, patologicznym stereotypem chodu lub niemożnością chodzenia (1, 16).
Objawy przedstawione przez Denta występują dość rzadko, jednakże osteoporozę
idiopatyczną można zdiagnozować także mimo braku powyższych objawów. Istotne jest wczesne rozpoznanie idiopatycznej osteoporozy młodzieńczej ze względu na
profilaktykę złamań. Część pacjentów zdrowieje spontanicznie, natomiast u innych
powstałe deformacje kostne wymagają niekiedy interwencji chirurgicznej. Pozostałością po ciężkim przebiegu idiopatycznej osteoporozy młodzieńczej może być kifoskolioza, klatka kurza, szpotawa lub koślawa deformacja osi kończyn (16, 17).
Drugim typem osteoporozy pierwotnej, występującym najczęściej, jest osteoporoza
inwolucyjna. W tej grupie chorób można wyróżnić osteoporozę postmenopauzalną
(typ I) oraz starczą (typ II). Głównym czynnikiem prowadzącym do rozwoju osteoporozy typu I jest zmniejszenie stężenia estrogenów w organizmie, wynikające
z niedoczynności jajników, które nasila się po 50 roku życia. Ubytek masy kostnej
w ciągu roku wynosi wówczas 2–3% rocznie. Osteoporoza starcza dotyczy głównie
osób powyżej 75 lat i jest wynikiem upośledzenia wchłaniania wapnia z przewodu
pokarmowego, zmniejszenia poziomu witaminy D oraz ograniczeniem aktywności
fizycznej. Złamania, do których dochodzi w trakcie przebiegu choroby najczęściej
dotyczą trzonów kręgów i szyjki kości udowej (10).
Osteoporoza wtórna jest spowodowana innymi czynnikami niż proces starzenia.
Czynnikiem rozwoju osteoporozy jest zwiększona utrata masy kostnej, ale również
niedostateczna wartość szczytowej masy kostnej. W początkowym okresie choroby
dominuje ból, obniżenie siły mięśniowej, a następnie złamania i deformacje układu
kostnego. Ten typ osteoporozy może wystąpić w przebiegu każdej przewlekłej choroby, której czas trwania jest dłuższy niż 6 tygodni, chorób endokrynologicznych,
przewodu pokarmowego lub tkanki łącznej. Szczególnym problemem jest tak zwana osteoporoza jatrogenna występująca na skutek przewlekłego stosowania leków,
szczególnie glikokortykosteroidów oraz długoterminowe unieruchomienia z przyczyn chirurgicznych lub ortopedycznych (3, 18, 19, 20).
Osteoporoza wtórna stanowi ok. 80% przypadków. Dziatkowiak i Roztoczyńska na podstawie swoich badań donoszą, iż zaburzenia hormonalne są jedną z najczęstszych przyczyn wtórnej osteoporozy (21). Może ona być wywołana również
niedoborami żywieniowymi, a w szczególności niedoborami wapnia i witaminy
D. Braki wapnia mogą być spowodowane częściową lub całkowitą eliminacją produktów mlecznych z diety. Przyczyną takiego stanu może być nietolerancja laktozy lub alergia na białko mleka krowiego. Również choroby układu pokarmowego,
w szczególności przewlekłe, mogą przyczyniać się do rozwoju osteoporozy wtórnej.
Dochodzi wówczas do zaburzenia wchłaniania wapnia, fosforu, magnezu oraz witamin D i K. Ponadto, istnieje kilka czynników, które mogą dodatkowo wpływać
na rozwój osteoporozy. Należy do nich między innymi nieaktywny tryb życia oraz
unikanie nasłonecznienia, stosowanie leków, a przede wszystkim niewłaściwa dieta (14, 22). Najbardziej zaawansowaną osteoporozę wtórną stwierdzono u dzieci
chorujących na zespół Cushinga – najczęściej jatrogenny, w nadczynności przytarczyc oraz we wszystkich przypadkach nieleczonego hypogonadyzmu. Ponadto,
952
J. Przysławski, I. Górna
Nr 4
osteoporoza występowała również u dzieci z jadłowstrętem psychicznym (anorexia
nervosa) w szczególności u dziewcząt, rzadziej chłopców. W przypadku tej choroby,
oprócz drastycznego odchudzania, osoby te intensywnie ćwiczą, co bezwzględnie
niszczy ich kości. Równocześnie dochodzi do zaburzeń w miesiączkowaniu, a następnie utraty miesiączki. Niedobór estrogenów, nieodpowiednia podaż wapnia oraz
wycieńczający wysiłek fizyczny powodują szybko postępujące odwapnienie szkieletu. Najnowsze badania przeprowadzone przez Serafinowicz i współpr. dowodzą,
że istnieje korelacja między czasem trwania braku miesiączki a gęstością mineralną kości. Ubytek masy kostnej może być nawet nieodwracalny, w szczególności,
gdy brak miesiączki wystąpił przed 18 rokiem życia (23). Przyczyną osteoporozy
wtórnej u dzieci są również choroby przewlekłe tkanki łącznej, do których zaliczyć
można wrodzoną łamliwość kości (osteogenesis imperfecta) oraz młodzieńcze idiopatyczne zapalenie stawów (1).
Rola czynników żywieniowych w leczeniu i profilaktyce
Ze względu na fakt, iż większość przypadków osteoporozy u dzieci jest następstwem przewlekłych chorób, należy prowadzić leczenie kompleksowe, rozpoczynając od leczenia choroby podstawowej. Istotnym czynnikiem wspomagającym każdą
terapię lekową jest rehabilitacja ruchowa, w tym fizykoterapia, kinezyterapia i mechanoterapia. Zalecany jest umiarkowany wysiłek fizyczny, szczególnie ćwiczenia
obciążające szkielet, przy czym roTa b e l a I. Zalecana podaż wapnia i witaminy D (24)
dzaj ćwiczeń musi być ściśle ustaTa b l e I. Recommended supply of calcium and vitamin D
lony przez lekarza. Wskazany jest
Zalecana podaż wapnia w mg/dobę
np. aerobik, natomiast niewskazane są długodystansowe biegi.
Niemowlęta i dzieci:
• 0 – 6 m-cy
• 300 – 400
Równocześnie wprowadza się le• 7 – 12 m-cy
• 400
czenie dietetyczne. Najważniejsze
• 1 – 3 lat
• 500
jest zapewnienie odpowiedniej po• 4 – 6 lat
• 600
daży wapnia, z czego co najmniej
• 7 – 9 lat
• 700
60% powinno pochodzić z produkMłodzież 10 – 18 lat
• 1300
tów mlecznych oraz zachowanie
Kobiety:
odpowiedniej proporcji wapnia do
• 19 lat do menopauzy
• 1000
fosforu. Prawidłowe przyswajanie
• po menopauzie
• 1300
• w czasie ciąży (ostatni trymestr)
• 1200
wapnia wymaga obecności wita• w czasie karmienia piersią
• 1000
miny D. Dzienne dawki tej witaminy zależą od grup wiekowych.
Mężczyźni:
• 19 – 65 lat
• 1000
Zlecana podaż wapnia i witaminy
• 65 lat i więcej
• 1300
D w zależności od wieku została
Zalecane dawki witaminy D w μg/dobę
przedstawiona w tab. I (24).
Odpowiednia ilość witaminy D
Grupy wiekowe:
• 0–9
• 5
podawanej w trakcie leczenia po• 10 – 18
• 5
woduje zwiększone wchłanianie
• 19 – 50
• 5
wapnia, pobudza syntezę składni• 51 – 65
• 10
ków kości oraz zmniejsza wydzie• 65 i więcej
• 15
• kobiety w ciąży
• 5
lanie parathormonu (9). Istotnym
• kobiety w czasie karmienia piersią • 5
czynnikiem warunkującym pra-
Nr 4
Osteoporoza u dzieci i młodzieży
953
widłowe przemiany witaminy D jest regularne, aczkolwiek rozsądne przebywanie
na słońcu, dzięki któremu pokrywane jest 80–90% jej zapotrzebowania. Witamina
D produkowana jest w naszej skórze zwłaszcza latem. Ekspozycja na światło słoneczne 10–15 min. dziennie skutecznie podwyższa produkcję witaminy D. Jej nadmiar magazynowany jest w tkance tłuszczowej, skąd organizm czerpie ten składnik
w zimie (9). Ciągłe podawanie witaminy D w trakcie leczenia, szczególnie razem
z wapniem, wymaga nieustannej kontroli ze względu na wysokie ryzyko przedawkowania. W leczeniu dietetycznym należy również pamiętać o ograniczeniu spożycia soli i białka oraz dostarczeniu organizmowi odpowiednich dawek miedzi, manganu i cynku, które są składnikami enzymów biorących udział w syntezie macierzy
kostnej (1, 9, 25).
W każdym okresie życia dobrze zbilansowana dieta sprzyja mocnym i zdrowym
kościom. Zrównoważona dieta powinna zapewniać wystarczającą wartość energetyczną oraz dostarczać odpowiednią ilość białka, węglowodanów, tłuszczu, witamin i składników mineralnych, w szczególności witaminy D i wapnia. Produkty
mleczne są głównym źródłem wapnia w diecie. Jednocześnie cechuje je największa
biodostępność wapnia, czyli zdolność organizmu do jego wykorzystania. Z tego też
powodu istotnym zagadnieniem staje się nietolerancja laktozy i jej wpływ na rozwój
osteoporozy (26, 27).
Oprócz terminu „nietolerancja laktozy”, który nawiązuje do symptomów brzusznych (np. skurcze, wzdęcia) spowodowanych niemożnością trawienia laktozy, występuje termin „złe trawienie laktozy”, który niekoniecznie prowadzi do nietolerancji laktozy (28). Większość ludzi, którzy chorują na niestrawność laktozy może bez
większych problemów spożywać pewne ilości pożywienia zawierającego laktozę
bez objawów jej nietolerancji. Występowanie niestrawności i nietolerancji laktozy
zależy od grupy etnicznej i waha się w granicach 2–30% u osób rasy białej, 50–80%
wśród osób rasy latynoskiej, 60–80% u osób rasy czarnej i Żydów aszkenazyjskich
oraz prawie 100% osób pochodzenia azjatyckiego (tab. II) (29, 30).
Nie ulega wątpliwości, że ludzie, którzy unikają produktów mlecznych z powodu
nietolerancji laktozy mogą być narażeni na rozwój osteoporozy. Dzięki licznym badaniom podjęto próby stwierdzenia
Ta b e l a II. Występowanie nietolerancji laktozy w różnych grukorelacji pomiędzy złym trawiepach etnicznych (30)
niem laktozy, niedoborami wapnia
Ta b l e II. Frequency of lactose intolerance in different ethnic
a rozwojem osteoporozy, jednakże
groups
wyniki badań dotyczące tego probProcent
lemu nie są jednoznaczne (27).
Grupa etniczna
z nietolerancją
Na ich podstawie stwierdzono, iż
laktozy
gęstość mineralna kości u osób
Europejczycy – część północna
2 – 15
zdrowych nie różniła się znacząco
Amerykanie
6 – 22
od pacjentów z łagodnym i ostrym
Europejczycy – część centralna
9 – 23
przebiegiem nietolerancji laktozy.
Żydzi aszkenazyjscy
60 – 800
Jednakże biorąc pod uwagę liczbę złamań kręgów wykazano, iż
Afroamerykanie
60 – 800
więcej wystąpiło ich w przypadku
Rdzenni amerykanie (Indianie)
80 – 100
osób z nietolerancją laktozy w poAzjaci
95 – 100
równaniu z grupą kontrolną oraz
954
J. Przysławski, I. Górna
Nr 4
z osobami cierpiącymi na nietolerancję laktozy o łagodnym przebiegu. Jackson i Savaiano w swojej pracy odnotowali, iż większość z przeprowadzonych badań sugeruje, że nietolerancja laktozy jest potencjalnym czynnikiem ryzyka utraty gęstości
mineralnej kości i osteoporozy, spowodowanym unikaniem przetworów mlecznych
i w ten sposób mniejszej podaży wapnia (26). Nietolerancja laktozy niekoniecznie
wyklucza wszystkie wyroby mleczne z diety; na przykład dojrzewające sery mogą
zawierać aż 95% mniej laktozy niż pełne mleko (28). Jogurty zawierające żywe kultury bakterii również zmniejszają objawy jelitowe, ponieważ obecne w nich kultury
bakterii produkują enzym – laktazę, który odpowiada za rozkład laktozy na prostsze
cukry wchłaniane przez organizm. Innym rozwiązaniem jest spożywanie tabletek lub
kropli laktazy wraz z produktami mlecznymi. Osoby z nietolerancją laktozy powinny
zwracać szczególna uwagę na odżywianie się w taki sposób, aby zapewnić sobie
wystarczającą podaż wapnia, co wiąże się ze zmniejszeniem ryzyka wystąpienia osteoporozy (29).
Oprócz produktów mlecznych, które zapewniają organizmowi odpowiednie ilości
wapnia i witaminy D, niezbędne jest również spożywanie zielonych warzyw liściastych, chudego czerwonego mięsa, drobiu, kasz oraz nasion roślin strączkowych.
Zawarte w nich składniki mineralne i witaminy, między innymi witamina K oraz
cynk, są niezbędne dla prawidłowego rozwoju kości. Cynk należy do kofaktorów
enzymów biorących udział w syntezie różnych składników macierzy kostnej, dodatkowo wspomaga odnowę tkanki kostnej i mineralizację kości (9). Równie istotna
jest rola witamin K i A, które wraz z witaminą D warunkują prawidłową syntezę osteokalcyny (białka niekolagenowego kości produkowanego przez osteoblasty) oraz
witaminy C, która jest niezbędna do produkcji kolagenu (25).
Należy podkreślić, że prawidłowe żywienie to również unikanie lub ograniczenie do minimum negatywnych przejawów tzw. „stylu życia”. Do najważniejszych,
istotnie wpływających na rozwój kości, zaliczyć można palenie papierosów, picie
alkoholu, kawy i napojów gazowanych. Panuje stwierdzenie, że osoby palące należą
do grupy wysokiego ryzyka osób zagrożonych osteoporozą. Zanotowano dodatnią
korelację między paleniem tytoniu a częstością złamań kręgów, kości przedramienia i biodra. Dokładny mechanizm tej zależności nie został poznany, przypuszcza
się jednak, że palenie może bezpośrednio hamować czynność osteoblastów (9).
W przypadku nadmiernego spożywania alkoholu zwykle występuje obniżenie poziomu wapnia w surowicy, co w konsekwencji prowadzi do zaburzenia czynności
osteoblastów. W przypadku kofeiny przeprowadzone badania wskazują na zwiększone ryzyko złamań kości u osób wypijających 2 filiżanki kawy bądź 4 herbaty
dziennie. Wykazano również, iż nadmierne spożycie kofeiny powoduje zmniejszenie masy kostnej, szczególnie u kobiet, u których dzienne spożycie wapnia jest niższe od zalecanego (9).
Profilaktyka osteoporozy zależy od etapu życia. Za rozwój szkieletu płodu odpowiedzialna jest matka, dlatego też istotny wpływ ma podaż wapnia i witaminy
D u matki w okresie ciąży. Dla dzieci koniecznym środkiem zapobiegawczym jest
przede wszystkim racjonalny tryb życia, stosowanie prawidłowej diety, z odpowiednią podażą wapnia, witaminy D i białka, zwiększenie aktywności fizycznej oraz unikanie używek (kawa, papierosy). Oprócz odpowiedniej zawartości składników mineralnych dieta powinna być odpowiednio zbilansowana energetycznie. Wszystkie
Nr 4
Osteoporoza u dzieci i młodzieży
955
te czynniki wpływają na prawidłową wartość wskaźnika masy ciała – BMI (Body
Mass Indeks). Zbyt niska wartość BMI jest czynnikiem, który w istotny sposób
wpływa na rozwój osteoporozy. W okresie przyspieszonego wzrostu oraz w przypadku chorób, które wpływają na wchłanianie wapnia, można stosować suplementację preparatami witaminowymi dostępnymi w aptekach.
U dzieci chorych na przewlekłe choroby należy szczególną uwagę zwrócić na
każdy czynnik wpływający negatywnie na ich kości. Głównym celem profilaktyki
jest uświadomienie, iż wystąpienie złamań osteoporotycznych poprzedza niekiedy
długi okres bezobjawowy. Z tego też względu najistotniejszą sprawą jest opracowanie i propagowanie zaleceń żywieniowych dla odpowiednich grup wiekowych.
Nieodłącznym elementem zapobiegania osteoporozie staje się więc edukacja żywieniowa będąca częścią jej profilaktyki.
J. P r z y s ł a w s k i, I. G ó r n a
OSTEOPOROSIS IN CHILDREN AND JUVENILES
PIŚMIENNICTWO
1. Saganowska R., Lalik B.: Osteoporoza u dzieci i młodzieży. Przegl. Pediatr., 2006; 36(2): 143-150.
– 2. Sewerynek E.: Wpływ współpracy lekarza z pacjentem na efektywność leczenia osteoporozy. Terapia,
2006; 3 (177): 43-46. – 3. Iwańczak B., Krzesiek E., Iwańczak F.: Osteoporoza i osteopenia u dzieci i młodzieży – przyczyny, diagnostyka i leczenie. Adv. Clin. Exp. Med., 2004; 13(1): 177-184. – 4. Lorenc R.S.,
Olszaniecka M.: Osteoporoza u dzieci. Prz. Lek., 2000; 57(2): 127-130. – 5. Giampiero I.B., Bertelloni
S., Sodini F., Saggese G.: Osteoporosis in children and adolescents: etiology and management. Pediatr.
Drugs, 2005; 7(5): 295-323. – 6. Schönau E.: Problems of bone analysis in childhood and adolescencje.
Pediatr. Nephrol., 1998; 12: 420-429. – 7. Leonard M.B., Zemel B.S.: Assessement of bone mineralization
in children and adolescents. Clinic. Rev. Bone Miner. Metab., 2004; 2(1): 3-18. – 8. Wajszczyk B., Charzewska J., Chabros E., Rogalska-Niedźwiedź M., Chwojnowska Z.: Zawartość wybranych składników
mineralnych w dietach dziewcząt w wieku pokwitania a gęstość mineralna kości. Żyw. Człow. Metab.,
2005; 32 (supl.): 122-128. – 9. Szponar L., Respondek W.: Żywienie w osteoporozie. Terapia, 1997; 10:
28-31. – 10. Gertig H., Gawęcki J.: Żywienie człowieka. Słownik terminologiczny. Wydawnictwo Naukowe, PWN, Warszawa 2007.
11. Górski R., Chmielewski D., Zgoda M.: Ocena społecznej świadomości zagrożenia osteoporozą
na podstawie ankiety celowanej. Ortop. Traum. Rehab., 2006; 6(6): 627-632. – 12. Report of a WHO
Scientific Group: Prevention and management of osteoporosis. WHO Technical Report Series 921, Genewa 2003. – 13. Kanis J.A., Borgstrom F., De Laet C., Johansson H., Johnell O., JOnsson B., Oden A.,
Zethraeus N., Pfleger B., Khaltaev N.: Assessment of fracture risk, Osteoporos. Int., 2005; 16: 581-589.
– 14. Rell-Bakalarska M.: Osteoporoza wtórna. Terapia 2006; 3(177): 47-51. – 15. Melchior R., Zabel B.,
Spranger J., Schumacher R.: Effective parenteral clodronate treatment of a child with serve juvenile idiopathic osteoporosis. Eur. J. Pediatr., 2005; 164: 22-27. – 16. Lorenc R.S.: Idiopathic juvenile osteoporosis.
Calcif Tissue Int., 2002; 70: 395-397. – 17. Płudowski P., Lebiedowski M., Olszaniecka M., Marowska J.,
Matusik H., Lorenc R.S.: Idiopathic juvenile osteoporosis – an analysis of the muscle – bone relationship.
Osteoporos. Int., 2006; 17: 1681-1690. – 18. Chlebna-Sokół D.: Osteoporoza u dzieci. Kwart. Ortop.,
1993; 1: 21-24. – 19. Chlebna-Sokół D.: Osteoporoza w wieku rozwojowym – wybrane zagadnienia. Prz.
Lek., 1997; 54(4): 276-278. – 20. Chlebna-Sokół D.: Osteoporoza w wieku rozwojowym – problemy
diagnostyczne i terapeutyczne. Pol. Merkuriusz Lek., 1998; 5(28): 229-232.
21. Dziatkowiak H., Roztoczyńska D.: Osteoporoza wtórna u dzieci ze szczególnym uwzględnieniem
endokrynopatii, Post. Nauk Med., 2000; 13 (2): 31-37. – 22. Nieszporek T., Więcek A.: Osteoporozy wtórne, Med. po Dyplomie, 2004; wydanie specjalne: 37-41. – 23. Serafinowicz E., Wąsikowa R., Iwanicka Z.,
Jędrzejuk D.: Bone metabolizm in adolescent girls with short course of anorexia nervosa. Endokryn. Dia-
956
J. Przysławski, I. Górna
Nr 4
bet. Chor. Przem. Mat. Wieku Rozoj., 2003; 9(2): 67-71. – 24. FAO/WHO, Human Witamin nad Mineral
Requirements. 2002. – 25. Cichy W., Rosińska A.: Żywienie a osteoporoza u dzieci: przykład na integrację
medycyny. Terapia, 2005; 2(162): 12-15. – 26. Jackson Jackson.A., Savaiano D.A.: Lactose maldigestion,
calcium intake and osteoporosis in African-, Asian-, and Hispanic- Americans. J. Am. Coll. Nutr., 2001;
20(2): 198-207. – 27. Kudlacek S., Freudenthaler O., Weissböeck H., Schneider B., Willvonseder R.:
Lactose intolerance: a risk factor for reduced bone mineral density and vertebral fractures. J. Gastroenterol., 2002; 37: 1014-1019. – 28. National Institutes of Health Osteoporosis and Related Bone Diseases
– National Resource Center: What people with lactose intolerance need to know about osteoporosis. 2006.
– 29. Wąsowska-Królikowska K.: Nietolerancja laktozy u niemowląt, dzieci i młodzieży. Aktualne (2006)
stanowisko Amerykańskiej Akademii Pediatrii. Med. Prakt. Pediatr., 2007; 1: 43-50. – 30. Swagerty D.Z.,
Walling A.D., Klein R.M.: Lactose intolerance. Am. Fam. Physic., 2002; 65(9): 1845-1850.
Adres: 60-354 Poznań, ul. Marcelińska 42












