Zakład Biotechnologii i Inżynierii Genetycznej SUM, 201/17
Wykorzystanie biotransformacji sorbitolu przez bakterie Gluconobacter oxydans ssp.
suboxydans w procesie produkcji witaminy C
Przeprowadzane przez mikroorganizmy reakcje biotransformacji (biokonwersji) mają
bardzo duże znaczenie w biotechnologii. Reakcje biotransformacji zarówno naturalnych
substratów, jak i ksenobiotyków charakteryzują się wysoką regio- oraz stereoselektywnością. Na
skalę przemysłową wykorzystuje się między innymi produkty biotransformacji węglowodorów,
cukrów, aminokwasów, antybiotyków, terpenów, alkaloidów, prostaglandyn, steroidów.
Szczególnie cenione są procesy biotransformacji wykorzystywane do otrzymywania związków
czynnych optycznie, gdzie możliwe jest otrzymanie produktów będących czystymi
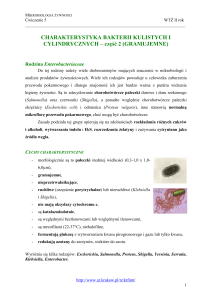
enancjomerami. Bakterie należące do rodziny Acetobacteriaceae nazywane są bakteriami
octowymi. Do rodziny tej zaliczane są dwa rodzaje: Acetobacter sp. i Gluconobacter sp.:
- bakterie Gram-ujemne lub Gram-zmienne
- bezwzględnie tlenowe
- kształt pałeczkowaty
- występują pojedynczo lub po dwie, a rzadziej w postaci krótkich łaocuszków
- mogą byd urzęsione lub nieurzęsione. Bakterie z rodzaju Acetobacter wykazują urzęsienie
peritrichalne, natomiast Gluconobacter – biegunowe.
Charakterystyczną cechą w hodowli jest występowanie form inwolucyjnych o
pogrubionych lub wydłużonych kształtach. Rodzaj Acetobacter wykazuje zdolnośd wzrostu na
podłożach zawierających azot w postaci mineralnej (sole amonowe), w przeciwieostwie do
Gluconobacter, który wymaga dodatku organicznego źródła azotu (najczęściej wyciągu
drożdżowego). Oba rodzaje bakterii octowych mają zdolnośd do utleniania etanolu do kwasu
octowego, jednak tylko Acetobacter może dalej utleniad kwas octowy do dwutlenku węgla i
wody, ponieważ posiada komplet enzymów cyklu Krebsa (podobnie może przekształcad kwas
mlekowy). Bakterie Gluconobacter sp. nie potrafią natomiast utleniad kwasu octowego i
mlekowego do CO2 i H2O z uwagi na brak enzymów cyklu Krebsa. Charakteryzują się za to wysoką
aktywnością ketogenną – utleniają glukozę do kwasu glukonowego i dalszych ketopochodnych.
Posiadają także zdolnośd utleniania alkoholi polihydroksylowych np. glicerolu do
dihydroksyacetonu lub sorbitolu do sorbozy.
Bakterie octowe pełnią ważną rolę w przemyśle farmaceutycznym oraz chemicznym. Są
wykorzystywane do produkcji kwasu octowego metodą biotechnologiczną (rodzaj Acetobacter
sp.). Do celów chemicznych kwas octowy otrzymywany jest w procesie suchej destylacji drewna
lub w wyniku pełnej syntezy chemicznej. Ocet konsumpcyjny nie może natomiast zawierad
syntetycznego kwasu octowego, lecz kwas uzyskany na drodze biotransformacji z surowców
pochodzenia naturalnego. Surowcem wyjściowym jest etanol zawarty w surówkach
gorzelniczych lub rektyfikacie (ocet spirytusowy) oraz etanol występujący w winach białych lub
czerwonych (tzw. ocet winny). Jako gotowy produkt („ocet spożywczy”) wykorzystuje się podłoże
pofermentacyjne, a nie oczyszczony kwas octowy. Bakterie octowe wykorzystywane są także do
utleniania cukrów prostych do kwasów jednokarboksylowych (-onowych) oraz do otrzymywania
produktów dalszego ich utleniania, czyli ketokwasów (kwas 5-ketoglukonowy, kwas 2ketoglukonowy, kwas 2,5-diketoglukonowy).
Praktyczne znaczenie ma otrzymywanie kwasu glukonowego z wykorzystaniem bakterii
Gluconobacter sp. oraz δ-laktonu kwasu glukonowego (zastosowanie w piekarnictwie). Kwas
glukonowy jest wykorzystywany w przemyśle spożywczym, a glukoniany stosowane są w
1
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 201/17
przemyśle farmaceutycznym do otrzymywania preparatów zawierających łatwo przyswajalne
źródło jonów wapnia lub żelaza. Glukonian sodu stosowany jest ponadto w produkcji płynów
myjących i proszków do prania oraz w budownictwie jako dodatek do zapraw betonowych.
Gluconobacter suboxydans (dawny syn. Acetobacter oxidans) jest wykorzystywany do
otrzymywania witaminy C mieszaną metodą chemiczno-mikrobiologiczną (synteza Reichsteina).
Bakterie te przeprowadzają biokonwersję sorbitolu do sorbozy, która jest dalej przekształcana na
drodze chemicznej do witaminy C (kwasu askorbowego). Substratem wyjściowym jest D-glukoza
(dekstroza).
Cel dwiczenia: Charakterystyka zdolności bakterii G. oxydans do biotransformacji sorbitolu.
Materiał: hodowla Gluconobacter oxydans (PCM 2091)
Odczynniki i podłoża:
Podłoże do hodowli Gluconobacter oxydans:
trypton
ekstrakt drożdżowy
glukoza
K2HPO4
CaCO3
agar
woda
10,0 g
5,0 g
20,0 g
1,0 g
1,0 g
20,0 g
do 1000 ml
Podłoże półsyntetyczne dla G. suboxydans z dodatkiem 10% sorbitolu
wyciąg drożdżowy
sorbitol
(NH4)2HPO4
KH2PO4
MgSO4 x 7 H2O
woda
5,0 g
100,0 g
2,0 g
1,0 g
0,25 g
do 1000 ml, pH 4,8-5,0
Odczynnika Luffa-Schoorla (syn. roztwór cytrynianu miedzi II alkaliczny)
Skład (proporcje na 1000 ml):
roztwór siarczanu miedziowego: rozpuścid 25 g CuSO4 x 5H2O w 100 ml wody
roztwór węglanu sodu: rozpuścid 143,8 g czystego, bezwodnego Na2CO3 w ok. 300 ml
ciepłej wody
roztwór kwasu cytrynowego: rozpuścid 50 g czystego kwasu cytrynowego w 50 ml
wody
Starannie mieszając, wlad roztwór kwasu cytrynowego do roztworu węglanu sodowego.
Dolad roztworu siarczanu miedziowego i uzupełnid wodą do 1000 ml. Odstawid roztwór na
2
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 201/17
noc do odstania się i przefiltrowad. Wartośd pH roztworu powinna wynosid w przybliżeniu
9,4.
A. Badanie morfologii bakterii octowych:
Sporządzid preparat mikroskopowy z hodowli płynnej Gluconobacter oxydans, utrwalid w
płomieniu i wybarwid fioletem goryczkowym. Obserwowad pod immersją. Wykonad rysunek:
B. Oznaczanie zawartości sorbozy w podłożu hodowlanym G. oxydans metodą
redukcyjną wg Luffa-Shoorla:
Zasada metody: Metoda opiera się na redukcji jonów Cu2+ zawartych w płynie Luffa przez
cukry redukujące obecne w badanym roztworze. W analizowanej hodowli bakteryjnej
właściwości redukujące posiada wyłącznie produkt biotransformacji, czyli D-sorboza,
natomiast substrat – D-sorbitol – ich nie wykazuje.
W środowisku alkalicznym D-sorboza redukuje CuSO4 do Cu2O. Dodanie, w kolejnym
etapie, do roztworu jodku potasu i kwasu siarkowego (VI) powoduje wydzielenie
jodowodoru, który ulega reakcji z niezredukowanym przez sacharydy CuSO4 i tworzy jodek
miedzi (I). Nadmiar jodu (z dodatku KI) odmiareczkowuje się tiosiarczanem(VI) sodu.
2 CuSO4 + 4 KI → 2 K2SO4 + Cu2I2 + I2
I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6
Oznaczenie wykonuje się dla również próby ślepej (pozbawionej cukrów
redukujących), aby ustalid zużycie tiosiarczanu sodu na zmiareczkowanie jodu wydzielonego
przez całkowitą ilośd miedzi zawartej w płynie Luffa (w próbie ślepej nie nastąpiła redukcja
jonów miedzi). Ilośd wytworzonego produktu bioprocesu (D-sorbozy) ocenia się na
podstawie różnicy w objętości uzyskanych z dwóch miareczkowao (próby ślepej i właściwej),
a następnie z krzywej wzorcowej (ryc. 8) odczytuje się zawartośd sacharydów redukujących
w analizowanej próbce.
Materiał: 4-dniowa hodowla wytrząsana Gluconobacter oxydans (PCM 2091) na podłożu
półsyntetycznym z dodatkiem 10% sorbitolu (temp. 30°C).
Wykonanie:
1. Odmierzyd 20 ml hodowli, przenieśd do litrowej kolby miarowej, uzupełnid wodą do
kreski. Dokładnie wymieszad.
2. Pobrad 25 ml do kolby, dodad 25 ml odczynnika Luffa-Schoorla, doprowadzid do wrzenia i
gotowad przez 10 min.
3. Po ostudzeniu ostrożnie dodad 25 ml 25% H2SO4 – wydzielający się dwutlenek węgla
może spowodowad wyciek mieszaniny z kolby!
3
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 201/17
4. Dodad 2 g jodku potasu i miareczkowad 0,1 M roztworem tiosiarczanu sodu wobec skrobi
(1% roztwór, 1 ml). Koocowym punktem miareczkowania jest uzyskanie przez roztwór
mlecznobiałej barwy.
5. Wyniki odnieśd do próby ślepej, którą stanowi czysta woda (25 ml) – z próbą ślepą
postępowad analogicznie jak z badaną (punkty 2-4).
6. Obliczyd różnicę (R) (w mililitrach) pomiędzy ilością titranta zużytą do zmiareczkowania
próby ślepej, a ilością zużytą do zmiareczkowania próby badanej.
7. Określid teoretyczną i praktyczną wydajnośd biotransformacji sorbitolu.
Wyniki:
objętośd titranta *ml+
próba ślepa
próba badana
średnia
średnia
1.
2.
3.
różnica *ml+
zawartośd sorbozy w
badanej hodowli [mg]
Wydajnośd teoretyczna i praktyczna bioprocesu:
Wnioski:
………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………..…
4