Wstęp teoretyczny do ćwiczenia 9
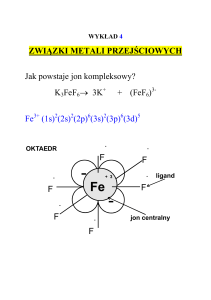
CHARAKTERYSTYCZNE REAKCJE ZWIĄZKÓW KOMPLEKSOWYCH
Tworzenie kompleksu polega na zastępowaniu jednego ligandu przez drugi ligand, o
większej zdolności kompleksotwórczej w stosunku do danego atomu centralnego.
Metale takie jak miedź czy wapń w roztworze wodnym znajdują się w postaci
akwakompleksów czyli hydratów: Cu(H2 O)4 2+, Ca(H2 O)6 2+ a nie w postaci wolnych jonów.
Cząsteczki wody w sferze koordynacyjnej metalu są zastępowane odpowiednimi ligandami.
Przykład – tworzenie się kompleksu aminaniklu(II) przez stopniową eliminację
cząsteczek wody z akwakompleksu
1. [Cu(H2 O)4 ]2 + + NH3
[Cu(H2 O)3 NH3 ]2 + + H2 O
2. [Cu(H2 O)3 NH3 ]2 + + NH3
[Cu(H2 O)2 (NH3 )2 ]2 + + H2 O
3. [Cu(H2 O)2 (NH3 )2 ]2 + + NH3
[Cu(H2 O)(NH3 )3 ]2 + + H2
4. [Cu(H2 O)(NH3 )3 ]2 + + NH3
[Cu(NH3 )4 ]2 + + H2 O
Związki kompleksowe ulegają:
a) reakcji podstawienia, w której nie zmienia się liczba koordynacyjna metalu.
[Co(NH3 )5 CO 3 ]+ + 2HF
[Co(NH3 )5 F]2 + + F- + CO 2 + H2 O
b) reakcji związanej ze zmianą stopnia utlenienia, np. substytucji utleniającej
2[Co(H2 O)6 ]Cl2 + 2NH4 Cl + 10NH3 + H2 O2
2[Co(NH3 )6 ]Cl3 + 14 H2 O
c) reakcji przyłączania, w której wzrasta liczba koordynacyjna metalu.
Zn(CN)2 + 2CN [Zn(CN)4 ]2Przy tworzeniu nazwy związku kompleksowego należy kierować się regułami
ustalonymi przez IUPAC (Międzynarodowa Unia Chemii Czystej i Stosowanej):
- nazwę kompleksu tworzy się dodając do nazwy jonu centralnego przedrostki określające
ilość i rodzaj ligandu
-w nazwie jonu kompleksowego wymienia się najpierw ligandy, a na końcu atom centralny
- stopień utlenienia atomu centralnego zaznacza się cyfrą rzymską w nawiasie na końcu
nazwy,
np. siarczan tetraaminamiedzi(II)
[Cu(NH3 )4 ]SO 4
- kompleksy o ładunku ujemnym (aniony kompleksowe) mają do nazwy anionu centralnego
dodaną końcówkę –an
np. tetrachloromiedzian(II) potasu
K2 [CuCl4 ]
- w kompleksach kationowych i zawierających obojętne cząstki podajemy nie zmienioną
nazwę pierwiastka
np. chlorek tetraakwadichlorochromu(III)
[Cr(H2 O)4 Cl2 ]Cl
- do najczęściej stosowanych ligandów należą:
- amina -NH3 ,
- hydrokso OH- akwa H2 O
- karbonyl CO
- bromo Br
- okso O 2- chloro Cl
- tio S2- cyjaniano CNO
- tiocyjaniano CNS- cyjano CN - tiosiarczano S2 O 3 2- fluoro F
- liczbę ligandów przedstawia się za pomocą przedrostków:
- dla ligandów prostych: mono, di, tri, tetra, penta, heksa
np. chlorek tetraaminakadmu(II)
[Cd(NH3 )4 ]Cl2
- dla ligandów złożonych: bis, tris, tetrakis, pentakis
np. tris(tetraoksosiarczan) bis(heksaaminakobaltu) [Co(NH3 )6 ]2 (SO 4 )3
- nazwy ligandów anionowych mają końcówkę -o,
np. cyjano - heksacyjanożelazian(III) potasu K 3 [Fe(CN)6 ]
- rodniki węglowodorowe mają ogólnie przyjęte skróty Me- metyl, Et – etyl, Ph – fenyl,
En- etylenodiamina
np. tetrafenyloboran(III) potasu
K[B(Ph)4 ]
- przedrostki w nawiasie są stosowane, jeśli nazwa ligandu zawiera już jeden z przedrostków
np. bromek tri(etylenodiamino)platyny(IV)
[Pt(En)3 ]Br4
- kolejność ligandów jest zgodna z kolejnością alfabetyczną bez uwzględnienia przedrostków
określających liczbę ligandów każdego typu występujących w sferze koordynacyjnej.
- w nawiasie, na końcu nazwy zamiast stopnia utlenienia (podawanego cyframi rzymskimi)
można umieścić znak ładunku całego jonu oraz ładunek (podawany cyframi arabskimi)
np.: K3 [Co(CN)6 ]
heksacyjanokobaltan(III)potasu,
heksacyjanokobaltan(3+) potasu,
heksacyjanokobaltan tripotasu,
Sfera
zwenetrzna
,
wewnetrzna
,
K3
potasu
[ Fe (CN)6 ]
heksa
liczba ligandów
.
zelazian(III) cyjano
ligandy
jon centralny
.
heksacyjanozelazian(III) potasu
Przykładowe wzory i nazwy związków i jonów kompleksowych:
[Co(H2 O)6 ](NO 3 )2
[Co(CO 3 )(NH3 )4 ]NO 3
[CoCl(NH3 )4 (H2 O)]2+
[CoCl(NH3 )5 ]Cl2
K3 [Fe(SCN)6 ]
[Fe(edta)]–
[Cr(OH)(H2 O)5 ]2+
[CrCl2 (H2 O)4 ]Cl
[Cu(NH3 )4 ]SO 4
[Cd(en)2 ]Cl2
Na3 [Cu(CN)4 ]
Na3 [Ag(S2 O 3 )2 ]
[Cu(H2 O)6 ]SO 3
K4 [NiF6 ]
[Cu(NH3 )4 ]SO 4
azotan(V) heksaakwakobaltu(II)
azotan(V) tetraakwawęglanokobaltu(III)
kation akwatetraaminachlorokobaltu(III)
chlorek pentaaminachlorokobaltu(III)
heksatiocyjanianożelazian(III)potasu
anion etylenodiaminatetraoctanożelazianowy(III)
kation pentaakwahydroksochromu(III)
chlorek tetraakwadichlorochromu(III)
siarczan(VI) tetraaminamiedzi(II)
chlorek bis1,2-diaminoetanokadmu(II)
tetracyjanomiedzian(I)sodu,
tiosiarczanosrebrzan(I)sodu,
siarczan(IV)heksaakwamiedzi(II),
heksafluoroniklan(II)sodu,
siarczan(VI) tetraaminamiedzi(II)