.II.Mechanika kwantowa.doc
(96 KB) Pobierz
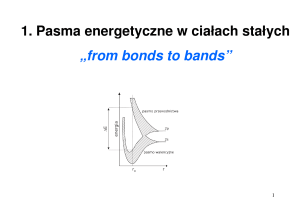
2. Elektronowa struktura atomu
= h/mv
Według hipotezy de Broglie`a (1924), elektron można rozpatrywać zarówno jako cząstkę materii, ale
również jako falę powstającą w wyniku poruszania się tej cząstki. Z ruchem elektronu w obrębie
atomu związana jest fala o długości zależnej od jego pędu m:
przy czym:
h – stała Plancka
m – masa elektronu
elektronu
v – prędkość poruszania się
Falowa natura cząstek leży u podstaw mechaniki kwantowej, która poprawnie i ilościowo opisuje
zachowanie cząstek elementarnych w atomach.
Zasada nieoznaczności Heisenberga: Nie jest też możliwe jednoczesne dokładne wyznaczenie położenia i pędu
elektronu, czyli równoczesne podanie po jakim torze porusza się on w atomie i gdzie znajduje się w danym
momencie
Można rozpatrywać tylko prawdopodobieństwo znalezienia elektronu w określonym czasie w
dowolnie wybranym punkcie przestrzeni wokół jądra
Zachowanie się elektronu w obrębie atomu można opisywać za pomocą fali, której
amplituda jest ciągłą funkcją współrzędnych przestrzennych x, y, z. Funkcję falową i energię
elektronu (cząstki) wiąże podstawowe równanie mechaniki kwantowej, zwane równaniem
Schrödingera;
dla układu jedno elektronowego równanie to ma uproszczoną
postać:
Równanie
gdzie: - funkcja falowa
m – masa elektronu poruszającego się w polu o potencjale V
h – stała Plancka
E – energia całkowita elektronu
Równanie to jest równaniem różniczkowym – jego rozwiązaniem są nie liczby tylko funkcje.
Rozwiązania te, zwane funkcjami własnymi, wyrażają stan fizyczny układu jedynie dla
pewnych wartości E, nazywanych wartościami własnymi. Oznacza to, że elektrony w
atomie nie mogą przyjmować dowolnej energii, czyli ich energia jest kwantowana.
Funkcje własne (x,y,z) , będące rozwiązaniami równania Schrödingera, są nazywane orbitalami
atomowymi i określają najbardziej prawdopodobne wartości energii elektronu w atomie, a
kwadrat ich modułu (x,y,z) podaje gęstość prawdopodobieństwa znalezienia elektronu w
określonym miejscu przestrzeni wokół jądra atomu.
2
Geometryczne kształty orbitali wskazują na przestrzenny rozkład prawdopodobieństwa
znalezienia elektronu opisanego danym orbitalem.
Kontur orbitalu, tzw. „chmura” elektronowa ogranicza przestrzeń, w której
prawdopodobieństwo znalezienia elektronu jest największe;
„Chmura” elektronowa nie ma wyraźnej granicy zewnętrznej, jednak im dalej od jądra, tym
mniejsze jest prawdopodobieństwo znalezienia elektronu.
Każdy stan kwantowy elektronu w atomie opisuje się za pomocą czterech liczb kwantowych:
n – główna liczba kwantowa, określająca energię elektronu w atomie; przyjmuje wartości liczb
naturalnych: n = 1, 2, 3, 4, 5, 6, 7.
Elektrony o takiej samej wartości głównej liczby kwantowej w atomie tworzą tę sama powłokę
elektronową atomu; powłoki oznacza się kolejno: K, L, M, N, O, P, Q.
l - poboczna liczba kwantowa, charakteryzuje symetrię orbitali (podpowłok) elektronowych, rozróżnia
stany energetyczne elektronów w tej samej powłoce; przyjmuje wartości liczb całkowitych: 0 l (n –1),
tzn., że:
główna liczba
kwantowa (n)
powłoka
orbitalna liczba
kwantowa (l)
podpowłoka
(orbital)
n=1
K
l=0
s
n=2
L
l=0
l=1
s
p
n=3
l=0
l=1
l=2
M
s
p
d
m - magnetyczna liczba kwantowa – określa liczbę poziomów orbitalnych związaną z ułożeniem
się orbitali w przestrzeni pod wpływem zewnętrznego pola magnetycznego; przyjmuje wartości liczb
całkowitych: - l m l
m – spinowa liczba kwantowa – związana z momentem pędu elektronu obracającego się wokół
własnej osi; przyjmuje tylko dwie wartości: + ½ i - ½
s
Zakaz Pauliego: w atomie nie mogą istnieć 2 elektrony o identycznym stanie kwantowym, tzn. o tych samych
wartościach czterech przypisanych im liczb kwantowych n, l, m i m . Muszą różnić się przynajmniej jedną z
nich
s
2n
2
Maksymalna liczba elektronów, które mogą zajmować daną powłokę:
Liczba kwantowa
Typ
orbitalu
n – główna l –
poboczna
Liczba kwantowa
Maksymalna liczba
elektronów
m–
magnetyczna
m –
spinowa
w
podpowłoce
(na orbitalu)
w powłoce
s
1
0
S
0
+½-½
2
2
2
0
S
0
+½-½
2
8
1
p
-1, 0 +1
+½-½
6
0
s
0
+½-½
2
1
p
-1, 0 +1
+½-½
6
2
d
-2, -1,0,+1,+2
+½-½
10
0
s
1
p
2
d
3
...
3
4
Plik z chomika:
sylvtronix
Inne pliki z tego folderu:
18
.I.Atom.doc (76 KB)
.II.Mechanika kwantowa.doc (96 KB)
.III.Uklad okresowy pierwiastkow.doc (72 KB)
Adsorpcja jonowymienna.doc (305 KB)
adsorpcja-tabela i histereza.doc (887 KB)
Inne foldery tego chomika:
Pytania do egzaminu
Wyklady
Wykłady-prezentacje
Wykłady-skany
Zgłoś jeśli naruszono regulamin
Strona główna
Aktualności
Kontakt
Dla Mediów
Dział Pomocy
Opinie
Program partnerski
Regulamin serwisu
Polityka prywatności
Ochrona praw autorskich
Platforma wydawców
Copyright © 2012 Chomikuj.pl