PODZIAŁ PROCESÓW SPALANIA
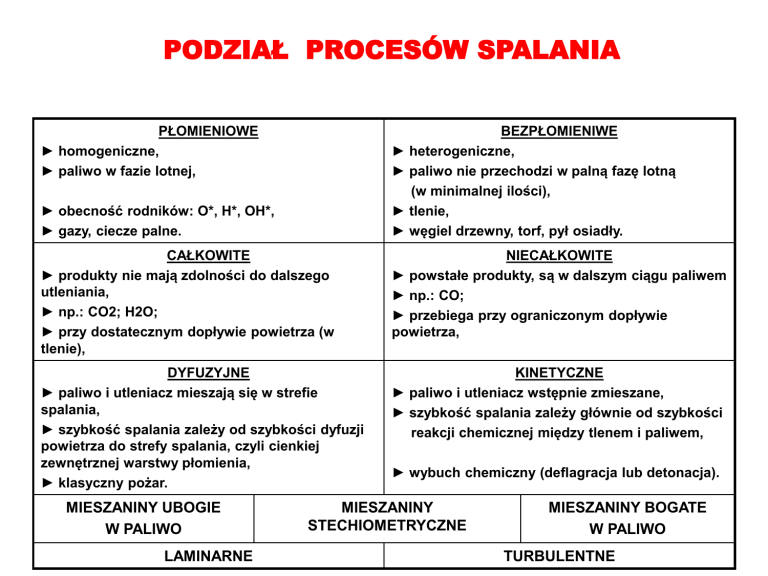
PŁOMIENIOWE
► homogeniczne,
► paliwo w fazie lotnej,
BEZPŁOMIENIWE
► heterogeniczne,
► paliwo nie przechodzi w palną fazę lotną
(w minimalnej ilości),
► tlenie,
► węgiel drzewny, torf, pył osiadły.
► obecność rodników: O*, H*, OH*,
► gazy, ciecze palne.
CAŁKOWITE
► produkty nie mają zdolności do dalszego
utleniania,
► np.: CO2; H2O;
► przy dostatecznym dopływie powietrza (w
tlenie),
NIECAŁKOWITE
► powstałe produkty, są w dalszym ciągu paliwem
► np.: CO;
► przebiega przy ograniczonym dopływie
powietrza,
DYFUZYJNE
► paliwo i utleniacz mieszają się w strefie
spalania,
► szybkość spalania zależy od szybkości dyfuzji
powietrza do strefy spalania, czyli cienkiej
zewnętrznej warstwy płomienia,
► klasyczny pożar.
KINETYCZNE
► paliwo i utleniacz wstępnie zmieszane,
► szybkość spalania zależy głównie od szybkości
reakcji chemicznej między tlenem i paliwem,
MIESZANINY UBOGIE
W PALIWO
LAMINARNE
► wybuch chemiczny (deflagracja lub detonacja).
MIESZANINY
STECHIOMETRYCZNE
MIESZANINY BOGATE
W PALIWO
TURBULENTNE
PŁOMIEŃ
Płomień jest to widzialna objętość gazowa, w której przebiegają procesy rozkładu
termicznego, utleniania i spalania. Płomień powstaje w części przestrzeni, w której zachodzi
chemiczna reakcja spalania.
Rozróżnia się dwa typy płomieni:
a) płomień dyfuzyjny tzn. płomień powstały w wyniku zapalenia tej części objętości, w
której następuje mieszanie się paliwa z powietrzem (utleniaczem); szybkość spalania w
płomieniu dyfuzyjnym jest określona szybkością dyfuzji (przenikania) powietrza do strefy
spalania płomienia;
b) Płomień kinetyczny- powstały w warunkach, gdy substancja palna była już wstępnie,
przed zapaleniem zmieszana z powietrzem, oznacza to, że szybkość spalania określana jest
przede wszystkim szybkością przebiegu reakcji spalania.
Reakcję spalania mieszaniny palnej (substancja palna wstępnie zmieszana z utleniaczem)
nazywa się spalaniem kinetycznym.
Reakcję spalania, której szybkość zależy od dyfuzji powietrza do paliwa nazywa się
spalaniem dyfuzyjnym.
W środowisku pożaru zachodzi spalanie dyfuzyjne.
Płomień dyfuzyjny
Najbardziej znanym płomieniem dyfuzyjnym jest płomień świecy. Szczegółową ilustrację
poszczególnych zjawisk i procesów zachodzących w takim płomieniu przedstawia rysunek.
Z chwilą zapalenia, pod wpływem ciepła promieniowania, wosk mięknie, topi się.
Działaniem sił kapilarnych po knocie wędruje do góry. W temp. 600—800°C, na powierzchni
knota ulega rozkładowi termicznemu. Powstałe produkty rozkładu termicznego migrują do
różnych części knota i dostają się do wewnętrznych części płomienia lub też unoszone prądami
konwekcyjnymi osiągają zewnętrzną warstwę płomienia. Wskutek tego, że powietrze jest
zużywane w zewnętrznej części płomienia, w części wewnętrznej płomienia powstałe z rozkładu
(pirolizy) fragmenty paliwa, ulegają dalszemu rozpadowi tworząc produkty o niskiej masie
cząsteczkowej. Produkty te wędrują do regionów, gdzie temperatura osiąga 1000°C. Tam ulegają
one spaleniu tworząc najczęściej CO2 oraz częściowo w wyniku różnych przemian prowadzą do
powstania sadzy. Rozpatrzmy ten typ spalania bardziej dokładnie.
Załóżmy, że substancją palną jest np. wodór. Z chwilą zetknięcia się wodoru z powietrzem, a
w następstwie różnicy ciśnień cząsteczkowych, zachodzi dyfuzja molekularna. W wyniku
wzajemnego przenikania się cząsteczek wodoru, azotu i tlenu, tworzy się mieszanina. Stężenie
wodoru w różnych punktach mieszaniny jest niejednakowe i zmniejsza się w miarę wzrostu
odległości od miejsca dyfuzji wodoru, do powietrza.
W zależności od stężenia wodoru całą objętość tworzącej się mieszaniny można podzielić na
trzy części: (rysunek
) w l obszarze znajduje się mieszanina zawierająca duży procent
wodoru, a mało tlenu. Taka mieszanina nie jest zdolna do spalania się, ponieważ stężenie wodoru
jest wyższe od stężenia odpowiadającego górnej granicy zapalności, czyli jest wyższe od
maksymalnego stężenia, przy którym zachodzi spalanie. W obszarze 2-gim znajduje się
mieszanina, w której stężenie wodoru leży w obszarze zapalności wodoru, a więc zdolna do
zapalenia się.
W 3-cim obszarze stężenie wodoru jest niższe od wartości dolnej granicy, tzn. jest niższe od
minimalnego stężenia, przy którym już zachodzi spalanie, a więc mieszanina nie spala się. Z
chwilą zbliżenia do powstałej mieszaniny źródła zapalenia, spalanie zachodzi tlko w obszarze 2gim.
Tworzenie się mieszaniny palnej w płomieniu w wyniku dyfuzji molekularnej.
a) do chwili rozpoczęcia procesu spalania:
1 - obszar, w którym stężenie składnika palnego przewyższa górną granicę zapalności,
2 - obszar stężeń w zakresie wybuchowym,
3 - obszar, w którym stężenie składnika palnego jest niższe od dolnej granicy wybuchowości.
b) budowa płomienia dyfuzyjnego podczas spalania:
1 - strefa palnych gazów,
2 - strefa spalania,
3 - mieszanina produktów spalania z powietrzem.
Strefą zadymienia nazywamy tę część przestrzeni. Bezpośrednio sąsiadującą ze
strefą spalania, która jest zapełniona dymowym aerozolem w takim stężeniu,
które stwarza zagrożenie zdrowia lub życia ludzi, którzy w niej przebywają.
Dym to aerozol, w którym fazę rozproszoną stanowią cząsteczki stałe i ciekłe
będące produktami spalania. Rozmiary cząsteczek dymu są rzędu ułamków
mikrona, dlatego są swobodnie unoszone nawet przez słabe prądy konwekcyjne.
Strefa ta ma szczególnie istotne znaczenie przy pożarach wewnętrznych.
PRODUKTY SPALANIA
Produkty spalania są to substancje otrzymywane w wyniku procesu spalania materiałów
palnych. Ze względu na stan skupienia dzielą się na gazowe, ciekłe i stałe.
W warunkach pożarowych produkty spalania o różnych stanach skupienia współistnieją ze sobą
w obszarze spalania i przemieszczania się ciepła, czyli w tzw. kolumnie konwekcyjnej ognia.
Wydzielanie się produktów spalania podczas pożaru stanowi niebezpieczeństwo ze względu na:
— ograniczenie widoczności,
— utrudnianie oddychania spowodowane ich działaniem
toksycznym oraz występującym niedoborem tlenu,
— działanie termiczne (wysoka temperatura mogąca uszkodzić układ
oddechowy),
Produktami całkowitego spalania nazywa się produkty powstałe podczas spalania, nie mające
zdolności do dalszego utleniania w warunkach, w których były otrzymane, np.: dwutlenek węgla,
woda, dwutlenek siarki, pięciotlenek fosforu itd.
Produktami niecałkowitego spalania nazywa się produkty powstałe. podczas spalania
przebiegającego przy ograniczonym dopływie powietrza np.: tlenek węgla, trójtlenek fosforu itd.
Lotne produkty spalania
dwutlenek węgla, tlenek węgla
wodór, siarkowodór, akroleina
cyjanowodór, metan, dwutlenek siarki
TLENEK WĘGLA
CO
Jest jednym z produktów niepełnego spalania substancji organicznych i
nieorganicznych. Jest to bezbarwny gaz bez zapachu. Jest nieco lżejszy
od powietrza. Z innymi związkami chemicznymi łączy się nieznacznie.
Przed tlenkiem węgla nie chroni zwykła maska przeciwgazowa. Tlenek
węgla zmieszany z powietrzem nabiera właściwości palnych i
wybuchowych. W pomieszczeniu, w którym powietrze jest nasycone CO,
nawet najmniejsza iskra, powstała np. przy dzwonieniu telefonu lub
dzwonka przy drzwiach, może spowodować wybuch. Jest bardzo
niebezpieczny ze względu na silne i skryte działanie toksyczne. CO
przedostaje się do krwi drogą inhalacyjną (oddechową), łączy się z
hemoglobiną, tzn. barwnikiem czerwonych ciałek krwi i tworzy związek
zwany karboksyhemoglobiną. Zdolność wiązania się CO z hemoglobiną
jest 250-300 razy większa niż z tlenem. Karboksyhemoglobina nie może
przyswajać tlenu i służyć jako przenośnik tlenu w organizmie.
Maksymalna dopuszczalna ilość CO w powietrzu wynosi 0,002 % (0,03
mg/l powietrza). Choroby przewlekłe, głód, awitaminoza itp., zwiększają
wrażliwość ustroju na tlenek węgla. W okresie zatrucia występują objawy
przede wszystkim ze strony ośrodkowego układu nerwowego. Objawy te
to : bóle głowy, zaczerwienienie i pieczenie skóry twarzy, dreszcze,
uczucie słabości i lęku, przyspieszenie tętna, pragnienie, nudności i bóle
brzucha, wymioty, a w drugiej fazie zatrucia poszkodowany popada w
stan oszołomienia, w którym traci wszelką zdolność do decydowania i
obojętnieje na niebezpieczeństwo (świadomość niebezpiecznej sytuacji z
jednoczesnym osłabieniem kończyn dolnych).
DWUTLENEK WĘGLA CO2
to produkt pełnego spalania węgla lub tlenku węgla i
powstaje podczas spalania przy dostatecznym dopływie
tlenu. Jest gazem cięższym od powietrza ok. 1,5 razy,
bezbarwnym i bez zapachu. Występuje też w wielu
procesach biologicznych. W normalnych warunkach
występuje dwutlenek węgla w ok. 0,03 % objętości
powietrza atmosferycznego. Przy stężeniu ok. 10 %
powoduje objawy niedotlenienia, przy 15 % utratę
przytomności, a w stężeniu powyżej 30 % powoduje
natychmiastową śmierć (nie jest toksyczny w swym
działania tylko wypiera tlen z atmosfery co powoduje
uduszenie).
CHLOROWODÓR
HCl
Powstaje podczas spalania i rozkładu termicznego
PCV chlorokauczuków. Jego generacja dochodzi do
50% masy wejściowej tworzywa. Ponieważ chlor
wchodzi w skład dodatków do tworzyw lub jest
używany do ochrony strukturalnej polimerów, to
występuje również w produktach spalania polistyrenu
i poliuretanu. Chlorowodór powoduje podrażnienie
układu oddechowego, niebezpieczny w postaci
gazowej i ciekłej.
Chlorowodór jest gazem niepalnym, żrącym,
wykazującym silne działanie drażniące na błony
śluzowe górnych dróg oddechowych i oczu, a w
bezpośrednim kontakcie ze skórą powoduje
zniszczenie tkanki skórnej.
CYJANOWODÓR HCN - kwas pruski
Powstaje on wyniku rozkładu wełny, poliamidów, a także tworzyw zawierających
azot w cząsteczce np. poliuretanów. Szkodliwość cyjanowodoru jest przypisywana
wchłanianiu tego związku w metabolizmie komórkowym, co zakłóca proces
wytwarzania niezbędnych dla życia organizmu enzymów i powoduje śmierć. Jest
to substancja bezbarwna o zapachu migdałowym, bardzo silnie trująca, działająca
na ośrodek oddechowy i naczynioworuchowy, dobrze rozpuszczalna w wodzie,
alkoholu i eterze, występuje podczas spalania wielu tworzyw sztucznych .
Cyjanowodór stosowany jest również jako silny środek dezynsekcyjny i
deratyzacyjny. Preparat "cyklon" jest mieszaniną estrów metylowego i etylowego
kwasu cyjanowodorowego, które w podwyższonej temperaturze łatwo rozkładają
się i wydzielają gazowy cyjanowodór. Szersze zastosowanie przemysłowe i
techniczne (m.in.: w galwanizerniach, w fotografice, w syntezach chemicznych)
mają sole kwasu cyjanowodorowego, a przede wszystkim cyjanek potasu. Jest on
też najczęstszą przyczyną zatruć omyłkowych i samobójczych. Rozkłada się pod
wpływem kwasu solnego z żołądka, wydzielając wolny cyjanowodór, który blokuje
tkankowe fermenty oddechowe, uniemożliwiając wykorzystanie tlenu przez tkanki,
czyli powoduje ich duszenie. Przeciętna dawka śmiertelna cyjanowodoru wynosi
0,07 g, cyjanku potasu 0,15-0,25 g. Przy wdychaniu cyjanowodoru w stężeniach ok.
0,05% objętości powietrza śmierć może nastąpić natychmiast. Przy stężeniach we
wdychanym powietrzu powyżej 0,02% - po kilku minutach. Stężenie cyjanowodoru
ok. 0,005% objętości powietrza już może być niebezpieczne dla życia i
spowodować śmierć po kilku godzinach. Przebieg zatrucia doustnego
cyjanowodorem i cyjankami może być różny, w zależności nie tylko od dawki, ale
także od kwasoty żołądka i indywidualnej wrażliwości. W przebiegu względnie
powolnym pojawia się najpierw ból głowy, szum w uszach, duszności, z uczuciem
ściskania w klatce piersiowej, wymioty, przyspieszenie i osłabienie tętna, spadek
ciśnienia, śpiączka. Przy tych objawach może zwrócić uwagę różowe zabarwienie
skóry i zapach gorzkich migdałów w otoczeniu.
Produkty spalania dym
Produktami spalania są pary, gazy i ciała stałe powstałe w rezultacie
procesu spalania. Większość materiałów palnych są to na ogół związki
organiczne tzn. składające się z węgla, wodoru, tlenu, rzadziej z siarki chloru i
azotu. Każdy z pierwiastków wchodzących w skład materiału palnego, jeśli
tylko zaistnieją odpowiednie warunki, łączy się w procesie palenia z tlenem z
powietrza. Podczas spalania 1 kg drewna wydziela się od 7,5-8,0 m3
produktów gazowych, 1 kg metanu daje 10,52 m3 produktów gazowych.
Do bezpiecznego (z przewagą CO2 i H2O w produktach
gazowych) spalenia 1kg drewna i większości tworzyw
znajdujących się w pożarze potrzebujemy około 5 m3 powietrza
(1m3 tlenu), natomiast do również tak samo bezpiecznego
spalenia węgla, aż około 9 m3 powietrz (1,8 m3 tlenu).
Dwutlenek węgla (CO2) - produkt pełnego spalania się węgla lub tlenku węgla,
powstający przy dostatecznym dopływie tlenu. Jest gazem cięższym od powietrza
ok. 1,5 raza, bezbarwnym i bez zapachu. Występuje też w wielu procesach
biologicznych. W normalnych warunkach dwutlenek węgla stanowi ok. 0,03%
objętości powietrza atmosferycznego. Przy stężeniach ok. 10% powoduje objawy
niedotlenienia, przy stężeniach 15% utratę przytomności, a w stężeniach powyżej
30% wywołuje natychmiastową śmierć.
Tlenek węgla (CO) - jest gazem bezbarwnym, bez zapachu, nieco lżejszym od
powietrza, jest produktem niecałkowitego spalania powstającym przy
niedostatecznym dopływie tlenu do strefy reakcji. Działając na organizm ludzki,
powoduje unieczynnienie hemoglobiny czerwonych ciałek krwi, uniemożliwiając
pobieranie tlenu przez krew, tym samym działa zabójczo. Duża zawartość ( 0,03
mg/l ) w powietrzu może spowodować śmierć już
po kilku oddechach.
% CO w powietrzu
0,02
czas działania
2—3 godziny
objawy
słabe bóle głowy
0,4
l—2 godziny
słabe bóle głowy i nudności
0,08
45 minut
słabe bóle głowy, nudności, zawroty głowy
0.08
2 godziny
utrata przytomności i zapaść
0,16
20 minut
bóle głowy, zawroty, nudności
Wodór (H2) - to najlżejszy z gazów, bezbarwny i bezwonny. Niebezpieczny
wybuchowo przy zapaleniu i przy kontakcie z substancjami utleniającymi i tlenem.
Siarkowodór (H2S) - gaz bezbarwny, o charakterystycznym zapachu zgniłych jaj.
Występuje w procesach gnilnych związków organicznych oraz rozpadzie niektórych
minerałów zawierających siarkę ( gips, dolomit, piryt). Stosowany jest często w
przemyśle chemicznym. Występuje niebezpieczeństwo wybuchu przy kontakcie z
substancjami utleniającymi i pyłami metali. Jest bardzo silną trucizną porażającą
układ oddechowy. Wchłaniany jest również przez skórę. Przy stężeniach w powietrzu
powyżej 0,1% już po kilku oddechach może nastąpić nagła śmierć w wyniku
porażenia układu oddechowo-krążeniowego.
Akroleina (C3H4O) – wydziela się podczas spalania materiałów zawierających
tłuszcze zwierzęce i oleje roślinne. Jest to ciecz łatwozapalna, cięższa ok. 2 razy od
powietrza, o zapachu spalonego tłuszczu. Przejawia silne działanie drażniące na
śluzówki górnych dróg oddechowych i oczu. W większych stężeniach może
powodować zapalenie płuc z możliwością zejścia śmiertelnego .
Cyjanowodór (HCH) - występuje podczas spalania wielu tworzyw sztucznych.
Substancja bezbarwna o zapachu migdałowym, bardzo silnie trująca, działająca
na ośrodek oddechowy i naczyniowo-ruchowy.
Metan (CH4) - powstaje w wyniku spalania, z połączenia wodoru i węgla w
procesie niepełnego spalania. Jest to gaz bezbarwny, bez zapachu, lżejszy od
powietrza. Występuje w gazie ziemnym ( błotnym ) i spotkać go można także w
studniach głębinowych, zbiornikach, dołach kloacznych. Jest gazem nietrującym,
może jednak spowodować niedobór tlenowy. Działa narkotycznie i drażni
ośrodkowy układ nerwowy. Jest gazem palnym a w stężeniach ( 5,3 – 14% )
tworzy mieszaninę wybuchową.
Dwutlenek siarki (SO2) - jest gazem bezbarwnym o ostrym zapachu. Silnie
oddziaływuje na śluzówki górnych dróg oddechowych i oczu. Jest stałym
składnikiem dymów pożarowych.
Ciepło spalania i wartość opałowa
• Ciepło spalania jest to ilość ciepła, która wydziela się podczas
całkowitego spalania jednostki masy danej substancji. Najczęściej,
wartość ciepła spalania podaje się w przypadku ciekłych i stałych
materiałów palnych w kilodżulach (kJ) w przeliczeniu na 1 kg, natomiast
dla gazów w kilodżulach (kJ)
w przeliczeniu na m3. Podczas
całkowitego spalania paliwa otrzymuje się na ogól w produktach
spalania dwutlenek węgla (CO2) i wodę (H2O).
W
obliczeniach ciepła spalania zakłada się, że powstała w czasie spalania
woda jest w stanie ciekłym.
• Wartością opalową nazywa się tę ilość ciepła w kilodżulach (kJ), która
wydziela się podczas całkowitego spalania jednostki masy (lub
objętości) substancji, przy założeniu, że woda po spaleniu występuje w
stanie pary. Czyli liczba określająca wartość opalową jest to wartość
liczbowa ciepła spalania zmniejszona o ciepło skraplania wody.
Wymiana ciepła w środowisku pożaru
Jedną z charakterystycznych cech procesu spalania jest wydzielenie się ciepła, powstającego w wyniku
spalania materiału palnego.
Wielkość tego ciepła mierzy się w kcal/kg (MJ/kg) lub w kcal/m3 i (MJ/m3) - dla gazów.
Zrozumienie zasad przenoszenia ciepła i przepływu płynów jest niezbędne dla zrozumienia zjawisk
występujących przy pożarze.
Wymiana ciepła w warunkach pożarowych odbywa się poprzez trzy drogi jego transportu:
przewodzenia ( kondukcji ),
promieniowania (radiacji ),
konwekcji ( unoszenia ).
W warunkach pożarowych przenoszenie ciepła przypuszczalnie zachodzi przy pomocy wszystkich
trzech typów, jednak jeden typ transportu ciepła jest dominujący w danej fazie rozwoju pożaru lub w danej
lokalizacji spalania. Wymianę ciepła w środowisku pożarowym przedstawia zamieszczony poniżej rysunek.
Rys. Wymiana ciepła w środowisku pożaru
Przewodność cieplna (kondukcja)
Zjawisko przewodności ciepła polega na wymianie energii drogą bezpośredniej styczności cząsteczek ciała o
różnych temperaturach. Wymiana energii, a więc i szybkość zrównania się temperatury stykających się ze sobą
ciał, zależy od przewodności cieplnej tych ciał.
Przewodzenie ciepła określa szybkość przepływu ciepła w ciałach stałych. Jest to ważny problem, biorąc
pod uwagę zapalność i szybkość rozprzestrzeniania się płomienia po powierzchni ciał stałych. Czyli w początku
pierwszej fazy pożaru przewodnictwo ciepła decyduje o tym jak szybko materiał ogrzewa się, rozkłada termicznie itd.
Przewodnictwo ciepła jest również istotne przy obliczaniu odporności ogniowej elementów budowlanych,
czyli czasu, po upływie, którego w temperaturze pożaru, element budowlany traci wytrzymałość, ponieważ przy
określaniu odporności ogniowej wymagana jest znajomość szybkości przepływu ciepła przez otaczające pomieszczenie
przegrody itd.
Przewodność cieplna jest to ilość ciepła przepływającego w jednostce czasu przez jednostkę powierzchni, przy spadku
temperatury o 10 C na jednostkę długości. Przewodność cieplna nie jest wielkością stałą. Zależy ona bowiem od
struktury, ciężaru właściwego, ciśnienia, temperatury i wilgotności danego materiału.
Dla strażaków duże znaczenie ma fakt, że różne materiały różnie przewodzą ciepło , a więc charakteryzują
się różną przewodnością ciepła. Ważne jest również i to, że przewodność cieplna materiałów stosowanych w
budownictwie, a z takimi w praktyce zawodowej najczęściej mamy do czynienia, wzrasta wraz ze wzrostem
temperatury. Znajomość tego zagadnienia może okazać się bardzo pomocna przy rozpatrywaniu i analizie zjawiska
pożaru, przy określaniu temperatur jakie mogą panować wewnątrz ogrzewanego materiału lub jego nie ogrzewanej
stronie itp.
Bardzo dobrymi przewodnikami ciepła są metale i stal. Złymi przewodnikami są np.: beton, drewno. Jeżeli
zbudowaliśmy dwie ściany o grubości 25 cm, jedną ze stali , a drugą z drewna i działali na nie jednakowym źródłem
ciepła to okaże się, że ściana drewniana od strony źródła ciepła zacznie się palić, ale po stronie przeciwnej nie
odczujemy wyraźnego wzrostu temperatury. Ściana stalowa będzie po przeciwnej stronie tak nagrzana, że może
spowodować zapalenie się zgromadzonego przy niej materiału palnego.
Unoszenie ciepła (konwekcja)
Zjawisko unoszenia ciepła ma miejsce w cieczach i gazach. Jest ono ściśle związane z ruchem
cieczy lub gazu. Ogrzane cząsteczki gazu lub cieczy są lżejsze od nie ogrzanych i unoszą się do góry. Unosząc
się oddają swoją energię cieplną cząsteczkom mniej ogrzanym. Zjawisko unoszenia zależy od warunków
powstawania ruchu cząsteczek i jego rodzaju oraz od właściwości fizycznych gazów lub cieczy.
Konwekcyjne unoszenie ciepła polega na wymianie ciepła pomiędzy gazem lub cieczą a ciałem
stałymi powoduje ruch np. ruch ogrzanego powietrza przepływającego nad powierzchnią ogrzanego materiału.
Konwekcyjne przenoszenie ciepła ma miejsce we wszystkich fazach rozwoju pożaru, ale szczególnie istotne jest w
tej fazie pożaru gdzie strumień ciepła promieniowania jest bardzo mały.
W zjawisku konwekcji (unoszenia) ciepła rodzaj ruchu ma bardzo duże znaczenie, określa on bowiem
mechanizm przenoszenia ciepła. Przy ruchu laminarnym (spokojnym) wymiana ciepła w kierunku prostopadłym
do ścianki odbywa się tylko na zasadzie przewodzenia i zależy od przewodności cieplnej cieczy lub gazu. Przy
ruchu burzliwym wymiana ciepła drogą przewodzenia odbywa się tylko w ograniczonej warstwie laminarnej, zaś
wewnątrz burzliwego jądra – drogą intensywnego mieszania się cząsteczek cieczy lub gazu.
Zjawisko unoszenia ciepła występuje podczas pożaru. Gorące gazy pożarowe oraz nagrzane powietrze
unoszą się do góry, wytwarzając w miejscu pożaru podciśnienie. Powoduje to szybki napływ świeżego powietrza,
które podsyca palenie. Przy dużych pożarach napływ świeżego powietrza jest tak szybki, że stwarza wrażenie
wiatru wiejącego ze wszystkich stron w kierunku pożaru. To zjawisko wykorzystywane jest do zakładania
przeciwogni przy dużych pożarach lasu.
Promieniowanie ciepła (radiacja)
O ile przewodnictwo i konwekcyjne przenoszenie ciepła jest to wymiana ciepła w
materiałach o różnych stanach skupienia lub pomiędzy różnymi ośrodkami gazowymi, o tyle transport
ciepła na drodze promieniowania nie wymaga ośrodka gazowego pomiędzy źródłem ciepła a obiektem,
który otrzymuje ciepło, ponieważ w przenoszeniu ciepła na drodze promieniowania biorą udział fale
elektromagnetyczne, które jako światło widzialne mogą być absorbowane, przenoszone lub odbijane
przy powierzchni i mogą być częściowo zatrzymywane przez obiekt np. ekran.
Przy nagrzewaniu ciał część energii cieplnej zawsze zamienia się na energię promieniowania.
Głównym czynnikiem tej przemiany jest temperatura, stąd też i ilość energii cieplnej ulegającej
przemianie na energię promieniowania zależy od temperatury. Przy wymianie ciepła drogą
promieniowania najważniejsze są promienie, które mogą być pochłonięte przez ciało i których energia
zamienia się w ciepło. Te właściwości mają promienie świetlne i podczerwone. Promieniowanie
rozchodzi się prostoliniowo i we wszystkich kierunkach, tworząc obszar zwany polem promieniowania.
Proces wysyłania promieniowania nazywa się emitowaniem. Promieniowanie cieplne mierzy się
strumieniem cieplnym. Który jest miarą ilości ciepła, która w jednostce czasu jest przekazywana przez
jednostkę powierzchni. Jednostka promieniowania cieplnego jest wat na metr kwadratowy – W/m2
(kcal/m2 x h) 1 kcal/m2 x h = 1,163 W/m2.
Promieniowanie cieplne może być wchłonięte (zaabsorbowane), odbite lub
przepuszczone przez ciało poddane promieniowaniu. Ciało doskonale czarne całkowicie absorbuje
promieniowanie cieplne. Ciało szare częściowo absorbuje , a częściowo odbija promieniowanie. Ciało
doskonale białe całkowicie odbija promieniowanie cieplne. Całkowicie przepuszcza promieniowanie
cieplne ciało doskonale przezroczyste. Materiały absorbujące promieniowanie cieplne zapalają się
szybciej niż te , które promieniowanie to odbijają.
Podczas pożaru dużą rolę odgrywa
promieniowanie cieplne płomieni. Podczas spalania zupełnego powstają jasne płomienie . emitują one
niewielką ilość energii cieplnej. Przy spalaniu niezupełnym występuje płomień świecący . W jego skład
wchodzi zawiesina rozżarzonych cząsteczek węgla powstałych z rozpadu węglowodorów, lotnych
cząstek koksiku i popiołu. Tego typu płomienie najczęściej występują podczas pożaru. Emitują one
znaczną ilość energii cieplnej. Odgrywa ona dużą
rolę w rozwoju i rozprzestrzenianiu się pożaru. Gęstość strumienia cieplnego zależy
od odległości i natężenia źródła promieniowania.
Promieniowanie jest dominującym, zasadniczym sposobem przenoszenia ciepła w
pożarach. Właśnie wskutek oddziaływania na materiały strumieni ciepła promieniowania, ulegają one
ogrzewaniu i w konsekwencji dalszym przemianom aż do wystąpienia zapalenia. Promieniowanie
warunkuje również ciągłość spalania materiałów i jest ono odpowiedzialne za szybkość rozwoju
pożarów na otwartych przestrzeniach np. pożarów lasów oraz za ogrzewanie się budynków.
Podstawowa ilość ciepła wydzielonego w płomieniach jest przenoszona do otoczenia drogą
promieniowania. Większość tego promieniowania jest emitowana przez cząsteczki sadzy, które tworzą
się w płomieniach dyfuzyjnych, powodując jego świecenie. Efekt termicznego promieniowania
płomienia do otoczenia lub z nagrzanych obiektów na sąsiadujące z nim powierzchnie, może być
zbadany na drodze obliczeń analitycznych. Takie właśnie analizy przeprowadza się, aby wyjaśnić jak
szybko materiał palny, eksponowany na promieniowanie cieplne osiąga stan, w którym może się on
zapalić i spalać stacjonarnie tzn. ze stałą szybkością spalania.
PŁOMIEŃ (1)
Płomień –
szybka, przemieszczająca się reakcja chemiczna,
której towarzyszy emisja światła i wydzielanie się
ciepła. Na reakcję tę składa się co najmniej
kilkadziesiąt reakcji elementarnych. W płomieniu
naturalnym utleniacz i paliwo są zmieszane ze sobą
lub mieszają się w momencie spalania.
PŁOMIEŃ (1)
Płomienie dzielimy na dwa typy :
Płomienie dyfuzyjne –
powstałe w wyniku zapalenia się objętości materiału palnego, w której
następuje mieszanie się jej z utleniaczem. Szybkość spalania
kontrolowana jest przez procesy dyfuzyjne. Przykładem jest płomień
świecy.
Płomienie kinetyczne –
powstają w wyniku zapalenia się materiału palnego wstępnie zmieszanego
z utleniaczem, o szybkości spalania decyduje szybkość reakcji
chemicznych zależna od składu mieszanki utleniacz-paliwo i temperatury.
PŁOMIEŃ (1)
W kinetycznym płomieniu laminarnym wyróżniamy strefy:
1) strefę podgrzewania
2) strefę reakcji spalania
3) strefę produktów spalania.
W strefie podgrzewania następuje ogrzewanie nie spalonych
gazów do pewnej temperatury, w strefie reakcji zachodzi
przedłużanie i rozgałęzianie reakcji łańcuchowej. W strefie
produktów spalania występuje rekombinacja wolnych rodników.
PŁOMIEŃ (2)
Istnieje również podział inny płomieni ze względu na emitowane widmo fal.
Rozróżniamy dwa rodzaje płomieni :
płomienie świecące,
płomienie nie świecące.
Płomień świecący
powstaje przy spalaniu ciał ulegających rozkładowi w wysokich temperaturach, o dużej
zawartości węgla, takich jak substancje ropopochodne czy celuloza. Świecenie wszystkich ciał
związane jest z pobudzeniem w nich atomów lub cząsteczek. Przejście w stan wzbudzony
zachodzi pod wpływem energii dostarczonej do tych ciał. Jeśli wzbudzenie atomu zachodzi
kosztem energii cieplnej, to promieniowanie nazywamy termicznym. Promieniowanie atomu
wzbudzonego w rezultacie działania energii chemicznej nazywamy luminescencją.
Intensywność termicznego promieniowania różnych ciał zależy od zdolności pochłaniania światła.
Ciała, które doskonale nie pochłaniają światła nie są zdolne do promieniowania termicznego.
Cząstkami stałymi w płomieniu substancji organicznej jest węgiel powstały w rezultacie rozłożenia
palnej substancji. Węgiel jako ciało stałe barwy czarnej zdolny jest do pochłaniania wszystkich
promieni świetlnych i dlatego promieniowanie termiczne węgla jest najbardziej intensywne. Świecenie
płomienia przy paleniu się drewna, nafty, gazu świetlnego, to kolor wypromieniowanych rozżarzonych
stałych cząstek węgla, unoszących się w strumieniu gazu i rozgrzewanych przez ciepło reakcji do
temperatury świecenia. Kolor płomienia substancji organicznych podczas palenia się ich na powietrzu
zależy od ich chemicznego składu, a głównie od zawartości w nich tlenu i węgla. Tlen znajdujący się
w palnej substancji rozchodzi się w procesie palenia na utlenianie pierwiastków substancji. Czym
więcej jest tlenu w substancji, tym mniej jest swobodnego węgla powstałego w płomieniu, co z kolei
powoduje słabsze jego świecenie.
PŁOMIEŃ (2)
Płomień nie świecący
powstaje przy dużej zawartości tlenu w substancji palnej. Węgiel wolny
nie występuje w płomieniu, gdyż jest całkowicie utleniany – wiążąc się
z tlenem. Płomień nie świecący powstaje podczas spalania materiału
przy udziale ponad 50 % tlenu. Płomień nie świecący powstaje przy
spalaniu wodoru, tlenku węgla, alkoholu metylowego i innych związków
chemicznych o niewielkiej zawartości węgla występującego w
wiązaniach chemicznych.
Przy dużej, ponad 60 % ilości węgla występującego w materiale palnym
powstaje płomień świecący z dużą zawartością sadzy. Węgiel powstający
podczas rozkładu materiału palnego przez pewien czas utrzymuje się w
stanie niezwiązanym powodują powstanie płomienia barwnego. Przy tym
udziale procentowym występuje zjawisko kopcenia.
PŁOMIEŃ (3)
Z uwagi na fakt, iż proces spalania jest procesem bardzo dynamicznym
i zmieniającym się w zależności od warunków, w których przebiega, także jego
objaw zewnętrzny – płomień jest niestabilny i zmienny, zależny od
zmieniającego się składu procentowego paliwa i utleniacza. Płomień kopcący
po doprowadzeniu większej ilości utleniacza zmieni się na jasno świecący bez
udziału sadzy. Podobnie, jeśli do wnętrza płomienia świecącego wprowadzimy
utleniacz, stanie się on płomieniem nie świecącym.
Choć barwa płomienia substancji organicznej zależna jest od obecności w nim
stałych cząsteczek węgla, to przy wprowadzaniu do płomienia cząsteczek
innych ciał stałych płomień będzie przybierał barwę charakterystyczną dla
danych pierwiastków. Przykładem może być doświadczenie polegające na
wprowadzeniu do nie świecącego płomienia alkoholu metylowego soli strontu
– płomień zabarwia się na kolor ciemno karminowy, lub wprowadzeniu soli
miedzi – powstanie płomień zielony.
Ze względu na mechanizm rozprzestrzeniania się płomienia rozróżnia się
płomienie laminarne i turbulentne.
W płomieniach laminarnych transport ciepła wywiązanego w reakcji
chemicznej odbywa się głównie na zasadzie przewodnictwa, a w płomieniach
turbulentnych – na zasadzie turbulentnej wymiany masy, pędu i energii.
Spalanie
(co to jest ? – uwarunkowania):
Jest to silnie egzotermiczna reakcja (z wydzielaniem dużej ilości ciepła),
Reaguje materiał palny (paliwo) i utleniacz (najczęściej tlen z powietrza),
Charakteryzujący się wydzielaniem oprócz ciepła, także światła, gazów i dymów,
Proces spalania może odbywać się wówczas, gdy układ palny zasilany jest w paliwo i
utleniacz,
Najpowszechniejszym paliwem w pożarach są związki węgla (drewno, papier, słoma,
rośliny, farby, alkohole, ropopochodne, tworzywa sztuczne),
Tlen jest utleniaczem najczęściej spotykanym w praktyce, fluor najsilniejszym,
Nagrzanie układu palnego w stopniu wystarczającym do zainicjowania procesu
spalania najczęściej zapewniają : otwarty ogień (płomień), zwarcie instalacji elektrycznej,
gorące powierzchnie, elektryczność statyczna,
Jest to reakcja ze zdolnością przemieszczania się w przestrzeni, co jest znacząco
istotne dla zjawiska pożaru,
Pożar jest szczególnym przypadkiem, w którym spalanie przestaje być kontrolowane.
Podstawy termodynamiki
Podstawowe definicje: system termodynamiczny, ograniczenie układu, otoczenie, parametr fizyczny
układu, parametr termodynamiczny układu, stan układu, przemiana termodynamiczna,
przemiana quasi - statyczna, ciało proste. Energia, jej rodzaje, jednostki. Prawo zachowania
energii. Gaz doskonały. Równanie stanu gazu doskonałego. Prawo Awogadra. Ciepło właściwe.
Mieszaniny gazów doskonałych. Przemiany: izotermiczna, izobaryczna, izochoryczna,
adiabatyczna, politropowa. Gaz rzeczywisty. Równanie stanu gazu rzeczywistego. Stan, w
którym gaz rzeczywisty zbliża się własnościami do gazu doskonałego. Pierwsza zasada
termodynamiki. Energia wewnętrzna. Praca zewnętrzna. Praca techniczna. Ciepło. Zerowa
zasada termodynamiki Zasady pomiaru temperatury. Druga zasada termodynamiki. Obiegi.
Sprawność silnika termodynamicznego. Entropia. Trzecia zasada termodynamiki. Przemiany
odwracalne i nieodwracalne.
Cele szczegółowe
•
•
•
•
•
•
•
•
•
•
•
•
•
W wyniku realizacji tematu uczeń powinien umieć:
opisać definicje i pojęcia termodynamiki,
scharakteryzować energię i dokonać jej klasyfikacji,
określić co to jest gaz doskonały i jego mieszaniny, przedstawić w sposób analityczny
równanie stanu gazu doskonałego,
omówićć prawo Awogadra,
uzasadnić różnice między przemianami: izotermiczna, izobaryczna, izochoryczna,
adiabatyczna, politropowa,
określić co to jest gaz rzeczywisty, przedstawić w sposób analityczny równanie gazu
rzeczywistego,
wskazać różnice między gazem doskonałym a rzeczywistym,
omówić pierwszą, drugą i trzecią zasadę termodynamiki,
uzasadnić różnice między poszczególnymi zasadami termodynamiki,
wyjaśnić pojęcie ciepła i zasady jego pomiaru,
scharakteryzować obiegi termodynamiczne i opisać sprawność silnika termodynamicznego,
wskazać różnicę między przemianą odwracalną i nieodwracalną.
TERMODYNAMIKA
•
Termodynamika to dział fizyki zajmujący się opisem zmiany ciepła na inne
postacie energii i odwrotnie. Dostarcza podstaw teoretycznych do badania
sprawności silników, takich jak np.: silniki parowe lub spalinowe.
Trzy podstawowe zasady termodynamiki można wyrazić jako:
I zasada termodynamiki;
energia nie może powstawać ani zanikać, a energia cieplna i mechaniczna
mogą się nawzajem przekształcać;
II zasada termodynamiki:
bez dodatkowej pracy niemożliwe jest przekazanie ciepła od ciała zimnego
do ciepłego
III zasada termodynamiki:
• nie jest możliwe doprowadzenie żadnego układu do temperatury zera
bezwzględnego w procesie o skończonej liczbie kroków (również
wyidealizowanego). Ciepło jest postacią energii równoważną energii
kinetycznej (energii ruchu) drgających atomów lub cząsteczek substancji
w temperaturze zera bezwzględnego.
W temperaturze zera bezwzględnego ruch zamiera i jest to jeden z
wniosków, płynących z III zasady termodynamiki.
Istnieje również zerowa zasada termodynamiki mówiąca że jeżeli dwa układy
są w równowadze termicznej z trzecim to są we wzajemnej równowadze.
ENTROPIA.
• Termodynamika wprowadza jeszcze jedną wielkość
zwaną entropią.
• W układach posiadających energię cieplną, entropia
jest miarą niedostępności tej energii do zamiany na
pracę mechaniczną. Jeżeli entropia wzrasta, mniej
energii może być zamieniona na pracę. Lecz,
podobnie jak w przypadku energii cieplnej, entropia
maleje z temperaturą i III zasada termodynamiki
mówi że w temperaturze zera bezwzględnego
entropia kryształu idealnego wynosi zero.
• Zero bezwzględne – najniższa możliwa teoretycznie
temperatura,
• zero Kelvinów (0o K) jest równoważna – 273, 15oC;
w tej temperaturze cząsteczki są w bezruchu.
Energia układu jest to funkcja stanu, której spadek jest równy pracy wykonanej przez układ
adiabatyczny gdzie Eu1 i Eu2 oznacza energię układu w stanie 1 i w stanie 2.
mv 2
E
k
Energia mechaniczna jest to suma energii kinetycznej
2
E p mgh
i potencjalnej
gdzie
m – masa ciała, v – prędkość ciała, g – przyspieszenie ziemskie,
h - wysokość ponad poziom odniesienia na którym energia jest równa zero.
Gaz doskonały jest to hipotetyczny gaz, jest to matematyczny model gazu, w którym brak
oddziaływań międzycząsteczkowych z wyjątkiem odpychania w momencie doskonale
sprężystych zderzeń cząsteczek znajdujących się w ciągłym chaotycznym ruchu, a ponadto
objętość cząsteczek jest znikoma w stosunku do objętości gazu.
Gaz taki w mechanice klasycznej opisuje równanie Clapeyrona (równanie stanu gazu
doskonałego):
gdzie:
•
p – ciśnienie gazu
•
V – objętość gazu
•
T – temperatura
•
n – liczba moli
•
R – stała gazowa R=8,31 J/(molK)
pV nRT
Prawo Avogadra mówi że w tych samych warunkach fizycznych tj. w takiej samej temperaturze
i pod takim samym ciśnieniem, w równych objętościach różnych gazów znajduje się taka
N
sama liczba cząsteczek. Między licznością
n materii, a liczbą Avogadra występuje
następująca zależność:
NA
gdzie:
•
N - liczba cząstek (atomów, cząsteczek, jonów i wszelkich innych indywiduów chemicznych)
•
NA - stała Avogadra = 6,0221367(36) × 1023 mol-1
Gaz rzeczywisty to gaz, który nie zachowuje się ściśle zgodnie z prawami ustalonymi dla gazu
doskonałego. W praktyce są to wszystkie gazy istniejące w realnym świecie.
Przemiana izotermiczna przebiega przy stałej
temperaturze:
pV const
Wykresy
przemian izotermicznych
Sprężanie izotermiczne:
Rozprężanie izotermiczne:
Przemiana izobaryczna przebiega przy stałym
ciśnieniu:
V
const
T
Wykresy
przemian izobarycznych
Ochładzanie /sprężanie/ izobaryczne:
Ogrzewanie /rozprężanie/ izobaryczne:
Przemiana izochoryczna przebiega przy stałej
objętości:
p
const
T
Wykresy
przemian izochorycznych
Ogrzewanie izochoryczne:
Ochładzanie izochoryczne:
Przykładowy cykl termodynamiczny
ogrzewanie /rozprężanie/ izobaryczne
rozprężanie izotermiczne
ochładzanie izochoryczne
ochładzanie /sprężanie/ izobaryczne
sprężanie izotermiczne
ogrzewanie izochoryczne
Przemiana adiabatyczna zachodzi w wyizolowanym układzie, który nie
nawiązuje wymiany ciepła, lecz całość energii dostarczana lub odbierana jest
z niego jako praca.
pV const
gdzie:
C
κ – wykładnik adiabaty, równy
stosunkowi ciepła właściwego przy stałej objętości
i przy stałym ciśnieniu, C
p
v
Przemiana politropowa proces,
podczas którego jest spełniony następujący
n
pV
const
związek:
gdzie:
• n – wykładnik politropy, stały dla danego procesu politropowego, ale
przyjmujący dla różnych procesów politropowych różne wartości, od minus do
plus nieskończoności.
Politropowy proces, przemiana gazowa odwracalna termodynamicznie, wyrażona równaniem pVn
const,
gdzie: p - ciśnienie gazu, V - objętość gazu, n - wykładnik potęgowy, który jest dowolną liczbą
rzeczywistą.
=
Praca w termodynamice, czyli energia przekazywana makroskopowo
Pierwsza zasada termodynamiki precyzuje zależność zmiany energii wewnętrznej od dostarczonego ciepła i pracy.
Pierwsza zasada termodynamiki wyraża się następującym wzorem:
∆U = Q + W
∆U - zmiana energii wewnętrznej ciała/układu - jednostka w układzie SI: dżul J
Q – ciepło dostarczone do ciała/układu - jednostka w układzie SI: dżul J
W – praca wykonana nad ciałem/układem - jednostka w układzie SI: dżul J
Treść tego wzoru (a więc i I zasady termodynamiki) można przedstawić w postaci sformułowania:
Zmiana energii wewnętrznej ciała, lub układu ciał jest równa sumie
dostarczonego ciepła i pracy wykonanej nad ciałem /układem ciał.
Umowa dotycząca znaku
Aby prawidłowo obliczać zmianę energii wewnętrznej należy trzymać się następującej konwencji dotyczącej
znaku pracy, lub ciepła:
•
Jeśli praca lub ciepło są dostarczane do ciała (układu ciał), to są one liczone ze znakiem plus - są
dodatnie.
•
Jeżeli są odbierane od ciała (układu ciał) , czyli jeśli to ciało/układ wykonuje jakąś pracę, to odpowiednie
wartości będą ujemne.
II zasada termodynamiki stwierdza, że w układzie
zamkniętym istnieje addytywna funkcja stanu,
zwana entropią S, która jest rosnącą funkcją energii
wewnętrznej, oraz której zmiana ΔS w procesie
adiabatycznym spełnia nierówność ΔS ≥ O,
przy czym równość zachodzi wtedy i tylko wtedy,
gdy proces jest odwracalny.
Dla układu izolowanego
dQ
dS
(entropia zawsze rośnie)
T
Dla układu oddziałującego
S 0 (pochłanianie ciepła zawsze powoduje wzrost
entropii)
III zasada termodynamiki mówi, iż nie można za
pomocą skończonej liczby kroków uzyskać
temperatury zera bezwzględnego (0K), jeżeli za
punkt wyjścia obierzemy niezerową temperaturę
Obiegi termodynamiczne to przemiany, w których stan końcowy czynnika
jest identyczny z początkowym. Obrazem obiegu w układzie p,V jest
krzywa zamknięta.
Sprawność silnika termodynamicznego jest to stosunek pracy
wykonanej przez silnik do ciepła pochłoniętego przez czynnik
obiegowy:
W
Q
Przemiana nieodwracalna jest to proces, w którym po osiągnięciu stanu
końcowego niemożliwe jest powrócenie do stanu początkowego.
Wszystkie procesy samorzutne są procesami nieodwracalnymi, m.in.:
samorzutne reakcje chemiczne, dyfuzja, przewodzenie ciepła oraz
rozprężanie gazów.
Przemiana odwracalna jest to proces, którego kierunek można odwrócić
poprzez nieskończenie małą zmianę wartości jednej lub więcej
zmiennych stanu termodynamicznego Procesy odwracalne zachodzą
bez produkcji entropii.
Właściwości fizyczne substancji to m.in.: stan skupienia, barwa,
kruchość, ciągliwość, plastyczność, sprężystość, gęstość,
przewodnictwo cieplne i elektryczne, temperatura topnienia i wrzenia,
rozpuszczalność.
Właściwości chemiczne substancji to m.in.: odczyn (kwaśny, zasadowy,
obojętny), palność, smak, zapach, potencjał oksydacyjno - redukcyjny,
ładunek (dodatni, ujemny), aktywność chemiczna, oddziaływanie na
środowisko naturalne, typ (związek kowalencyjny, jonowy, mieszany,
II Zasada termodynamiki
sformułowanie
•
Plancka. Jest rzeczą niemożliwą skonstruowanie takiego silnika (maszyny
działającej periodycznie), którego działanie polegało by na podnoszeniu
ciężarów i równoczesnym ochładzaniu jednego źródła ciepła. Silnik taki nosi
nazwę perpetum mobile II rodzaju.
•
Clausjusa ciepło nie może przejść samorzutnie od ciała o temp niższej do
ciała o temp wyższej. Aby spowodować taki przepływ ciepła musimy
zastosować lewo bieżną maszynę cieplną i wkładać do niej energię z
zewnątrz, tzn. wywoływać zmiany w innych ciałach.
•
Samorzutne przejście – zjawisko któremu nie towarzyszą żadne zmiany w
otoczeniu (otoczenie nie oddziałuje na układ)
•
Schmidta – nie można całkowicie odwrócić przemiany, w której występuje
tarcie. Pracę w całości można zmienić na ciepło przez tarcie, jednak z tego
ciepła nie można w całości odzyskać pracy.
•
Ostwalda – perpetum mobile II rodzaju jest niemożliwe – DOWÓD
czyli cykl pracy silnika stąd SPM II R=0 bo entropia jest wielkością stanu a stan w punkcie 1-2 jest sobie równy
to =0;
=SPM II R+SŹR=0 - ; Q – ciepło tarcia
> 0 sprzeczne z prawem wzrostu entropii
Entropia układu zamkniętego i izolowanego nie może maleć podczas dowolnej przemiany i wzrastać przy
przemianach
nieodwracalnych.
Zasada zachowania energii i masy w warunkach
pożarów.
Rozważamy zasadę zachowania energii opierając się na
opisie integralnym (dawny opis pożaru przy założeniu, że mamy
w nim do czynienia z idealnym mieszaniem się gazów –
uśredniamy parametry po objętości całego pomieszczenia).
W wyniku spalania materiału palnego w ciągu jednostki
czasu, w strefie spalania wydziela się pewna ilość ciepła.
Zjawisko to charakteryzuje parametr zdefiniowany jako moc
pożaru, lub szybkość wydzielania się ciepła. Jest to jeden z
najistotniejszych parametrów pożaru. Szybkość wydzielania się
ciepła determinuje rozwój pożaru i jest parametrem pierwotnym.
Wszystkie pozostałe zjawiska mają charakter wtórny, ale te
wtórne zjawiska jak np.: wymiana gazowa nie powstają bez
wpływu na moc pożaru.
Ciepło wydzielone w czasie spalania można podzielić na
następujące składniki opisane na rysunku.
Zasady zachowania energii w warunkach pożaru wewnętrznego
•
•
•
•
q – ciepło wypromieniowane ze strefy spalania do otoczenia. W przypadku pożarów wewnętrznych
strumień ten przechodząc przez strefę oddziaływania cieplnego może być częściowo pochłonięty przez gaz
znajdujący się w tej strefie. Jeżeli strefa jest silnie zadymiona wówczas strumień ten jest pochłonięty
całkowicie i idzie na podniesienie temperatury tego gazu. Silne pochłanianie ma miejsce również wówczas
gdy w gazie jest dużo pary wodnej i dwutlenku węgla. W przeciwnym razie promieniowanie to dociera do
przedmiotów znajdujących się w pomieszczeniu oraz do konstrukcji i nagrzewa je. Część ciepła która
dotarła do konstrukcji odprowadzana jest w głąb materiału na drodze przewodnictwa qλ.
qp – jest to ta część ciepła która podgrzewa produkty spalania. Ogrzane produkty spalania unoszą się do
góry niosąc ze sobą energię i mieszają się z gazem znajdującym się w pomieszczeniu.
qk – przenoszenie ciepła na drodze konwekcji. Strumienie konwekcyjne spełniają w pożarze istotną rolę.
Unoszenie produktów spalania pozwala na napływ do strefy spalania powietrza podtrzymującego proces
spalania.
Należy również pamiętać o tym że w procesie wymiany gazowej część energii jest „ wynoszona” przez
wypływające nagrzane gazy q1, ale również wnosi ze sobą pewną ilość energii powietrze napływające do
pomieszczenia q2.
Rozkład ciśnienia w pomieszczeniu w warunkach
pożaru
Strefa spalania jest nie tylko źródłem energii, ale
również jest źródłem masy. Masy gazów wychodzących
ze strefy spalania są to produkty spalania i rozkładu
termicznego.
Mieszają się one z gazem zawartym w objętości
pomieszczenia. Gaz podgrzewa się, rośnie ciśnienie.
Wzrost ciśnienia wewnątrz pomieszczenia powoduje
wypływ gazu przez wszystkie otwory znajdujące się w
pomieszczeniu.
Wypływ gazu wszystkimi otworami pomieszczenia na
początku
pierwszej
fazy
pożaru
jest
cechą
charakterystyczną
dla
wszystkich
pożarów
wewnętrznych.
W rezultacie wypływu gazu, średnie ciśnienie
wewnątrz pomieszczenia maleje. Do pomieszczenia
Rozkład ciśnienia w pomieszczeniu w warunkach
pożaru
Ciśnienie wewnątrz pomieszczenia maleje razem z wysokością. Maleje
ono również i na zewnątrz pomieszczenia, przy czym spadek ciśnienia na
zewnątrz z wysokością jest większy. Oznacza to, że istnieje pewna wysokość,
na której ciśnienie wewnątrz pomieszczenia i na zewnątrz są sobie równe.
Płaszczyzna znajdująca się na wysokości odpowiadającej równym ciśnieniom
nosi nazwę płaszczyzny równych ciśnień /PRC/ lub często nazywa się ją
strefą neutralną. Poniżej strefy neutralnej ciśnienie wewnątrz pomieszczenia
jest mniejsze niż na zewnątrz, powyżej zaś ciśnienie jest większe od ciśnienia
zewnętrznego. Na początku strefa neutralna znajduje się zawsze z fizycznego
punktu widzenia na poziomie podłogi. Zgodnie z jej definicją ciśnienie wewnątrz
pomieszczenia w każdym jego punkcie jest większe od ciśnienia zewnętrznego.
Gaz wypływa każdym otworem wentylacyjnym. W miarę upływu czasu strefa
neutralna podnosi się do góry. Kiedy strefa neutralna znajdzie się powyżej dolnej
krawędzi np.: otworu okiennego wówczas zaczyna do pomieszczenia napływać
powietrze G2, oczywiście powyżej strefy neutralnej gaz w dalszym ciągu
wypływa G1.
Schemat wymiany gazowej w warunkach pożaru wewnętrznego. Opis
integralny. Wędrówka strefy neutralnej kończy się w miarę rozwoju pożaru.
Z obliczeń wynika że w czasie rozwoju pożaru ilość powietrza
napływającego
do pomieszczenia jest zawsze mniejsza od ilości wypływających gazów.
Wymiana gazowa w warunkach pożaru przy opisie integralnym.
Podstawowe pojęcia z zakresu samonagrzewania i
samozapalenia
• Samonagrzewanie poprzedza samozapalenie i jest to proces
charakteryzujący się tym, że temperatura układu palnego (materiał
palny ulegający samonagrzewaniu – powietrze lub inny utleniacz)
podwyższa się w wyniku generacji ciepła wewnątrz samego układu
niezależnie od dopływu strumienia ciepła z zewnątrz.
• Jeśli wzrost szybkości wydzielania się ciepła jest bardzo duży, to
zjawisko samonagrzewania przyspiesza się z możliwością przejścia
w proces spalania (samozapalenia).
• Temperatura układu palnego, przy której zaczyna się już
samoprzyspieszenie reakcji i akumulacja ciepła, nazywa się
temperaturą krytyczną samonagrzewania.
• Czas od momentu ogrzewania się substancji (ciepłem będącym
wynikiem reakcji chemicznych, procesów biologicznych, zjawisk
fizycznych) do pojawienia się płomienia
nazywa się okresem indukcji.
• Samonagrzewaniu (samozapaleniu) mogą ulegać: gazy, ciecze i
ciała stałe.
Samonagrzewanie materialów może
zachodzić
w różny sposób i może być wynikiem :
• reakcji chemicznych (utlenianie,
polimeryzacja),
• zjawisk fizycznych (adsorpcja),
• przemian biologicznych (rozmnażanie,
oddychanie komórek roślinnych).
• – – – – – – okres indukcji
Wykres zmian temperatury w funkcji czasu samonagrzewania się materiału palnego
SPALANIE BEZPŁOMIENIOWE
TLENIE -jest to termicznego materiałów palnych pochodzenia organicznego tzn.
węgla lub materiałów silnie porowatych.
ŻARZENIE -jest to zjawisko świecenia powierzchni palnego materiału
nieorganicznego, który nie uległ rozkładowi termicznemu, lecz ogrzał się w wyniku
różnych zjawisk i przemian chemicznych.
SPALANIE HOMOGENICZNE I HETEROGENICZNE
SPALANIE HOMOGENICZNE- zachodzi wówczas, jeśli układ palny składa się z
jednej fazy (tzn. jest gazem lub znajduje się w fazie gazowej na skutek parowania).
Spalanie homogeniczne charakteryzuje się występowaniem płomieni.
SPALANIE HETEROGENICZNE jest spalaniem na granicy tzw. rozdziału faz, tj. na
powierzchni ciała. Ten rodzaj spalania odnosi się jedynie do ciał stałych. Cechą
charakterystyczną tego rodzaju spalania jest obok płomieni, przede wszystkim
świecenie ciała stałego.












