MODEL ODPOWIEDZI I SCHEMAT OCENIANIA
ATOM I CZĄSTECZKA. WIĄZANIA CHEMICZNE
Dział II
Numer
zadania
Liczba
punktów
Modele odpowiedzi i punktacja cząstkowa
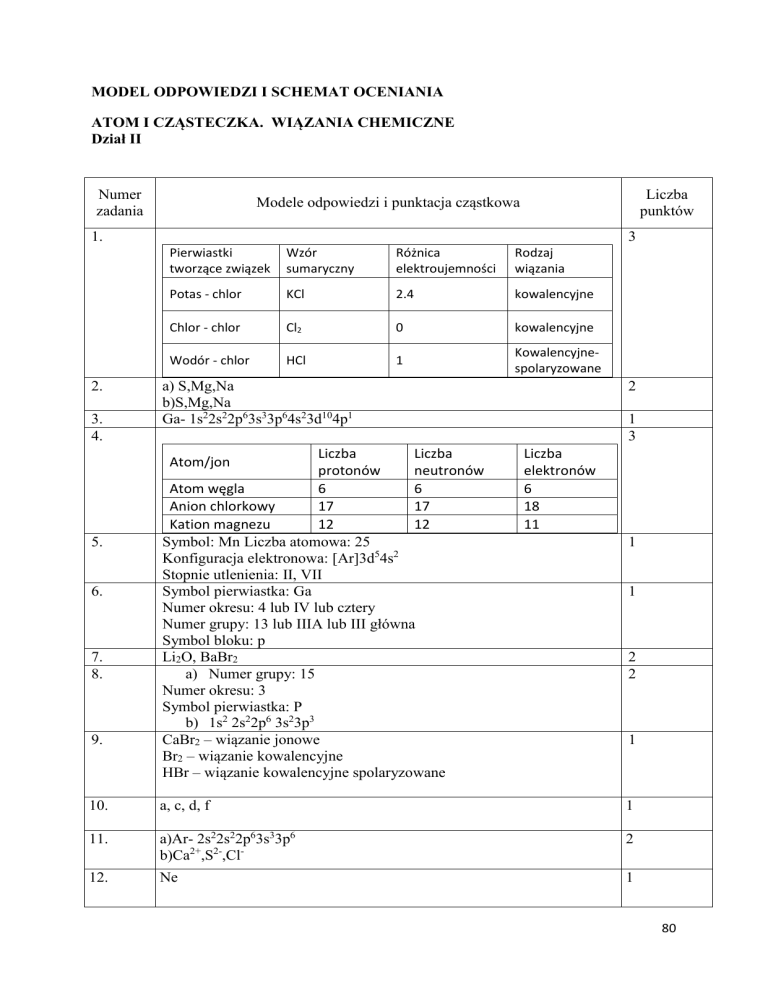
1.
2.
3.
4.
3
Pierwiastki
tworzące związek
Wzór
sumaryczny
Różnica
elektroujemności
Rodzaj
wiązania
Potas - chlor
KCl
2.4
kowalencyjne
Chlor - chlor
Cl2
0
kowalencyjne
Wodór - chlor
HCl
1
Kowalencyjnespolaryzowane
a) S,Mg,Na
b)S,Mg,Na
Ga- 1s22s22p63s33p64s23d104p1
Liczba
Liczba
protonów
neutronów
Atom węgla
6
6
Anion chlorkowy
17
17
Kation magnezu
12
12
Symbol: Mn Liczba atomowa: 25
Konfiguracja elektronowa: [Ar]3d54s2
Stopnie utlenienia: II, VII
Symbol pierwiastka: Ga
Numer okresu: 4 lub IV lub cztery
Numer grupy: 13 lub IIIA lub III główna
Symbol bloku: p
Li2O, BaBr2
a) Numer grupy: 15
Numer okresu: 3
Symbol pierwiastka: P
b) 1s2 2s22p6 3s23p3
CaBr2 – wiązanie jonowe
Br2 – wiązanie kowalencyjne
HBr – wiązanie kowalencyjne spolaryzowane
Atom/jon
5.
6.
7.
8.
9.
2
1
3
Liczba
elektronów
6
18
11
1
1
2
2
1
10.
a, c, d, f
1
11.
a)Ar- 2s22s22p63s33p6
b)Ca2+,S2-,Cl-
2
12.
Ne
1
80
13.
Wiązanie jonowe
14.
a) 1s22s2p4 - suma 8 elektronów = 8 protonów
( Z = 8 ); 8O 3
tlen,
b) K2L8M18N8O2 - suma 38 elektronów = 38 protonów (Z = 38);
38Sr - stront
c) [54Xe]4f145d106s1 - suma 54 + 25 = 79 elektronów = 79 protonów
(Z = 79); 79Au – złoto
2 2 6 2
1s 2s 2p 3s
3
a) n = 3 wskazuje na 3 okres, 3s2 wskazuje na 2 grupę
b) konfiguracja elektronowa 3s2 wskazuje na blok energetyczny s
c) 1s22s22p63s2 (kolor czerwony elektrony walencyjne, kolor
niebieski trzon atomowy)
d) w 3 okresie i 2 grupie znajduje się magnez
15.
1
1s22s22p63s23p4
a) n = 3 wskazuje na 3 okres, 3s23p4 wskazuje na 16 grupę
b) konfiguracja elektronowa 3s23p4 wskazuje na blok energetyczny
p
c) c1s22s22p63s23p4
d) w 3 okresie i 16 grupie znajduje się siarka
1s22s22p63s23p64s23d8
a) n = 4 wskazuje na 4 okres, 4s23d8 wskazuje na 10 grupę
b) konfiguracja elektronowa 4s23d8 wskazuje na blok energetyczny
d
c) 1s22s22p63s23p64s23d8
d) w 4 okresie i 10 grupie znajduje się nikiel
16.
a) pierwiastki 3 okresu: Na, Mg, Al., Si, P, S, Cl, Ar,
b) pierwiastki 15 grupy: N, P, As, Sb, Bi,
c) P
17.
3
3
Dane:
A1 = 14
A2 = 15
ma(E) = 14,0067u (odczytana z układu okresowego pierwiastków
chemicznych)
ma(E) = (m1% * A1 + m2% * A2) / 100%
Mamy dwie niewiadome i tylko jedno równanie, więc nie uda nam się
wyliczyć pożądanej wartości. Musimy więc coś zmienić. Wiemy, że:
m1% + m2% = 100%
zatem:
81
m1 % = x
m2% = 100% - x
i otrzymujemy:
ma(E) = (x* A1 + (100% - x)* A2) / 100%
mnożąc obie strony równania przez 100% dostajemy:
ma(E) * 100% = x* A1 + (100% - x)* A2
podstawiając wartości otrzymujemy:
14,0067 * 100% = 14x + 100*15 – 15x
1400,67 % = -x + 1500 %
-x = -99,33 %
x = 99,33 %
a więc:
m1% = 99,33 %
m2% = 100% - 99,33 % = 0,67 %
Odp: Izotop azotu 14N ma zawartość 99,33 % , a izotop 15N 0,67 %.
18.
19.
20.
21.
22.
23.
Mają wiązania kowalencyjne (atomowe): azot, grafit
3
Mają wiązania kowalencyjne spolaryzowane
(atomowe spolaryzowane): azot, grafit
Mają budowę jonową: bromek sodu
Mogą przewodzić prąd elektryczny w stanie
Stałym: miedź, grafit
Dobrze rozpuszczają się w wodzie: amoniak, bromek sodu
Charakter wiązania: kowalencyjne spolaryzowane.
2
W temperaturze pokojowej i pod ciśnieniem atmosferycznym jest gazem.
Dobrze rozpuszcza się w rozpuszczalnikach polarnych, np. w wodzie.
Powłoka walencyjna atomu H: 1s1 ( jeden elektron niesparowany)
Powłoka walencyjna atomu Br: 4s24p5 (3 pary + 1 elektron
niesparowany)
Różnica elektroujemności ΔE = 2,8 - 2,1 = 0,7 (1 wiązanie kowalencyjne
pojedyncze spolaryzowane sigma)
Najbliższym helowcem dla at. H jest He (at. H brakuje 1 elektronu),
najbliższym
helowcem dla at. Br jest Kr (at. Br brakuje 1 elektronu)
Uwaga ; cząsteczka HCl ma kształt liniowy, cząsteczka jest polarna - jest
dipolem
Mg
III lub 3
2 lub II
Wzór jonu potasu: K+
Wzór jonu siarki: S2–
a) tlen
3
1
1
2
82
24.
25.
26.
b) stront
c) złoto
a) O2
b) Sr
c) Cs
1
A
Ponieważ ma mniejsza gęstość.
1
2
27.
3
28.
2
29.
30.
31.
32.
33.
34.
35.
36.
Cecha
Palność
Przewodnictwo elektryczne
Eten- C2H2
Azotan (III) potasu- KNO3
38.
39.
40.
Diament
Nie pali
Nie przewodzi
- III z wodorem, + V z tlenem
x – procentowa zawartość izotopu 10B
y – procentowa zawartość izotopu 11B
x + y = 100%
𝑀𝑎𝑡.10𝐵 ∗𝑥+𝑀𝑎𝑡.11𝐵 ∗𝑦
10,81 𝑢 ∗ 𝑥 + 11,01 𝑢 ∗𝑦
Mat. B =
=
= 10,81 u
100%
100%
y = 100% - x
10,01 𝑢 ∗x+11,01 u ∗(100%−x)
= 10,81 u
100%
X = 20%, y = 100% - 20% = 80%
a) 2n2 = 32
b) -2, -1, 0,1, 2
c) kulisty
a) [Ar] 4s13d10
b) [Kr] 5s1
c) [Kr] lub [Ar] 4s23d104p6
Kowalencyjne – chlor, azot, tlen
Kowalencyjne spolaryzowane – amoniak, tlenek węgla (IV), woda
Jonowe – sól kuchenna, chlorek potasu, tlenek litu
16
14
a) 6 E i 7 E
32
37.
Grafit
nie pali
przewodzi
33
2
1
1
2
3
3
2
2
36
b) 16E, 16E i 16E
1wiązań 𝜎
1 wiązanie 𝜋
x – procentowa zawartość izotopu 63Cu
y – procentowa zawartość izotopu 65Cu
x + y = 100%
y = (100% - x)
𝑀𝑎𝑡.63𝐶𝑢 ∗𝑥+𝑀𝑎𝑡.65𝐶𝑢 ∗𝑦
62,93 𝑢 ∗ 𝑥 +64,93 (100%−𝑥)
Mat.Cu =
=
= 63,55 u
100%
100%
a) F b) F c) F d) P
a) Al., Mg, Na
b) Na, Mg, Al
1
2
1
2
83
84