WYMAGANIA EDUKACYJNE
Z CHEMII
DLA KLASY I , II i III GIMNAZJUM
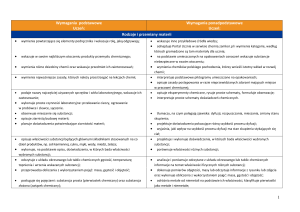
1. Ogólne wymagania edukacyjne na poszczególne oceny z chemii w klasie I, II i III gimnazjum.
Otrzymanie oceny wyższej oznacza spełnienie wymagań także na ocenę niższą
1. Stopień celujący otrzymuje uczeń, który:
wyróżnia się wiedzą i umiejętnościami określonymi w programie nauczania przedmiotu obowiązującymi w danej klasie,
samodzielnie i twórczo rozwija własne uzdolnienia,
zdobytą wiedzę stosuje w rozwiązywaniu problemów teoretycznych i praktycznych,
samodzielnie i twórczo dobiera stosowne rozwiązanie w nowych, nietypowych sytuacjach problemowych,
chętnie podejmuje prace dodatkowe, służy pomocą innym, pomaga w pracach związanych z prawidłowym funkcjonowaniem pracowni
chemicznej,
bierze udział w konkursach i olimpiadach przedmiotowych,
bardzo aktywnie uczestniczy w procesie lekcyjnym.
2. Stopień bardzo dobry otrzymuje uczeń, który:
opanował wiedzę i umiejętności określone w programie nauczania przedmiotu obowiązującego w danej klasie,
potrafi zastosować zdobytą wiedzę w praktyce,
samodzielnie rozwiązuje zadania problemowe i obliczeniowe o dużym stopniu trudności,
wie, jak poprawić ewentualne błędy,
aktywnie uczestniczy w procesie lekcyjnym.
3. Stopień dobry otrzymuje uczeń, który:
dobrze opanował wiadomości określone programem nauczania,
samodzielnie rozwiązuje zadania problemowe i obliczeniowe o średnim stopniu trudności,
zna podstawowe pojęcia i właściwą terminologię z przedmiotu,
czasem popełnia błędy, ale potrafi je wskazać i poprawić,
jest aktywny na lekcji.
4. Stopień dostateczny otrzymuje uczeń, który:
opanował podstawowe treści programowe określone programem nauczania danej klasy,
rozwiązuje proste zadania obliczeniowe i problemowe,
posługuje się podstawowymi pojęciami podczas opisu zjawisk i procesów chemicznych,
stara się poprawiać błędy wskazane przez nauczyciela,
wykazuje zadowalającą aktywność na lekcjach.
5. Stopień dopuszczający otrzymuje uczeń, który:
opanował wiadomości i umiejętności w stopniu dopuszczającym możliwość dalszego kształcenia, posiadając braki,
rozumie podstawowe pojęcia chemiczne, ale zdarzają się mu pomyłki podczas operowania nimi,
korzystając z pomocy nauczyciela rozwiązuje bardzo proste zadania obliczeniowe,
stosuje posiadane wiadomości tylko z pomocą nauczyciela,
ma trudności z zastosowaniem swojej wiedzy w praktyce i operowaniem terminologią chemiczną,
jest mało aktywny na lekcji.
6. Stopień niedostateczny otrzymuje uczeń, który:
nie opanował wiadomości i umiejętności określonych programem nauczania danej klasy,
braki w wiadomościach i umiejętnościach uniemożliwiają kontynuację dalszej nauki z zakresu przedmiotu,
nie potrafi wykonać zadań o podstawowym stopniu trudności, nawet z pomocą nauczyciela, wykazuje postawę bierna.
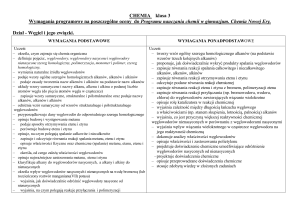
2. Wymagania edukacyjne na poszczególne oceny dla klasy I, II i III gimnazjum.
Otrzymanie oceny wyższej oznacza spełnienie wymagań także na ocenę niższą
KLASA I GIMNAZJUM
(do programu „Świat Chemii”, WSiP )
OCENIANIE ŚRÓDROCZNE
Dział 1. Rodzaje i przemiany materii
Ocena dopuszczająca
Ocena dostateczna
Ocena dobra
Uczeń:
- podaje przykłady obecności chemii
w swoim życiu
- wymienia podstawowe narzędzia
pracy chemika
- zna i stosuje zasady bezpiecznej
pracy w pracowni chemicznej
- dzieli substancje na stałe, ciekłe
i gazowe;
- wskazuje przykłady substancji
stałych, ciekłych i gazowych
w swoim otoczeniu
- wymienia podstawowe właściwości
substancji
- zna wzór na gęstość substancji
- zna podział substancji na metale
i niemetale
- wskazuje przedmioty wykonane
z metali
Uczeń:
‐ wskazuje w swoim najbliższym
otoczeniu produkty przemysłu
chemicznego
‐ wymienia różne dziedziny chemii
oraz wskazuje przedmiot ich
zainteresowań
- rozpoznaje i nazywa podstawowy
sprzęt i naczynia laboratoryjne
- wie, w jakim celu stosuje się
oznaczenia na etykietach
opakowań odczynników
chemicznych i środków czystości
stosowanych w gospodarstwie
domowym
- bada właściwości substancji
- korzysta z danych zawartych
w tabelach (odczytuje gęstość
oraz wartości temperatury
Uczeń:
- wskazuje zawody w wykonywaniu,
których niezbędna jest
znajomość zagadnień
chemicznych
- wyszukuje w dostępnych źródłach
informacje na temat historii
i rozwoju chemii na przestrzeni
dziejów
- potrafi udzielić pierwszej pomocy
w pracowni chemicznej
- określa zastosowanie
podstawowego sprzętu
laboratoryjnego
- identyfikuje substancje
na podstawie przeprowadzonych
badań
- bada właściwości wybranych
metali (w tym przewodzenie
-
-
-
Ocena bardzo dobra
Ocena celująca
Uczeń:
przedstawia zarys historii rozwoju
chemii
wskazuje chemię wśród innych
nauk przyrodniczych
wskazuje związki chemii z innymi
dziedzinami nauki
bezbłędnie posługuje się
podstawowym sprzętem
laboratoryjnym
wyjaśnia, na podstawie budowy
wewnętrznej substancji,
dlaczego ciała stałe mają na ogół
największą gęstość, a gazy
najmniejszą
wskazuje na związek zastosowania
substancji z jej właściwościami
wyjaśnia rolę metali w rozwoju
cywilizacji i gospodarce
- wymienia czynniki powodujące
niszczenie metali
- podaje przykłady niemetali
- podaje właściwości wybranych
niemetali
- sporządza mieszaniny substancji
- podaje przykłady mieszanin
znanych z życia codziennego
wymienia przykładowe metody
rozdzielania mieszanin;
- zna pojęcie reakcji chemicznej;
- podaje co najmniej trzy objawy
reakcji chemicznej;
- dzieli poznane substancje na proste
i złożone.
- posługuje się symbolami
pierwiastków: H, O, N, Cl, S, C,
P, Si, Na, K, Ca, Mg, Fe, Zn, Cu,
Al, Pb, Sn, Ag, Hg;
- definiuje pierwiastek chemiczny;
- wyjaśnia , że substancje
są zbudowane z atomów
- definiuje atom
- wyjaśnia zjawisko dyfuzji
-
-
-
-
-
-
wrzenia i temperatury topnienia
substancji)
zna jednostki gęstości
podstawia dane do wzoru
na gęstość
odróżnia metale od innych
substancji i wymienia ich
właściwości
odczytuje dane tabelaryczne,
dotyczące wartości temperatury
wrzenia i temperatury topnienia
metali
wie, co to są stopy metali
wie, w jakich stanach skupienia
niemetale występują
w przyrodzie
sporządza mieszaniny jednorodne
i niejednorodne
wskazuje przykłady mieszanin
jednorodnych i niejednorodnych
odróżnia mieszaniny jednorodne
od niejednorodnych
odróżnia substancję od mieszaniny
wie, co to jest: dekantacja,
sedymentacja, filtracja,
odparowanie rozpuszczalnika
i krystalizacja
wykazuje na dowolnym
przykładzie różnice między
zjawiskiem fizycznym a reakcją
chemiczną
podaje przykłady przemian
chemicznych znanych z życia
codziennego
ciepła i prądu elektrycznego)
- interpretuje informacje z tabel
chemicznych dotyczące
właściwości metali
- zna skład wybranych stopów metali
- wyjaśnia różnice
we właściwościach metali
i niemetali
- planuje i przeprowadza proste
doświadczenia dotyczące
rozdzielania mieszanin
jednorodnych i niejednorodnych
- montuje zestaw do sączenia
- wyjaśnia, na czym polega metoda
destylacji
- wskazuje w podanych przykładach
przemianę chemiczną i zjawisko
fizyczne
- wyjaśnia, czym jest związek
chemiczny
- wykazuje różnice między
mieszaniną, a związkiem
chemicznym
- wymienia pierwiastki chemiczne
znane w starożytności
- odróżnia modele przedstawiające
drobiny różnych pierwiastków
chemicznych
- wyjaśnia budowę wewnętrzną
atomu, wskazując miejsce
protonów, neutronów
i elektronów
- wskazuje inne przykładowe źródła
wiedzy
człowieka
- tłumaczy, dlaczego metale stapia
się ze sobą
- bada właściwości innych (niż
podanych na lekcji) metali oraz
wyciąga prawidłowe wnioski na
podstawie obserwacji z badań
- wyjaśnia pojęcie: sublimacja
- porównuje właściwości stopu
(mieszaniny metali)
z właściwościami
jego składników
- opisuje rysunek przedstawiający
aparaturę do destylacji
- wskazuje różnice między
właściwościami substancji,
a następnie stosuje je do
rozdzielania mieszanin
- projektuje proste zestawy
doświadczalne do rozdzielania
wskazanych mieszanin
- sporządza kilkuskładnikowe
mieszaniny, a następnie rozdziela
je poznanymi metodami
- podaje, jakie znaczenie miało
pojęcie pierwiastka
w starożytności
- tłumaczy, w jaki sposób tworzy się
symbole pierwiastków
chemicznych
- planuje i przeprowadza
doświadczenia potwierdzające
dyfuzję zachodzącą w ciałach
o różnych stanach skupienia
- przyporządkowuje nazwom
pierwiastków chemicznych ich
symbole i odwrotnie
- tłumaczy, na czym polega zjawisko
dyfuzji
- podaje dowody ziarnistości materii
- definiuje pierwiastek chemiczny
jako zbiór prawie jednakowych
atomów
‐ wyjaśnia jaki wpływ na szybkość
procesu dyfuzji ma stan skupienia
stykających się ciał
‐ porównuje właściwości różnych
substancji
‐ przeprowadza obliczenia z
wykorzystaniem pojęć: masa, gęstość
i objętość
‐ tłumaczy skąd pochodzą symbole
pierwiastków chemicznych, podaje
przykłady
‐ wskazuje te różnice między
właściwościami fizycznymi
składników mieszaniny, które
umożliwiają ich rozdzielenie
‐ projektuje i wykonuje
doświadczenia, w których bada
właściwości wybranych substancji
‐ dokonuje pomiarów objętości, masy
lub odczytuje informacje z rysunku,
zdjęcia
‐ przewiduje właściwości stopu na
podstawie właściwości jego
składników
-oblicza zadania z wykorzystaniem
gęstości o większym stopniu
trudności, jednocześnie z
uwzględnieniem przeliczania
jednostek
-opisuje eksperyment chemiczny,
uwzględniając: szkło, sprzęt
laboratoryjny, odczynniki, schemat,
obserwacje i wnioski
Dział 2. Budowa materii
Ocena dopuszczająca
Uczeń:
- definiuje atom
- zna pojęcia: proton, neutron,
elektron, elektron walencyjny,
konfiguracja elektronowa
- kojarzy nazwisko Mendelejewa
z układem okresowym
pierwiastków chemicznych
- zna treść prawa okresowości
- wie, że pionowe kolumny
w układzie okresowym
pierwiastków chemicznych to
grupy, a poziome rzędy to okresy
- posługuje się układem okresowym
pierwiastków chemicznych
w celu odczytania symboli
pierwiastków i ich charakteru
chemicznego
- wie, co to są izotopy
- wymienia przykłady izotopów
- wymienia przykłady zastosowań
izotopów
- odczytuje z układu okresowego
pierwiastków chemicznych
podstawowe informacje
niezbędne do określenia budowy
atomu: numer grupy i numer
okresu oraz liczbę atomową
i liczbę masową
‐ zdaje sobie sprawę, ze poglądy na
Ocena dostateczna
-
-
-
-
-
-
-
-
Ocena dobra
Ocena bardzo dobra
Ocena celująca
Uczeń:
Uczeń:
Uczeń:
definiuje pierwiastek chemiczny
- odróżnia modele przedstawiające
- zna historię rozwoju pojęcia atom
jako zbiór prawie jednakowych
drobiny różnych pierwiastków
- tłumaczy, dlaczego wprowadzono
atomów
chemicznych
jednostkę masy atomowej u
podaje symbole, masy i ładunki
- wyjaśnia budowę wewnętrzną
- wyjaśnia, jakie znaczenie mają
protonów, neutronów
atomu, wskazując miejsce
elektrony walencyjne
i elektronów
protonów, neutronów
- omawia, jak zmienia się aktywność
wie, co to jest powłoka
i elektronów
metali i niemetali w grupach
elektronowa
- wie, jak tworzy się nazwy grup
i okresach
oblicza liczby protonów,
- wskazuje w układzie okresowym - projektuje i buduje modele jąder
elektronów i neutronów
pierwiastków chemicznych
atomowych izotopów
znajdujących się w atomach
miejsce metali i niemetali
- charakteryzuje przemiany:
danego pierwiastka
- tłumaczy, dlaczego masa atomowa - oblicza średnią masę atomową
chemicznego, korzystając
pierwiastka chemicznego ma
pierwiastka chemicznego na
z liczby atomowej i masowej
wartość ułamkową
podstawie mas atomowych
określa rozmieszczenie elektronów - oblicza liczbę neutronów
poszczególnych izotopów i ich
w poszczególnych powłokach
w podanych izotopach
zawartości procentowej
elektronowych i wskazuje
pierwiastków chemicznych
- szuka rozwiązań dotyczących
elektrony walencyjne
- wskazuje zagrożenia wynikające ze
składowania odpadów
wie, jaki był wkład D.Mendelejewa
stosowania izotopów
promieniotwórczych
w prace nad uporządkowaniem
promieniotwórczych
- tłumaczy, dlaczego pierwiastki
pierwiastków chemicznych
- bierze udział w dyskusji na temat
chemiczne znajdujące się w tej
rozumie prawo okresowości
wad i zalet energetyki jądrowej;
samej grupie mają podobne
wskazuje w układzie okresowym
wskazuje położenie pierwiastka
właściwości
pierwiastków chemicznych
w układzie okresowym
- tłumaczy, dlaczego gazy szlachetne
grupy i okresy
pierwiastków chemicznych na
są pierwiastkami mało aktywnymi
porządkuje podane pierwiastki
podstawie budowy jego atomu
chemicznie.
chemiczne według wzrastającej - odróżnia modele przedstawiające ‐ przelicza masę atomową wyrażoną
liczby atomowej
drobiny różnych pierwiastków
w atomowych jednostkach masy u na
wyszukuje w dostępnych mu
chemicznych
gramy, wyniki podaje w notacji
temat budowy materii zmieniały się
na przestrzeni dziejów
-
-
źródłach informacje
o właściwościach i aktywności
chemicznej podanych
pierwiastków
wyjaśnia, co to są izotopy
nazywa i zapisuje symbolicznie
izotopy pierwiastków
chemicznych
wyjaśnia, na czym polegają
przemiany promieniotwórcze
omawia wpływ promieniowania
jądrowego na organizmy
określa na podstawie położenia
w układzie okresowym budowę
atomu danego pierwiastka i jego
charakter chemiczny
- wyjaśnia budowę wewnętrzną
atomu, wskazując miejsce
protonów, neutronów
i elektronów
- wie, jak tworzy się nazwy grup
- wskazuje w układzie okresowym
pierwiastków chemicznych
miejsce metali i niemetali
- tłumaczy, dlaczego masa atomowa
pierwiastka chemicznego ma
wartość ułamkową
- oblicza liczbę neutronów
w podanych izotopach
pierwiastków chemicznych
- wskazuje zagrożenia wynikające ze
stosowania izotopów
promieniotwórczych
- bierze udział w dyskusji na temat
wad i zalet energetyki jądrowej
wykładniczej
‐ wymienia oddziaływania
utrzymujące atom w całości
‐ porównuje aktywność chemiczną
pierwiastków należących do tej
samej grupy na przykładzie litowców
i fluorowców oraz należących do
tego samego okresu na przykładzie
okresu trzeciego
‐ podaje przykłady pierwiastków
posiadających odmiany izotopowe ‐
określa znaczenie badań
Marii Skłodowskiej Curie dla
rozwoju wiedzy na temat zjawiska
promieniotwórczości
‐ oblicza masę atomową wskazanego
pierwiastka na podstawie
liczb masowych i zawartości
procentowej w przyrodzie trwałych
izotopów
‐ oblicza zawartość procentową
izotopów w przyrodzie na
podstawie masy atomowej
pierwiastka i liczb masowych
trwałych izotopów
-interpretuje treść prawa
okresowości w oparciu o układ
okresowy pierwiastków
–rysuje na podstawie
układu okresowego pierwiastków
modele planetarne atomów o liczbie
atomowej 87–89
–uzasadnia mocne i słabe strony
szanse i zagrożenia wynikające z
zastosowania izotopów
promieniotwórczych,
–oblicza średnią masę atomową
pierwiastka chemicznego
–oblicza zawartość procentową
izotopów w pierwiastku chemicznym
-opisuje eksperyment chemiczny,
uwzględniając: szkło, sprzęt
laboratoryjny, odczynniki, schemat,
obserwacje i wnioski
Dział 3. Wiązania i reakcje chemiczne
Ocena dopuszczająca
-
-
-
-
-
-
Uczeń:
zapisuje w sposób symboliczny
aniony i kationy
definiuje pojęcie jonów
odróżnia atom od cząsteczki
wie, na czym polega wiązanie
jonowe, a na czym wiązanie
atomowe (kowalencyjne)
odczytuje wartościowość pierwiastka
z układu okresowego pierwiastków
chemicznych
wskazuje substraty i produkty
nazywa tlenki zapisane za pomocą
wzoru sumarycznego
odczytuje masy atomowe
pierwiastków z układu
okresowego pierwiastków
chemicznych
zapisuje proste równania reakcji
na podstawie zapisu słownego
zna trzy typy reakcji chemicznych
łączenie (syntezę), rozkład
(analizę) i wymianę
podaje po jednym przykładzie
reakcji łączenia (syntezy),
rozkładu (analizy) i wymiany
zna treść prawa zachowania masy;
zna treść prawa stałości składu.
Ocena dostateczna
Ocena dobra
Ocena bardzo dobra,
Ocena celująca
Uczeń:
Uczeń:
Uczeń:
-rozróżnia typy wiązań
‐ wyjaśnia pomiędzy molekułami:
‐ przewiduje rodzaj wiązania
przedstawione w sposób modelowy atomem, cząsteczką, jonem:
pomiędzy atomami
‐ rysuje schemat powstawania wiązań kationem i anionem
‐ wskazuje związki w których
jonowych i kowalencyjnych na
‐ tłumaczy mechanizm powstawania występuje wiązanie kowalencyjne
prostych przykładach
jonów i wiązania jonowego
spolaryzowane
‐ tłumaczy pojęcia oktetu i dubletu ‐ ‐ zapisuje elektronowo mechanizm
‐ wyjaśnia w jaki sposób polaryzacja
opisuje jak powstają jony
powstawania jonów, na przykładzie wiązania wpływa na właściwości
‐ interpretuje zapisy H2, 2H, 2H2, itp. Na, Mg, Al, Cl, S
związku
- opisuje rolę elektronów
‐ oblicza liczby atomów
‐ przewiduje właściwości związku
walencyjnych w łączeniu się atomów na podstawie rodzaju wiązań (stan
poszczególnych pierwiastków
chemicznych na podstawie zapisów ‐ na przykładzie cząsteczek H2, Cl2, skupienia, weryfikuje przewidywania
typu: 3 H2O
N2, CO2 , H2O, HCl, NH3 opisuje
korzystając z różnorodnych źródeł
wiedzy)
‐ porównuje właściwości związków powstawanie wiązań atomowych
(kowalencyjnych), zapisuje wzory
‐ wyjaśnia, dlaczego nie we
kowalencyjnych i jonowych (stan
sumaryczne
i
strukturalne
tych
skupienia, rozpuszczalność w
wszystkich przypadkach związków
cząsteczek
wodzie, temperatury topnienia i
może rysować wzory strukturalne
‐ ilustruje graficznie powstawanie
wrzenia)
‐ wykonuje różnorodne obliczenia,
wiązań
jonowych
i
wiązań
‐ odczytuje z układu okresowego
np. pozwalające ustalać wzory
kowalencyjnych
wartościowość maksymalną dla
sumaryczne związków o podanym
‐ rysuje wzór strukturalny cząsteczki stosunku masowym, wyznacza
pierwiastków grup 1., 2., 13., 14.,
15., 16. i 17. (względem tlenu i
związku dwupierwiastkowego
indeksy stechiometryczne dla
wodoru)
(o wiązaniach kowalencyjnych)
związków o znanej masie atomowej
o znanych wartościowościach
itp.
‐ ustala dla prostych związków
‐ układa równania reakcji
dwupierwiastkowych, na przykładzie pierwiastków
tlenków: nazwę na podstawie wzoru ‐ odróżnia wzory elektronowe
przedstawionych w formie
sumarycznego; wzór sumaryczny na kreskowe, strukturalne
chemografów
podstawie nazwy; wzór sumaryczny ‐ ustala wzory sumaryczne
‐ wykonuje obliczenia dotyczące
na podstawie wartościowości
chlorków, siarczków i strukturalne
równań reakcji, korzystając
‐ zna wartościowości niektórych
związków kowalencyjnych
z proporcji
pierwiastków (wodoru, tlenu,
litowców, berylowców, żelaza,
miedzi, węgla, siarki)
‐ oblicza masy cząsteczkowe
prostych związków chemicznych
‐ definiuje pojęcia: reakcje
egzoenergetyczne i reakcje
endoenergetyczne
‐ zapisuje proste równania reakcji, na
podstawie zapisu słownego
‐ określa typ reakcji
‐ dobiera współczynniki w
równaniach reakcji chemicznych
‐ wykonuje proste obliczenia oparte
na prawie zachowania masy i stałości
składu
‐ określa wartościowość pierwiastka
na podstawie wzoru sumarycznego
jego tlenku/chlorku/siarczku
‐ dokonuje obliczeń związanych z
zastosowaniem prawa zachowania
masy i prawa stałości składu
‐ samodzielnie formułuje obserwacje
i wnioski
‐ pisze równania reakcji
chemicznych na podstawie opisu
słownego oraz modelowego
‐ uzupełnia równania reakcji
chemicznych
‐ podaje przykłady różnych typów
reakcji
- wyjaśnia, od czego zależy
trwałości konfiguracji
elektronowej
- rozumie istotę przemian
chemicznych w ujęciu teorii
atomistyczno-cząsteczkowej
-opisuje eksperyment chemiczny,
uwzględniając: szkło, sprzęt
laboratoryjny, odczynniki, schemat,
obserwacje i wnioski
Ocenę niedostateczną
Otrzymuje uczeń, który nie spełnia wymagań na ocenę dopuszczającą. Wykazuje rażący brak wiadomości i umiejętności, które uniemożliwiają mu
świadome i aktywne uczestnictwo w lekcjach chemii. Nie potrafi wykonać zadań o elementarnym stopniu trudności, nawet z pomocą nauczyciela.
OCENIANIE ROCZNE
Ocena roczna obejmuje także wymagania na ocenę śródroczną.
Dział 1. Rodzaje i przemiany materii
Ocena dopuszczająca
-
-
Uczeń:
podaje przykłady obecności chemii
w swoim życiu
wymienia podstawowe narzędzia
pracy chemika
zna i stosuje zasady bezpiecznej
pracy w pracowni chemicznej
dzieli substancje na stałe, ciekłe
i gazowe
wskazuje przykłady substancji
stałych, ciekłych i gazowych
w swoim otoczeniu
wymienia podstawowe właściwości
substancji
zna wzór na gęstość substancji
zna podział substancji na metale
i niemetale
wskazuje przedmioty wykonane
z metali
wymienia czynniki powodujące
niszczenie metali
podaje przykłady niemetali
podaje właściwości wybranych
niemetali
sporządza mieszaniny substancji
podaje przykłady mieszanin
Ocena dostateczna
Uczeń:
-wskazuje w swoim najbliższym
otoczeniu produkty przemysłu
chemicznego
‐ wymienia różne dziedziny chemii
oraz wskazuje przedmiot ich
zainteresowań
- rozpoznaje i nazywa podstawowy
sprzęt i naczynia laboratoryjne
- wie, w jakim celu stosuje się
oznaczenia na etykietach
opakowań odczynników
chemicznych i środków czystości
stosowanych w gospodarstwie
domowym
- bada właściwości substancji
- korzysta z danych zawartych
w tabelach (odczytuje gęstość
oraz wartości temperatury
wrzenia i temperatury topnienia
substancji)
- zna jednostki gęstości
- podstawia dane do wzoru
na gęstość
- odróżnia metale od innych
substancji i wymienia ich
Ocena dobra
-
-
-
-
-
-
-
Uczeń:
wskazuje zawody w wykonywaniu,
których niezbędna jest
znajomość zagadnień
chemicznych
wyszukuje w dostępnych źródłach
informacje na temat historii
i rozwoju chemii na przestrzeni
dziejów
potrafi udzielić pierwszej pomocy
w pracowni chemicznej
określa zastosowanie
podstawowego sprzętu
laboratoryjnego
identyfikuje substancje
na podstawie przeprowadzonych
badań
bada właściwości wybranych
metali (w tym przewodzenie
ciepła i prądu elektrycznego)
interpretuje informacje z tabel
chemicznych dotyczące
właściwości metali
zna skład wybranych stopów metali
wyjaśnia różnice
we właściwościach metali
-
-
-
-
Ocena bardzo dobra
Ocena celująca
Uczeń:
przedstawia zarys historii rozwoju
chemii
wskazuje chemię wśród innych
nauk przyrodniczych
wskazuje związki chemii z innymi
dziedzinami nauki
bezbłędnie posługuje się
podstawowym sprzętem
laboratoryjnym
wyjaśnia, na podstawie budowy
wewnętrznej substancji,
dlaczego ciała stałe mają na ogół
największą gęstość, a gazy
najmniejszą
wskazuje na związek zastosowania
substancji z jej właściwościami
wyjaśnia rolę metali w rozwoju
cywilizacji i gospodarce
człowieka
tłumaczy, dlaczego metale stapia
się ze sobą
bada właściwości innych (niż
podanych na lekcji) metali oraz
wyciąga prawidłowe wnioski na
podstawie obserwacji z badań
znanych z życia codziennego
wymienia przykładowe metody
rozdzielania mieszanin;
- zna pojęcie reakcji chemicznej;
- podaje co najmniej trzy objawy
reakcji chemicznej;
- dzieli poznane substancje na proste
i złożone.
- posługuje się symbolami
pierwiastków: H, O, N, Cl, S, C,
P, Si, Na, K, Ca, Mg, Fe, Zn, Cu,
Al, Pb, Sn, Ag, Hg;
- definiuje pierwiastek chemiczny;
- wyjaśnia , że substancje
są zbudowane z atomów
- definiuje atom
- wyjaśnia zjawisko dyfuzji
właściwości
- odczytuje dane tabelaryczne,
dotyczące wartości temperatury
wrzenia i temperatury topnienia
metali
- wie, co to są stopy metali
- wie, w jakich stanach skupienia
niemetale występują
w przyrodzie
- sporządza mieszaniny jednorodne
i niejednorodne
- wskazuje przykłady mieszanin
jednorodnych i niejednorodnych
- odróżnia mieszaniny jednorodne
od niejednorodnych
- odróżnia substancję od mieszaniny
- wie, co to jest: dekantacja,
sedymentacja, filtracja,
odparowanie rozpuszczalnika
i krystalizacja
- wykazuje na dowolnym
przykładzie różnice między
zjawiskiem fizycznym a reakcją
chemiczną
- podaje przykłady przemian
chemicznych znanych z życia
codziennego
- przyporządkowuje nazwom
pierwiastków chemicznych ich
symbole i odwrotnie
- tłumaczy, na czym polega zjawisko
dyfuzji
- podaje dowody ziarnistości materii
- definiuje pierwiastek chemiczny
i niemetali
- planuje i przeprowadza proste
doświadczenia dotyczące
rozdzielania mieszanin
jednorodnych i niejednorodnych
- montuje zestaw do sączenia
- wyjaśnia, na czym polega metoda
destylacji
- wskazuje w podanych przykładach
przemianę chemiczną i zjawisko
fizyczne
- wyjaśnia, czym jest związek
chemiczny
- wykazuje różnice między
mieszaniną, a związkiem
chemicznym
- wymienia pierwiastki chemiczne
znane w starożytności
- odróżnia modele przedstawiające
drobiny różnych pierwiastków
chemicznych
- wyjaśnia budowę wewnętrzną
atomu, wskazując miejsce
protonów, neutronów
i elektronów
- wskazuje inne przykładowe źródła
wiedzy
‐ wyjaśnia jaki wpływ na szybkość
procesu dyfuzji ma stan skupienia
stykających się ciał
‐ porównuje właściwości różnych
substancji
‐ przeprowadza obliczenia z
wykorzystaniem pojęć: masa, gęstość
- wyjaśnia pojęcie: sublimacja
- porównuje właściwości stopu
(mieszaniny metali)
z właściwościami
jego składników
- opisuje rysunek przedstawiający
aparaturę do destylacji
- wskazuje różnice między
właściwościami substancji,
a następnie stosuje je do
rozdzielania mieszanin
- projektuje proste zestawy
doświadczalne do rozdzielania
wskazanych mieszanin
- sporządza kilkuskładnikowe
mieszaniny, a następnie rozdziela
je poznanymi metodami
- podaje, jakie znaczenie miało
pojęcie pierwiastka
w starożytności
- tłumaczy, w jaki sposób tworzy się
symbole pierwiastków
chemicznych
- planuje i przeprowadza
doświadczenia potwierdzające
dyfuzję zachodzącą w ciałach
o różnych stanach skupienia
‐ projektuje i wykonuje
doświadczenia, w których bada
właściwości wybranych substancji
‐ dokonuje pomiarów objętości, masy
lub odczytuje informacje z rysunku,
zdjęcia
‐ przewiduje właściwości stopu na
jako zbiór prawie jednakowych
atomów
i objętość
‐ tłumaczy skąd pochodzą symbole
pierwiastków chemicznych, podaje
przykłady
‐ wskazuje te różnice między
właściwościami fizycznymi
składników mieszaniny, które
umożliwiają ich rozdzielenie
podstawie właściwości jego
składników
-oblicza zadania z wykorzystaniem
gęstości o większym stopniu
trudności, jednocześnie z
uwzględnieniem przeliczania
jednostek
-opisuje eksperyment chemiczny,
uwzględniając: szkło, sprzęt
laboratoryjny, odczynniki, schemat,
obserwacje i wnioski
Dział 2. Budowa Materii
Ocena dopuszczająca
-
-
-
-
Uczeń:
definiuje atom
zna pojęcia: proton, neutron,
elektron, elektron walencyjny,
konfiguracja elektronowa
kojarzy nazwisko Mendelejewa
z układem okresowym
pierwiastków chemicznych
zna treść prawa okresowości
wie, że pionowe kolumny
w układzie okresowym
pierwiastków chemicznych to
grupy, a poziome rzędy to okresy
posługuje się układem okresowym
pierwiastków chemicznych
w celu odczytania symboli
-
-
-
-
Ocena dostateczna
Ocena dobra
Uczeń:
definiuje pierwiastek chemiczny
jako zbiór prawie jednakowych
atomów
podaje symbole, masy i ładunki
protonów, neutronów
i elektronów
wie, co to jest powłoka
elektronowa
oblicza liczby protonów,
elektronów i neutronów
znajdujących się w atomach
danego pierwiastka
chemicznego, korzystając
z liczby atomowej i masowej
określa rozmieszczenie elektronów
Uczeń:
odróżnia modele przedstawiające
drobiny różnych pierwiastków
chemicznych
wyjaśnia budowę wewnętrzną
atomu, wskazując miejsce
protonów, neutronów
i elektronów
wie, jak tworzy się nazwy grup
wskazuje w układzie okresowym
pierwiastków chemicznych
miejsce metali i niemetali
tłumaczy, dlaczego masa atomowa
pierwiastka chemicznego ma
wartość ułamkową
oblicza liczbę neutronów
-
-
-
-
-
-
-
Ocena bardzo dobra
Ocena celująca
Uczeń:
zna historię rozwoju pojęcia atom
tłumaczy, dlaczego wprowadzono
jednostkę masy atomowej u
wyjaśnia, jakie znaczenie mają
elektrony walencyjne
omawia, jak zmienia się aktywność
metali i niemetali w grupach
i okresach
projektuje i buduje modele jąder
atomowych izotopów
charakteryzuje przemiany: ;
oblicza średnią masę atomową
pierwiastka chemicznego na
podstawie mas atomowych
poszczególnych izotopów i ich
pierwiastków i ich charakteru
chemicznego
- wie, co to są izotopy
- wymienia przykłady izotopów
- wymienia przykłady zastosowań
izotopów
- odczytuje z układu okresowego
pierwiastków chemicznych
podstawowe informacje
niezbędne do określenia budowy
atomu: numer grupy i numer
okresu oraz liczbę atomową
i liczbę masową
‐ zdaje sobie sprawę, ze poglądy na
temat budowy materii zmieniały się
na przestrzeni dziejów
-
-
-
-
-
-
w poszczególnych powłokach
elektronowych i wskazuje
elektrony walencyjne
wie, jaki był wkład D.Mendelejewa
w prace nad uporządkowaniem
pierwiastków chemicznych
rozumie prawo okresowości
wskazuje w układzie okresowym
pierwiastków chemicznych
grupy i okresy
porządkuje podane pierwiastki
chemiczne według wzrastającej
liczby atomowej
wyszukuje w dostępnych mu
źródłach informacje
o właściwościach i aktywności
chemicznej podanych
pierwiastków
wyjaśnia, co to są izotopy
nazywa i zapisuje symbolicznie
izotopy pierwiastków
chemicznych
wyjaśnia, na czym polegają
przemiany promieniotwórcze
omawia wpływ promieniowania
jądrowego na organizmy
określa na podstawie położenia
w układzie okresowym budowę
atomu danego pierwiastka i jego
charakter chemiczny
-
-
-
-
-
-
-
-
-
w podanych izotopach
pierwiastków chemicznych
wskazuje zagrożenia wynikające ze
stosowania izotopów
promieniotwórczych
bierze udział w dyskusji na temat
wad i zalet energetyki jądrowej;
wskazuje położenie pierwiastka
w układzie okresowym
pierwiastków chemicznych na
podstawie budowy jego atomu
odróżnia modele przedstawiające
drobiny różnych pierwiastków
chemicznych
wyjaśnia budowę wewnętrzną
atomu, wskazując miejsce
protonów, neutronów
i elektronów
wie, jak tworzy się nazwy grup
wskazuje w układzie okresowym
pierwiastków chemicznych
miejsce metali i niemetali
tłumaczy, dlaczego masa atomowa
pierwiastka chemicznego ma
wartość ułamkową
oblicza liczbę neutronów
w podanych izotopach
pierwiastków chemicznych
wskazuje zagrożenia wynikające ze
stosowania izotopów
promieniotwórczych
bierze udział w dyskusji na temat
wad i zalet energetyki jądrowej
zawartości procentowej
- szuka rozwiązań dotyczących
składowania odpadów
promieniotwórczych
- tłumaczy, dlaczego pierwiastki
chemiczne znajdujące się w tej
samej grupie mają podobne
właściwości
- tłumaczy, dlaczego gazy szlachetne
są pierwiastkami mało aktywnymi
chemicznie.
‐ przelicza masę atomową wyrażoną
w atomowych jednostkach masy u na
gramy, wyniki podaje w notacji
wykładniczej
‐ wymienia oddziaływania
utrzymujące atom w całości
‐ porównuje aktywność chemiczną
pierwiastków należących do tej
samej grupy na przykładzie litowców
i fluorowców oraz należących do
tego samego okresu na przykładzie
okresu trzeciego
‐ podaje przykłady pierwiastków
posiadających odmiany izotopowe ‐
określa znaczenie badań Marii
Skłodowskiej Curie dla rozwoju
wiedzy na temat zjawiska
promieniotwórczości
‐ oblicza masę atomową wskazanego
pierwiastka na podstawie liczb
masowych i zawartości procentowej
w przyrodzie trwałych izotopów
‐ oblicza zawartość procentową
izotopów w przyrodzie na podstawie
masy atomowej pierwiastka i liczb
masowych trwałych izotopów
-interpretuje treść prawa okresowości
w oparciu o układ okresowy
pierwiastków
–rysuje na podstawie układu
okresowego pierwiastków modele
planetarne atomów o liczbie
atomowej 87–89
–uzasadnia mocne i słabe strony
szanse i zagrożenia wynikające z
zastosowania izotopów
promieniotwórczych,
–oblicza średnią masę atomową
pierwiastka chemicznego
–oblicza zawartość procentową
izotopów w pierwiastku chemicznym
-opisuje eksperyment chemiczny,
uwzględniając: szkło, sprzęt
laboratoryjny, odczynniki, schemat,
obserwacje i wnioski
Dział 3. Wiązania i reakcje chemiczne
Ocena dopuszczająca
-
-
-
-
-
-
Uczeń:
zapisuje w sposób symboliczny
aniony i kationy
definiuje pojęcie jonów
odróżnia atom od cząsteczki
wie, na czym polega wiązanie
jonowe, a na czym wiązanie
atomowe (kowalencyjne)
odczytuje wartościowość pierwiastka
z układu okresowego pierwiastków
chemicznych
wskazuje substraty i produkty
nazywa tlenki zapisane za pomocą
wzoru sumarycznego
odczytuje masy atomowe
pierwiastków z układu
okresowego pierwiastków
chemicznych
zapisuje proste równania reakcji
na podstawie zapisu słownego
zna trzy typy reakcji chemicznych
łączenie (syntezę), rozkład
(analizę) i wymianę
podaje po jednym przykładzie
reakcji łączenia (syntezy),
rozkładu (analizy) i wymiany
zna treść prawa zachowania masy;
zna treść prawa stałości składu.
Ocena dostateczna
Ocena dobra
Ocena bardzo dobra,
Ocena celująca
Uczeń:
Uczeń:
Uczeń:
- rozróżnia typy wiązań
- wyjaśnia pomiędzy molekułami:
- przewiduje rodzaj wiązania
przedstawione w sposób modelowy atomem, cząsteczką, jonem:
pomiędzy atomami
‐ rysuje schemat powstawania wiązań kationem i anionem
‐ wskazuje związki w których
‐ tłumaczy mechanizm powstawania występuje wiązanie kowalencyjne
jonowych i kowalencyjnych na
prostych przykładach
jonów i wiązania jonowego
spolaryzowane
‐ tłumaczy pojęcia oktetu i dubletu ‐ ‐ zapisuje elektronowo mechanizm
‐ wyjaśnia w jaki sposób polaryzacja
opisuje jak powstają jony
powstawania jonów, na przykładzie wiązania wpływa na właściwości
związku
‐ interpretuje zapisy H2, 2H, 2H2, itp. Na, Mg, Al, Cl, S
- opisuje rolę elektronów
‐ przewiduje właściwości związku
‐ oblicza liczby atomów
walencyjnych w łączeniu się atomów na podstawie rodzaju wiązań (stan
poszczególnych pierwiastków
chemicznych na podstawie zapisów ‐ na przykładzie cząsteczek H2, Cl2, skupienia, weryfikuje przewidywania
N2, CO2 , H2O, HCl, NH3 opisuje
korzystając z różnorodnych źródeł
typu: 3 H2O
wiedzy)
‐ porównuje właściwości związków powstawanie wiązań atomowych
(kowalencyjnych),
zapisuje
wzory
‐ wyjaśnia, dlaczego nie we
kowalencyjnych i jonowych (stan
sumaryczne
i
strukturalne
tych
wszystkich przypadkach związków
skupienia, rozpuszczalność w
cząsteczek
może rysować wzory strukturalne
wodzie, temperatury topnienia i
‐
ilustruje
graficznie
powstawanie
‐ wykonuje różnorodne obliczenia,
wrzenia)
wiązań
jonowych
i
wiązań
np. pozwalające ustalać wzory
‐ odczytuje z układu okresowego
kowalencyjnych
sumaryczne związków o podanym
wartościowość maksymalną dla
‐ rysuje wzór strukturalny cząsteczki stosunku masowym, wyznacza
pierwiastków grup 1., 2., 13., 14.,
związku dwupierwiastkowego
indeksy stechiometryczne dla
15., 16. i 17. (względem tlenu i
(o wiązaniach kowalencyjnych)
związków o znanej masie atomowej
wodoru)
o znanych wartościowościach
itp.
‐ ustala dla prostych związków
pierwiastków
‐ układa równania reakcji
dwupierwiastkowych, na przykładzie
przedstawionych w formie
tlenków: nazwę na podstawie wzoru ‐ odróżnia wzory elektronowe
chemografów
sumarycznego; wzór sumaryczny na kreskowe, strukturalne
‐ wykonuje obliczenia dotyczące
podstawie nazwy; wzór sumaryczny ‐ ustala wzory sumaryczne
na podstawie wartościowości
chlorków, siarczków i strukturalne
równań reakcji, korzystając
związków kowalencyjnych
z proporcji
‐ zna wartościowości niektórych
pierwiastków (wodoru, tlenu,
litowców, berylowców, żelaza,
miedzi, węgla, siarki)
‐ oblicza masy cząsteczkowe
prostych związków chemicznych
‐ definiuje pojęcia: reakcje
egzoenergetyczne i reakcje
endoenergetyczne
‐ zapisuje proste równania reakcji, na
podstawie zapisu słownego
‐ określa typ reakcji
‐ dobiera współczynniki w
równaniach reakcji chemicznych
‐ wykonuje proste obliczenia oparte
na prawie zachowania masy i stałości
składu
‐ określa wartościowość pierwiastka
na podstawie wzoru sumarycznego
jego tlenku/chlorku/siarczku
‐ dokonuje obliczeń związanych z
zastosowaniem prawa zachowania
masy i prawa stałości składu
‐ samodzielnie formułuje obserwacje
i wnioski
‐ pisze równania reakcji
chemicznych na podstawie opisu
słownego oraz modelowego
‐ uzupełnia równania reakcji
chemicznych
‐ podaje przykłady różnych typów
reakcji
- wyjaśnia, od czego zależy trwałość
konfiguracji elektronowej
- rozumie istotę przemian
chemicznych w ujęciu teorii
atomistyczno-cząsteczkowej
-opisuje eksperyment chemiczny,
uwzględniając: szkło, sprzęt
laboratoryjny, odczynniki, schemat,
obserwacje i wnioski
Dział 4. Gazy
Ocena dopuszczająca
-
-
-
Uczeń:
przedstawia dowody na istnienie
powietrza
wie, z jakich substancji składa się
powietrze
opisuje na schemacie obieg tlenu
w przyrodzie
definiuje tlenek
podaje, jakie są zastosowania tlenu
wyjaśnia znaczenie azotu dla
organizmów
podaje podstawowe zastosowania
azotu
odczytuje z układu okresowego
nazwy pierwiastków należących
do18. grupy
zna wzór sumaryczny i strukturalny
tlenku węgla(IV)
wymienia podstawowe
zastosowania tlenku węgla(IV)
omawia podstawowe właściwości
wodoru
wymienia praktyczne zastosowania
wodoru
wymienia źródła zanieczyszczeń
powietrza
wyjaśnia skutki zanieczyszczeń
powietrza dla przyrody
i człowieka
wymienia podstawowe
Ocena dostateczna
-
-
-
-
Uczeń:
bada skład oraz podstawowe
właściwości powietrza
tłumaczy, dlaczego bez tlenu nie
byłoby życia na Ziemi
wskazuje źródła pochodzenia
ozonu oraz określa jego
znaczenie dla organizmów
podaje podstawowe zastosowania
praktyczne kilku wybranych
tlenków
proponuje spalanie jako sposób
otrzymywania tlenków
ustala nazwy tlenków na podstawie
wzorów
ustala wzory sumaryczne tlenków
na podstawie nazwy
oblicza masę cząsteczkową
wybranych tlenków
uzupełnia współczynniki
stechiometryczne w równaniach
reakcji otrzymywania tlenków
metodą utleniania pierwiastków
omawia właściwości azotu
wyjaśnia znaczenie azotu dla
organizmów
wymienia źródła tlenku węgla(IV)
wyjaśnia znaczenie tlenku
węgla(IV) dla organizmów
przeprowadza identyfikację tlenku
Ocena dobra
-
-
-
-
-
Uczeń:
oblicza objętość poszczególnych
składników powietrza
w pomieszczeniu o podanych
wymiarach
rozumie, dlaczego zmienia się
naturalny skład powietrza
określa na podstawie obserwacji
zebranego gazu jego podstawowe
właściwości (stan skupienia,
barwę, zapach, rozpuszczalność
w wodzie)
otrzymuje tlenki w wyniku
spalania, np. tlenek węgla(IV)
ustala wzory tlenków na podstawie
modeli i odwrotnie
zapisuje równania reakcji
otrzymywania kilku tlenków
odróżnia na podstawie opisu
słownego reakcję egzotermiczną
od reakcji endotermicznej
tłumaczy, na czym polega obieg
azotu w przyrodzie
omawia właściwości
i zastosowanie gazów
szlachetnych
tłumaczy na schemacie obieg
tlenku węgla(IV) w przyrodzie
przeprowadza i opisuje
doświadczenie otrzymywania
-
-
-
-
-
-
Ocena bardzo dobra
Ocena celująca
Uczeń:
oblicza, na ile czasu wystarczy
tlenu osobom znajdującym się
w pomieszczeniu (przy
założeniu, że jest to
pomieszczenie hermetyczne i jest
mu znane zużycie tlenu na
godzinę)
konstruuje proste przyrządy
dobadania następujących zjawisk
atmosferycznych i właściwości
powietrza: wykrywanie
powietrza w „pustym” naczyniu,
badanie składu powietrza,
badanie udziału powietrza
w paleniu się świecy
otrzymuje pod nadzorem
nauczyciela tlen podczas reakcji
termicznego rozkładu
manganianu(VII) potasu
wie, kiedy reakcję łączenia się
tlenu z innymi pierwiastkami
nazywa się spalaniem
przedstawia podział tlenków na
tlenki metali i tlenki niemetali
oraz podaje przykłady takich
tlenków
podaje skład jąder atomowych
i rozmieszczenie elektronów na
poszczególnych powłokach dla
zastosowania tlenku węgla(IV)
- omawia podstawowe właściwości
wodoru
- wymienia praktyczne zastosowania
wodoru
- wymienia źródła zanieczyszczeń
powietrza
- wyjaśnia skutki zanieczyszczeń
powietrza dla przyrody
i człowieka
-
-
-
-
-
węgla(IV) przy użyciu wody
wapiennej
wie, jaka właściwość tlenku
węgla(IV) zadecydowała o jego
zastosowaniu
omawia właściwości wodoru
bezpiecznie obchodzi się
z substancjami i mieszaninami
wybuchowymi
podaje, jakie właściwości wodoru
zdecydowały o jego
zastosowaniu
podaje przyczyny i skutki smogu
wyjaśnia powstawanie efektu
cieplarnianego i konsekwencje
jego wzrostu na życie
mieszkańców Ziemi
wymienia przyczyny i skutki
dziury ozonowej
podaje, jakie właściwości wodoru
zdecydowały o jego
zastosowaniu
-
-
-
-
-
-
tlenku węgla(IV) w szkolnych
warunkach laboratoryjnych
bada doświadczalnie właściwości
fizyczne tlenku węgla(IV)
uzasadnia konieczność
wyposażenia pojazdów
i budynków użyteczności
publicznej w gaśnice pianowej
lub proszkowe
otrzymuje wodór w reakcji octu
z wiórkami magnezowymi
opisuje doświadczenie, za pomocą
którego można zbadać
właściwości wybuchowe
mieszaniny wodoru i powietrza
podaje znaczenie warstwy
ozonowej dla życia na Ziemi;
sprawdza eksperymentalnie, jaki
jest wpływ zanieczyszczeń
gazowych na rozwój roślin
bada stopień zapylenia powietrza
w swojej okolicy
odróżnia na podstawie opisu
słownego reakcję egzotermiczną
od reakcji endotermicznej
tłumaczy, na czym polega obieg
azotu w przyrodzie
omawia właściwości
i zastosowanie gazów
szlachetnych
tłumaczy na schemacie obieg
tlenku węgla(IV) w przyrodzie
przeprowadza i opisuje
doświadczenie otrzymywania
czterech helowców (He, Ne, Ar,
Kr)
- wyjaśnia, dlaczego wzrost
zawartości tlenku węgla(IV)
w atmosferze jest niekorzystny;
- uzasadnia, przedstawiając
odpowiednie obliczenia, kiedy
istnieje zagrożenie zdrowia
i życia ludzi przebywających
w niewietrzonych
pomieszczeniach;
- wyjaśnia, jak może dojść do
wybuchu mieszanin
wybuchowych, jakie są jego
skutki i jak przed wybuchem
można się zabezpieczyć
- porównuje gęstość wodoru
z gęstością powietrza
- przeprowadza doświadczenie
udowadniające, że dwutlenek
węgla jest gazem cieplarnianym;
- proponuje działania mające na celu
ochronę powietrza przed
zanieczyszczeniami
- doświadczalnie dowodzi, że
powietrze jest mieszaniną jednorodną
- opisuje eksperyment chemiczny,
uwzględniając: szkło, sprzęt
laboratoryjny, odczynniki, schemat,
obserwacje i wnioski
-
-
-
-
tlenku węgla(IV) w szkolnych
warunkach laboratoryjnych
bada doświadczalnie właściwości
fizyczne tlenku węgla(IV)
uzasadnia konieczność
wyposażenia pojazdów
i budynków użyteczności
publicznej w gaśnice pianowej
lub proszkowe
otrzymuje wodór w reakcji octu
z wiórkami magnezowymi
opisuje doświadczenie, za pomocą
którego można zbadać
właściwości wybuchowe
mieszaniny wodoru i powietrza
podaje znaczenie warstwy
ozonowej dla życia na Ziemi
sprawdza eksperymentalnie, jaki
jest wpływ zanieczyszczeń
gazowych na rozwój roślin
bada stopień zapylenia powietrza
w swojej okolicy
Dział 5. Woda i roztwory wodne
Ocena dopuszczająca
Ocena dostateczna
Ocena dobra
Ocena bardzo dobra
Ocena celująca
Uczeń:
Uczeń:
Uczeń:
Uczeń:
- charakteryzuje rodzaje wód
- opisuje budowę cząsteczki wody
– wyjaśnia, na czym polega
– wymienia laboratoryjne sposoby
występujących w przyrodzie
– wyjaśnia, co to jest cząsteczka
tworzenie wiązania kowalencyjnego otrzymywania wody
– podaje, na czym polega obieg
polarna
spolaryzowanego w cząsteczce
– proponuje doświadczenie
wody w przyrodzie
– wymienia właściwości wody
wody
udowadniające, że woda jest
– wymienia stany skupienia wody
zmieniające się pod wpływem
– wyjaśnia budowę polarną cząsteczki związkiem wodoru i tlenu
– nazywa przemiany stanów
zanieczyszczeń
wody
– opisuje wpływ izotopów wodoru i
skupienia wody
– proponuje sposoby racjonalnego
– określa właściwości wody
tlenu na właściwości wody
– opisuje właściwości wody
gospodarowania wodą
wynikające z jej budowy polarnej – określa wpływ ciśnienia
– zapisuje wzory sumaryczny i
– tłumaczy, na czym polega proces
– wyjaśnia, dlaczego woda dla
atmosferycznego na wartość
strukturalny cząsteczki wody
mieszania, rozpuszczania
jednych substancji jest
temperatury wrzenia wody
– definiuje pojęcie dipol
– określa, dla jakich substancji woda rozpuszczalnikiem, a dla innych nie – porównuje rozpuszczalność w
– identyfikuje cząsteczkę wody jako
jest dobrym rozpuszczalnikiem
– przedstawia za pomocą modeli
wodzie związków kowalencyjnych i
dipol
– charakteryzuje substancje ze
proces rozpuszczania w wodzie
jonowych
– wyjaśnia podział substancji na
względu na ich rozpuszczalność w
substancji o budowie
– wykazuje doświadczalnie, czy
dobrze i słabo rozpuszczalne oraz
wodzie
polarnej, np. chlorowodoru
roztwór jest nasycony, czy
praktycznie nierozpuszczalne w
– planuje doświadczenia wykazujące – podaje rozmiary cząstek substancji
nienasycony
wodzie podaje przykłady
wpływ różnych czynników na
wprowadzonych do wody i
– rozwiązuje zadania rachunkowe na
substancji, które rozpuszczają się i szybkość rozpuszczania substancji
znajdujących się
stężenie
nie rozpuszczają się w wodzie
stałych w wodzie
w roztworze właściwym, koloidzie, procentowe z wykorzystaniem gęstości
– wyjaśnia pojęcia rozpuszczalnik i
– porównuje rozpuszczalność różnych zawiesinie
– oblicza rozpuszczalność substancji
substancja rozpuszczana
substancji w tej samej temperaturze
– wykazuje doświadczalnie wpływ
w danej temperaturze, znając
– definiuje pojęcie rozpuszczalność – oblicza ilość substancji, którą
różnych czynników na szybkość
stężenie procentowe jej roztworu
– wymienia czynniki, które wpływają można rozpuścić w określonej ilości rozpuszczania
nasyconego w tej temperaturze
na rozpuszczalność
wody w podanej temperaturze
substancji stałej w wodzie
–mając masę roztworu nasyconego
– określa, co to jest wykres
– podaje przykłady substancji, które – posługuje się sprawnie wykresem
w danej temperaturze ,oblicza, ile
rozpuszczalności
rozpuszczają się w wodzie, tworząc rozpuszczalności
substancji wykrystalizuje po jego
– odczytuje z wykresu
roztwory właściwe
– dokonuje obliczeń z
ochłodzeniu do podanej temperatury
rozpuszczalności rozpuszczalność – podaje przykłady substancji, które
wykorzystaniem wykresu
- opisuje eksperyment chemiczny,
danej substancji w podanej
nie rozpuszczają się w wodzie i
rozpuszczalności
uwzględniając: szkło, sprzęt
temperaturze
– wymienia czynniki wpływające na
szybkość rozpuszczania się substancji
stałej w wodzie
– definiuje pojęcia roztwór
właściwy, koloid i zawiesina
– definiuje pojęcia roztwór nasycony
i roztwór nienasycony oraz roztwór
stężony i roztwór rozcieńczony
– definiuje pojęcie krystalizacja
– podaje sposoby otrzymywania
roztworu nienasyconego z
nasyconego i odwrotnie
– definiuje stężenie procentowe
roztworu
– podaje wzór opisujący stężenie
procentowe
– prowadzi obliczenia z
wykorzystaniem pojęć: stężenie
procentowe, masa substancji, masa
rozpuszczalnika, masa roztworu
(proste)
tworzą koloidy lub zawiesiny
– wskazuje różnice między
roztworem właściwym a zawiesiną
– opisuje różnice między roztworem
rozcieńczonym, stężonym,
nasyconym i nienasyconym
– przeprowadza krystalizację
– przekształca wzór na stężenie
procentowe roztworu tak, aby
obliczyć masę substancji
rozpuszczonej lub masę roztworu
– oblicza masę substancji
rozpuszczonej lub masę roztworu,
znając stężenie procentowe roztworu
– wyjaśnia, jak sporządzić roztwór
o określonym stężeniu procentowym
(np. 100 g
20-procentowego roztworu soli
kuchennej)
– oblicza masę wody, znając masę
laboratoryjny, odczynniki, schemat,
roztworu
obserwacje i wnioski
i jego stężenie procentowe
– prowadzi obliczenia z
wykorzystaniem pojęcia gęstości
– podaje sposoby na zmniejszenie lub
zwiększenie stężenia roztworu
– oblicza stężenie procentowe
roztworu powstałego przez
zagęszczenie, rozcieńczenie
roztworu
– oblicza stężenie procentowe
roztworu nasyconego w danej
temperaturze
(z wykorzystaniem wykresu
rozpuszczalności)
– wymienia czynności prowadzące
do sporządzenia określonej ilości
roztworu o określonym stężeniu
procentowym
– sporządza roztwór o określonym
stężeniu procentowym wyjaśnia, co
to jest woda destylowana
i czym się różni od wód
występujących w przyrodzie
Ocenę niedostateczną
Otrzymuje uczeń, który nie spełnia wymagań na ocenę dopuszczającą. Wykazuje rażący brak wiadomości i umiejętności, które uniemożliwiają mu
świadome i aktywne uczestnictwo w lekcjach chemii. Nie potrafi wykonać zadań o elementarnym stopniu trudności, nawet z pomocą nauczyciela.
KLASA II GIMNAZJUM
(do programu „Chemia Nowej Ery”, Nowa Era)
OCENIANIE ŚRÓDROCZNE
Dział 4. Kwasy
Ocena dopuszczająca
Ocena dostateczna
Uczeń:
– wymienia zasady bhp dotyczące
obchodzenia się z kwasami
– definiuje pojęcia: elektrolit i
nieelektrolit
– wyjaśnia, co to jest wskaźnik i
wymienia trzy przykłady
wskaźników
– opisuje zastosowania wskaźników
– odróżnia kwasy od innych
substancji chemicznych za pomocą
wskaźników
– definiuje pojęcie kwasy
– opisuje budowę kwasów
beztlenowych i tlenowych
– odróżnia kwasy tlenowe od
beztlenowych
– wskazuje wodór i resztę kwasową
we wzorze kwasu
– wyznacza wartościowość reszty
kwasowej
– zapisuje wzory sumaryczne
kwasów: HCl, H2S, H2SO4, H2SO3,
Uczeń:
– wymienia wspólne właściwości
kwasów
– wyjaśnia, z czego wynikają
wspólne właściwości kwasów
– zapisuje wzory strukturalne
poznanych kwasów
– wyjaśnia pojęcie tlenek kwasowy
– wskazuje przykłady tlenków
kwasowych
– wymienia metody otrzymywania
kwasów tlenowych i beztlenowych
– zapisuje równania reakcji
otrzymywania poznanych kwasów
– opisuje właściwości poznanych
kwasów
– opisuje zastosowania poznanych
kwasów
Ocena dobra
Uczeń:
– wyjaśnia, dlaczego podczas pracy
ze stężonymi roztworami kwasów
należy zachować szczególną
ostrożność
– wymienia poznane tlenki kwasowe
– zapisuje równania reakcji
otrzymywania wskazanego kwasu
– wykazuje doświadczalnie żrące
właściwości kwasu siarkowego(VI)
– podaje zasadę bezpiecznego
rozcieńczania stężonego roztworu
kwasu siarkowego(VI)
– wyjaśnia, dlaczego kwas
siarkowy(VI) pozostawiony w
otwartym naczyniu zwiększa swą
objętość
– planuje doświadczalne wykrycie
białka w próbce żywności (w serze,
jonowa
mleku, jajku)
– zapisuje i odczytuje wybrane
– opisuje reakcję ksantoproteinową
równania reakcji dysocjacji jonowej – zapisuje i odczytuje równania
kwasów
reakcji dysocjacji jonowej
Ocena bardzo dobra,
Ocena celująca
Uczeń:
– zapisuje wzór strukturalny
dowolnego kwasu nieorganicznego
o podanym wzorze sumarycznym
– projektuje doświadczenia, w
których wyniku można otrzymywać
kwasy
– identyfikuje kwasy, na podstawie
podanych informacji
– odczytuje równania reakcji
chemicznych
– potrafi rozwiązywać trudniejsze
chemografy
– proponuje sposoby ograniczenia
powstawania kwaśnych opadów
–analizuje przyczynę przewodnictwa
elektrycznego przez roztwór kwasu ,
-prezentuje i interpretuje na
modelach przebieg reakcji dysocjacji
elektrolitycznej kwasów
–projektuje i wykonuje
doświadczenie pozwalające otrzymać
kwasy,
HNO3, H2CO3, H3PO4
– definiuje pojęcie odczyn kwasowy
– podaje nazwy poznanych kwasów – zapisuje obserwacje do
– opisuje właściwości kwasów:
przeprowadzanych doświadczeń
chlorowodorowego, azotowego(V)
i siarkowego(VI)
– opisuje podstawowe zastosowania
kwasów: chlorowodorowego,
azotowego(V) i siarkowego(VI)
– wyjaśnia, na czym polega
dysocjacja jonowa (elektrolityczna)
kwasów
– definiuje pojęcia jon, kation i anion
– zapisuje równania reakcji
dysocjacji jonowej kwasów (proste
przykłady)
– wyjaśnia pojęcie kwaśne opady
(elektrolitycznej) kwasów
– określa odczyn roztworu
kwasowego na podstawie
znajomości jonów obecnych
w badanym roztworze
– analizuje proces powstawania
kwaśnych opadów i skutki ich
działania
– rozwiązuje chemografy
– opisuje doświadczenia
przeprowadzane na lekcjach
(schemat, obserwacje, wniosek)
–projektuje doświadczenie
pozwalające zbadać właściwości
kwasów ,
–opisuje eksperyment chemiczny,
uwzględniając: szkło i sprzęt
laboratoryjny, odczynniki
chemiczne, obserwacje i wnioski
Dział 5. Wodorotlenki
Ocena dopuszczająca
Uczeń:
– wymienia zasady bhp dotyczące
obchodzenia się z zasadami
– odróżnia zasady od innych
substancji chemicznych za pomocą
wskaźników
– definiuje pojęcia wodorotlenek i
zasada
– opisuje budowę wodorotlenków
– podaje wartościowość grupy
wodorotlenowej
Ocena dostateczna
Uczeń:
– wymienia wspólne właściwości
zasad
– wyjaśnia, z czego wynikają
wspólne właściwości zasad
– definiuje pojęcie tlenek zasadowy
– podaje przykłady tlenków
zasadowych
– wymienia dwie główne metody
otrzymywania wodorotlenków
– zapisuje równania reakcji
Ocena dobra
Uczeń:
– rozróżnia pojęcia wodorotlenek i
zasada
– wymienia przykłady
wodorotlenków i zasad
– wyjaśnia, dlaczego podczas pracy
z zasadami należy zachować
szczególną ostrożność
– wymienia poznane tlenki zasadowe
– zapisuje równania reakcji
otrzymywania wybranego
Ocena bardzo dobra
Ocena celująca
Uczeń:
– zapisuje wzór sumaryczny
wodorotlenku dowolnego metalu
– planuje doświadczenia, w których
wyniku można otrzymać różne
wodorotlenki, także trudno
rozpuszczalne
– zapisuje równania reakcji
otrzymywania różnych
wodorotlenków
– identyfikuje wodorotlenki na
– zapisuje wzory sumaryczne
wodorotlenków: NaOH, KOH,
Ca(OH)2, Al(OH)3
– opisuje właściwości oraz
zastosowania wodorotlenków: sodu,
potasu i wapnia
otrzymywania wodorotlenku sodu,
potasu i wapnia
– wyjaśnia pojęcia woda wapienna,
wapno palone i wapno gaszone
– określa rozpuszczalność
wodorotlenków na podstawie tabeli
rozpuszczalności
– zapisuje obserwacje do
przeprowadzanych doświadczeń
wodorotlenku
– planuje doświadczenia, w których
wyniku, można otrzymać
wodorotlenek: sodu, potasu lub
wapnia
– planuje sposób otrzymywania
wodorotlenków trudno
rozpuszczalnych
– rozwiązuje chemografy
– opisuje doświadczenia
przeprowadzane na lekcjach
(schemat, obserwacje, wniosek)
podstawie podanych informacji
– odczytuje równania reakcji
chemicznych
– rozwiązuje chemografy
o większym stopniu trudności
- wykonuje doświadczenie
pozwalające otrzymać wodorotlenek
i zbadać właściwości
wodorotlenków,
-opisuje eksperyment chemiczny,
uwzględniając : szkło i sprzęt
laboratoryjny , odczynniki
chemiczne, obserwacje i wnioski
Ocenę niedostateczną
Otrzymuje uczeń, który nie spełnia wymagań na ocenę dopuszczającą. Wykazuje rażący brak wiadomości i umiejętności, które uniemożliwiają mu
świadome i aktywne uczestnictwo w lekcjach chemii. Nie potrafi wykonać zadań o elementarnym stopniu trudności, nawet z pomocą nauczyciela.
OCENIANIE ROCZNE
Ocena roczna obejmuje także wymagania na ocenę śródroczną.
Dział 4. Kwasy
Ocena dopuszczająca
Ocena dostateczna
Ocena dobra
Ocena bardzo dobra
Ocena celująca
Uczeń:
Uczeń:
Uczeń:
Uczeń:
– wymienia zasady bhp dotyczące – wymienia wspólne właściwości – wyjaśnia, dlaczego podczas
– zapisuje wzór strukturalny
obchodzenia się z kwasami
kwasów
pracy ze stężonymi roztworami
dowolnego kwasu
– definiuje pojęcia: elektrolit i
– wyjaśnia, z czego wynikają
kwasów należy zachować
nieorganicznego o podanym
nieelektrolit
wspólne właściwości kwasów
szczególną ostrożność
wzorze sumarycznym
– wyjaśnia, co to jest wskaźnik i – zapisuje wzory strukturalne
– wymienia poznane tlenki
– projektuje doświadczenia, w
wymienia trzy przykłady
poznanych kwasów
kwasowe
których wyniku można
wskaźników
– wyjaśnia pojęcie tlenek
– zapisuje równania reakcji
otrzymywać kwasy
– opisuje zastosowania
kwasowy
otrzymywania wskazanego
– identyfikuje kwasy, na
wskaźników
– wskazuje przykłady tlenków
kwasu
podstawie podanych informacji
– odróżnia kwasy od innych
kwasowych
– wykazuje doświadczalnie żrące – odczytuje równania reakcji
substancji chemicznych za
– wymienia metody
właściwości kwasu
chemicznych
pomocą wskaźników
otrzymywania kwasów
siarkowego(VI)
– potrafi rozwiązywać trudniejsze
– definiuje pojęcie kwasy
tlenowych i beztlenowych
– podaje zasadę bezpiecznego
chemografy
– opisuje budowę kwasów
– zapisuje równania reakcji
rozcieńczania stężonego
– proponuje sposoby ograniczenia
beztlenowych i tlenowych
otrzymywania poznanych
roztworu kwasu siarkowego(VI) powstawania kwaśnych opadów
– odróżnia kwasy tlenowe od
kwasów
– wyjaśnia, dlaczego kwas
–projektuje i wykonuje
beztlenowych
– opisuje właściwości poznanych siarkowy(VI) pozostawiony w
doświadczenie pozwalające
– wskazuje wodór i resztę
kwasów
otwartym naczyniu zwiększa
otrzymać kwasy
kwasową we wzorze kwasu
– opisuje zastosowania poznanych swą objętość
–projektuje doświadczenie
– wyznacza wartościowość reszty kwasów
– planuje doświadczalne wykrycie pozwalające zbadać właściwości
kwasowej
białka w próbce żywności
kwasów
– zapisuje wzory sumaryczne
jonowa
(w serze, mleku, jajku)
–opisuje eksperyment chemiczny,
kwasów: HCl, H2S, H2SO4,
– zapisuje i odczytuje wybrane
– opisuje reakcję
uwzględniając: szkło i sprzęt
H2SO3, HNO3, H2CO3, H3PO4
równania reakcji dysocjacji
ksantoproteinową
laboratoryjny, odczynniki
– podaje nazwy poznanych
jonowej kwasów
kwasów
– definiuje pojęcie odczyn
– opisuje właściwości kwasów:
kwasowy
chlorowodorowego,
– zapisuje obserwacje do
azotowego(V) i siarkowego(VI)
przeprowadzanych doświadczeń
– opisuje podstawowe
zastosowania kwasów:
chlorowodorowego,
azotowego(V) i siarkowego(VI)
– wyjaśnia, na czym polega
dysocjacja jonowa
(elektrolityczna) kwasów
– definiuje pojęcia jon, kation i
anion
– zapisuje równania reakcji
dysocjacji jonowej kwasów
(proste przykłady)
– wyjaśnia pojęcie kwaśne opady
Dział 5. Wodorotlenki
Ocena dopuszczająca
Ocena dostateczna
– zapisuje i odczytuje równania
reakcji dysocjacji jonowej
(elektrolitycznej) kwasów
– określa odczyn roztworu
kwasowego na podstawie
znajomości jonów obecnych
w badanym roztworze
– analizuje proces powstawania
kwaśnych opadów i skutki ich
działania
– rozwiązuje chemografy
– opisuje doświadczenia
przeprowadzane na lekcjach
(schemat, obserwacje, wniosek)
Ocena dobra
chemiczne, obserwacje i wnioski
–analizuje przyczynę
przewodnictwa elektrycznego
przez roztwór kwasu
-prezentuje i interpretuje na
modelach przebieg reakcji
dysocjacji elektrolitycznej
kwasów
Ocena bardzo dobra
Ocena celująca
Uczeń:
Uczeń:
Uczeń:
Uczeń:
– wymienia zasady bhp dotyczące – wymienia wspólne właściwości – rozróżnia pojęcia wodorotlenek – zapisuje wzór sumaryczny
obchodzenia się z zasadami
zasad
i zasada
wodorotlenku dowolnego metalu
– odróżnia zasady od innych
– wyjaśnia, z czego wynikają
– wymienia przykłady
– planuje doświadczenia, w
substancji chemicznych za
wspólne właściwości zasad
wodorotlenków i zasad
których wyniku można otrzymać
pomocą wskaźników
– definiuje pojęcie tlenek
– wyjaśnia, dlaczego podczas
różne wodorotlenki, także trudno
– definiuje pojęcia wodorotlenek i zasadowy
pracy z zasadami należy
rozpuszczalne
zasada
– opisuje budowę wodorotlenków
– podaje wartościowość grupy
wodorotlenowej
– zapisuje wzory sumaryczne
wodorotlenków: NaOH, KOH,
Ca(OH)2, Al(OH)3
– opisuje właściwości oraz
zastosowania wodorotlenków:
sodu, potasu i wapnia
– wyjaśnia, na czym polega
dysocjacja jonowa
(elektrolityczna) zasad
– zapisuje równania dysocjacji
jonowej zasad (proste przykłady)
powstałych w wyniku
– odróżnia zasady od kwasów za
pomocą wskaźników
– wymienia rodzaje odczynu
roztworów
– określa zakres pH i barwy
wskaźników dla poszczególnych
odczynów
– podaje przykłady tlenków
zasadowych
– wymienia dwie główne metody
otrzymywania wodorotlenków
– zapisuje równania reakcji
otrzymywania wodorotlenku
sodu, potasu i wapnia
– wyjaśnia pojęcia woda
wapienna, wapno palone i wapno
gaszone
– określa rozpuszczalność
wodorotlenków na podstawie
tabeli rozpuszczalności
– odczytuje proste równania
dysocjacji jonowej
(elektrolitycznej) zasad
– definiuje pojęcie odczyn
zasadowy
– omawia skalę pH
– bada odczyn i pH roztworu
– zapisuje obserwacje do
przeprowadzanych doświadczeń
zachować szczególną ostrożność
– wymienia poznane tlenki
zasadowe
– zapisuje równania reakcji
otrzymywania wybranego
wodorotlenku
– planuje doświadczenia, w
których wyniku, można otrzymać
wodorotlenek: sodu, potasu lub
wapnia
– planuje sposób otrzymywania
wodorotlenków trudno
rozpuszczalnych
– zapisuje i odczytuje równania
dysocjacji jonowej
(elektrolitycznej) zasad
– określa odczyn roztworu
zasadowego na podstawie
znajomości jonów obecnych
w badanym roztworze
– rozwiązuje chemografy
– opisuje doświadczenia
przeprowadzane na lekcjach
(schemat, obserwacje, wniosek)
– wymienia przyczyny odczynu
kwasowego, zasadowego,
obojętnego roztworów
– interpretuje wartość pH w
ujęciu jakościowym (odczyn
kwasowy, zasadowy, obojętny)
– opisuje zastosowania
wskaźników
– zapisuje równania reakcji
otrzymywania różnych
wodorotlenków
– identyfikuje wodorotlenki na
podstawie podanych informacji
– odczytuje równania reakcji
chemicznych
– rozwiązuje chemografy o
większym stopniu trudności
– wyjaśnia pojęcie skala pH
- wykonuje doświadczenie
pozwalające otrzymać
wodorotlenek i zbadać
właściwości wodorotlenków,
-opisuje eksperyment chemiczny,
uwzględniając : szkło i sprzęt
laboratoryjny , odczynniki
chemiczne, obserwacje i wnioski
–analizuje przyczynę
przewodnictwa elektrycznego
przez roztwór zasady,
–prezentuje i interpretuje na
modelach przebieg reakcji
dysocjacji elektrolitycznej zasad
– planuje doświadczenie, które
umożliwi zbadanie wartości pH
produktów używanych w życiu
codziennym
Dział 6. Sole
Ocena dopuszczająca
Ocena dostateczna
Ocena dobra
Ocena bardzo dobra
Ocena celująca
Uczeń:
– opisuje budowę soli
– wskazuje metal i resztę
kwasową we wzorze soli
– zapisuje wzory sumaryczne soli
(chlorków, siarczków)
– tworzy nazwy soli na podstawie
wzorów sumarycznych i zapisuje
wzory sumaryczne soli na
podstawie ich nazw, np. wzory
soli kwasów:
chlorowodorowego,
siarkowodorowego i metali, np.
sodu, potasu i wapnia
– wskazuje wzory soli wśród
zapisanych wzorów związków
chemicznych
– opisuje, w jaki sposób dysocjują
sole
– zapisuje równania reakcji
dysocjacji jonowej soli (proste
Uczeń:
– wymienia cztery najważniejsze
sposoby otrzymywania soli
– podaje nazwy i wzory soli
(typowe przykłady)
– zapisuje równania reakcji
otrzymywania soli (reakcja
zobojętniania) w postaci
cząsteczkowej, jonowej oraz
jonowej skróconej
– odczytuje równania reakcji
otrzymywania soli
– wyjaśnia pojęcia reakcja
zobojętniania i reakcja
strąceniowa
– zapisuje równania reakcji
otrzymywania soli (reakcja
strąceniowa) w postaci
cząsteczkowej
– korzysta z tabeli
rozpuszczalności wodorotlenków
Uczeń:
– podaje nazwy i wzory
dowolnych soli
– zapisuje i odczytuje równania
dysocjacji jonowej
(elektrolitycznej) soli
– stosuje metody otrzymywania
soli
– wyjaśnia przebieg reakcji
zobojętniania
– zapisuje równania reakcji
otrzymywania soli w postaci
cząsteczkowej i jonowej
– określa, korzystając z szeregu
aktywności metali, które metale
reagują z kwasami według
schematu:
metal + kwas sól + wodór
– wymienia przykłady soli
występujących w przyrodzie
projektuje doświadczenia
Uczeń:
– wskazuje substancje, które
mogą ze sobą reagować, tworząc
sól
– podaje metody otrzymywania
soli
– identyfikuje sole na podstawie
podanych informacji
– wyjaśnia, jakie zmiany zaszły w
odczynie roztworów poddanych
reakcji zobojętniania
– przewiduje, czy zajdzie dana
reakcja chemiczna
– proponuje reakcję tworzenia soli
trudno rozpuszczalnej
– określa zastosowanie reakcji
strąceniowej
– zapisuje i odczytuje równania
reakcji otrzymywania dowolnej
soli w postaci cząsteczkowej i
jonowej
przykłady)
– dzieli sole ze względu na ich
rozpuszczalność w wodzie
– określa rozpuszczalność soli w
wodzie na podstawie tabeli
rozpuszczalności wodorotlenków
i soli
– podaje sposób otrzymywania
soli trzema podstawowymi
metodami (kwas + zasada, metal
+ kwas, tlenek metalu + kwas)
– zapisuje cząsteczkowo równania
reakcji otrzymywania soli
(najprostsze)
– definiuje pojęcia reakcje
zobojętniania i reakcje
strąceniowe
– odróżnia zapis cząsteczkowy od
zapisu jonowego równania
reakcji chemicznej
– określa związek ładunku jonu z
wartościowością metalu i reszty
kwasowej
– wymienia zastosowania
najważniejszych soli, np. chlorku
sodu
i soli
– zapisuje i odczytuje wybrane
równania reakcji dysocjacji
jonowej soli
– dzieli metale ze względu na ich
aktywność chemiczną (szereg
aktywności metali)
– wymienia sposoby zachowania
się metali w reakcji z kwasami
(np. miedź lub magnez w reakcji
z kwasem chlorowodorowym)
– zapisuje obserwacje z
przeprowadzanych na lekcji
doświadczeń
umożliwiające otrzymywanie soli
w reakcjach strąceniowych
– formułuje wniosek dotyczący
wyniku reakcji strąceniowej na
podstawie analizy tabeli
rozpuszczalności soli
i wodorotlenków
– podaje zastosowania soli
– opisuje doświadczenia
przeprowadzane na lekcjach
(schemat, obserwacje, wniosek)
– projektuje doświadczenia
otrzymywania soli
– przewiduje efekty
zaprojektowanych doświadczeń
– formułuje wniosek do
zaprojektowanych doświadczeń,
- projektuje doświadczenie na
identyfikację produktu gazowego
w reakcji kwasu z metalem
aktywnym, np. kwas
chlorowodorowy
z magnezem
- projektuje i wykonuje
doświadczenie pozwalające
otrzymać sole w reakcjach
strąceniowych,
-opisuje eksperyment chemiczny,
uwzględniając: szkło i sprzęt
laboratoryjny, odczynniki
chemiczne, obserwacje i wnioski
Ocenę niedostateczną
Otrzymuje uczeń, który nie spełnia wymagań na ocenę dopuszczającą. Wykazuje rażący brak wiadomości i umiejętności, które uniemożliwiają mu
świadome i aktywne uczestnictwo w lekcjach chemii. Nie potrafi wykonać zadań o elementarnym stopniu trudności, nawet z pomocą nauczyciela.
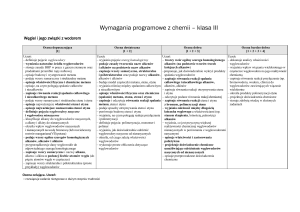
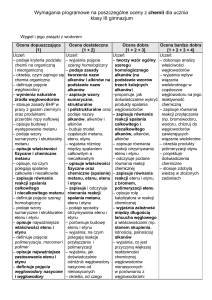
KLASA III GIMNAZJUM
(do programu „Chemia Nowej Ery”, Nowa Era)
OCENIANIE ŚRÓDROCZNE
7. Węgiel i jego związki z wodorem
Ocena dopuszczająca
Ocena dostateczna
Ocena dobra
Ocena bardzo dobra
Ocena celująca
Uczeń:
– podaje kryteria podziału chemii na
organiczną i nieorganiczną
– określa, czym zajmuje się chemia organiczna
– definiuje pojęcie węglowodory
– wymienia naturalne źródła węglowodorów
– stosuje zasady BHP w pracy z gazem
ziemnym oraz produktami przeróbki ropy
naftowej
– opisuje budowę i występowanie metanu
– podaje wzory sumaryczny i strukturalny
metanu
– opisuje właściwości fizyczne i chemiczne
metanu
– opisuje, na czym polegają spalanie
całkowite i niecałkowite
– zapisuje równania reakcji spalania
całkowitego i niecałkowitego metanu
– definiuje pojęcie szereg homologiczny
– podaje wzory sumaryczne i strukturalne
etenu i etynu
– opisuje najważniejsze właściwości etenu i
Uczeń:
– wyjaśnia pojęcie szereg homologiczny
– podaje zasady tworzenia nazw
alkenów i alkinów na podstawie nazw
alkanów
– zapisuje wzory sumaryczne,
strukturalne i półstrukturalne oraz
podaje nazwy alkanów, alkenów i
alkinów
– buduje model cząsteczki metanu, etenu,
etynu
– wyjaśnia różnicę między spalaniem
całkowitym a niecałkowitym
– opisuje właściwości fizyczne oraz
chemiczne (spalanie) metanu, etanu,
etenu i etynu
– zapisuje i odczytuje równania reakcji
spalania metanu, etenu i etynu
– podaje sposoby otrzymywania etenu i
etynu
– porównuje budowę etenu i etynu
– wyjaśnia, na czym polegają reakcje
Uczeń:
– tworzy wzór ogólny szeregu
homologicznego alkanów (na
podstawie wzorów trzech kolejnych
alkanów)
–proponuje, jak doświadczalnie wykryć
produkty spalania węglowodorów
– zapisuje równania reakcji spalania
całkowitego i niecałkowitego alkanów,
alkenów, alkinów
– zapisuje równania reakcji
otrzymywania etenu i etynu
– odczytuje podane równania reakcji
chemicznej
– zapisuje równania reakcji etenu i etynu
z bromem, polimeryzacji etenu
– opisuje rolę katalizatora w reakcji
chemicznej
– wyjaśnia zależność między długością
łańcucha węglowego a właściwościami
(np. stanem skupienia, lotnością,
palnością) alkanów
Uczeń:
– dokonuje analizy właściwości
węglowodorów
– wyjaśnia wpływ wiązania
wielokrotnego w cząsteczce
węglowodoru na jego reaktywność
chemiczną
– zapisuje równania reakcji
przyłączania (np. bromowodoru,
wodoru, chloru) do węglowodorów
zawierających wiązanie wielokrotne
– określa produkty polimeryzacji
etynu
– projektuje doświadczenia
chemiczne
– stosuje zdobytą wiedzę w złożonych
zadaniach
etynu
przyłączania i polimeryzacji
– definiuje pojęcia: polimeryzacja, monomer – wyjaśnia, jak doświadczalnie odróżnić
i polimer
węglowodory nasycone od
– opisuje najważniejsze zastosowania etenu i
nienasyconych
etynu
– określa, od czego zależą właściwości
– definiuje pojęcia węglowodory nasycone
węglowodorów
i węglowodory nienasycone
– wykonuje proste obliczenia dotyczące
– klasyfikuje alkany do węglowodorów
węglowodorów
nasyconych, a alkeny i alkiny do
nienasyconych
– określa wpływ węglowodorów nasyconych
i nienasyconych na wodę bromową (lub
rozcieńczony roztwór manganianu(VII)
potasu)
– podaje wzory ogólne szeregów
homologicznych alkanów, alkenów i
alkinów
– przyporządkowuje dany węglowodór do
odpowiedniego szeregu homologicznego
– odróżnia wzór sumaryczny od wzorów
strukturalnego i półstrukturalnego
– zapisuje wzory sumaryczne i nazwy
alkanu, alkenu i alkinu o podanej liczbie
atomów węgla (do pięciu atomów węgla w
cząsteczce)
– zapisuje wzory strukturalne i
półstrukturalne (proste przykłady)
węglowodorów
– wyjaśnia, co jest przyczyną większej
reaktywności chemicznej
węglowodorów nienasyconych
w porównaniu z węglowodorami
nasyconymi
– opisuje właściwości i zastosowania
polietylenu
– projektuje doświadczenie chemiczne
umożliwiające odróżnienie
węglowodorów nasyconych od
nienasyconych
– opisuje przeprowadzane doświadczenia
chemiczne
8. Pochodne węglowodorów
Ocena dopuszczająca
Ocena dostateczna
Ocena dobra
Ocena bardzo dobra
Ocena bardzo dobra
Uczeń:
– dowodzi, że alkohole, kwasy
karboksylowe, estry, aminy, aminokwasy są
pochodnymi węglowodorów
– opisuje budowę pochodnych
węglowodorów (grupa węglowodorowa +
grupa funkcyjna)
– wymienia pierwiastki chemiczne
wchodzące w skład pochodnych
węglowodorów
– klasyfikuje daną substancję organiczną do
odpowiedniej grupy związków
chemicznych
– określa, co to jest grupa funkcyjna
– zaznacza grupy funkcyjne w alkoholach,
kwasach karboksylowych, estrach, aminach i
aminokwasach i podaje ich nazwy
– zapisuje wzory ogólne alkoholi, kwasów
karboksylowych i estrów
– zapisuje wzory sumaryczne i strukturalne
prostych alkoholi monohydroksylowych i
kwasów karboksylowych (do 2 atomów
węgla w cząsteczce) oraz tworzy ich nazwy
– zaznacza we wzorze kwasu
karboksylowego resztę kwasową
– określa, co to są nazwy zwyczajowe i
systematyczne
– wymienia reguły tworzenia nazw
systematycznych związków organicznych
– podaje nazwy zwyczajowe omawianych
Uczeń:
– zapisuje nazwy i wzory omawianych
grup funkcyjnych
– zapisuje wzory i wymienia nazwy
alkoholi
– zapisuje wzory sumaryczny i
strukturalny glicerolu
– uzasadnia stwierdzenie, że alkohole i
kwasy karboksylowe tworzą szeregi
homologiczne
– podaje odczyn roztworu alkoholu
– opisuje fermentację alkoholową
– zapisuje równania reakcji spalania
etanolu
– podaje przykłady kwasów
organicznych występujących w
przyrodzie i wymienia ich zastosowania
– tworzy nazwy prostych kwasów
karboksylowych (do 5 atomów węgla
w cząsteczce) oraz zapisuje ich wzory
sumaryczne i strukturalne
– podaje właściwości kwasów
metanowego (mrówkowego) i
etanowego (octowego)
– omawia dysocjację jonową kwasów
karboksylowych
– zapisuje równania reakcji spalania,
reakcji dysocjacji jonowej, reakcji z:
metalami, tlenkami metali i zasadami
kwasów metanowego i etanowego
Uczeń:
– wyjaśnia, dlaczego alkohol etylowy
wykazuje odczyn obojętny
– wyjaśnia, w jaki sposób tworzy się
nazwę systematyczną glicerolu
– zapisuje równania reakcji spalania
alkoholi
– podaje nazwy zwyczajowe i
systematyczne kwasów
karboksylowych
– wyjaśnia, dlaczego wyższe kwasy
karboksylowe nazywa się kwasami
tłuszczowymi
– porównuje właściwości kwasów
organicznych i nieorganicznych
– porównuje właściwości kwasów
karboksylowych
– podaje metodę otrzymywania kwasu
octowego
– wyjaśnia proces fermentacji octowej
– opisuje równania reakcji chemicznych
dla kwasów karboksylowych
– podaje nazwy soli kwasów
organicznych
– opisuje przeprowadzone doświadczenia
chemiczne
Uczeń:
– proponuje doświadczenie
chemiczne do podanego tematu
– formułuje wnioski z doświadczeń
chemicznych
– przeprowadza doświadczenia
chemiczne
– zapisuje wzory dowolnych
alkoholi i kwasów
karboksylowych
– zapisuje równania reakcji
chemicznych dla alkoholi, kwasów
karboksylowych o wyższym
stopniu trudności (np. więcej niż 5
atomów węgla w cząsteczce) (dla
alkoholi i kwasów
karboksylowych)
– wyjaśnia zależność między
długością łańcucha węglowego a
stanem skupienia i reaktywnością
chemiczną alkoholi oraz kwasów
karboksylowych
– przewiduje produkty reakcji
chemicznej
– identyfikuje poznane substancje
– zapisuje równania reakcji
chemicznych w postaci
cząsteczkowej, jonowej oraz
skróconej jonowej
– potrafi wykorzystać swoją wiedzę
kwasów karboksylowych (mrówkowy,
octowy)
– opisuje najważniejsze właściwości
metanolu, etanolu, glicerolu oraz kwasów
etanowego i metanowego
– zapisuje równanie reakcji spalania metanolu
– opisuje podstawowe zastosowania etanolu i
kwasu etanowego
– dokonuje podziału alkoholi na
monohydroksylowe, polihydroksylowe oraz
kwasów karboksylowych na nasycone i
nienasycone
– określa, co to są alkohole
polihydroksylowe
– opisuje zagrożenia związane z alkoholami
(metanol, etanol)
– zna toksyczne właściwości poznanych
substancji
– podaje nazwy soli pochodzących od
kwasów metanowego i etanowego
– opisuje negatywne skutki działania
etanolu na organizm ludzki
– zapisuje obserwacje do wykonywanych
doświadczeń chemicznych
do rozwiązywania złożonych zadań
Ocenę niedostateczną
Otrzymuje uczeń, który nie spełnia wymagań na ocenę dopuszczającą. Wykazuje rażący brak wiadomości i umiejętności, które uniemożliwiają mu
świadome i aktywne uczestnictwo w lekcjach chemii. Nie potrafi wykonać zadań o elementarnym stopniu trudności, nawet z pomocą nauczyciela.
OCENIANIE ROCZNE
Ocena roczna obejmuje także wymagania na ocenę śródroczną.
7. Węgiel i jego związki z wodorem
Ocena dopuszczająca
Ocena dostateczna
Ocena dobra
Ocena bardzo dobra
Ocena celująca
Uczeń:
– podaje kryteria podziału chemii na
organiczną i nieorganiczną
– określa, czym zajmuje się chemia organiczna
– definiuje pojęcie węglowodory
– wymienia naturalne źródła węglowodorów
– stosuje zasady BHP w pracy z gazem
ziemnym oraz produktami przeróbki ropy
naftowej
– opisuje budowę i występowanie metanu
– podaje wzory sumaryczny i strukturalny
metanu
– opisuje właściwości fizyczne i chemiczne
metanu
– opisuje, na czym polegają spalanie
całkowite i niecałkowite
– zapisuje równania reakcji spalania
całkowitego i niecałkowitego metanu
– definiuje pojęcie szereg homologiczny
– podaje wzory sumaryczne i strukturalne
etenu i etynu
– opisuje najważniejsze właściwości etenu i
etynu
– definiuje pojęcia: polimeryzacja, monomer
Uczeń:
– wyjaśnia pojęcie szereg homologiczny
– podaje zasady tworzenia nazw
alkenów i alkinów na podstawie nazw
alkanów
– zapisuje wzory sumaryczne,
strukturalne i półstrukturalne oraz
podaje nazwy alkanów, alkenów i
alkinów
– buduje model cząsteczki metanu, etenu,
etynu
– wyjaśnia różnicę między spalaniem
całkowitym a niecałkowitym
– opisuje właściwości fizyczne oraz
chemiczne (spalanie) metanu, etanu,
etenu i etynu
– zapisuje i odczytuje równania reakcji
spalania metanu, etenu i etynu
– podaje sposoby otrzymywania etenu i
etynu
– porównuje budowę etenu i etynu
– wyjaśnia, na czym polegają reakcje
przyłączania i polimeryzacji
– wyjaśnia, jak doświadczalnie odróżnić
Uczeń:
– tworzy wzór ogólny szeregu
homologicznego alkanów (na
podstawie wzorów trzech kolejnych
alkanów)
–proponuje, jak doświadczalnie wykryć
produkty spalania węglowodorów
– zapisuje równania reakcji spalania
całkowitego i niecałkowitego alkanów,
alkenów, alkinów
– zapisuje równania reakcji
otrzymywania etenu i etynu
– odczytuje podane równania reakcji
chemicznej
– zapisuje równania reakcji etenu i etynu
z bromem, polimeryzacji etenu
– opisuje rolę katalizatora w reakcji
chemicznej
– wyjaśnia zależność między długością
łańcucha węglowego a właściwościami
(np. stanem skupienia, lotnością,
palnością) alkanów
– wyjaśnia, co jest przyczyną większej
reaktywności chemicznej
Uczeń:
– dokonuje analizy właściwości
węglowodorów
– wyjaśnia wpływ wiązania
wielokrotnego w cząsteczce
węglowodoru na jego reaktywność
chemiczną
– zapisuje równania reakcji
przyłączania (np. bromowodoru,
wodoru, chloru) do węglowodorów
zawierających wiązanie wielokrotne
– określa produkty polimeryzacji
etynu
– projektuje doświadczenia
chemiczne
– stosuje zdobytą wiedzę w złożonych
zadaniach
i polimer
– opisuje najważniejsze zastosowania etenu i
etynu
– definiuje pojęcia węglowodory nasycone
i węglowodory nienasycone
– klasyfikuje alkany do węglowodorów
nasyconych, a alkeny i alkiny do
nienasyconych
– określa wpływ węglowodorów nasyconych
i nienasyconych na wodę bromową (lub
rozcieńczony roztwór manganianu(VII)
potasu)
– podaje wzory ogólne szeregów
homologicznych alkanów, alkenów i
alkinów
– przyporządkowuje dany węglowodór do
odpowiedniego szeregu homologicznego
– odróżnia wzór sumaryczny od wzorów
strukturalnego i półstrukturalnego
– zapisuje wzory sumaryczne i nazwy
alkanu, alkenu i alkinu o podanej liczbie
atomów węgla (do pięciu atomów węgla w
cząsteczce)
– zapisuje wzory strukturalne i
półstrukturalne (proste przykłady)
węglowodorów
węglowodory nasycone od
węglowodorów nienasyconych
nienasyconych
w porównaniu z węglowodorami
– określa, od czego zależą właściwości
nasyconymi
węglowodorów
– opisuje właściwości i zastosowania
– wykonuje proste obliczenia dotyczące polietylenu
węglowodorów
– projektuje doświadczenie chemiczne
umożliwiające odróżnienie
węglowodorów nasyconych od
nienasyconych
– opisuje przeprowadzane doświadczenia
chemiczne
8. Pochodne węglowodorów
Ocena dopuszczająca
Ocena dostateczna
Ocena dobra
Ocena bardzo dobra
Ocena celująca
Uczeń:
– dowodzi, że alkohole, kwasy
karboksylowe, estry, aminy, aminokwasy są
pochodnymi węglowodorów
– opisuje budowę pochodnych
węglowodorów (grupa węglowodorowa +
grupa funkcyjna)
– wymienia pierwiastki chemiczne
wchodzące w skład pochodnych
węglowodorów
– klasyfikuje daną substancję organiczną do
odpowiedniej grupy związków
chemicznych
– określa, co to jest grupa funkcyjna
– zaznacza grupy funkcyjne w alkoholach,
kwasach karboksylowych, estrach, aminach i
aminokwasach i podaje ich nazwy
– zapisuje wzory ogólne alkoholi, kwasów
karboksylowych i estrów
– zapisuje wzory sumaryczne i strukturalne
prostych alkoholi monohydroksylowych i
kwasów karboksylowych (do 2 atomów
węgla w cząsteczce) oraz tworzy ich nazwy
– zaznacza we wzorze kwasu
karboksylowego resztę kwasową
– określa, co to są nazwy zwyczajowe i
systematyczne
– wymienia reguły tworzenia nazw
systematycznych związków organicznych
Uczeń:
– zapisuje nazwy i wzory omawianych
grup funkcyjnych
– zapisuje wzory i wymienia nazwy
alkoholi
– zapisuje wzory sumaryczny i
strukturalny glicerolu
– uzasadnia stwierdzenie, że alkohole i
kwasy karboksylowe tworzą szeregi
homologiczne
– podaje odczyn roztworu alkoholu
– opisuje fermentację alkoholową
– zapisuje równania reakcji spalania
etanolu
– podaje przykłady kwasów
organicznych występujących w
przyrodzie i wymienia ich zastosowania
– tworzy nazwy prostych kwasów
karboksylowych (do 5 atomów węgla
w cząsteczce) oraz zapisuje ich wzory
sumaryczne i strukturalne
– podaje właściwości kwasów
metanowego (mrówkowego) i
etanowego (octowego)
– omawia dysocjację jonową kwasów
karboksylowych
– zapisuje równania reakcji spalania,
reakcji dysocjacji jonowej, reakcji z:
metalami, tlenkami metali i zasadami
Uczeń:
– wyjaśnia, dlaczego alkohol etylowy
wykazuje odczyn obojętny
– wyjaśnia, w jaki sposób tworzy się
nazwę systematyczną glicerolu
– zapisuje równania reakcji spalania
alkoholi
– podaje nazwy zwyczajowe i
systematyczne kwasów
karboksylowych
– wyjaśnia, dlaczego wyższe kwasy
karboksylowe nazywa się kwasami
tłuszczowymi
– porównuje właściwości kwasów
organicznych i nieorganicznych
– porównuje właściwości kwasów
karboksylowych
– podaje metodę otrzymywania kwasu
octowego
– wyjaśnia proces fermentacji octowej
– opisuje równania reakcji chemicznych
dla kwasów karboksylowych
– podaje nazwy soli kwasów
organicznych
– określa miejsce występowania wiązania
podwójnego w cząsteczce kwasu
oleinowego
– projektuje doświadczenie chemiczne
umożliwiające odróżnienie kwasów
Uczeń:
– proponuje doświadczenie
chemiczne do podanego tematu
– formułuje wnioski z doświadczeń
chemicznych
– przeprowadza doświadczenia
chemiczne
– zapisuje wzory dowolnych
alkoholi i kwasów
karboksylowych
– zapisuje równania reakcji
chemicznych dla alkoholi, kwasów
karboksylowych o wyższym
stopniu trudności (np. więcej niż 5
atomów węgla w cząsteczce) (dla
alkoholi i kwasów
karboksylowych)
– wyjaśnia zależność między
długością łańcucha węglowego a
stanem skupienia i reaktywnością
chemiczną alkoholi oraz kwasów
karboksylowych
– zapisuje równania reakcji
otrzymywania estru o podanej
nazwie lub podanym wzorze
– projektuje doświadczenie
chemiczne umożliwiające
otrzymanie estru o podanej nazwie
– opisuje właściwości estrów w
– podaje nazwy zwyczajowe omawianych
kwasów karboksylowych (mrówkowy,
octowy)
– opisuje najważniejsze właściwości
metanolu, etanolu, glicerolu oraz kwasów
etanowego i metanowego
– zapisuje równanie reakcji spalania metanolu
– opisuje podstawowe zastosowania etanolu i
kwasu etanowego
– dokonuje podziału alkoholi na
monohydroksylowe, polihydroksylowe oraz
kwasów karboksylowych na nasycone i
nienasycone
– określa, co to są alkohole
polihydroksylowe
– wymienia dwa najważniejsze kwasy
tłuszczowe
– opisuje właściwości długołańcuchowych
kwasów karboksylowych (kwasów
tłuszczowych: stearynowego i oleinowego)
– definiuje pojęcie mydła
– wymienia związki chemiczne, będące
substratami reakcji estryfikacji
– definiuje pojęcie estry
– wymienia przykłady występowania estrów
w przyrodzie
– opisuje zagrożenia związane z alkoholami
(metanol, etanol)
– zna toksyczne właściwości poznanych
substancji
– określa, co to są aminy i aminokwasy
– podaje przykłady występowania amin i
aminokwasów
kwasów metanowego i etanowego
– podaje nazwy soli pochodzących od
kwasów metanowego i etanowego
– podaje nazwy wyższych kwasów
karboksylowych
– zapisuje wzory sumaryczne kwasów
palmitynowego, stearynowego i
oleinowego
– opisuje, jak doświadczalnie
udowodnić, że dany kwas karboksylowy
jest kwasem nienasyconym
– podaje przykłady estrów
– tworzy nazwy estrów pochodzących
od podanych nazw kwasów i alkoholi
(proste przykłady)
– wyjaśnia, na czym polega reakcja
estryfikacji
– określa sposób otrzymywania
wskazanego estru, np. octanu etylu
– wymienia właściwości fizyczne octanu
etylu
– opisuje budowę i właściwości amin na
przykładzie metyloaminy
– zapisuje wzór najprostszej aminy
– opisuje negatywne skutki działania
etanolu na organizm ludzki
– zapisuje obserwacje do wykonywanych
doświadczeń chemicznych
oleinowego od palmitynowego lub
stearynowego
– zapisuje równania reakcji chemicznych
prostych kwasów karboksylowych
z alkoholami monohydroksylowymi
– zapisuje równania reakcji
otrzymywania podanych estrów
– tworzy wzory estrów na podstawie
podanych nazw kwasów i alkoholi
– zapisuje wzory poznanej aminy i
aminokwasu
– opisuje budowę, właściwości fizyczne
i chemiczne aminokwasów na
przykładzie glicyny
– opisuje przeprowadzone doświadczenia
chemiczne
kontekście ich zastosowań
– przewiduje produkty reakcji
chemicznej
– identyfikuje poznane substancje
– dokładnie omawia reakcję
estryfikacji
– omawia różnicę między reakcją
estryfikacji a reakcją zobojętniania
– zapisuje równania reakcji
chemicznych w postaci
cząsteczkowej, jonowej oraz
skróconej jonowej
– analizuje konsekwencje istnienia
dwóch grup funkcyjnych w
cząsteczce aminokwasu
– zapisuje równanie reakcji
tworzenia dipeptydu
– wyjaśnia mechanizm powstawania
wiązania peptydowego
– potrafi wykorzystać swoją wiedzę
do rozwiązywania złożonych zadań
9. Substancje o znaczeniu biologicznym
Ocena dopuszczająca
Ocena dostateczna
Ocena dobra
Ocena bardzo dobra
Ocena celująca
Uczeń:
– wymienia główne pierwiastki chemiczne
wchodzące w skład organizmu człowieka
– wymienia podstawowe składniki żywności
oraz miejsce ich występowania
– wymienia miejsca występowanie celulozy
i skrobi w przyrodzie
– określa, co to są makroelementy i
mikroelementy
– wymienia pierwiastki chemiczne, które
wchodzą w skład tłuszczów, sacharydów i
białek
– klasyfikuje tłuszcze ze względu na
pochodzenie, stan skupienia i charakter
chemiczny
– wymienia rodzaje białek
– klasyfikuje sacharydy
– definiuje białka, jako związki chemiczne
powstające z aminokwasów
– wymienia przykłady tłuszczów,
sacharydów i białek
– określa, co to są węglowodany
– podaje wzory sumaryczne: glukozy,
sacharozy, skrobi i celulozy
– podaje najważniejsze właściwości
omawianych związków chemicznych
– definiuje pojęcia denaturacja, koagulacja
– wymienia czynniki powodujące
denaturację białek
– podaje reakcję charakterystyczną białek i
Uczeń:
– wyjaśnia rolę składników żywności w
prawidłowym funkcjonowaniu
organizmu
– definiuje pojęcie: tłuszcze
– opisuje właściwości fizyczne
tłuszczów
– opisuje właściwości białek
– opisuje właściwości fizyczne glukozy,
sacharozy, skrobi i celulozy
– wymienia czynniki powodujące
koagulację białek
– opisuje różnice w przebiegu
denaturacji i koagulacji białek
– określa wpływ oleju roślinnego na
wodę bromową
– omawia budowę glukozy
– zapisuje za pomocą wzorów
sumarycznych równanie reakcji
sacharozy z wodą
– określa przebieg reakcji hydrolizy
skrobi
– wykrywa obecność skrobi i białka w
różnych produktach spożywczych
Uczeń:
– podaje wzór ogólny tłuszczów
– omawia różnice w budowie tłuszczów
stałych i ciekłych
– wyjaśnia, dlaczego olej roślinny
odbarwia wodę bromową
– definiuje pojęcia: peptydy, zol, żel,
koagulacja, peptyzacja
– wyjaśnia, co to znaczy, że sacharoza
jest disacharydem
– porównuje budowę cząsteczek skrobi i
celulozy
– wymienia różnice we właściwościach
fizycznych skrobi i celulozy
– zapisuje poznane równania reakcji
hydrolizy sacharydów
– definiuje pojęcie wiązanie peptydowe
– projektuje doświadczenie chemiczne
umożliwiające odróżnienie tłuszczu
nienasyconego od nasyconego
– planuje doświadczenia chemiczne
umożliwiające badanie właściwości
omawianych związków chemicznych
– opisuje przeprowadzane doświadczenia
chemiczne
– opisuje znaczenie i zastosowania skrobi,
celulozy oraz innych poznanych
związków chemicznych
Uczeń:
– podaje wzór tristearynianu
glicerolu
– projektuje doświadczenia
chemiczne umożliwiające
wykrycie białka
– określa, na czym polega wysalanie
białka
– definiuje pojęcie izomery
– wyjaśnia, dlaczego skrobia i
celuloza są polisacharydami
– wyjaśnia, co to są dekstryny
– omawia hydrolizę skrobi
– umie zaplanować i przeprowadzić
reakcje weryfikujące postawioną
hipotezę
– identyfikuje poznane substancje
skrobi
– opisuje znaczenie: wody, tłuszczów,
białek, sacharydów, witamin i
mikroelementów dla organizmu człowieka
– opisuje, co to są związki
wielkocząsteczkowe i wymienia ich
przykłady
– wymienia funkcje podstawowych
składników pokarmu
Ocenę niedostateczną
Otrzymuje uczeń, który nie spełnia wymagań na ocenę dopuszczającą. Wykazuje rażący brak wiadomości i umiejętności, które uniemożliwiają mu
świadome i aktywne uczestnictwo w lekcjach chemii. Nie potrafi wykonać zadań o elementarnym stopniu trudności, nawet z pomocą nauczyciela.
3. Zasady oceniania z chemii w klasie I, II i III gimnazjum
Ocenie podlega : odpowiedź ustna, kartkówki, sprawdziany, prace klasowe, zeszyt ćwiczeń, referaty, prezentacje, zadanie domowe,
zaangażowanie uczniów w lekcje, praca w grupie, udział w konkursach, wykonywanie eksperymentów chemicznych.
Uczeń przed lekcją może zgłosić nieprzygotowanie do zajęć; 2 razy w ciągu półrocza klasa 1 i 3, klasa 2 – raz w ciągu półrocza.
Jako nieprzygotowanie rozumie się ; brak zeszytu, podręcznika, zeszytu ćwiczeń, brak zadania domowego, brak gotowości do odpowiedzi,
brak pomocy potrzebnych do lekcji.
Prace klasowe, sprawdziany, kartkówki, odpowiedzi ustne i zadania domowe są obowiązkowe.
Jeśli uczeń nie pisał pracy klasowej, sprawdzianu, kartkówki to powinien ją napisać w ciągu dwóch tygodniom dnia powrotu do szkoły. Termin
uzgadnia z nauczycielem.
Uczeń może poprawić ocenę niedostateczną z pracy klasowej, sprawdzianu w ciągu dwóch tygodni od dnia oddania przez nauczyciela
sprawdzonych prac. Termin uzgadnia z nauczycielem. Inne oceny może poprawić po uzgodnieniu z nauczycielem.
Uczeń, który posiada nieusprawiedliwioną nieobecność na lekcji, na którą zapowiedziano pisemną kontrolę wiadomości , nie ma prawa do
zaliczania pracy i otrzymuje ocenę niedostateczną.
Odpowiedzi ustne obejmują materiał z 3 ostatnich lekcji; kartkówki – materiał z 3-4 ostatnich lekcji.
Nieodrobione zadanie domowe uczeń musi wykonać na kolejną lekcję.
Każdy uczeń ma prawo do otrzymania oceny za wykonane prace nadobowiązkowe.
Ocena roczna/śródroczna ucznia jest wynikiem całorocznej/śródrocznej pracy i nie jest ona średnią arytmetyczną ocen cząstkowych.
Uczniowie posiadający opinie z poradni psychologiczno – pedagogicznej o specyficznych trudnościach w uczeniu się oraz uczniowie
posiadający orzeczenia o potrzebie nauczania indywidualnego są oceniani z uwzględnieniem zaleceń z poradni.
Nauczyciel dostosowuje wymagania edukacyjne do indywidualnych potrzeb psychofizycznych i edukacyjnych ucznia posiadającego opinie
poradni psychologiczno – pedagogicznej o specyficznych trudnościach w uczeniu się.
W stosunku do wszystkich uczniów posiadających dysfunkcje zastosowane zostaną zasady wzmacniania własnej wartości, bezpieczeństwa,
motywowania do pracy i doceniania małych sukcesów.
Prace pisemne w ciągu semestru ocenia się wg następującej skali:
0 –30 % możliwych do zdobycia punktów – ocena ndst
31% - 43% możliwych do zdobycia punktów – ocena dop
44% - 49% możliwych do zdobycia punktów – ocena + dop
50% - 67% możliwych do zdobycia punktów – ocena dst
68% - 74% możliwych do zdobycia punktów – ocena + dst
75% - 84% możliwych do zdobycia punktów – ocena db
85% - 89% możliwych do zdobycia punktów – ocena + db
90% – 94% możliwych do zdobycia punktów – ocena bdb
95% - 97% możliwych do zdobycia punktów - ocena + bdb
98% - 100% możliwych do zdobycia punktów – ocena cel
4. Uwagi końcowe
Rodzice informacje o postępach ucznia uzyskują na zebraniu klasowym lub w czasie dyżuru nauczyciela.
Oceny są jawne; uczniowie i rodzice maja prawo wglądu do prac pisemnych.
Uczeń ma prawo do testu sprawdzającego w celu podniesienia oceny końcowej z przedmiotu (zgodnie z postanowieniami ze Statutu Szkolnego)