Nowiny Lekarskie 2008, 77, 6, 446–453
MONIKA STARCZEWSKA, BOGNA MALENDOWICZ-MAJOR, HELENA SKRZYPEK, MAŁGORZATA DRZEWIECKA, AGNIESZKA PIASNA
WRZECIONA SNU U DZIECI I MŁODZIEŻY
SLEEP SPINDLES IN CHILDREN AND ADOLESCENTS
Katedra i Klinika Neurologii Wieku Rozwojowego
Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
Kierownik Jednostki: dr hab. n. med. Barbara Steinborn, prof. UM
Streszczenie
Sen jest odmianą stanu czynnościowego układu nerwowego odmiennego od stanu czuwania. We śnie występuje zmniejszona wrażliwość na bodźce, zniesiona aktywność ruchowa, zwolniona czynność serca, oddychania i innych czynności fizjologicznych oraz
czasowy zanik świadomości. W rytmie dobowym występuje naprzemiennie z czuwaniem.
Badaniem, które przybliża obraz snu jest badanie czynności bioelektrycznej mózgu – EEG. Ocenie podlega podstawowa czynność
we śnie, przeważnie zaznaczona w postaci fal ostrych wierzchołkowych, wrzecion snu, jak i kompleksów K oraz elementy patologiczne rejestrowane na jej tle.
Wrzeciona snu (ang. sleep spindle) są charakterystycznym elementem drugiego stadium snu wolnofalowego. W zależności od wieku
mogą przybierać różną formę. Najczęściej są to salwy o częstotliwości 11–15 Hz, zazwyczaj o różnej topografii, lecz o wyższej
amplitudzie w okolicach centralnych głowy. Amplituda bywa zmienna, najczęściej poniżej 50 µV u dorosłych. Tzw. skrajne wrzeciona snu są nieprawidłowościami, występującymi we śnie u niemowląt i dzieci, nawet do 9. roku życia. Zazwyczaj skrajne wrzeciona
snu są spowodowane uszkodzeniami lub zaburzeniami czynności struktur ośrodkowego układu nerwowego.
SŁOWA KLUCZOWE: sen, elektroencefalografia, wrzeciona snu.
Summary
Sleep is a variation of the functional condition of the nervous system different to standby.
In a dream, a reduced sensitivity to stimuli, abolished motor activity, slowed heart rate, breathing and other physiological functions,
and temporary loss of consciousness are noted.
The circadian rhythm of alertness alternates with sleep. The study, which brings the image of sleep is the study of bioelectrical brain
activity-EEG. Its primary function is evaluated in a dream, mostly in the form of selected vertex sharp waves, sleep spindles and
K complexes and pathological features recorded in the background. Sleep spindles are a characteristic part of the second stage of slow
wave sleep. Depending on age it may take different forms. Most frequent are volleys of 11–15 Hz frequency, usually with different
topography, but with higher amplitude over the central regions of the head. The amplitude is sometimes variable, but usually less
than 50 µV in adults. Extreme spindles may occur in infants and children up to nine years of age. They are connected with organic
or functional impairment of central nervous system.
KEY WORDS: sleep, EEG, sleep spindle.
Od zarania ludzkości sen stanowił zagadkę i niespożyte możliwości interpretacyjne. Do dnia dzisiejszego rola
biologiczna snu nie została do końca wyjaśniona. Wiadomo, że sen jest niezbędny do życia i prawidłowego przebiegu procesów psychicznych i pamięciowych.
Sen jest odmianą stanu czynnościowego układu nerwowego odmiennego od stanu czuwania. We śnie występuje zmniejszona wrażliwość na bodźce, zniesiona aktywność
ruchowa, zwolniona czynność serca, oddychania i innych
czynności fizjologicznych oraz czasowy zanik świadomości. W rytmie dobowym sen występuje naprzemiennie
z czuwaniem. Zapotrzebowanie na długość snu w różnych
przedziałach wiekowych jest różne. U osób dorosłych sen
nocny średnio trwa 7,5 godziny. Najdłużej śpią noworodki,
potem czas snu stopniowo maleje, aż do wieku dojrzałego a
właściwie do zakończenia wzrostu organizmu. Kolejne
zmniejszenie liczby godzin snu nocnego następuje w wieku
starszym [1].
Sen – obraz elektroencefalograficzny
Aby zarejestrować czynność bioelektryczną snu musimy wykonać badanie elektroencefalograficzne (EEG) rozpoczynając od stanu czuwania, aby następnie ocenić stan
zasypiania oraz występowanie poszczególnych stadiów
i faz snu. Sen może być metodą aktywacyjną zapisu czynności bioelektrycznej mózgu wykorzystywaną podczas badania
elektroencefalograficznego w diagnostyce padaczki [1].
EEG jest metodą umożliwiającą badanie aktywności
bioelektrycznej mózgu przez nienaruszone powłoki czaszki.
Rejestrowana czynność jest wypadkową wielu zachodzących jednocześnie procesów, które określają obraz czynności bioelektrycznej mózgu. Należą do nich: czuwanie, zasypianie, sen, budzenie, znieczulenie ogólne, śpiączka, wpływ
leków, funkcje metaboliczne i enzymatyczne tkanki nerwowej mózgu, reaktywność na bodźce oraz cechy genetyczne. W celu wykonania badania ustawia się na głowie
Wrzeciona snu u dzieci i młodzieży
pacjenta 19 elektrod podstawowych zgodnie z systemem
10–20% w miejscach określonych przez Międzynarodową
Federację Neurofizjologii Klinicznej [2–3]. Przez rejestrację i zapisanie prądów odbieranych z elektrod otrzymuje się
elektroencefalogram. W zależności od modelu i rodzaju
aparatu można uzyskać zapis EEG w postaci kilku lub
kilkunastu krzywych, które odzwierciedlają wartości potencjałów między odpowiednimi parami elektrod. Odchylenia
od wartości prawidłowych są formułowane i oceniane na
koniec każdego badania EEG. Nieprawidłowości zapisów
czynności bioelektrycznej mózgu powinny zawierać w swo
ich opisach elementy patologiczne, do których między
innymi należą: fale ostre, iglice, wieloiglice, zespoły fali
ostrej z falą wolną, zespoły iglicy z falą wolną, zespoły
wieloiglicy z falą wolną oraz czynność wolną [2–3], jak
również nieprawidłowości we śnie badanego. Ocenie musi
podlegać podstawowa czynność we śnie, przeważnie zaznaczona w postaci fal ostrych wierzchołkowych, wrzecion
snu, jak i kompleksów K oraz elementy patologiczne rejestrowane na jej tle.
Zapis elektroencefalograficzny snu składa się z następujących faz i stadiów:
Stadium snu 1 NREM, na które składa się czynność
theta 4–7 Hz czasami wymieszana z niskonapięciowymi
falami delta, która pojawia się w miejscu czynności alfa
widocznej podczas czuwania. To stadium charakteryzuje się
występowaniem szybkiej czynności EEG o amplitudzie 50–
75 µV. W czasie tego stadium mogą pojawiać się fale ostre
wierzchołkowe, charakteryzujące się wysokonapięciowym
ostrym ujemnym wychyleniem, z następującym ostrym
wychyleniem dodatnim i maksimum amplitudy nad elektrodą z oznaczeniem Cz. Wrzeciona snu lub kompleksy K
nie są częścią fali ostrej wierzchołkowej. Wzbudzenie w
zapisie EEG jest określone jako wyładowanie fal o szybkiej
częstotliwości alfa lub o częstotliwości theta, trwające zazwyczaj około 3 sekund ale poniżej 15 sekund. Pojawiają
się wolne ruchy gałek ocznych. Czas trwania stadium
1 NREM może wzrastać wraz z wiekiem.
Stadium snu 2 NREM – charakteryzuje się przewagą
czynności theta i minimalną czynnością alfa w EEG. Stadium 2 NREM stanowi prawie 50% długości snu nocnego
u osoby dorosłej. W tym stadium pojawiają się kompleksy K
oraz wrzeciona snu i są one zazwyczaj epizodyczne. Kompleksy K przeważają w okolicach centralno-wierzchołkowych mózgu – mają morfologię dwufazowych fal
wolnych o ostrym wierzchołku, o wychyleniu ujemnym
z następową komponentą dodatnią. Ich charakterystyczna
morfologia wyróżnia je od czynności podstawowej. Kompleksy K nawet bez obecności wrzecion snu są wystarczającym kryterium do rozpoznania 2 NREM. Zwiększona
liczba wrzecion u osoby badanej może wskazywać na stosowanie przez pacjenta leków z grupy benzodiazepin.
Wrzeciona snu powstają w jądrach wzgórza i są wynikiem
hamowania czynności mózgu. Wraz z wiekiem częstotliwość wrzecion snu ma tendencję do zmniejszania się.
447
Stadium snu 3 i 4 NREM – może też być określane
terminem snu głębokiego, snu wolnofalowego lub snu
delta. Stadium snu wolnofalowego ma tendencję do
zmniejszania się wraz z wiekiem. Stadium 3 NREM
pojawia się około 30–45 minut po zaśnięciu i oznacza
rozpoczęcie snu wolnofalowego.
Stadium snu z szybkimi ruchami gałek ocznych
(REM) – pojawia się po 90–120 minutach od zaśnięcia
i stanowi 20–25% całkowitego czasu snu. Czynność
EEG w stadium REM charakteryzuje się stosunkowo
niskonapięciową czynnością mieszaną theta i alfa, zazwyczaj 1–2 Hz wolniejszą niż w czuwaniu. Czynność
EEG jest bardziej podobna do stanu czuwania niż do
snu. Bywa tak, że stadium REM można już rozpoznać w
EEG przed rozpoczęciem ruchów gałek ocznych.
Pierwsze stadium REM jest krótsze niż kolejne stadia
REM. Stadium REM charakteryzuje się występowaniem
fal EEG o częstotliwości 4–7 Hz ułożonych w szeregu.
Fale te mogą pojawiać się w seriach do kilku sekund
o najwyższej amplitudzie znad okolic wierzchołkowych
[1–4].
W 2001 roku Peigneux i wsp. uznali, że sen bez
szybkich ruchów gałek ocznych (Non-rapid eye movement, NREM) i sen z szybkim ruchem gałek ocznych
(Rapid eye movement, REM) odpowiadają za różne
procesy pamięciowe (Peigneux et al. 2001). Sen NREM
wg ich hipotezy ma być odpowiedzialny za pamięć deklaratywną a sen REM za pamięć proceduralną i umiejętności (Peigneux et al. 2001). Obserwacje te zostały
potwierdzone przez Rauchs i wsp. [6]. Jednocześnie podkreślono, że różnorodne procesy pamięciowe ulegają
konsolidacji w różnych fazach snu [6].
Wrzeciona snu
Wrzeciona snu są charakterystycznym elementem drugiego stadium snu wolnofalowego. W zależności od wieku
mogą przybierać różną formę. Badaniem, w którym można
ocenić ich obecność i jakość jest badanie EEG.
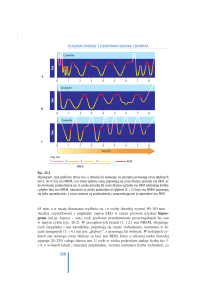
Wrzeciona snu (ang. sleep spindle) są to salwy o częstotliwości 11–15 Hz, ale najczęściej 12–14 Hz, zazwyczaj o różnej topografii, lecz o wyższej amplitudzie nad
centralnymi okolicami głowy, występujące podczas snu.
Amplituda bywa zmienna, ale najczęściej poniżej 50 µV
u dorosłych [7] (Ryc. 1., Ryc. 2.).
Jednym z elementów dojrzewania w pierwszych
miesiącach życia jest występowanie snu spokojnego,
który jest obecny tuż po zaśnięciu niemowląt, jak również wiele nowych zjawisk bioelektrycznych. Pewne
etapy rozwojowe znajdują odzwierciedlenie w opisach
badań elektroencefalograficznych. Charakterystyczna dla
okresu noworodkowego jest krzywa zmienna wyrażona
w postaci wolnej, wysokonapięciowej czynności we śnie
spokojnym.
448
Rycina 1. Prawidłowe wrzeciona snu.
Figure 1. Normal sleep spindles.
Rycina 2. Prawidłowe wrzeciona snu.
Figure 2. Normal sleep spindles.
Monika Starczewska i inni
Wrzeciona snu u dzieci i młodzieży
449
Rycina 3. Krzywa zmienna.
Figure 3. High voltage slow waves.
Wraz ze stopniowym dojrzewaniem dochodzi do
powstawania nowych form snu, na przykład zwiększonej
liczby fal wolnych delta. Nowym zjawiskiem rozwojowym jest pojawienie się wrzecion snu. Na ogół panuje
przekonanie, że pojawiają się one między 4. i 6. tygodniem życia. Około 1. miesiąca życia (wg Metcalfa)
przyjmują formę „przedwrzecion” snu, czyli fal 14–16 Hz
o niskiej i zmiennej amplitudzie [8]. Przybierają one
bardziej dojrzałą formę w kolejnych tygodniach życia
charakteryzując się wyższą amplitudą i niższą częstotliwością. Około 8. tygodnia życia przyjmują dojrzałą
formę, początkowo występując w salwach 0,5 do 3 sekundowych w okolicach wierzchołkowych, aż wreszcie
zarówno w okolicach przednich i tylnych obu półkul
mózgu. Kształtem przypominają sinusoidę. Dojrzewanie
wrzecion snu może być szybsze u wcześniaków i mogą
też przybierać formę niedojrzałych wrzecion snu. Wraz
z dojrzewaniem wrzeciona snu mogą mieć dłuższy czas
trwania. W pierwszych 6 miesiącach życia okresy wrzecion snu bywają najkrótsze, regularne, niesymetryczne
i niesynchroniczne, a w drugiej połowie 1. roku stają się
dłuższe i mało regularne. Dzieje się tak dlatego, że różne
okolice mózgowia dojrzewają w różnej kolejności. Jako
pierwsze wymienia się centralne okolice mózgowia,
później czołowe, ciemieniowe, potyliczne i skroniowe.
W takiej właśnie kolejności wraz z dojrzewaniem można
doszukiwać się obecności wrzecion snu u dzieci. Przebieg dojrzewania wrzecion snu jest indywidualny i może
być nieco inny dla każdego osobnika. Uważa się, że
wrzeciona snu osiągają dojrzałą formę w 3. miesiącu
życia. Brak wrzecion snu jako wyraz opóźnienia dojrze-
wania stwierdzono np. w niedoczynności tarczycy, mającej bardzo istotny wpływ na dojrzewanie licznych
funkcji OUN. Poza wrzecionami snu około 5–6. miesiąca życia pojawiają się kompleksy K oraz fale ostre
wierzchołkowe. We śnie głębszym znikają wrzeciona
snu i fale ostre wierzchołkowe, a występuje więcej
czynności wolnej i narasta jej amplituda. Przy zmianach
poziomu snu i przejścia do snu płytszego pojawiają się
ponownie fale ostre wierzchołkowe i wrzeciona snu.
Zapis EEG jest więc wyrazem różnorodnych poziomów
snu, zasypiania i budzenia, a ocena tych stanów w
pierwszym roku życia wymaga dobrej znajomości tych
zjawisk. Duże różnice indywidualne stwarzają szerokie
granice normy, ale mają też istotne znaczenie w ocenie
poziomu dojrzałości zapisu.
Skrajne wrzeciona snu
Nieprawidłowościami występującymi we śnie u niemowląt i dzieci, nawet do 9. roku życia, są nieprawidłowe
wrzeciona snu spowodowane uszkodzeniami lub zaburzeniami czynności struktur ośrodkowego układu nerwowego. Wrzeciona te według Gibasów [9] zwane są „skrajnymi” (extreme spindles) i charakteryzują się wysokim
woltażem, przekraczającym niekiedy 200 µV i niższą
częstotliwością niż wrzeciona prawidłowe (Ryc. 4.).
Wśród opisywanych sześciu typów tych wrzecion,
różniących się między sobą, stwierdza się takie formy,
w których równocześnie obecne są fale wolne lub ostre
oraz czynność szybka. Obecność „skrajnych wrzecion”
450
Monika Starczewska i inni
Rycina 4. Skrajne wrzeciona.
Figure 4. Extreme spindles.
opisywano w różnorodnego rodzaju niedorozwojach umysłowych u dzieci i w fenyloketonurii [10]. Uważa się jednak, że ich obecność jest związana z upośledzeniem umysłowym [9, 11] uwarunkowanym tzw. „organicznymi”
uszkodzeniami mózgu, zależnymi od wad rozwojowych,
przebytych urazów i infekcji, a także w części uszkodzeń
o nieznanych przyczynach. Obecność „skrajnych wrzecion”
snu stwierdza się zarówno w mózgowym porażeniu dziecięcym, jak i w padaczce. Przy czym u dzieci z padaczką wraz
z wrzecionami snu współistnieją fale ostre, a u dzieci z różnego rodzaju zespołami neurologicznymi również fale wolne
i ostre. U dzieci, u których występują „wrzeciona skrajne”
stwierdza się w zapisach czuwania zwykle obfitą czynność
szybką [12].
Sen i padaczka wykazują wzajemne zależności. Sen może
wpływać na częstość wyładowań padaczkowych u człowieka, a te wyładowania mogą wpływać na regulację snu
i być powodem wybudzeń [13].
Stwierdzono, że deprywacja snu nasila wyładowania
napadowe u pacjentów z padaczką uogólnioną [14]. Sen
może wyzwalać aktywność napadową nawet u jednej trzeciej chorych na padaczkę i u prawie 90% pacjentów z padaczką z napadami pojawiającymi się podczas snu [13, 15].
Niektóre postacie padaczki, np. łagodna padaczka Rolandyczna oraz nocne napady z płata czołowego charakteryzują się występowaniem napadów tylko we śnie [16]
(Ryc. 5., Ryc. 6.).
Wrzeciona snu u dzieci i młodzieży
451
Rycina 5. Padaczka Rolandyczna.
Figure 5. Rolandic epilepsy.
Rycina 6. Padaczka czołowa.
Figure 6. Frontal lobe epilepsy.
Piśmiennictwo
1. Gryz E.A., Szczudlik A.: Domowy poradnik medyczny.
Janicki K. (red.), PZWL, Warszawa 2008.
2. Majkowski J.: Badania elektroencefalograficzne w padaczce u dzieci. W: Padaczka i inne stany napadowe
u dzieci. Michałowicz R. (red.). PZWL, Warszawa 2001,
145-184.
452
Monika Starczewska i inni
3. Majkowski J.: Atlas elektroencefalografii. PZWL, Warszawa 1991, 3-100.
4. Avidan A.Y., Zee P.C.: Podręcznik medycyny snu.,
MediPage, Warszawa 2007, 243-255.
5. Peigneux P., Laureys S., Delbeuck X. et al.: Sleeping
brain, learning brain. The role of sleep for memory systems. Neuroreport, 2001, 12, 111-124.
6. Rauchs G., Desgranges B., Foret J. et al.: The relationships between memory systems and sleep stages. J. Sleep
Res., 2005,14, 123-140.
7. Majkowski J.: Leksykon elektroencefalografii. Biblioteka Epileptologii, Warszwa 2005, 72-73.
8. Metcalf D.R.: EEG Sleep spindle ontogenesis. Neuropediatrie, 1970, 1, 428.
9. Gibbs E.L., Gibbs F.A.: Clinical Correlates of Various
Types of Extreme Spindles. Clin. Electroencephalogr.,
1973, 4, 2-89.
10. Gross H.P., Schulte F.J.: On increased spindle activity in
the sleep EEG of children with phenyloketonuria. Z. Kinderkeilk, 1969,105, 324.
11. Feinberg J. et al.: EEG Steep patterns in mental retardation: EEG Clin. Neurophysiol., 1969, 27, 128.
12. Koślacz-Folga A.: Elektroencefalografia wieku rozwojowego. PZWL, Warszawa 1980, 56-130.
13. Vaughn B.V., D’Cruz O.F.: Sleep and epilepsy. Sem. Neurol., 2004, 24, 301-313.
14. Degen R., Degen H.E.: Sleep and sleep deprivation in
epileptology. Epilepsy Res. Suppl., 1991, 2, 235-260.
15. Dinner DS.: Effect of sleep on epilepsy. J. Clin. Neurophysiol., 2002, 19, 504-513.
16. Steinborn B.: Dziecięce padaczki ogniskowe uwarunkowane genetycznie. Postępy w diagnostyce i leczeniu
chorób układu nerwowego u dzieci. Jóźwiak S. (red.).
BiFolium. Lublin 2007, 9-20.
Adres do korespondencji:
Monika Starczewska
Katedra i Klinika Neurologii Wieku Rozwojowego
ul. Przybyszewskiego 49
61-355 Poznań
Tel. 61 869 12 55
mail: [email protected]