Temat: Model Bohra
budowy atomu wodoru
1. Model Thomsona -1898 r.
(ciasto z rodzynkami) – Atom zbudowany
jest z dodatniej materii, w której
umieszczone są dowolnie ujemne elektrony.
2. 1911 – model Rutherforda
Atom składa się z jądra o ładunku dodatnim (rzędu
10-15 m) i z elektronów o ładunku ujemnym, które
krążą wokół jądra tworząc powłokę elektronową.
3. Niels Henrik Bohr w 1913 roku
opublikował nową teorię budowy atomów.
Przyjął on, tak jak wcześniej Rutherford, że
elektrony krążą po orbitach kołowych
dookoła jądra. Szczegóły budowy ujął w
swoich postulatach.
4. Postulaty Bohra:
I. Elektron może krążyć w atomie tylko po
takich orbitach kołowych, dla których iloczyn
masy elektronu (m), jego szybkości (v) i
promienia orbity (r) jest równy całkowitej
wielokrotności stałej Plancka (h) podzielonej
przez 2p.
h
mVr = n
2p
II. Postulat Bohra:
§ Elektron w atomie może przeskoczyć z orbity o mniejszym
promieniu na orbitę o większym promieniu, jeśli
dostarczymy mu odpowiednią porcję energii.
§ Przeskokowi elektronu z orbity o większym promieniu na
orbitę o mniejszym promieniu towarzyszy wysłanie
odpowiedniej porcji energii.
hn = ES - Em
5. Z pierwszego postulatu Bohra wynika, że elektron
może krążyć w atomie wodoru tylko po dozwolonej
orbicie o ściśle określonym promieniu spełniającym
warunek:
rn = n r1
2
Gdzie r1 nazywamy promieniem Bohra atomu wodoru,
a litera n oznacza numer orbity i jest liczbą naturalną.
r1 » 5,3 ×10
-11
m
Jeżeli elektron nie znajduje się na pierwszej orbicie
dozwolonej, to mówimy, że znajduje się w stanie
wzbudzonym.
Jeżeli do wzoru:
rn = n r1
2
Wstawimy kolejne liczby naturalne to otrzymamy
następujące wartości:
r2 = 2 r1 = 4r1
2
r3 = 3 r1 = 9r1
2
r4 = 4 r1 = 16r1
2
Zatem otrzymujemy zależność na kolejne promienie:
r1 : r2 : r3 : r4 ... = 1 : 4 : 9 : 16...
6. Całkowita energia elektronu na n-tej
orbicie wyraża się wzorem:
A
En = - 2
n
Gdzie wartość A wynosi:
A = 13,6eV » 2,2 ×10 J
-18
Wartość E1= -13,6eV
7. Wartość energii emitowanej przy przejściu
elektronu z n-tej orbity dozwolonej na k-tą
orbitę dozwoloną:
1 ö
A æ Aö
æ 1
E = En - Ek = - 2 - ç - 2 ÷ = Aç 2 - 2 ÷
n è k ø
n ø
èk
Wartość tej energii możemy wyrazić przez
częstotliwość lub długość fali:
hc
E = hn =
l
Jeżeli przekształcimy wzór
do postaci
hc
E = hn =
l
1 n
E
Aæ 1
1 ö
= =
= ç 2- 2÷
l c hc hc è k
n ø
to otrzymujemy wzór Balmera, który był podany
przez niego i tłumaczył powstawanie widma
liniowego.
1
1 ö
æ 1
= RH ç 2 - 2 ÷
ln
n ø
è2
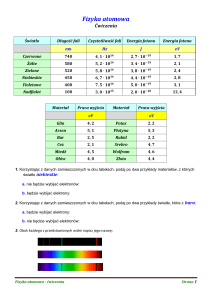
8. Wyjaśnienie powstawania serii widm
liniowych wodoru.
Seria Lymana – przy przejściu elektronu na
pierwszą orbitę:
1
æ1 1 ö
= Rh ç 2 - 2 ÷
ln
n ø
è1
Seria Balmera – przy przejściu elektronu na
drugą orbitę
1
1 ö
æ 1
= Rh ç 2 - 2 ÷
ln
n ø
è2
Seria Paschena - przy przejściu elektronu
na trzecią orbitę:
1
1 ö
æ 1
= Rh ç 2 - 2 ÷
ln
n ø
è3
Powyższe wzory pozwalają wyznaczyć
długości fal, dla których powstają prążki w
widmie wodoru.