I.
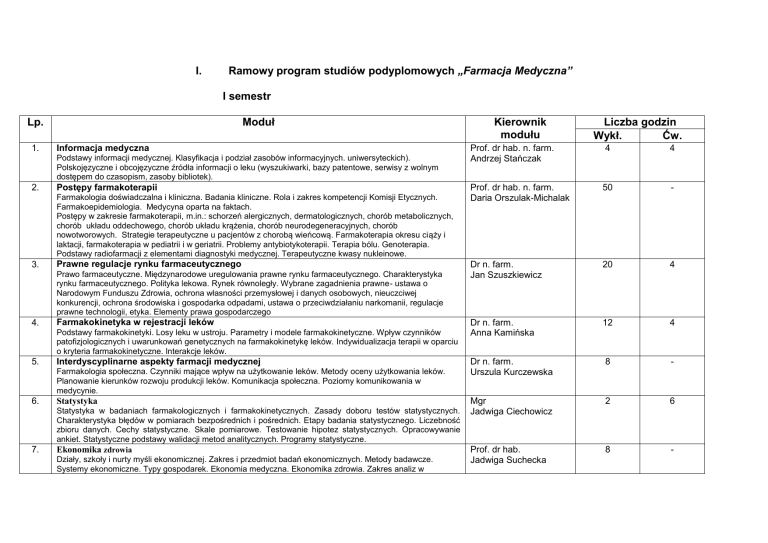
Ramowy program studiów podyplomowych „Farmacja Medyczna”
I semestr
Moduł
Lp.
1.
Informacja medyczna
Podstawy informacji medycznej. Klasyfikacja i podział zasobów informacyjnych. uniwersyteckich).
Polskojęzyczne i obcojęzyczne źródła informacji o leku (wyszukiwarki, bazy patentowe, serwisy z wolnym
dostępem do czasopism, zasoby bibliotek).
2.
Postępy farmakoterapii
Farmakologia doświadczalna i kliniczna. Badania kliniczne. Rola i zakres kompetencji Komisji Etycznych.
Farmakoepidemiologia. Medycyna oparta na faktach.
Postępy w zakresie farmakoterapii, m.in.: schorzeń alergicznych, dermatologicznych, chorób metabolicznych,
chorób układu oddechowego, chorób układu krążenia, chorób neurodegeneracyjnych, chorób
nowotworowych. Strategie terapeutyczne u pacjentów z chorobą wieńcową. Farmakoterapia okresu ciąży i
laktacji, farmakoterapia w pediatrii i w geriatrii. Problemy antybiotykoterapii. Terapia bólu. Genoterapia.
Podstawy radiofarmacji z elementami diagnostyki medycznej. Terapeutyczne kwasy nukleinowe.
3.
Prawne regulacje rynku farmaceutycznego
Prawo farmaceutyczne. Międzynarodowe uregulowania prawne rynku farmaceutycznego. Charakterystyka
rynku farmaceutycznego. Polityka lekowa. Rynek równoległy. Wybrane zagadnienia prawne- ustawa o
Narodowym Funduszu Zdrowia, ochrona własności przemysłowej i danych osobowych, nieuczciwej
konkurencji, ochrona środowiska i gospodarka odpadami, ustawa o przeciwdziałaniu narkomanii, regulacje
prawne technologii, etyka. Elementy prawa gospodarczego
4.
Farmakokinetyka w rejestracji leków
Podstawy farmakokinetyki. Losy leku w ustroju. Parametry i modele farmakokinetyczne. Wpływ czynników
patofizjologicznych i uwarunkowań genetycznych na farmakokinetykę leków. Indywidualizacja terapii w oparciu
o kryteria farmakokinetyczne. Interakcje leków.
5.
Interdyscyplinarne aspekty farmacji medycznej
Farmakologia społeczna. Czynniki mające wpływ na użytkowanie leków. Metody oceny użytkowania leków.
Planowanie kierunków rozwoju produkcji leków. Komunikacja społeczna. Poziomy komunikowania w
medycynie.
6.
7.
Statystyka
Statystyka w badaniach farmakologicznych i farmakokinetycznych. Zasady doboru testów statystycznych.
Charakterystyka błędów w pomiarach bezpośrednich i pośrednich. Etapy badania statystycznego. Liczebność
zbioru danych. Cechy statystyczne. Skale pomiarowe. Testowanie hipotez statystycznych. Opracowywanie
ankiet. Statystyczne podstawy walidacji metod analitycznych. Programy statystyczne.
Ekonomika zdrowia
Działy, szkoły i nurty myśli ekonomicznej. Zakres i przedmiot badań ekonomicznych. Metody badawcze.
Systemy ekonomiczne. Typy gospodarek. Ekonomia medyczna. Ekonomika zdrowia. Zakres analiz w
Kierownik
modułu
Liczba godzin
Wykł.
Ćw.
Prof. dr hab. n. farm.
Andrzej Stańczak
4
4
Prof. dr hab. n. farm.
Daria Orszulak-Michalak
50
-
Dr n. farm.
Jan Szuszkiewicz
20
4
Dr n. farm.
Anna Kamińska
12
4
Dr n. farm.
Urszula Kurczewska
8
-
Mgr
Jadwiga Ciechowicz
2
6
Prof. dr hab.
Jadwiga Suchecka
8
-
ekonomice zdrowia. Podaż usług medycznych. Popyt na świadczenia medyczne. Ujęcie modelowe sektora
zdrowia. Sposoby i metody finansowania świadczeń medycznych. Finansowanie świadczeń we współczesnym
systemie zdrowia w Polsce. Farmakoekonomika. Ewaluacja analiz ekonomicznych w ochronie zdrowia
(metody, mierniki, narzędzia wartościowania wyniku).
8
Prof. dr hab. n. farm.
Andrzej Stańczak
Suplementy diety
8
-
112
18
Suplementy diety – aspekty: legislacyjny i praktyczny. Rynek suplementów diety w Polsce. Żywność
funkcjonalna a nutraceutyki. Probiotyki, prebiotyki, synbiotyki. Bezpieczeństwo stosowania suplementów diety.
Razem
II semestr
Moduł
Lp.
9.
Rejestracja leków
Zasady i przepisy dotyczące dopuszczania produktów leczniczych do obrotu. Dobra Praktyka Wytwarzania
GMP. Dobra Praktyka Laboratoryjna GLP. Dobra Praktyka Kliniczna GCP. Dobra Praktyka Dystrybucji GDP.
Wyroby medyczne. Leki sieroce. Leki weterynaryjne. Produkty biobójcze. Preparaty homeopatyczne. Leki
roślinne. Dokumentacja rejestracyjna – warsztaty.
10.
Elementy biofarmacji
Kierownik modułu
Liczba godzin
Wykł.
Ćw.
Prof. dr hab. n. farm.
Andrzej. Stańczak
42
8
Dr n. farm.
Urszula Kurczewska
16
4
Dr n. farm.
Jan Szuszkiewicz
12
-
Prof. dr hab. n. farm.
Jadwiga Szymańska
8
-
Dr n. farm.
Jan Szuszkiewicz
8
-
Mgr
8
-
Biofarmaceutyczne aspekty formułowania i podawania leków. Kryteria oceny jakości postaci leku. Dostępność
farmaceutyczna. Dostępność biologiczna. Trwałość leku. Postacie leku o modyfikowanej szybkości uwalniania.
Nowe postacie leku. Alternatywne drogi podania leków. Nanotechnologia. Testy diagnostyczne. Leki
innowacyjne i odtwórcze.
11.
Zarządzanie
Zarządzanie w opiece zdrowotnej. Kierunki i nurty zarządzania. Cechy struktury organizacyjnej (centralizacja,
formalizacja, specjalizacja, hierarchizacja). Zarządzanie zasobami ludzkimi. Systemy zarządzania.
Zarządzanie strategiczne i operacyjne. Style kierowania. Umiejętności i role kierownicze. Planowanie
strategiczne i operacyjne. Analiza SWOT. Czynniki oddziałujące na opiekę zdrowotną i ich wpływ na
zarządzanie. Modele opieki zdrowotnej. Poziomy opieki medycznej w Polsce. Formy gospodarki finansowej.
Dostawcy świadczeń. Koordynowana opieka medyczna. Międzynarodowa Klasyfikacja Chorób i Procedur
Medycznych. Klasyfikacja badań laboratoryjnych. Kodowanie badań. Grupy jednorodne. Klasyfikacja badań
medycznych. Publiczne i niepubliczne ZOZ. Przedsiębiorstwo farmaceutyczne.
12.
Monitorowanie niepożądanych działań leków
Działania niepożądane leków, przyczyny występowania, podział. Czynniki egzogenne i endogenne wpływające
na różnice w odpowiedzi na lek. Monitorowanie działań niepożądanych. leków (regulacje prawne, systemy
zbierania danych, ośrodki międzynarodowe i regionalne, osoby uprawnione do zgłaszania działań
niepożądanych, okresowe raporty o bezpieczeństwie stosowania leków). Formularze zgłoszeń działań
niepożądanych. Niepożądane odczyny poszczepienne – regulacje prawne, formularze zgłoszeń. Alergie
lekowe. Choroby polekowe. Działanie rakotwórcze leków.
13.
Instytucje nadzoru farmaceutycznego
Rola i zadania Ministerstwa Zdrowia, Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i
Produktów Biobójczych i Głównego Inspektoratu Sanitarnego w zapewnieniu skuteczności i bezpieczeństwa
stosowania produktów leczniczych i suplementów diety. Organizacja i zakres działań Państwowej Inspekcji
Farmaceutycznej. Nadzór nad warunkami wytwarzania i jakością produktów leczniczych. Nadzór nad obrotem
hurtowym i detalicznym produktami leczniczymi. Wycofywanie i wstrzymywanie w obrocie produktów
leczniczych.
14.
Marketing farmaceutyczny
Rodzaje marketingu. Marketing niestandardowy. Rynek farmaceutyczny w kraju i na świecie. Rejestracje leków w USA i
Europie. Największe firmy farmaceutyczne, produkty najlepiej sprzedające się (klasy terapeutyczne, leki). Sprzedaż
apteczna (leki refundowane, leki pełnopłatne). Działania marketingowe, typy działań. Reklama produktów leczniczych –
regulacje prawne, rodzaje reklamy produktów leczniczych i suplementów diety
15.
Michał Tracz
Prof. dr hab. n. farm.
Daria Orszulak-Michalak
Seminarium dyplomowe
-
24
94
36
Student zobowiązany jest przygotować pracę dyplomową w ramach zajęć seminaryjnych pod kierunkiem
promotora. Temat pracy dyplomowej ustala promotor w porozumieniu ze studentem
Razem
1 pkt ECTS = 25 godz.; 60 pkt ECTS = 1500 godz.
Studia podyplomowe „Farmacja Medyczna”: 260 godz. zajęć dydaktycznych, 1240 godz. pracy własnej, 60 ECTS