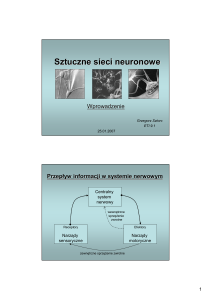
PRZEWODNICTWO NERWOWE I TRANSMISJA SYNAPTYCZNA
Rozdział 4
Potencjał błonowy – różnica w ładunku elektrycznym (potencjałów) pomiędzy wnętrzem a zewnętrzem komórki
Jak go zarejestrować? – używając mikroelektrod. Jedną wprowadza się do neuronu, drugą do płynu zewnątrzkomórkowego.
=> potencjał wewnątrz komórki w stanie spoczynku wynosi o ok. 70mV mniej niż na zewnątrz neuronu
Stały potencjał błonowy wynoszący ok. –70mV nazywany jest SPOCZYNKOWYM POTENCJAŁEM BŁONOWYM
=> neuron w stanie spoczynku określany jest jako SPOLARYZOWANY
I. Jonowa podstawa potencjałów spoczynkowych
Dlaczego neurony w stanie spoczynku są spolaryzowane?
-
w roztworze soli znajdującym się w tkance nerwowej obecne są dodatnio i ujemnie naładowane cząsteczki
=> JONY
-> stosunek ujemnie naładowanych cząsteczek do ładunków dodatnich jest większy wewnątrz neuronu
Skąd to nierówne rozmieszczenie?
-
interakcja czterech czynników
-> działanie dwóch z nich zmierza do równomiernego rozmieszczenia jonów w płynie wewnątrzi zewnątrzkomórkowym (to czynniki homogenizujące)
-> dwa następne – cechy błony komórkowej – przeciwdziałają tym homogenizującym siłom
A. Siły homogenizujące
1.
GRADIENT STĘŻEŃ (DYFUZJA)
- wszystkie cząsteczki poruszające się ruchem dowolnym (tu jony w płynie okołokomórkowym) dążą
do równomiernego rozmieszczenia
Dlaczego?
- cząsteczki łatwiej się przemieszczą z miejsc, gdzie cząsteczek jest więcej (wysokie stężenie) do
miejsc, gdzie jest ich mniej (niskie stężenie) niż odwrotnie
2.
GRADIENT ELEKTROCHEMICZNY (CIŚNIENIE ELEKTROSTATYCZNE)
- posiadające ładunek elektryczny cząsteczki odpychane są przez znajdujące się w pobliżu cząsteczki
o podobnym znaku lecz przyciągane przez inne cząsteczki, ale o ładunku przeciwnym.
-> wszelkie nagromadzenie ładunków o podobnym znaku ma więc tendencję do rozpraszania się.
Żadna pojedyncza klasa jonów nie jest rozmieszczona równomiernie po obu stronach błony komórkowej.
Jony uczestniczące w utrzymaniu potencjału spoczynkowego
-
jony sodowe
jony potasowe
jony chlorkowe
ujemnie naładowane jony białkowe
Na+
K+
Cl-
Stężenie jonów sodowych i chlorkowych większe jest NA ZEWNĄTRZ neuronu, a jonów potasowych
neuronu. Ujemnie naładowane jony białkowe syntetyzowane są wewnątrz neuronu.
WEWNĄTRZ
B. Właściwości błony komórkowej odpowiedzialne za nierównomierne rozmieszczenie Na+, K+, Cli jonów białkowych w niepobudzonym neuronie
3.
SELEKTYWNA PRZEPUSZCZALNOŚĆ
- to bierny mechanizm: nie wymaga użytkowania energii
W neuronach niepobudzonych:
-> K+ i Cl- z łatwością przechodzą przez błonę komórkową
-> Na+ z trudnością przechodzą przez błonę komórkową
-> ujemnie naładowane jony białkowe w ogóle nie przechodzą przez błonę komórkową
Jak przechodzą to gdzie?
- w wyspecjalizowanych przejściach zwanych KANAŁAMI JONOWYMI;
są ich różne rodzaje, każdy wybiórczy dla określonego jonu
4.
POMPA SODOWO-POTASOWA
- to czynny mechanizm: wymaga poboru energii
W latach 50tych ALAN HODGKIN i ANDREW HUXLEY przeprowadzili klasyczne dziś eksperymenty
Wynik?
-> w utrzymaniu spoczynkowego potencjału błonowego wydatkowana jest energia
Ich tok myślenia przebiegał następująco:
Dlaczego wysokie stężenie jonów sodowych i chlorkowych na zewnątrz neuronu i wysokie stężenie
jonów potasowych w jego wnętrzu nie zostanie wyeliminowane przez tendencje jonów do poruszania
się zgodnie z gradientem stężeń do miejsc o niższej ich koncentracji?
Czy wynoszące –70mV ciśnienie elektrostatyczne pomiędzy wnętrzem a zewnętrzem neuronu może
być siłą przeciwdziałającą ruchom jonów zgodnie z gradientem stężeń i utrzymującą
nierównomierne rozmieszczenie jonów?
Pinel 1
Co więc zrobili?
Obliczyli dla każdego z trzech jonów – Na+, K+ i Cl- - wartość ładunku elektrostatycznego
niezbędnego dla zrównoważenia siły wynikającej z gradientu stężeń.
1. obliczony ładunek elektrostatyczny dla JONÓW CHLORKOWYCH – Cl- - wynosił -70mV
-> czyli tyle samo co potencjał spoczynkowy.
Wniosek?
Gdy komórka nerwowa jest w stanie spoczynku nierówne rozmieszczenie jonów chlorkowych
utrzymywane jest przez:
- wynoszącą 70mV wartość gradientu stężeń skierowaną do wnętrza neuronu
- wynoszącą 70mV wartość gradientu elektrycznego skierowaną na zewnątrz neuronu
2. obliczony ładunek elektrostatyczny dla JONÓW POTASOWYCH – K+ - wynosił 90mV
-> czyli dla powstrzymania znajdujących się wewnątrz komórki jonów potasu od jej opuszczenia
(i skierowania się zgodnie z jej gradientem stężeń) niezbędne byłoby ciśnienie elektrostatyczne
o wartości 90mV
A dokładniej?
- zarejestrowano wynoszącą 90mV wartość gradientu stężeń skierowaną na zewnątrz neuronu
- oraz wynoszące 70mV ciśnienie elektrostatyczne skierowane do wewnątrz
3. obliczony ładunek elektrostatyczny dla JONÓW SODOWYCH – Na+ - wynosił –120mV
-> w tym przypadku siły zarówno gradientu stężeń, jak i gradientu elektrostatycznego skierowane
są w tym samym kierunku: do wnętrza komórki
- 50mV siły wpychającej jony sodowe zgodnie z gradientem stężeń do wnętrza neuronu
- 70mV ciśnienia elektrostatycznego wciskającego je również do wnętrza komórki
No i rzeczywiście!
=> jony potasu są nieustannie wypychane z niepobudzonej komórki przez 20mV ciśnienia
=> jony sodowe są nieustannie wtłaczane do wnętrza komórki przez siłę 120mV i to pomimo
ogromnego oporu błony komórkowej!
Dlaczego więc wewnątrz- i zewnątrzkomórkowe stężenie jonów sodu i potasu jest w
niepobudzonych neuronach stałe?
=> Błona komórkowa ma aktywne mechanizmy przeciwdziałające napływowi kationów sodowych do
wnętrza komórki (gdy tylko uda im się tam dotrzeć wypompowuje je na zewnątrz) oraz wypływowi
kationów potasowych z jej wnętrza (wpompowuje je z powrotem)
=> procesy transportu jonów sodu na zewnątrz i jonów potasu do wewnątrz komórki nie są
niezależne, ale ze sobą związane: oba wykonywane są przez wymagający stałego dostarczania
energii mechanizm błony komórkowej nieustannie wymieniający trzy jony sodowe z wnętrza
komórki na dwa jony potasowe z jej zewnętrza. Ten mechanizm to POMPA SODOWO-POTASOWA
II. Generowanie i przewodzenie potencjałów postsynaptycznych
Po wyładowaniach neuronów z ich kolebek synaptycznych uwalniane są neuroprzekaźniki
-> rozprzestrzeniają się one w szczelinie synaptycznej i wchodzą w interakcje ze specjalnymi molekułami
(receptorami) ulokowanymi na błonie recepcyjnej następnego neuronu.
Co dzieje się, gdy molekuły neuroprzekaźnika przyłączają się do receptorów postsynaptycznych?
1.
DEPOLARYZUJĄ ONE BŁONĘ RECEPCYJNĄ
- czyli obniżają potencjał spoczynkowy błony (np. z –70mv do –67mV)
Postsynaptyczne depolaryzacje nazywamy POSTSYNAPTYCZNYMI POTENCJAŁAMI POBUDZENIOWYMI (EPSPs)
ponieważ zwiększają one prawdopodobieństwo wyładowania neuronu.
lub:
2.
HIPERPOLARYZUJĄ BŁONĘ RECEPCYJNĄ
- czyli podwyższają potencjał spoczynkowy błony (np. z –70mV do –72mV)
Postsynaptyczne hiperpolaryzacje nazywamy POSTSYNAPTYCZNYMI POTENCJAŁAMI HAMULCOWYMI (IPSPs)
ponieważ zmniejszają one prawdopodobieństwo wyładowania neuronu.
Zarówno EPSPs, jak i IPSPs to REAKCJE STOPNIOWALNE (graded responses): ich amplitudy są proporcjonalne
do siły bodźca, który je wywołał
- słabe bodźce wywołują małe potencjały postsynaptyczne
- silne bodźce wywołują duże potencjały postsynaptyczne
Potencjały postsynaptyczne przemieszczają się biernie z miejsca ich wygenerowania
Jakie są najważniejsze cechy przewodzenia potencjałów postsynaptycznych?
1. JEST ONO NAGŁE
Ważne jednak nie mylić czasu trwania potencjałów postsynaptycznych z ich tempem przewodzenia
-> ich czas trwania może być zróżnicowany, lecz tempo ich przewodzenia jest zawsze nagłe (b. szybkie)
2. JEST ONO UBYTKOWE (Z DEKREMENTEM)
Potencjały postsynaptyczne zmniejszają swoją amplitudę podczas przemieszczania się po neuronie
Pinel 2
III. Integracja potencjałów postsynaptycznych i powstawanie potencjału czynnościowego
Wyładowanie neuronu uzależnione jest od zsumowanego efektu oddziaływania tysięcy synaps pokrywających obszary
recepcyjne neuronu
lub, ściślej mówiąc, zależy od równowagi sygnałów pobudzeniowych i hamulcowych docierających do WZGÓRKA AKSONALNEGO.
Stopniowalne pobudzeniowe (EPSPs) i hamulcowe (IPSPs) potencjały postsynaptyczne przewodzone są nagle
i ubytkowo do wzgórka aksonalnego
- jeżeli suma odebranych depolaryzacji i hiperpolaryzacji wystarczająca jest dla zdepolaryzowania błony
komórkowej do poziomu zazwyczaj –55mV – czyli PROGU POBUDZENIA NEURONU – na wzgórku aksonalnym
wygenerowany zostaje potencjał czynnościowy.
POTENCJAŁ CZYNNOŚCIOWY jest chwilowym odwróceniem (ok. 1 milisekunda) potencjału błonowego neuronu
z –70mV do około +50mV.
=> potencjały czynnościowe nie są reakcjami stopniowalnymi
– ich wielkości nie jest związana z intensywnością bodźców, które je wywołały
=> potencjały czynnościowe są reakcjami „wszystko-albo-nic”
- zachodzą albo z pełną siła, albo w ogóle nie zachodzą
Każdy neuron sumuje wszystkie stopniowalne potencjały postsynaptyczne (EPSPs i IPSPs) docierające do
wzgórka aksonalnego i dokonuje wyładowania (lub nie) na podstawie wartości tych sum.
=> sumowanie tych pojedynczych sygnałów w jeden, większy sygnał nazywane jest INTEGRACJĄ
- neurony integrują sygnały na dwa sposoby: w czasie i przestrzeni.
1. sumowanie przestrzenne
Trzy możliwe kombinacje:
- lokalne postsynaptyczne potencjały pobudzeniowe (EPSPs) wygenerowane jednocześnie
sumują się tworząc większy potencjał pobudzeniowy
- lokalne postsynaptyczne potencjały hamulcowe (IPSPs) wygenerowane jednocześnie sumują
się tworząc większy potencjał hamulcowy
- lokalne postsynaptyczne potencjały pobudzeniowe (EPSPs) i hamulcowe (IPSPs) wygenerowane
jednocześnie znoszą się
2. sumowanie czasowe
Potencjały postsynaptyczne generowane szybko jeden po drugim na tej samej synapsie sumują
się tworząc większy sygnał
Dlaczego?
Ponieważ potencjały postsynaptyczne często trwają dłużej niż samo pobudzenie.
Krótki, podprogowy bodziec pobudzeniowy doprowadzić może do wyładowania neuronu, jeśli zadziała np.
dwukrotnie szybko jeden po drugim.
=> każdy neuron nieustannie integruje bodźce zarówno w czasie i przestrzeni
=> umiejscowienie synapsy na błonie recepcyjnej jest ważnym czynnikiem wpływającym na jej
potencjał pobudzeniowy (czyli jej zdolność „odpalania” neuronu)
- ten potencjał tym większy, im synapsa bliżej wzgórka aksonalnego
IV. Przewodzenie potencjału czynnościowego
1. Jonowa podstawa potencjałów czynnościowych
W jaki sposób tworzone są potencjały czynnościowe? W jaki sposób przewodzone są one wzdłuż aksonu?
=> przez działanie napięciowozależnych kanałów jonowych
NAPIĘCIOWOZALEŻNE KANAŁY JONOWE otwierają się lub zamykają w odpowiedzi na zmiany w wartości
potencjału błonowego.
Co dzieje się, gdy potencjał błonowy na wzgórku aksonalnym obniżony zostaje do wartości progu pobudzenia?
=> szeroko otwierają się napięciowozależne kanały sodowe na wzgórku aksonalnym i jony sodu
gwałtownie wlewają się do wnętrza neuronu
=> gwałtowny napływ Na+ zmienia potencjał błonowy z –70mV na +30mV
=> zmiana napięcia błony prowadzi do otwarcia napięciowozależnych kanałów potasowych
=> otwarcie napięciowozależnych kanałów potasowych powoduje wypływ położonych blisko błony jonów
potasu przez te otwarte kanały.
Dlaczego?
- początkowo z powodu ich wysokiego stężenia wewnątrz neuronu (zgodnie z gradientem stężeń)
- następnie z powodu dodatniego ładunku wnętrza neuronu (zgodnie z gradientem elektrycznym)
=> po około 1 milisekundzie napięciowozależne kanały sodowe zamykają się
- moment ten oznacza zakończenie fazy wznoszącej potencjału czynnościowego
- moment ten oznacza początek repolaryzacji neuronu poprzez wypływ jonów potasowych
Po osiągnięciu repolaryzacji kanały potasowe STOPNIOWO się zamykają. Z tego powodu przed ich całkowitym
zamknięciem z wnętrza neuronu wypływa zbyt wiele jonów potasu i neuron jest przejściowo zhiperpolaryzowany.
Potencjał czynnościowy obejmuje tylko te jony, które znajdują się tuż przy błonie neuronu.
-> To bardzo niewiele jonów w porównaniu z ich całkowitą liczbą wewnątrz i na zewnątrz komórki nerwowej.
Wniosek?
Pompa sodowo-potasowa odgrywa raczej niewielką rolę w przywracaniu błonowego potencjału spoczynkowego!
Pinel 3
2. Okresy refrakcji
Po inicjacji potencjału czynnościowego następuje krótki okres (1-2 milisekundy), gdy ponowne wzbudzenie komórki
(i wywołanie następnego potencjału czynnościowego) nie jest możliwe
=> jest to OKRES REFRAKCJI BEZWZGLĘDNEJ
Tuż po okresie refrakcji bezwzględnej możliwe jest ponowne wzbudzenie neuronu (i wywołanie nowego potencjału
czynnościowego), ale wyłącznie poprzez silniejszą niż zazwyczaj stymulację
=> jest to OKRES REFRAKCJI WZGLĘDNEJ
Okresy refrakcji odpowiedzialne są za dwie charakterystyczne cechy aktywności nerwowej:
A.
B.
przemieszczanie się potencjałów czynnościowych zazwyczaj w jednym kierunku
powiązanie tempa wyładowań neuronu z intensywnością stymulacji
Jeśli bodziec jest silny, ponowne wyładowanie neuronu nastąpi tuż po zakończeniu się okresu refrakcji
bezwzględnej
- pośrednia siła stymulacji wywołuje więc pośrednie tempo wyładowań neuronu
3. Przewodzenie potencjałów czynnościowych
W jaki sposób przewodzenie potencjałów czynnościowych różni się od przewodzenie potencjałów
postsynaptycznych (EPSPs i IPSPs)?
1. jest ono bezubytkowe (bez dekrementu)
- potencjały czynnościowe nie słabną
2. nie jest ono nagłe
- potencjały czynnościowe przewodzone są wolniej niż potencjały postsynaptyczne
DLACZEGO?
Ponieważ potencjały postsynaptyczne przewodzone są biernie, podczas gdy transmisja aksonalna
potencjałów czynnościowych jest w większej części czynna.
=> Każdy potencjał czynnościowy przesuwa się biernie ze wzgórka aksonalnego (gdzie jest on
generowany) po błonie aksonu do najbliższego napięciowozależnego kanału sodowego
- po dotarciu doń potencjału czynnościowego kanał ten otwiera się (w odpowiedzi na ten
sygnał) i wytwarza następny – o pełnej sile – potencjał czynnościowy
- który przesuwa się następnie biernie do następnego kanału sodowego itd.
Ta sekwencja zdarzeń powtarza się, dopóki sygnał nie dotrze do kolbki synaptycznej wywołując tam
pełnowartościowy potencjał czynnościowy.
POTENCJAŁ CZYNNOŚCIOWY jest raczej więc serią oddzielnych wydarzeń niż pojedynczą falą pobudzenia, choć tak
właśnie jest zazwyczaj postrzegany.
Powstanie potencjału czynnościowego na błonie wzgórka aksonalnego wywołuje falę pobudzenia, która
rozprzestrzenia się również w kierunku ciała komórki i dendrytów
=> ten kierunek pobudzenia ma zazwyczaj charakter bierny, ponieważ kanały jonowe w ciele komórki
i dendrytach zazwyczaj nie są napięciowozależne
Co stałoby się, gdyby wystarczająco silny bodziec elektryczny przyłożony został do kolbki synaptycznej aksonu?
=> wytworzony zostałby potencjał czynnościowy poruszający się w kierunku ciała komórki.
- Ten typ przewodnictwa nazywany jest PRZEWODNICTWEM ANTYDROMOWYM (ANTYDROMICZNYM)
Przewodnictwo nerwowe w normalnym kierunku (od ciała komórki w stronę zakończeń synaptycznych) nazywane
jest PRZEWODNICTWEM ORTODROMOWYM (ORTODROMICZNYM)
4. Przewodnictwo w aksonach zmielinizowanych
W aksonach zmielinizowanych jony przenikać mogą błonę neuronu tylko w PRZEWĘŻENIACH RANVIERA – przerwach
pomiędzy przylegającymi do siebie segmentami mieliny.
W jaki sposób potencjały czynnościowe przewodzone są w zmielinizowanych aksonach?
=> sygnał przekazywany jest biernie – czyli natychmiast i z dekrementem – z kolbki synaptycznej wzdłuż
pierwszego segmentu mieliny do pierwszego przewężenia Ranviera
=> docierający tam sygnał jest więc nieco osłabiony, wystarczająco jednak silny, by otworzyć znajdujące
się w tym miejscu napięciowozależne kanały sodowe i zainicjować pełnowartościowy potencjał
czynnościowy
Mielinizacja zwiększa prędkość przewodzenia impulsów nerwowych wzdłuż aksonu.
DLACZEGO?
Ponieważ przewodzenie wzdłuż zmielinizowanych segmentów aksonu jest bierne, jest ono natychmiastowe:
sygnał po prostu „przeskakuje” po aksonie od przewężenia do przewężenia.
- w każdym przewężeniu zachodzi więc nieznaczne opóźnienie sygnału, niezbędne dla czynnego
wytworzenia nowego potencjału czynnościowego
Przewodzenie potencjałów czynnościowych w zmielinizowanych aksonach nazywane jest PRZEWODNICTWEM SKOKOWYM
lub PRZEWODNICTWEM SALTACYJNYM
5. Prędkość przewodnictwa w aksonach
Z jaką szybkością potencjały czynnościowe przewodzone są po aksonie?
- przewodnictwo jest większe w aksonach o dużej średnicy
- przewodnictwo jest większe w zmielinizowanych aksonach
=> Niektóre neurony motoryczne w mózgu ssaków (duże i zmielinizowane) przewodzą impulsy z szybkością
100 metrów na sekundę (360km/h).
=> Małe, niezmielinizowane aksony: 1 metr na sekundę (3,6km/h)
=> Maksymalna szybkość przewodzenia u ludzi (neurony motoryczne) wynosi ok. 60 metrów na sekundę (216km/h)
Pinel 4
6. Przewodnictwo w neuronach bez aksonu
Potencjały czynnościowe są środkiem, który wykorzystuje komórka nerwowa do przesyłania sygnałów typu
wszystko-albo-nic, bez dekrementu, na duże odległości.
=> wiele neuronów w mózgach ssaków nie posiada jednak aksonów
- nie inicjują więc one potencjałów czynnościowych
Przewodnictwo nerwowe w tych INTERNEURONACH zachodzi więc zazwyczaj za pośrednictwem stopniowalnych
i przewodzonych z ubytkiem (dekrementem) potencjałów postsynaptycznych
7. Zmiana poglądów na funkcjonowanie dendrytów
DENDRYTY przez długi czas uważano za nic więcej niż bierne przewodniki potencjałów postsynaptycznych.
=> dendryty niektórych jednak neuronów mogą funkcjonować również czynnie!
- niektóre dendryty potrafią generować potencjały czynnościowe
- niektóre sygnały dendrytyczne są skomparamentalizowane, czyli ograniczone do poszczególnych
obszarów danego dendrytu
V. Przekaźnictwo synaptyczne: chemiczne przekaźnictwo sygnałów
- W jaki sposób potencjały czynnościowe docierające do kolbek synaptycznych inicjują uwolnienie
neuroprzekaźnika?
- W jaki sposób neuroprzekaźniki przenoszą sygnały do innych komórek?
1. Struktura synaps
Cząsteczki neuroprzekaźnika uwalniane są z kolbki synaptycznej do przestrzeni synaptycznej, gdzie inicjują one
potencjały postsynaptyczne w innych neuronach poprzez związanie się z receptorami postsynaptycznymi.
Wyróżniamy następujące typy synaps:
- synapsy aksodendrytyczne
–> w których kolbka synaptyczna przylega do dendrytu (często specjalnych jego wypustek nazywanych kolcami,
lub APARATEM KOLCOWYM)
- synapsy aksosomatyczne
–> w których kolbka synaptyczna przylega do ciała komórki
- synapsy dendrodendrytyczne
–> mające często zdolność przewodzenia impulsów w obie strony
- synapsy aksoaksonalne
-> potrafiące indukować hamowanie presynaptyczne
SYNAPSY PUNKTOWE (directed synapses) występują, gdy miejsce uwalniania neuroprzekaźnika oraz jego wiązania
przez receptory znajdują się blisko siebie.
SYNAPSY OBJĘTOŚCIOWE (nondirected synapses) występują, gdy miejsce uwalniania neuroprzekaźnika oraz wrażliwe
na niego receptory znajdują się od siebie w pewnym oddaleniu.
- w tym przypadku działanie neuroprzekaźnika nie ogranicza się do obszaru synapsy, w której został on uwolniony
- cząsteczki neuroprzekaźnika mogą być uwolnione z serii tzw. żylakowatości (varicosities) znajdujących się na
aksonie i jego odgałęzieniach (to tak zwane synapsy koralikowe)
2. Synteza, pakowanie i transport cząsteczek neuroprzekaźnika
Występują dwa podstawowe typy cząsteczek neuroprzekaźnika
- małe
- duże
NEUROPRZEKAŹNIKI NISKOCZĄSTECZKOWE występują w kilku rodzajach, NEUROPRZEKAŹNIKI WIELKOCZĄSTECZKOWE są
wszystkie peptydami.
PEPTYDY są krótkimi proteinami (białkami), czyli łańcuchami aminokwasów składającymi się z 10 lub mniej ich
cząsteczek.
A. NEUROPRZEKAŹNIKI NISKOCZĄSTECZKOWE są zazwyczaj syntetyzowane w cytoplazmie kolbki synaptycznej i pakowane
do pęcherzyków synaptycznych przez znajdujący się tam aparat Golgiego
=> wypełnione neuroprzekaźnikiem pęcherzyki przechowywane są w pobliżu błony presynaptycznej
B. NEUROPRZEKAŹNIKI PEPTYDOWE (tak jak inne białka) syntetyzowane są w cytoplazmie ciała komórki na rybosomach
=> pakowane są one później do pęcherzyków przez aparat Golgiego i transportowane przez MIKROTUBULE do
kolbek synaptycznych (z szybkością ok. 40 centymetrów na dzień)
=> te wielkocząsteczkowe pęcherzyki synaptyczne nie gromadzą się tak blisko błony presynaptycznej
Wiele neuronów zawiera dwa neuroprzekaźniki, jeden neuroprzekaźnik niskocząsteczkowy i jeden przekaźnik
peptydowy (NEUROPEPTYD)
=> sytuacja taka nazywana jest KOEGZYSTENCJĄ (coexistence), a transmisja synaptyczna oparta na współdziałaniu
neuroprzekaźników nazywa się KOTRANSMISJĄ.
Przez wiele lat w nauce o przekaźnictwie synaptycznym obowiązywało prawo Dale’a, zgodnie z którym jeden
neuron wytwarza tylko jeden rodzaj neuroprzekaźnika. Jak widać zasada ta okazała się nieprawdziwa.
APARAT GOLGIEGO jest częścią siateczki śródplazmatycznej gładkiej, odpowiedzialną za dalszą obróbkę wytworzonych na
rybosomach białek. Tutaj wytworzone białka są sortowane i pakowane do pęcherzyków oraz uwalniane do cytoplazmy.
RYBOSOMY są globularnymi strukturami mieszczącymi się zazwyczaj w siateczce śródplazmatycznej szorstkiej, głównym
obszarze syntezy białek w neuronie. Rybosomy dokonują translacji informacji zawartych w mRNA (które się z nimi wiąże)
tworząc cząsteczki białka, wykorzystując do tego obecne w cytoplazmie aminokwasy.
Pinel 5
3. Uwalnianie cząsteczek neuroprzekaźnika
Proces uwalniania cząsteczek neuroprzekaźnika nazywany jest EGZOCYTOZĄ
W jaki sposób dochodzi do uwolnienia cząsteczek neuroprzekaźnika z kolbki synaptycznej (czyli egzocytozy)?
=> w niepobudzonym neuronie pęcherzyki niskocząsteczkowe gromadzą się gęsto w pobliżu obszarów błony
presynaptycznej bogatej w napięciowozależne kanały wapniowe
=> pobudzone przez potencjał czynnościowy, kanały te otwierają się inicjując napływ jonów wapnia Ca2+ do
wnętrza kolbki synaptycznej
=> napływ jonów wapnia do wnętrza kolbki prowadzi do połączenia (FUZJI) pęcherzyków synaptycznych z błoną
presynaptyczną i uwolnienia ich zawartości do przestrzeni synaptycznej
Jaka jest różnica między egzocytozą neuroprzekaźników niskocząsteczkowych i neuropeptydów?
=> neuroprzekaźniki niskocząsteczkowe uwalniane są zazwyczaj pulsowo - w postaci oddzielnych pakietów,
noszących nazwę kwantów – w odpowiedzi na potencjał czynnościowy wyzwalający napływ jonów wapnia przez
błonę presynaptyczną do wnętrza komórki
=> neuroprzekaźniki wielkocząsteczkowe (neuropeptydy) są zazwyczaj uwalniane stopniowo, w odpowiedzi na
ogólny wzrost poziomu obecnych wewnątrz komórki jonów wapnia
- taka sytuacja występuje podczas ogólnego wzrostu tempa wyładowań danego neuronu
4. Pobudzenie receptorów przez cząsteczki neuroprzekaźnika
Uwolnione cząsteczki neuroprzekaźnika wiążą się z receptorami w błonie postsynaptycznej, w ten sposób
wyzwalając sygnały w neuronie.
Każdy receptor jest cząsteczką białka (proteiną) zawierającą miejsca wiązań wyłącznie dla określonego
neuroprzekaźnika.
=> neuroprzekaźnik oddziałuje więc wyłącznie na te komórki, które posiadają odpowiednie receptory
=> każda cząsteczka wiążąca się z inną jest jej LIGANDEM (czyli neuroprzekaźnik jest ligandem swojego receptora)
Większość neuroprzekaźników wiąże się z kilkoma różnymi typami receptorów
=> takie różne typy (odmiany) receptorów, z którymi wiązać się może dany przekaźnik nazywają się PODTYPAMI
RECEPTORA dla danego neuroprzekaźnika
- różne podtypy receptora znajdują się zazwyczaj w różnych obszarach mózgu i zazwyczaj inaczej
reagują na ten sam neuroprzekaźnik
- umożliwiają one tym samym przekazywanie informacji różnego rodzaju do różnych rejonów mózgu za
pomocą tego samego neuroprzekaźnika
W jaki sposób związanie się neuroprzekaźnika z receptorem (a raczej jednym z jego podtypów) wpłynąć może
na neuron postsynaptyczny?
=> otóż zachodzi to na jeden z dwóch fundamentalnie różnych sposobów, zależnie od tego, czy receptor jest
jonotropowy czy metabotropowy
- RECEPTORY JONOTROPOWE związane są z aktywowanymi ligandem kanałami jonowymi
- RECEPTORY METABOTROPOWE związane są z białkami sygnałowymi i białkami G
Gdy cząsteczka neuroprzekaźnika wiąże się z receptorem jonotropowym, związany z nim kanał jonowy zazwyczaj
natychmiast otwiera się lub zamyka
- inicjując tym samym natychmiastowy potencjał postsynaptyczny
Receptory metabotropowe są częstsze niż receptory jonotropowe
=> efekty ich pobudzenia wolniej się rozwijają, trwają dłużej, są bardziej rozlane i bardziej zróżnicowane
=> każdy receptor metabotropowy (a jest ich wiele rodzajów) związany jest z białkiem sygnałowym, które wygląda
jak siedmiokrotnie zwinięty sznurek przechodzący przez błonę komórki
- receptor metabotropowy znajduje się na zewnętrznej części tak „zawiniętego” białka sygnałowego
- białko G znajduje się na wewnętrznej części białka sygnałowego
Gdy cząsteczka neuroprzekaźnika wiąże się z receptorem metabotropowym, część związanego z nim białka G
odrywa się od wewnętrznej części białka sygnałowego
Tak więc, zależnie od rodzaju białka G:
1. oderwana jego część może przemieszczać się wewnątrz neuronu wzdłuż jego błony i związać się z
najbliższym kanałem jonowym
- inicjując w ten sposób potencjał postsynaptyczny (EPSP lub IPSP)
2. oderwana jego część zainicjować może syntezę substancji chemicznej zwanej PRZEKAŹNIKIEM WTÓRNYM
- przekaźnikiem pierwotnym jest neuroprzekaźnik uwalniany przez kolbkę synaptyczną do synapsy
Wytworzony przekaźnik wtórny przemieszczający się po cytoplazmie wpływać może na czynność neuronu na różne
sposoby
=> na przykład przedostać się do jądra neuronu i związać z DNA, wpływając tym samym na ekspresję
obecnych tam genów
Jak widać wpływ neuroprzekaźników może być dość radykalny i bardzo trwały
AUTORECEPTORY są receptorami metabotropowymi mającymi dwie szczególne cechy:
- wiążą się one z cząstkami neuroprzekaźnika własnego neuronu
- znajdują się one na błonie presynaptycznej
DLACZEGO? JAKA JEST ICH FUNKCJA?
Monitorują one liczbę cząstek neuroprzekaźnika w szczelinie synaptycznej
- zmniejszając uwalnianie neuroprzekaźnika, gdy jego poziom w szczelinie jest wysoki
- zwiększając uwalnianie neuroprzekaźnika, gdy jego poziom w szczelinie jest niski
Pinel 6
Jakie różnice pomiędzy NEUROPRZEKAŹNIKAMI NISKOCZĄSTECZKOWYMI i NEUROPEPTYDAMI sugerują, że odgrywają one
różne funkcje?
=> różnice w schematach uwalniania i wiązaniach z receptorami
Więc, jakie są ich funkcje?
A. neuroprzekaźniki niskocząsteczkowe są zazwyczaj uwalniane w synapsach punktowych
- uczynniają one receptory jonotropowe lub metabotropowe, które oddziałują bezpośrednio na kanały
jonowe
- ich funkcją jest przewodzenie nagłych, krótkich sygnałów pobudzeniowych lub hamulcowych do
pobliskich neuronów
B. neuroprzekaźniki peptydowe są zazwyczaj uwalniane w synapsach objętościowych (dyfuzyjnie)
- wiążą się one z receptorami metabotropowymi, których działanie mediowane jest przez przekaźniki
wtórne
- ich funkcją jest przewodzenie sygnałów wolnych, rozlanych i długotrwałych
5. Wychwyt zwrotny, rozkład enzymatyczny i recykling neuroprzekaźnika
Dwa mechanizmy powodują zakończenie przekaźnictwa synaptycznego (powstrzymując neuroprzekaźniki od
ciągłego pobudzania receptorów postsynaptycznych i zakłócania w ten sposób efektywnej komunikacji nerwowej).
Te mechanizmy dezaktywujące to:
A. wychwyt zwrotny
B. rozkład enzymatyczny
WYCHWYT ZWROTNY jest bardziej rozpowszechnionym mechanizmem: większość neuroprzekaźników jest po
uwolnieniu natychmiast z powrotem wychwytywana przez kolbkę synaptyczną, a ich składniki odzyskiwane
(recyklowane)
Inne neuroprzekaźniki są ROZKŁADANE w synapsie przez ENZYMY – substancje chemiczne, które pobudzają lub hamują
reakcje chemiczne bez bezpośredniego w nich uczestnictwa. Składniki rozłożonych neuroprzekaźników są
reabsorbowane i recyklowane
6. Zmiana poglądów na funkcjonowanie komórek glejowych
KOMÓRKI GLEJOWE (np. astrocyty), jak się wydaje, wydzielać potrafią neuroprzekaźniki, posiadają też ich receptory;
potrafią przewodzić sygnały, wpływać na rozwój synaps i uczestniczą w wychwycie zwrotnym neuroprzekaźników.
VI. Neuroprzekaźniki
Istnieją cztery klasy neuroprzekaźników niskocząsteczkowych
-
aminokwasy
monoaminy
rozpuszczalne gazy
acetylocholina
Istnieje jedna klasa neuroprzekaźników wielkocząsteczkowych
-
neuropeptydy
Większość neuroprzekaźników wytwarza albo pobudzenie albo hamowanie, lecz niektóre z nich wytwarzać potrafią
oba typy sygnałów, zależnie od tego, na jaki podtyp swojego receptora oddziałują.
1. Aminokwasy
Większość szybko działających, punktowych synaps w ośrodkowym układzie nerwowym działa w oparciu o
aminokwasy.
Cztery najważniejsze aminokwasy to:
-
glutaminian
asparaginian
glicyna
kwas gamma-aminomasłowy (GABA)
GLUTAMINIAN, ASPARAGINIAN i GLICYNA obecne są w białkach potraw, które codziennie spożywamy. GABA natomiast
syntetyzowany jest z glutaminianu, przez prostą jego modyfikację.
Glutaminian jest najpopularniejszym neuroprzekaźnikiem pobudzeniowym, GABA zaś najpopularniejszym
neuroprzekaźnikiem hamulcowym.
2. Monoaminy
MONOAMINY syntetyzowane są z pojedynczego aminokwasu. Są one nieco większe od neuroprzekaźników
aminokwasowych, a ich oddziaływanie jest zazwyczaj bardziej rozlane.
=> obecne są one w małych grupach neuronów, których ciało komórki znajduje się zazwyczaj w pniu mózgu
=> mają one zazwyczaj bardzo rozgałęzione aksony z licznymi żylakowatościami (synapsami koralikowymi),
z których neuroprzekaźniki monoaminowe uwalniane są objętościowo (w rozlany sposób) do płynu
zewnątrzkomórkowego
Istnieją cztery neuroprzekaźniki monoaminowe:
-
dopamina
nerepinefryna (noradrenalina)
epinefryna (adrenalina)
serotonina
Pinel 7
Dzielą się one następnie na dwie podgrupy (w oparciu o strukturę):
-
katecholaminy
indolaminy
KATECHOLAMINY syntetyzowane są z aminokwasu tyrozyny.
=> tyrozyna -> L-dopa -> dopamina -> epinefryna -> norepinefryna
Jedyna INDOLAMINA – serotonina – syntetyzowana jest z aminokwasu tryptofanu.
=> tryptofan -> 5-hydroksytryptofan –> 5-hydroksytryptamina (serotonina) -> melatonina
3. Gazy rozpuszczalne
Odkryto je całkiem niedawno. Do tej pory zalicza się do nich:
-
tlenek azotu
tlenek węgla
Wytwarzane w cytoplazmie komórki nerwowej natychmiast dyfundują przez błonę komórkową do płynu
zewnątrzkomórkowego, a następnie do pobliskich komórek.
=> neuroprzekaźniki te są rozpuszczalne w tłuszczach (lipidach), z łatwością więc przenikają przez błonę
komórkową
=> gdy dostaną się do pobliskiej komórki inicjują wytwarzanie wtórnego przekaźnika, po czym są natychmiast
rozkładane
=> w niektórych synapsach tlenek azotu mediować może przekaźnictwo wsteczne
4. Acetylocholina
Tworzona jest poprzez dodanie grupy acetylowej do cząsteczki choliny (czy, inaczej mówiąc, syntetyzowana jest
z choliny i kwasu octowego).
Rozkładana jest przez enzym – acetylocholinestrazę. Neurony syntetyzujące ACh nazywamy cholinergicznymi.
Istnieją dwa rodzaje receptorów acetylocholiny: nikotynowe i muskarynowe.
Receptory nikotynowe obecne są w synapsach nerwowo-mięśniowych i w zwojach wegetatywnych.
Receptory muskarynowe obecne są w synapsach mięśni gładkich narządów wewnętrznych.
Receptory nikotynowe są receptorami jonotropowymi, muskarynowe zaś metabotropowymi.
5. Neuropeptydy
Istnieje ponad 50 peptydów pretendujących do roli neuroprzekaźników. Peptydy takie nazywamy NEUROPEPTYDAMI.
Do neuropeptydów należą ENDORFINY, czyli opiaty endogenne
- uczynniają one układy nerwowe wytwarzające analgezję (czyli supresję bólu) oraz układy nerwowe pośredniczące
w odczuwaniu przyjemności.
VII. Farmakologia przekaźnictwa synaptycznego
Środki farmakologiczne mają dwojaki, fundamentalnie odmienny, wpływ na przekaźnictwo synaptyczne
- ułatwiają je lub hamują
=> substancje wspomagające działanie neuroprzekaźnika są jego agonistami
=> substancje hamujące działanie neuroprzekaźnika są jego antagonistami
1. Jak środki farmakologiczne wpływają na przekaźnictwo synaptyczne
Siedem kroków oddziaływania neuroprzekaźnika:
1.
SYNTEZA CZĄSTECZEK NEUROPRZEKAŹNIKA POD WPŁYWEM ENZYMÓW
=> środki farmakologiczne mogą zwiększać lub hamować tę syntezę
(zwiększając ilość prekursora danego przekaźnika lub rozkładających go enzymów)
2.
3.
CZĄSTECZKI NEUROPRZEKAŹNIKA PRZECHOWYWANE SĄ W PĘCHERZYKACH SYNAPTYCZNYCH
CZĄSTECZKI NEUROPRZEKAŹNIKA WYCIEKAJĄCE ZE SWOICH PĘCHERZYKÓW NISZCZONE SĄ PRZEZ ENZYMY
=> środki farmakologiczne mogą zniszczyć te enzymy lub też spowodować większe wyciekanie
przekaźnika z pęcherzyków (i jego rozkład)
4.
EGZOCYTOZA
=> środki farmakologiczne zwiększać mogą lub blokować uwalnianie neuroprzekaźnika
5.
HAMUJĄCE SPRZĘŻENIE ZWROTNE POPRZEZ AUTORECEPTORY
=> środki farmakologiczne wiązać się mogą z autoreceptorami i blokować ich hamujący wpływ
lub też aktywować je, w ten sposób hamując uwalnianie neuroprzekaźnika
6.
UWOLNIONE CZĄSTKI NEUROPRZEKAŹNIKA WIĄŻĄ SIĘ Z RECEPTORAMI POSTSYNAPTYCZNYMI
=> środki farmakologiczne wiązać się mogą z receptorami postsynaptycznymi i albo je aktywować
(zwiększając oddziaływanie na nie neuroprzekaźnika) albo je blokować (bloker receptora)
7.
UNIECZYNNIENIE NEUROPRZEKAŹNIKA PRZEZ WYCHWYT ZWROTNY LUB ROZKŁAD ENZYMATYCZNY
=> środki farmakologiczne mogą hamować dezaktywację neuroprzekaźnika (poprzez zablokowanie
rozkładu lub wychwytu zwrotnego)
2. Substancje psychoaktywne: przykłady
AGONIŚCI
Kokaina
=> potężny agonista katecholamin.
Zwiększa aktywność dopaminy i norepinefryny hamując ich wychwyt zwrotny.
Wpływ kokainy: euforia, utrata apetytu, bezsenność
Pinel 8
Benzodiazepiny
=> które są agonistami GABA.
Wiążą się z jonotropowym receptorem GABAA. Nie naśladują działania GABA i nie wiążą się z receptorem
w tym samym miejscu, co cząstki GABA. Zwiększają one wiązanie się cząstek GABA z receptorem (co jest
efektem hamulcowym, poprzez zwiększenie napływu jonów chlorkowych do neuronu).
Wpływ: anksjolityczny (przeciwlękowy), sedatywny (uspokajający, usypiający) i przeciwdrgawkowy
ANTAGONIŚCI
Atropina
=> jest blokerem receptora wiążącym się z receptorem metabotropowym acetylocholiny, zwanym
receptorem muskarynowym
Kurara
=> jest blokerem receptora dla synaps cholinergicznych receptorów nikotynowych acetylocholiny.
Blokuje sygnały płynące do mięśni paraliżując osobę i prowadząc do śmierci przez uduszenie.
Pinel 9