Skały i minerały
Skały wapienne
Skały gipsowe
Hydraty (sole uwodnione)
Krzemionka
Zjawisko krasu
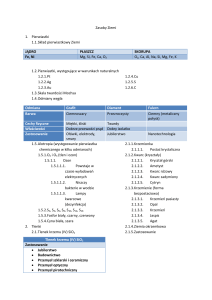
Minerały a skały
Skorupa ziemska – zewnętrzna skalna warstwa
Ziemi
Minerały – to pierwiastki w stanie wolnym
oraz związki chemiczne, które powstały w
przyrodzie bez ingerencji człowieka
Skały – naturalne skupiska minerałów, które
powstały w wyniku procesów geologicznych
Surowce mineralne – skały i minerały
wydobywane i stosowane przez człowieka
w różnych dziedzinach życia
Ważniejsze minerały pierwiastkowe
i formie związków chemicznych
Minerały pierwiastkowe
Złoto (Au)
Srebro (Ag)
Platyna (Pt)
Siarka (S)
Odmiany alotropowe
węgla (C);
diament
grafit
Minerały – związki chemiczne
Kwarc / krzemionka: SiO2
Korund: Al2O3
Kalcyt: CaCO3
(wchodzi w skład skał wapiennych,
kredowych, marmuru, alabastru)
Gips: (CaSO4) ∙ 2H2O
Apatyt: Ca3(PO4)2
Halit: NaCl
Kainit: KCl
Saletra chilijska: NaNO3
Saletra indyjska: KNO3
Saletra norweska: Ca(NO3)2
Magnezyt: MgCO3
Dolomit: CaCO3∙MgCO3
Surowce mineralne
Rodzaje surowców mineralnych
Budowlane
Chemiczne
Skały:
Nawozy
wapienne,
minerale:
gipsowe,
saletry,
Krzemionka
wapniowe,
Gliny,
magnezowe,
kaoliny
apatyty
Asfalty
i fosforyty,
halit
Sól
kamienna,
Rudy metali
Energetyczne
Węgle
kopalne,
Ropa
naftowa,
Gaz
ziemny
Metalurgiczne
Rudy
metali:
żelaza,
miedzi,
cynku,
ołowiu
Zdobnicze
Metale: Au,
Pt, Ag
Kamienie
szlachetne i
półszlachetne
(diamenty,
rubiny,
szafiry,
topazy)
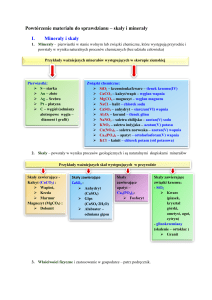
Skały wapienne – kalcyt
Węglan wapnia – CaCO3 (kalcyt) wchodzi w skład skał: kreda, marmur, wapień
Wykrywanie kalcytu – kwas węglowy jest kwasem słabym i nietrwałym,
wypierany jest z soli przez kwasy mocniejsze:
CaCO3 + 2HCl CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- Ca2+ + 2Cl- + H2O + CO2↑ : wydziela się
bezbarwny, bezwonny gaz i rozpuszczalny w wodzie chlorek wapnia
CaCO3 + H2SO4 CaSO4+ H2O + CO2↑
CaCO3 + 2H+ + SO42- CaSO4 + H2O + CO2↑ : wydziela się bezbarwny,
bezwonny gaz i trudno rozpuszczalny w wodzie siarczan(VI) wapnia
3CaCO3 + 2H3PO4 Ca3(PO4)2 + 3H2O + 3CO2↑
3CaCO3 + 6H+ + 2PO43- Ca3(PO4)2 + 3H2O + 3CO2↑ : wydziela się
bezbarwny, bezwonny gaz i trudno rozpuszczalny w wodzie ortofosforan(V)
wapnia
CaCO3 + 2HNO3 Ca(NO3)2 + H2O + CO2↑
CaCO3 + 2H+ + NO3- Ca2+ + 2NO3- + H2O + CO2↑ : wydziela się
bezbarwny, bezwonny gaz i rozpuszczalny w wodzie azotan(V) wapnia
Skały wapienne – kalcyt
Identyfikacja CO2:
Ca(OH)2 + CO2 CaCO3↓ + H2O; Ca2+ + 2OH- + CO2 CaCO3↓ + H2O
Minerały krzemionka, gips (anhydryt), skały (granit) nie reagują
z kwasem chlorowodorowym co umożliwia wykrywanie minerałów, skał i
soli węglanowych (CaCO3, MgCO3)
Anhydryt reaguje z kwasem siarkowym(VI), powstaje wodorosiarczan(VI)
wapnia rozpuszczalny w wodzie , lecz nie wydziela się gaz
CaSO4 + H2SO4 Ca2+ + HSO4- ;
CaSO4 + HCl r. nie zachodzi
Krzemionka nie reaguje z kwasami (wyjątek HF(aq)), natomiast reaguje
z wodnymi roztworami mocnych zasad, powstają rozpuszczalne w wodzie
sole kwasu krzemowego(IV)
SiO2 + HCl r. nie zachodzi
SiO2 + 4HF SiF4↑ + 2H2O
SiO2 + 2NaOH Na2SiO3 + H2O
SiO2 + 2Na+ + 2OH- 2Na+ + SiO32- + H2O
Skały wapienne i ich zastosowanie
Wapień – CaCO3
Skała osadowa
Barwa biała lub
beżowa, z
domieszkami barwy
czerwonawej,
zielonkawej lub
brunatnej
Produkcja wapna
palonego,
odkwaszający nawóz,
produkcja szkła
Kreda – do 70%
CaCO3
Skała osadowa
Barwa biała lub
szara
Biały pigment
farb,
Wyrób kredy do
pisania, past do
zębów, kitów,
nawóz
odkwaszający
Marmur i alabaster
CaCO3
Skała metamorficzna,
utworzona z wapieni
pod wpływem
wysokich temp. i
ciśnienia
Budowa krystaliczna
Barwa białej,
różowej, zielonkawej
Materiał budowlany,
rzeźbiarski
Skały gipsowe
Anhydryt CaSO4
Gips CaSO4 ∙ 2H2O
Budowa krystaliczna, barwy
niebieskoszarej, rzadko białej
lub kremowej, łatwo chłonie
wodę zwiększając objętość do
60% z jednoczesnym pękaniem
i rozwarstwieniem
Stosowany w budownictwie,
przemyśle cementowym,
jubilerstwie
Budowa
drobnokrystaliczna,
półprzezroczysta,
plastyczna i miękka,
słabo rozpuszczalna
w wodzie zimnej, lepiej
w ciepłej
Stosowany
w budownictwie,
medycynie,
w rzeźbiarstwie
Hydraty – sole uwodnione
Hydraty – sole, które w stanie stałym mają wbudowane w sieć
krystaliczną cząsteczki wody – tzw. wodę krystaliczną:
CuSO4 – siarczan(VI) miedzi(II); bezbarwny
CuSO4 ∙ 5H2O – siarczan(VI) miedzi(II) – woda (1/5) (odczyt
woda 1 do 5); barwa niebieska
CaSO4 – siarczan(VI) wapnia / anhydryt
CaSO4 ∙ 2H2O – siarczan(VI) wapnia – woda (1/2) / gips
(CaSO4)2 ∙ H2O – siarczan(VI) wapnia – woda (2/1) / gips
palony
CaSO4 ∙ H2O siarczan(VI) wapnia – woda (1/1)
CoCl2 – chlorek kobaltu(II); barwa niebieska
CoCl2 ∙ 2H2O – chlorek kobaltu(II) – woda (1/2); barwa różowa,
CoCl2 ∙ 6H2O – chlorek kobaltu(II) woda (1/6): barwa
intensywnie różowa
Wodę krystaliczną można usunąć przez prażenie hydratów
Skala twardości Mohsa
Skala
1
2
3
4
5
6
7
8
9
10
Przykłady minerałów
talk,
(paznokieć 2,5) / gips, grafit, sól kamienna
kalcyt
fluoryt
(stal noża – 5,5) / apatytyt
szkło okienne / ortoklaz
kwarc
topaz
korund
diament
Krzemionka / kwarc
Kwarc – minerał wchodzący w skład skał (piasek, żwir, piaskowce,
granit, gnejs) – jest tlenkiem krzemu(IV) SiO2
Właściwości fizyczne
Budowa krystaliczna
Bez domieszek jest bezbarwny
Twardy ale kruchy
Gęstość 2,65g/cm3
Właściwości chemiczne
Mało reaktywny chemicznie
Reaguje z kwasem HF i
wodnymi roztworami mocnych
zasad
Tp = 1723oC, Tw = 2230oC
SiO2 + HCl/H2SO4/HNO3 r. nie zachodzi
SiO2 + 4HF SiF4↑ + 2H2O
SiO2 + 2NaOH Na2SiO3 + H2O
SiO2 + 2Na+ + 2OH- 2Na2+ + SiO32- + H2O
SiO2 + 4KOH K4SiO4 + 2H2O
SiO2 + 4K+ + 4OH- 4K+ + SiO44- + 2H2O
Krzemionka / kwarc
Odmiany kwarcu
Kryształ górski – bezbarwny,
o silnym połysku
Ametyst – fioletowa barwa
jest efektem domieszek
tlenków żelaza
Agat – mikrokrystaliczna
struktura,
bardzo twardy
Tygrysie oczko –
nieprzezroczysta odm. ,
barwy żółtej lub brunatnej
Zjawisko krasu
Kras – procesy chemicznej erozji skał i minerałów pod wpływem
czynników środowiska:
wody,
tlenków kwasowych (CO2, SO2, NO2)
kwaśnych opadów
Węglany – sole kwasu węglowego przechodzą w wodorowęglany
(wapnia, magnezu) rozpuszczalne w wodzie, w wyniku
rozpuszczania powstają jaskinie krasowe z stalaktytami
i stalagmitami
CaCO3 + CO2 + H2O ↔Ca2+ + 2HCO3 MgCO3 + CO2 + H2O ↔ Mg2+ + 2HCO3 Przechodzące do roztworu kationy wapnia i magnezu nadają
wodzie twardość węglanową (przemijającą)